2. 广西壮族自治区中国科学院广西植物研究所,广西植物功能物质与资源持续利用重点实验室,广西桂林 541006
2. Guangxi Key Laboratory of Plant Functional Phytochemicals and Sustainable Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
全球农业生产每年能产生5×109t生物质残留物,它们是减轻能源危机的重要能量来源,也是获得碳水化合物的宝贵原料,可开发出以生物质为基础的众多产品[1]。植物材料的木质纤维素主要由纤维素、半纤维素和木质素3大组分构成。木质材料和禾本科植物材料是人们获取半纤维素的重要来源[2, 3]。这些材料的木质纤维素干物质中纤维素含量占35%-50%,半纤维素占10%-30%,木质素占15%-30%[4]。纤维素是自然界中含量最丰富的有机化合物,大部分是结晶态的葡萄糖线性聚合高分子化合物。木质素是一种由苯丙烷单元连接在一起的非晶态芳香族聚合物,它与半纤维素、纤维素紧密相连,是仅次于纤维素的第二大丰富的天然聚合物。半纤维素是由木糖与半乳糖、阿拉伯糖、甘露糖和葡萄糖等单体组合的聚合物。木聚糖是半纤维素的主要成分[5],主链由木糖残基经β-1, 4糖苷键连接而成[6],它们通过共价键和氢键等相互作用与其他细胞壁成分相连,如纤维素、蛋白质、木质素和一些酚类化合物(如阿魏酸等)[7]。木聚糖作为唯一的五碳糖聚合物,具有区别于其他多糖的物化特性,如果充分利用这些特性开发一系列具有独特性能或生物活性的全新产品,极有可能是未来突破木质纤维素现有应用模式的重要方向。
目前,国内外研究人员在木聚糖的提取、分离纯化和应用方面开展了大量的研究工作。木聚糖在许多领域的应用都需要高纯度的样品作为基础,虽然碱提取能快速有效地提取大部分木聚糖,但其分离纯化仍然是一个难题。木聚糖的分离和纯化仍然需要广泛的研究,以适应工业化应用的要求。本文对从植物中提取、分离纯化木聚糖的方法和木聚糖在食品、医药、材料等方面的应用进行综述,旨在为木聚糖的开发利用提供参考。
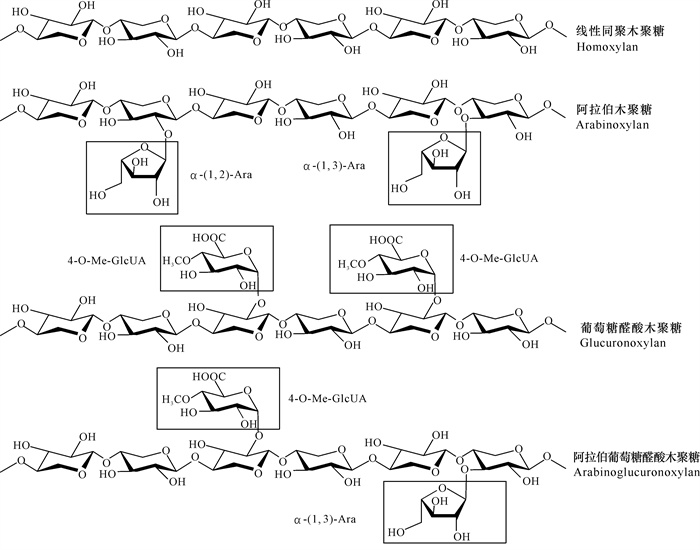
1 木聚糖的制备天然木聚糖可分为同源木聚糖(如线性同聚木聚糖Homoxylan)和异源木聚糖(如阿拉伯木聚糖Arabinoxylan、葡萄糖醛酸木聚糖Glucuronoxylan、阿拉伯葡萄糖醛酸木聚糖Arabinoglucuronoxylan等)(图 1),这些聚合物具有广阔的应用前景[8, 9]。为了更好地开发和应用木聚糖,首先要解决木聚糖的制备问题。植物材料中半纤维素、纤维素与木质素之间的复杂键合结构导致木聚糖分离纯化困难。从植物材料中提取木聚糖一般需要经过脱脂、脱淀粉及水溶性多糖、脱木质素、溶剂提取、膜分离、中和、沉淀分离等步骤,按照制备过程可以分为预处理、溶剂提取、分离纯化3个部分。
为了解常见的处理步骤在木聚糖制备过程中的定位和目的,将制备流程概括如图 2。从大多数报道中指出的问题来看,不同制备方法引起的产物差异有迹可循。因此,结合制备方法的特点和对制备产物的要求以及植物材料成分的差异等因素,适当地调整制备流程是必要的。

|
| 图 2 木聚糖的制备流程 Fig. 2 Preparation process of xylan |
1.1 提取预处理
植物材料成分非常复杂,如果直接进行溶剂提取就会加大后续分离纯化工艺的难度,而对不同植物材料进行恰当的预处理能有效减少提取物杂质的含量,提高产物收率。脱脂、脱淀粉和多糖、脱木质素是常见的预处理方法。
1.1.1 脱脂植物生物质中都含有少量的脂类化合物,包括甘油磷脂、脂肪酸、鞘脂、固醇脂和糖脂类等,脂类物质含量也因植物种类不同而存在差异。柠条干物质中含有约4.5%的油脂和蜡[11],而海枣果实中粗脂肪含量仅为0.56%[12]。因此,应在预处理前先了解或检测原材料的脂类含量,再判断是否需要脱脂。在提取植物材料半纤维素之前,可以通过有机溶剂提取去除脂溶性杂质,以便提高产品的纯度。常用的脱脂溶剂包括甲醇、乙醇、乙醇-甲苯混合物、石油醚、氯仿等。Pavlovich-Abril等[13]用85%(V∶V)乙醇回流提取2 h,去除麦麸中的低聚糖、挥发油和其他小分子。Md Salim等[14]通过乙醇-甲苯回流提取6 h,从植物材料中提取脂类化合物。Cantu-Jungles等[15]使用氯仿-甲醇(1∶1)处理亚马逊莓,以去除脂质、色素和其他疏水性物质。木聚糖产品的应用,尤其是产品对溶剂使用有要求的应用方向,限制了脱脂方法的选择。
1.1.2 脱淀粉和多糖生物质中的多糖和淀粉常用水提取法分离。这些易溶于水的成分可以通过热水提取预先分离,而大部分木聚糖仍能保留在生物质残渣中。Svärd等[16]发现热水提取油菜秸秆,获得的组分富含半乳葡甘聚糖(Galactoglucomannan),而碱提取的主要成分是木聚糖。研究表明,木聚糖通常与β-葡聚糖共同出现在禾本科植物细胞壁中[17]。Yao等[18]先用热水提取大麦中的β-葡聚糖,再以残渣进行碱提取,产物β-葡聚糖含量降低,说明水提取预处理对提高木聚糖纯度有利。Ma等[19]利用透射电镜结合免疫金标记研究水热预处理杨树纤维细胞壁木聚糖的微观分布变化,发现与未处理的纤维相比,经脱木质素和酶处理的纤维中木聚糖标记损失更大,与纤维素紧密结合的木聚糖在水热处理过程中难以去除。研究表明,淀粉会降低提取效率,还会导致后续膜分离过程中超滤膜污染[20],因此,为提高木聚糖的产率和纯度,特别是富含淀粉和多糖的植物材料,水提取预处理是需要考虑的预处理步骤。
1.1.3 脱木质素木质纤维素组分间的化学键和连接结构非常复杂,木质素与纤维素、半纤维素结合形成的致密植物结构难以水解。因此,在提取木聚糖之前应进行脱木质素预处理,只有将木质素-碳水化合物复合体(Lingin-Carbohydrate Complex,LCC)结构打破,才能使木聚糖从原材料扩散到溶剂中。
亚氯酸钠[21]、过氧化物[22]、二氧六环[23]等是常用的脱木质素试剂。另外,氢氧化钠-乙醇混合物也可用于脱木质素[24],醇和碱的混合液可以使木聚糖沉淀,而木质素仍保留在混合液中[25]。脱木质素既可作为预处理步骤,也可同时提取半纤维素和木质素,再通过后续步骤分离,这取决于方法的差异。将脱木质素作为预处理步骤时,处理方法是将植物材料置于脱木质素试剂中,在确定的工艺条件下降解一段时间,再分离固液两相[26]。液相中木质素含量较高,固相一般称为全纤维素。脱木质素的固相用蒸馏水和乙醇洗涤并干燥后可获得全纤维素[11]。De Carvalho等[27]发现, 与传统的亚氯酸钠相比,过氧乙酸脱木质素能获得更高的木聚糖提取率和纯度。
一般在碱性条件下同时提取半纤维素和木质素,利用氢氧化钠、亚氯酸钠、过氧化氢等破坏木质纤维素的结构,使半纤维素和木质素溶解。然而,也有研究发现,在酸性条件下脱木质素的同时也能提取部分半纤维素。白杨木屑依次经过0.5%的硫酸加压浸渍、亚硫酸钠浸渍和化学热磨机械处理,收集液体部分调整pH值为2.5,通过离心分离去除沉淀(大部分是木质素),离心上清液再加入3倍体积的95%乙醇,得到的沉淀物质即为半纤维素[28]。Yang等[29]研究表明,深共晶溶剂(Deep Eutectic Solvent,DES)也可用于脱木质素。Almeida等[30]研究发现,1-丁基-3-甲基咪唑甲磺酸+水或氯化胆碱+咪唑组成的深共晶溶剂系统表现出显著的去除金合欢木材中木质素的能力,木质素脱除率分别为92.4%和90.2%。
木质素的脱除率因原材料、处理条件不同存在差异,经过预处理后仍会剩余一些木质素,这是由LCC结构的顽固性和复杂性所决定的。因此,如果过高地追求木质素脱除率可能会使木聚糖产率下降,甚至会影响产物的结构。Naran等[31]认为,尽量减少木聚糖提取的潜在变化比提高木质素脱除率更重要。脱木质素预处理是提高木聚糖产量和纯度的重要步骤,如何确定工艺条件应根据原材料木质素含量、产物收率和产物纯度来衡量。
1.1.4 其他预处理方法除上述3种方法外,脱色、除果胶、除金属离子也是常见的预处理步骤。Capek等[32]在提取洋苏草半纤维素时用甲醇-氯仿(10∶1,V∶V)进行预处理,以去除有色化合物。Zahraa等[33]用草酸钾去除苹果渣含有的果胶。De Carvalho等[27]在用过氧乙酸脱木质素之前,先用0.2%(W∶V)乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)在90℃下处理甘蔗渣和稻草1 h,持续搅拌,以去除金属离子。Naran等[31]通过EDTA预处理去除可能干扰过氧化氢脱木质素的金属离子。
1.2 溶剂提取碱、水、二甲基亚砜(Dimethyl Sulfoxide, DMSO)是提取木聚糖常用的3种溶剂。物理和机械作用(压力、超声、微波、物理挤压)以及酶的生物催化作用均有利于实现半纤维素的提取。碱提取能够溶解植物材料中的大部分半纤维素;水提取一般需要加压才能有效地水解LCC复合物;二甲基亚砜和水提取得到的提取液,水溶性木聚糖含量较高。
1.2.1 碱提取碱提取是提取和溶解半纤维素组分的首选方法,其能够破坏氢键和水解酯键[34],导致纤维素膨胀,降低纤维素的结晶度[35]。Gu等[36]使用不同类型的碱提取木聚糖,在相同条件下使用NaOH、KOH和NH3·H2O提取的木聚糖收率分别为57.4%、46.2%和37.2%。Kaur等[24]研究表明,碱浓度过高或过低均会降低木聚糖产率,在最佳条件下(11.04% NaOH、3.126 h、80.146℃)木聚糖产率为干稻草的19.4%。为提高木聚糖产率,也有研究认为通过多步提取的方式处理原材料更有效[11]。
碱提取一般先将固液两相分离,然后中和提取液,使部分提取物从溶剂中析出,分离析出沉淀和上清液两部分,沉淀物主要是水不溶性木聚糖,常含有部分木质素,上清液主要成分是水溶性木聚糖。Egüés等[37]使用6 mol/L的HCl中和碱提取玉米秸秆滤液,pH值调至5.5后,加入3倍体积无水乙醇使半纤维素沉淀,用乙醇水(70∶30,V∶V)洗涤,干燥后用于进一步鉴定。Peng等[38]研究表明,水溶性半纤维素主要由葡萄糖(27.83%)、木糖(27.32%)和半乳糖(16.81%)组成,碱溶性半纤维素主要由木糖(69.73%-88.62%)和阿拉伯糖(5.41%-16.20%)组成。
研究表明,提取条件对木聚糖产物结构和性质有重要的影响。Svärd等[16]发现,较低浓度碱提取的半纤维素分子量相对较高,含有高分子量木聚糖和半乳糖甘露聚糖混合物的提取物,即使不添加任何增塑剂,也具有机械完整性,这些半纤维素产物适用于生产薄膜或包装材料。Sun等[39]发现,甜高粱茎秆水溶性半纤维素含有较多的葡萄糖,分子量较低;相比之下,碱溶性半纤维素主要由木糖(36.1%-73.0%)组成,具有线性结构和较大的分子量,并且长时间的低温碱提取比短时间较高温度碱提取的半纤维素含有更多的木质素[40]。
1.2.2 加压提取加压提取一般以水作为溶剂,有时也会加入少量乙醇[41]。在1-5 MPa压力(常用N2作为加压介质)、150-250℃温度下提取1-2 h,能有效地提取植物材料中的可溶性木聚糖。研究表明,在时间(10-50 min)、温度(170-190℃)和压力(1-5 MPa) 3个因素中,温度对降解产物和溶解木质素产率的影响比时间更明显[42]。在180℃以上的温度,半纤维素很容易从植物材料中分离出来[43]。加压热水提取能够分离可溶性木聚糖,提取率因原料水溶性木聚糖的含量而异。Borrega等[44]用加压热水提取获得了桦木牛皮纸浆中50%-80%的木聚糖,并且纤维素产率没有损失。Monteiro等[45]将芒果核置于2.5 MPa、180℃条件下,以水作为溶剂提取半纤维素,15 min提取了原料中40%的半纤维素,其中聚合度为2-6的低聚木糖占8.2%,聚合度大于6的可溶性木聚糖占31.1%。
加压热水处理的优点是能避免酸碱处理、减轻设备腐蚀、简化工艺步骤,是一种有效的半纤维素提取技术。据报道,加压水提取获得的木聚糖产物与碱提取产物有差异。Banerjee等[34]发现,加压热水提取的半纤维素分子量低、分支较多,木糖含量仅为43.1%-69.0%;而碱提取的半纤维素分子量高、分支较少,木糖含量高达78.8%-83.4%。加压热水提取过程中半纤维素的降解是需要关注的另一个问题。
1.2.3 有机溶剂提取二甲基亚砜(DMSO)是一种中性温和的有机溶剂,也常用于提取木聚糖。在100℃以内,以纯溶剂提取5-24 h,可以获得植物材料中的部分木聚糖,这种方法具有高效性和选择性。如果使用传统的碱提取法获取半纤维素,就会丢失大部分原来木聚糖中含有的乙酰酯,而DMSO能够在提取过程中保留植物材料中木聚糖的乙酰基团[33]。Peng等[46]依次使用DMSO、饱和Ba(OH)2水溶液、1.0 mol/L NaOH水溶液提取脱木质素的芦竹,各组分的产率分别为10.2%、6.7%和10.0%,单糖、分子量、红外光谱、1D(1H和13C)和2D(HSQC)核磁共振分析结果显示,各组分在结构特征和理化性质上存在差异。研究表明,附着在木聚糖链上的乙酰基显著影响着木聚糖的构象行为[33],有机可溶性半纤维素组分比碱可溶性半纤维素组分的分支度更高,并且不同方法获得的半纤维素组分,其化学结构的内在变化对其热稳定性具有重要的影响[47]。
1.2.4 其他提取方法机械作用、超声、微波、酶等是辅助提取木聚糖的常用方法。在半纤维素提取的相关研究中,机械辅助提取常借助双螺杆挤出机来实现。Daou等[48]结合双螺杆挤出机提取半纤维素,发现机械作用使可溶性膳食纤维含量从5.9%增加到6.8%。Vandenbossche等[49]结合了热、机械(双螺杆挤出机)、化学作用和酶的催化作用,经过碱性预处理、提取-中和-分离和生物挤压处理3个阶段,虽然只获得原材料18%-54%的半纤维素,但是它具有植物材料停留时间短和水消耗量低等优点。挤压-热机械工艺是一种可行的连续提取手段,易于在工业规模上实现,工艺调整具有灵活性[50]。值得注意的是,机械作用会增加提取液的复杂性,使更多的物质转移到溶剂内,包括一些水解产物和提取得到的其他分子(蛋白质、木质素和无机盐)。因此,若借助双螺杆挤出机等机械作用辅助提取木聚糖,对于后续开发高效的分离纯化步骤十分重要。
在提取木聚糖的过程中适当地施加超声或微波,能够有效地增加相同时间下的木聚糖提取率。Jiang等[51]研究了木聚糖的超声辅助提取工艺,当超声波功率从200 W增加到500 W时,水不溶性阿拉伯木聚糖的产率从21.64%增加到25.39%,当达到600 W时产率迅速下降。随着超声或微波辅助提取时间的延长,产品得率可能会降低。Buranov等[41]发现,随着微波照射时间的增加,半纤维素产量会降低,这可能是大分子木聚糖的降解所致。超声和微波辅助提取的最大优势是能够极大地减少提取所需要的时间,如果提取时间继续增加可能就会引起提取物的降解。
在酶法辅助提取的过程中,木聚糖酶、纤维素酶也常用于辅助提取木聚糖。Vandenbossche等[49]利用纤维素酶和半纤维素酶辅助提取甜玉米、甘蔗渣等植物材料的半纤维素。此外,Morais等[52]开拓性地开发硬木木聚糖的深共晶溶剂提取法,由氯化胆碱和尿素或乙酸形成深共晶溶剂,应用响应面法优化木聚糖的溶解条件(深共晶溶剂水溶液的温度、摩尔比和浓度),并以此条件提取蓝桉木木聚糖,收率为14.81%。
1.3 分离纯化离心分离是木聚糖分离纯化过程的常用方法。无论是溶剂提取完成后生物质残渣与提取液的分离,还是酸或醇沉降后的固液分离都需要利用离心力将两相分开,这种物理作用虽然不会对提取物的结构和性质造成影响,但是分离效果却直接影响杂质的含量以及产物的纯度和收率。此外,酶解也能提高提取液的木聚糖纯度,通过淀粉酶、蛋白酶、葡萄糖淀粉酶等的生物催化作用能有效地去除溶解在提取液中的淀粉和蛋白质[18, 53, 54]。相比于离心分离和酶解,膜分离和沉淀分离是纯化木聚糖更重要的方法。因此,只有充分了解各种纯化方法的特点,优化分离条件,才能够提高混合物中各组分的分离程度,为进一步的纯化或应用做铺垫。
1.3.1 膜分离膜分离是浓缩和纯化木聚糖提取液的高效方法。工业上,不同分子量截止膜可以纯化和浓缩复杂的多糖混合物,在浓度差或压力的作用下,分子质量较低的溶质透过膜,而大分子则被截留在另一侧。膜分离可用于分离木聚糖溶液中的低聚糖和小分子物质,如酸、碱、盐等。Wijaya等[55]使用RS50超滤膜(截留分子量150 000 Da)先回收酶解液中的大分子木聚糖,再使用NTR-7410纳滤膜(截留分子量3 000 Da)和NTR-7450纳滤膜(截留分子量600-800 Da)将低聚木糖与单糖(木糖)分离。Sukhbaatar等[42]应用超滤膜ETNA10PP (截留分子量10 000 Da)分离高分子量的半纤维素分子,再用纳滤膜ETNA01PP(截留分子量1 000 Da)和Alfa Laval-NF (截留分子量400 Da)分离低分子量和单体半纤维素组分。木聚糖提取液中含有部分低聚糖和单糖,纳滤膜可用于分离这些副产物。低聚木糖通常由木聚糖水解产生,水解液中的木糖被认为是低聚木糖生产中不需要的副产品[56]。Lian等[57]通过150-200 Da的纳滤膜去除木聚糖酶解液中的低分子量物质,能够回收酶解液中84.15%的低聚木糖和87.45%的木聚糖。当溶液中组分与膜的平均截留分子量相近时,容易引发膜孔隙堵塞,导致渗透通量急剧下降[58]。
膜通量、选择性和污染情况是分离过程首要考虑的3个因素,通量、滞留物和污垢对超滤过程的成本有相当大的影响[59]。Arkell等[60]发现降低麦麸半纤维素的黏度能够增加超滤过程的膜通量,黏度降低25%,通量增加了约30%,通过不同截留分子量膜分离依次进行,能更有效地纯化木聚糖。
1.3.2 沉淀分离法沉淀分离法是木聚糖分离纯化的另一个重要的方法。由于木聚糖大部分溶于碱,部分溶于水,通过加酸(乙酸、盐酸等)调整木聚糖浓缩液的pH值(3.5-7)使提取物沉降,再经过离心、过滤等方式得到分离产物(水不溶性木聚糖),酸性条件下未沉降的提取物可以通过加入乙醇使其沉淀(水溶性木聚糖)。
中和与醇沉得到的组分在结构和性质上存在差异。Jiang等[61]研究表明,中和、乙醇沉淀半纤维素收率分别为36.4%和50.4%,中和组分比醇沉组分单糖组成更均匀,两者的物理化学性质明显不同,如平均分子质量、粒径、Zeta电位和热稳定性等。并且,不同乙醇浓度沉淀的提取物结构和性质也有区别。更多高度支化的半纤维素倾向于在更高浓度的乙醇溶液中沉淀[38]。Bian等[62]采用分级醇沉的方法分离半纤维素,分析结果表明,分子量大、分支较少的半纤维素在较低的乙醇百分比浓度中沉淀,随着乙醇浓度的增加,得到更多低分子量、高分支的半纤维素。
2 木聚糖的应用天然提取得到的木聚糖多应用于食品与制药,可作为人类食物的植物,尤其是富含木聚糖的禾本科植物,是人们摄取膳食纤维的主要来源。哺乳动物本身不能降解植物细胞壁多糖,而是依赖于肠道微生物的分解[63]。膳食纤维的摄入与健康的肠道微生物群、有利的体质量以及整体代谢健康有关,同时也能够降低心血管疾病发生的风险和死亡率[64]。肠道微生物发酵利用富含木聚糖等成分的膳食纤维,代谢产生的短链脂肪酸SCFA(木聚糖发酵主要在小肠中产生丁酸[65]),既是肠道上皮细胞的主要能量来源,同时也能影响菌群结构,参与宿主的代谢机能与生理调控[66]。Yang等[67]研究发现,木聚糖能够增强大菱鲆幼鱼肠道黏膜屏障功能和调节微生物群。Wang等[68]的研究结果表明,补充木聚糖可以选择性促进大肠内假小链双歧杆菌(Bifidobacterium pseudocatenulatum)增殖来缓解肠道菌群失调。麦麸衍生的阿拉伯木聚糖具有刺激抗体介导的鸡免疫应答的潜力,可作为一种低成本的植物成分替代对抗疗法药物来预防禽球虫病[69]。虽然这些研究表明木聚糖具备应用于食品与药物领域的巨大潜力,但是其来源、结构和性质以及生物活性的关系未有足够广泛和完善的研究支撑。Gill等[70]认为,不同膳食纤维的物理化学性质(如溶解性、黏度和发酵性)因其来源和加工有很大差异,是其功能特性和临床用途的决定因素。因此,未来的研究应特别强调特定结构,以及同时摄入不同结构类型复合多糖对健康益处的评估。
木聚糖交联制备的水凝胶在生物医学领域有广泛的应用,如皮肤护理材料[71]、伤口敷料[72]、药物传递载体[73]等。基于木聚糖-硫辛酸(Xylan-lipoic acid)结合物的纳米颗粒被开发用于癌症治疗中靶向给药治疗[74]。由木聚糖解聚得到的低聚木糖可以作为一种益生元[75]。此外,木聚糖或一些修饰改性木聚糖(磷酸化[76]、羧甲基化[77]、羟丙基磺化[78]、季铵化[79]等)可以应用于食品包装、可降解薄膜、抗菌薄膜等膜材料领域。木聚糖的成膜能力和生物降解性使其有望成为食品塑料包装的替代品[80-82]。木聚糖还可以应用于造纸[83]、作为染料絮凝剂[84]或生产糠醛[85]、乙醇[86]等。
3 展望本文从预处理、提取方法、分离纯化方法和应用4个方面总结了木聚糖制备和应用相关的研究现状。在预处理方法中,应根据植物材料的淀粉、多糖、脂质和木质素含量来确定如何进行脱脂、水提取预处理、脱木质素。含种实的禾本科植物淀粉含量较高,水提取预处理是提高产品纯度的有效预处理方法。利用亚氯酸钠等试剂脱木质素能有效提高产物纯度,但是过高地追求木质素脱除率反而会降低木聚糖产率并影响产物结构,最佳方式是以木聚糖产率和纯度来综合衡量脱木质素的方法和工艺条件。在提取方法中,不同溶剂(碱、水、二甲基亚砜等)提取的木聚糖,结构和性质存在差异,机械作用、压力、超声、微波和酶等也可用于辅助溶剂提取。在分离纯化方法中,膜分离能有效去除小分子杂质,沉淀分离是获得木聚糖的重要方法。经过这些制备步骤获取的木聚糖可广泛应用于食品、医药、水凝胶、包装膜材料、药物传递载体、染料絮凝剂和造纸增强剂等领域。
复杂多样的木聚糖结构虽然难以清晰地被分离纯化,但也正是结构的多样性使木聚糖应用广泛。大量的研究表明,不同提取方法获得的木聚糖产物在结构与性质上有区别。提取及分离纯化方法无一不是根据物质的结构和性质差异来实现的,如膜分离(依据分子量)、色谱分离(依据极性、分子间作用力等)、沉淀分离(依据酸、醇不相溶性)等。未来从植物材料中获取木聚糖,应以结构和性质差异为导向来制定并实施提取分离纯化策略,这是一个极具研究和工业应用价值的方向。以此分离得到结构相似、性质相同的高纯度组分,才能在最适合的应用领域发挥其应有的作用。同时,在分离纯化木聚糖的过程中,木质纤维素中另外两大组分(纤维素与木质素)也应得到分离,根据其化学性质再分别开发出一系列的生物基产品,实现全组分的开发利用。以综合收益取得效益最大化,是商业可行的关键。
| [1] |
NAIDU D S, HLANGOTHI S P, JOHN M J. Bio-based products from xylan: A review[J]. Carbohydrate Polymers, 2018, 179: 28-41. DOI:10.1016/j.carbpol.2017.09.064 |
| [2] |
XU C, ZHANG X, HUSSEIN Z, et al. Influence of the structure and properties of lignocellulose on the physicochemical characteristics of lignocellulose-based residues used as an environmentally friendly substrate[J]. Science of the Total Environment, 2021, 790: 148089. DOI:10.1016/j.scitotenv.2021.148089 |
| [3] |
GHOSH D, TANNER J, LAVOIE J M, et al. An integrated approach for hemicellulose extraction from forest residue[J]. Bioresources, 2021, 16(2): 2524-2547. DOI:10.15376/biores.16.2.2524-2547 |
| [4] |
ISIKGOR F H, BECER C R. Lignocellulosic biomass: A sustainable platform for the production of bio-based chemicals and polymers[J]. Polymer Chemistry, 2015, 6(25): 4497-4559. DOI:10.1039/C5PY00263J |
| [5] |
CAO L J, ZHANG R, ZHOU J P, et al. Biotechnological aspects of salt-tolerant xylanases: A review[J]. Journal of Agricultural and Food Chemistry, 2021, 69(31): 8610-8624. DOI:10.1021/acs.jafc.1c03192 |
| [6] |
KHAIRE K C, SHARMA K, THAKUR A, et al. Extraction and characterization of xylan from sugarcane tops as a potential commercial substrate[J]. Journal of Bioscience and Bioengineering, 2021, 131(6): 647-654. DOI:10.1016/j.jbiosc.2021.01.009 |
| [7] |
SCHAFER J, SATTLER M, IQBAL Y, et al. Characterization of Miscanthus cell wall polymers[J]. Global Change Biology Bioenergy, 2019, 11(1): 191-205. DOI:10.1111/gcbb.12538 |
| [8] |
LIU X X, LIN Q X, YAN Y H, et al. Hemicellulose from plant biomass in medical and pharmaceutical application: A critical review[J]. Current Medicinal Chemistry, 2019, 26(14): 2430-2455. DOI:10.2174/0929867324666170705113657 |
| [9] |
DA COSTA URTIGA S C, MARCELINO H R, DO TABOSA EGITO E S, et al. Xylan in drug delivery: A review of its engineered structures and biomedical applications[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2020, 151: 199-208. DOI:10.1016/j.ejpb.2020.04.016 |
| [10] |
DE CARVALHO D M, BERGLUND J, MARCHAND C, et al. Improving the thermal stability of different types of xylan by acetylation[J]. Carbohydrate Polymers, 2019, 220: 132-140. DOI:10.1016/j.carbpol.2019.05.063 |
| [11] |
PENG F, BIAN J, REN J L, et al. Fractionation and characterization of alkali-extracted hemicelluloses from peashrub[J]. Biomass and Bioenergy, 2012, 39: 20-30. DOI:10.1016/j.biombioe.2010.08.034 |
| [12] |
SIDDEEG A, ZENG X A, AMMAR A F, et al. Sugar profile, volatile compounds, composition and antioxidant activity of Sukkari date palm fruit[J]. Journal of Food Science and Technology-Mysore, 2019, 56(2): 754-762. DOI:10.1007/s13197-018-3534-y |
| [13] |
PAVLOVICH-ABRIL A, ROUZAUD-SÁNDEZ O, CARVAJAL-MILLÁN E, et al. Molecular characterization of water extractable arabinoxylans isolated from wheat fine bran and their effect on dough viscosity[J]. LWT-Food Science and Technology, 2016, 74: 484-492. DOI:10.1016/j.lwt.2016.08.007 |
| [14] |
MD SALIM R, ASIK J, SARJADI M S. Chemical functional groups of extractives, cellulose and lignin extracted from native Leucaena leucocephala bark[J]. Wood Science and Technology, 2021, 55(2): 295-313. DOI:10.1007/s00226-020-01258-2 |
| [15] |
CANTU-JUNGLES T M, IACOMINI M, CIPRIANI T R, et al. Isolation and characterization of a xylan with industrial and biomedical applications from edible açaí berries (Euterpe oleraceae)[J]. Food Chemistry, 2017, 221: 1595-1597. DOI:10.1016/j.foodchem.2016.10.133 |
| [16] |
SVÄRD A, BRÄNNVALL E, EDLUND U. Rapeseed straw as a renewable source of hemicelluloses: Extraction, characterization and film formation[J]. Carbohydrate Polymers, 2015, 133: 179-186. DOI:10.1016/j.carbpol.2015.07.023 |
| [17] |
BULONE V, SCHWERDT J G, FINCHER G B. Co-evolution of enzymes involved in plant cell wall metabolism in the grasses[J]. Frontiers in Plant Science, 2019, 10: 1009. DOI:10.3389/fpls.2019.01009 |
| [18] |
YAO H Y, WANG Y X, YIN J Y, et al. Isolation, physicochemical properties, and structural characteristics of arabinoxylan from hull-less barley[J]. Molecules, 2021, 26(10): 3026. DOI:10.3390/molecules26103026 |
| [19] |
MA J, JI Z, CHEN J C, et al. The mechanism of xylans removal during hydrothermal pretreatment of poplar fibers investigated by immunogold labeling[J]. Planta, 2015, 242(1): 327-337. DOI:10.1007/s00425-015-2313-5 |
| [20] |
JACQUEMIN L, MOGNI A, ZEITOUN R, et al. Comparison of different twin-screw extraction conditions for the production of arabinoxylans[J]. Carbohydrate Polymers, 2015, 116: 86-94. DOI:10.1016/j.carbpol.2014.06.071 |
| [21] |
KISHANI S, ESCALANTE A, TORIZ G, et al. Experimental and theoretical evaluation of the solubility/insolubility of spruce xylan (arabino glucuronoxylan)[J]. Biomacromolecules, 2019, 20(3): 1263-1270. DOI:10.1021/acs.biomac.8b01686 |
| [22] |
HAN Y Z, BAI Y C, ZHANG J Z, et al. A comparison of different oxidative pretreatments on polysaccharide hydrolyzability and cell wall structure for interpreting the greatly improved enzymatic digestibility of sugarcane bagasse by delignification[J]. Bioresources and Bioprocessing, 2020, 7: 24. DOI:10.1186/s40643-020-00312-y |
| [23] |
JIN X C, HU Z H, WU S F, et al. Promoting the material properties of xylan-type hemicelluloses from the extraction step[J]. Carbohydrate Polymers, 2019, 215: 235-245. DOI:10.1016/j.carbpol.2019.03.092 |
| [24] |
KAUR P, KAUR R. Optimization of xylan extraction process from rice straw for production of autohydrolysates rich in prebiotic xylooligosaccharides[J]. Cellulose Chemistry and Technology, 2021, 55(9/10): 1001-1017. |
| [25] |
SINGH R D, BANERJEE J, SASMAL S, et al. High xylan recovery using two stage alkali pre-treatment process from high lignin biomass and its valorisation to xylooligosaccharides of low degree of polymerisation[J]. Bioresource Technology, 2018, 256: 110-117. DOI:10.1016/j.biortech.2018.02.009 |
| [26] |
SHARMA K, KHAIRE K C, THAKUR A, et al. Acacia xylan as a substitute for commercially available xylan and its application in the production of xylooligosaccharides[J]. ACS Omega, 2020, 5(23): 13729-13738. DOI:10.1021/acsomega.0c00896 |
| [27] |
DE CARVALHO D M, MARTÍNEZ-ABAD A, EV-TUGUIN D V, et al. Isolation and characterization of acetylated glucuronoarabinoxylan from sugarcane bagasse and straw[J]. Carbohydrate Polymers, 2017, 156: 223-234. DOI:10.1016/j.carbpol.2016.09.022 |
| [28] |
LIU W, HOU Q X, MAO C B, et al. Hemicelluloses prior to aspen chemithermomechanical pulping: Pre-extraction, separation, and characterization[J]. Journal of Agricultural and Food Chemistry, 2012, 60(19): 4880-4885. DOI:10.1021/jf300787b |
| [29] |
YANG R, CAO Q H, LIANG Y Y, et al. High capacity oil absorbent wood prepared through eco-friendly deep eutectic solvent delignification[J]. Chemical Engineering Journal, 2020, 401: 126150. DOI:10.1016/j.cej.2020.126150 |
| [30] |
ALMEIDA R O, MOREIRA A, MOREIRA D, et al. High-performance delignification of invasive tree species wood with ionic liquid and deep eutectic solvent for the production of cellulose-based polyelectrolytes[J]. Royal Society of Chemistry, 2022, 12(7): 3979-3989. |
| [31] |
NARAN R, BLACK S, DECKER S R, et al. Extraction and characterization of native heteroxylans from delignified corn stover and aspen[J]. Cellulose, 2009, 16(4): 661-675. DOI:10.1007/s10570-009-9324-y |
| [32] |
CAPEK P, MATULOVÁ M. An arabino(glucurono)xylan isolated from immunomodulatory active hemicellulose fraction of Salvia officinalis L[J]. International Journal of Biological Macromolecules, 2013, 59: 396-401. DOI:10.1016/j.ijbiomac.2013.04.076 |
| [33] |
ZAHRAA J, KARIM M, ALEXANDRE B, et al. Mea-ning of xylan acetylation on xylan-cellulose interactions: A quartz crystal microbalance with dissipation (QCM-D) and molecular dynamic study[J]. Carbohydrate Polymers, 2020, 226: 115315. DOI:10.1016/j.carbpol.2019.115315 |
| [34] |
BANERJEE P N, PRANOVICH A, DAX D, et al. Non-cellulosic heteropolysaccharides from sugarcane bagasse-sequential extraction with pressurized hot water and alkaline peroxide at different temperatures[J]. Bioresource Technology, 2014, 155: 446-450. DOI:10.1016/j.biortech.2014.01.020 |
| [35] |
WEI L S, YAN T J, WU Y F, et al. Optimization of alkaline extraction of hemicellulose from sweet sorghum bagasse and its direct application for the production of acidic xylooligosaccharides by Bacillus subtilis strain MR44[J]. PLoS One, 2018, 13(4): e0195616. DOI:10.1371/journal.pone.0195616 |
| [36] |
GU H Q, ZHU Y Y, LI J, et al. Ultrasound-assisted fractionation of dried distillers′ grains with solubles (DDGS) at mild temperature for co-production of xylan and protein feed[J]. Journal of Chemical Technology and Biotechnology, 2019, 94(3): 829-836. DOI:10.1002/jctb.5830 |
| [37] |
EGÜÉS I, SANCHEZ C, MONDRAGON I, et al. Effect of alkaline and autohydrolysis processes on the purity of obtained hemicelluloses from corn stalks[J]. Bioresource Technology, 2012, 103(1): 239-248. DOI:10.1016/j.biortech.2011.09.139 |
| [38] |
PENG X P, NIE S X, LI X P, et al. Characteristics of the water- and alkali-soluble hemicelluloses fractionated by sequential acidification and graded-ethanol from sweet maize stems[J]. Molecules, 2019, 24(1): 212. DOI:10.3390/molecules24010212 |
| [39] |
SUN S L, WEN J L, MA M G, et al. Successive alkali extraction and structural characterization of hemicelluloses from sweet sorghum stem[J]. Carbohydrate Polymers, 2013, 92(2): 2224-2231. DOI:10.1016/j.carbpol.2012.11.098 |
| [40] |
CHIMPHANGO A F A, VAN ZYL W H, GÖRGENS J F. Isolation, characterization and enzymatic modification of water soluble xylans from Eucalyptus grandis wood and sugarcane bagasse[J]. Journal of Chemical Technology and Biotechnology, 2012, 87(10): 419-1429. |
| [41] |
BURANOV A U, MAZZA G. Extraction and characterization of hemicelluloses from flax shives by different methods[J]. Carbohydrate Polymers, 2010, 79(1): 17-25. DOI:10.1016/j.carbpol.2009.06.014 |
| [42] |
SUKHBAATAR B, HASSAN EL B, KIM M, et al. Optimization of hot-compressed water pretreatment of bagasse and characterization of extracted hemicelluloses[J]. Carbohydrate Polymers, 2014, 101: 196-202. DOI:10.1016/j.carbpol.2013.09.027 |
| [43] |
ZHANG Z X, SMITH C, LI W L. Extraction and modification technology of arabinoxylans from cereal by-products: A critical review[J]. Food Research International, 2014, 65(Part C): 423-436. |
| [44] |
BORREGA M, SIXTA H. Purification of cellulosic pulp by hot water extraction[J]. Cellulose, 2013, 20(6): 2803-2812. DOI:10.1007/s10570-013-0086-1 |
| [45] |
MONTEIRO C R M, ÁVILA P F, PEREIRA M A F, et al. Hydrothermal treatment on depolymerization of hemicellulose of mango seed shell for the production of xylooligosaccharides[J]. Carbohydrate Polymers, 2021, 253: 117274. DOI:10.1016/j.carbpol.2020.117274 |
| [46] |
PENG F, BIAN J, PENG P, et al. Separation and characterization of acetyl and non-acetyl hemicelluloses of Arundo donax by ammonium sulfate precipitation[J]. Journal of Agricultural and Food Chemistry, 2012, 60(16): 4039-4047. DOI:10.1021/jf3000828 |
| [47] |
SUN Y C, WEN J L, XU F, et al. Structural and thermal characterization of hemicelluloses isolated by organic solvents and alkaline solutions from Tamarix austromongolica[J]. Bioresource Technology, 2011, 102(10): 5947-951. DOI:10.1016/j.biortech.2011.03.012 |
| [48] |
DAOU C, ZHANG H. Study on functional properties of physically modified dietary fibres derived from defatted rice bran[J]. Journal of Agricultural Science, 2012, 4(9): 85-97. |
| [49] |
VANDENBOSSCHE V, BRAULT J, HERNANDEZ-MELENDEZ O, et al. Suitability assessment of a continuous process combining thermo-mechano-chemical and bio-catalytic action in a single pilot-scale twin-screw extruder for six different biomass sources[J]. Bioresource Technology, 2016, 211: 146-153. DOI:10.1016/j.biortech.2016.03.072 |
| [50] |
KARUNANITHY C, MUTHUKUMARAPPAN K. Thermo-mechanical pretreatment of feedstocks [M]//Gu, T. (eds) Green Biomass Pretreatment for Biofuels Production. SpringerBriefs in Molecular Science. Springer, Dordrecht, 2013: 31-65. 10.1007/978-94-007-6052-3_2
|
| [51] |
JIANG Y Y, BAI X, LANG S M, et al. Optimization of ultrasonic-microwave assisted alkali extraction of arabinoxylan from the corn bran using response surface methodology[J]. International Journal of Biological Macromolecules, 2019, 128: 452-458. DOI:10.1016/j.ijbiomac.2019.01.138 |
| [52] |
MORAIS E S, MENDONCA P V, COELHO J F J, et al. Deep eutectic solvent aqueous solutions as efficient media for the solubilization of hardwood xylans[J]. ChemSusChem, 2018, 11(4): 753-762. DOI:10.1002/cssc.201702007 |
| [53] |
FADEL A, PLUNKETT A, ASHWORTH J, et al. The effect of extrusion screw-speed on the water extractability and molecular weight distribution of arabinoxylans from defatted rice bran[J]. Journal of Food Science and Technology, 2018, 55(3): 1201-1206. DOI:10.1007/s13197-017-3010-0 |
| [54] |
SAVITHA PRASHANTH M R, MURALIKRISHNA G. Arabinoxylan from finger millet (Eleusine coracana, v. Indaf 15) bran: Purification and characterization[J]. Carbohydrate Polymers, 2014, 99: 800-807. DOI:10.1016/j.carbpol.2013.08.079 |
| [55] |
WIJAYA H, SASAKI K, KAHAR P, et al. High enzymatic recovery and purification of xylooligosaccharides from empty fruit bunch via nanofiltration[J]. Processes, 2020, 8(5): 619. DOI:10.3390/pr8050619 |
| [56] |
ZHOU X, XU Y. Integrative process for sugarcane bagasse biorefinery to co-produce xylooligosaccharides and gluconic acid[J]. Bioresource Technology, 2019, 282: 81-87. DOI:10.1016/j.biortech.2019.02.129 |
| [57] |
LIAN Z, WANG Y, LUO J, et al. An integrated process to produce prebiotic xylooligosaccharides by autohydrolysis, nanofiltration and endo-xylanase from alkali-extracted xylan[J]. Bioresource Technology, 2020, 314: 123685. DOI:10.1016/j.biortech.2020.123685 |
| [58] |
SUEB M S M, LUO J Q, MEYER A S, et al. Impact of the fouling mechanism on enzymatic depolymerization of xylan in different configurations of membrane reactors[J]. Separation and Purification Technology, 2017, 178: 154-162. DOI:10.1016/j.seppur.2017.01.038 |
| [59] |
PERSSON T, JÖNSSON A S. Isolation of hemicelluloses by ultrafiltration of thermomechanical pulp mill process water-influence of operating conditions[J]. Chemical Engineering Research and Design, 2010, 88(12): 1548-1554. DOI:10.1016/j.cherd.2010.04.002 |
| [60] |
ARKELL A, KRAWCZYK H, JÖNSSON A S. Influence of heat pretreatment on ultrafiltration of a solution containing hemicelluloses extracted from wheat bran[J]. Separation and Purification Technology, 2013, 119: 46-50. DOI:10.1016/j.seppur.2013.09.001 |
| [61] |
JIANG H, CHEN Q Q, GE J H, et al. Efficient extraction and characterization of polymeric hemicelluloses from hybrid poplar[J]. Carbohydrate Polymers, 2014, 101: 1005-1012. DOI:10.1016/j.carbpol.2013.10.030 |
| [62] |
BIAN J, PENG F, PENG P, et al. Isolation and fractionation of hemicelluloses by graded ethanol precipitation from Caragana korshinskii[J]. Carbohydrate Research, 2010, 345(6): 802-809. DOI:10.1016/j.carres.2010.01.014 |
| [63] |
HAO Z Z, WANG X L, YANG H M, et al. PUL-mediated plant cell wall polysaccharide utilization in the gut bacteroidetes[J]. International Journal of Molecular Sciences, 2021, 22(6): 3077. DOI:10.3390/ijms22063077 |
| [64] |
BARBER T M, KABISCH S, PFEIFFER A F H, et al. The health benefits of dietary fibre[J]. Nutrients, 2020, 12(10): 3209. DOI:10.3390/nu12103209 |
| [65] |
TIWARI U P, SINGH A K, JHA R. Fermentation characteristics of resistant starch, arabinoxylan, and beta-glucan and their effects on the gut microbial ecology of pigs: A review[J]. Animal Nutrition, 2019, 5(3): 217-226. DOI:10.1016/j.aninu.2019.04.003 |
| [66] |
KOH A, VADDER F D, KOVATCHEVA-DATCHA-RY P, et al. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [67] |
YANG P, HU H B, LI Y X, et al. Effect of dietary xylan on immune response, tight junction protein expression and bacterial community in the intestine of juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture, 2019, 512: 734361. DOI:10.1016/j.aquaculture.2019.734361 |
| [68] |
WANG Z Y, BAI Y, PI Y, et al. Xylan alleviates dietary fiber deprivation-induced dysbiosis by selectively promoting updates Bifidobacterium pseudocatenulatum in pigs[J]. Microbiome, 2021, 9(1): 227. DOI:10.1186/s40168-021-01175-x |
| [69] |
AKHTAR M, TARIQ A F, AWAIS M M, et al. Studies on wheat bran Arabinoxylan for its immunostimulatory and protective effects against avian coccidiosis[J]. Carbohydrate Polymers, 2012, 90(1): 333-339. DOI:10.1016/j.carbpol.2012.05.048 |
| [70] |
GILL S K, ROSSI M, BAJKA B, et al. Dietary fibre in gastrointestinal health and disease[J]. Nature Reviews Gastroenterology and Hepatology, 2021, 18(2): 101-116. DOI:10.1038/s41575-020-00375-4 |
| [71] |
FU G Q, ZHANG S C, CHEN G G, et al. Xylan-based hydrogels for potential skin care application[J]. International Journal of Biological Macromolecules, 2020, 158: 244-250. DOI:10.1016/j.ijbiomac.2020.04.235 |
| [72] |
AJOVALASIT A, SABATINO M A, TODARO S, et al. Xyloglucan-based hydrogel films for wound dressing: Structure-property relationships[J]. Carbohydrate Polymers, 2018, 179: 262-272. DOI:10.1016/j.carbpol.2017.09.092 |
| [73] |
LI J, LU Z J, CHEN Z X, et al. Preparation and characterization of pH-responsive microgel using arabinoxylan from wheat bran for BSA delivery[J]. Food Chemistry, 2021, 342: 128220. DOI:10.1016/j.foodchem.2020.128220 |
| [74] |
SAURAJ, KUMAR A, KUMAR B, et al. Redox-sensitive nanoparticles based on xylan-lipoic acid conjugate for tumor targeted drug delivery of niclosamide in cancer therapy[J]. Carbohydrate Research, 2021, 499: 108222. DOI:10.1016/j.carres.2020.108222 |
| [75] |
POLETTO P, PEREIRA G N, MONTEIRO C R M, et al. Xylooligosaccharides: Transforming the lignocellulosic biomasses into valuable 5-carbon sugar prebiotics[J]. Process Biochemistry, 2020, 91: 352-363. DOI:10.1016/j.procbio.2020.01.005 |
| [76] |
QIAN S Q, YU Y T, MA J, et al. Evaluation of a novel phosphorylated corn straw xylan for enhancement of thermal stability, crystallinity and functional activity[J]. International Journal of Food Science and Technology, 2022, 57(1): 481-488. DOI:10.1111/ijfs.15428 |
| [77] |
GENG W H, VENDITTI R A, PAWLAK J J, et al. Carboxymethylation of hemicellulose isolated from poplar (Populus grandidentata) and its potential in water-soluble oxygen barrier films[J]. Cellulose, 2020, 27(6): 3359-3377. DOI:10.1007/s10570-020-02993-2 |
| [78] |
SOUSA S, RAMOS A, EVTUGUIN D V, et al. Xylan and xylan derivatives-Their performance in bio-based films and effect of glycerol addition[J]. Industrial Crops and Products, 2016, 94: 682-689. DOI:10.1016/j.indcrop.2016.09.031 |
| [79] |
ŠIMKOVIC I, TRACZ A, KELNAR I, et al. Quaternized and sulfated xylan derivative films[J]. Carbohydrate Polymers, 2014, 99: 356-364. DOI:10.1016/j.carbpol.2013.08.075 |
| [80] |
ZHAO Y L, SUN H, YANG B, et al. Hemicellulose-based film: Potential green films for food packaging[J]. Polymers, 2020, 12(8): 1775. DOI:10.3390/polym12081775 |
| [81] |
NECHITA P, MIRELA R, CIOLACU F. Xylan hemicellulose: A renewable material with potential properties for food packaging applications[J]. Sustainability, 2021, 13(24): 13504. DOI:10.3390/su132413504 |
| [82] |
SEIWERT K, KAMDEM D P, KOCABAŞ D S, et al. Development and characterization of whey protein isolate and xylan composite films with and without enzymatic crosslinking[J]. Food Hydrocolloids, 2021, 120: 106847. DOI:10.1016/j.foodhyd.2021.106847 |
| [83] |
WANG X Y, HU F H, LU X M, et al. Impact of degree of substitution of cationic xylan on strength of cellulose fiber networks along with medium conductivity[J]. Industrial Crops and Products, 2021, 159: 113058. DOI:10.1016/j.indcrop.2020.113058 |
| [84] |
XU D D, LIU Z M, ZHOU W P, et al. Preparation of xylan-acrylic acid polymer with high molecular weight and its application as a dye removal flocculant[J]. Journal of Wood Chemistry and Technology, 2019, 39(2): 75-89. DOI:10.1080/02773813.2018.1508300 |
| [85] |
HOANG P H, CUONG T D, DIEN L Q. Ultrasound assisted aonversion of corncob-derived xylan to furfural under HSO3-ZSM-5 zeolite catalyst[J]. Waste and Biomass Valorization, 2021, 12(4): 1955-1962. DOI:10.1007/s12649-020-01152-9 |
| [86] |
OKAMOTO K, GODA T, YAMADA T, et al. Direct ethanol production from xylan and acorn using the starch-fermenting basidiomycete fungus Phlebia acerina[J]. Fermentation, 2021, 7(3): 116. DOI:10.3390/fermentation7030116 |