2. 江苏省海洋水产研究所,江苏南通 226007;
3. 上海海洋大学,上海 201306
2. Jiangsu Marine Fisheries Research Institute, Nantong, Jiangsu, 226007, China;
3. Shanghai Ocean University, Shanghai, 201306, China
条斑紫菜(Neopyropia yezoensis)是我国重要的经济红藻,主产于江苏海区,此外山东与辽宁海区也有少量分布。2020-2021生产年度,条斑紫菜育苗面积达8×105 m2,海上栽培面积4.1×104 hm2,干紫菜产量5.6×109枚(数据由江苏省紫菜协会提供),条斑紫菜产业是我国长江以北人工栽培海藻中最具经济价值的产业[1]。长期以来条斑紫菜种苗培育效率滞后于栽培面积的快速发展,每年均会出现部分地区种苗供应紧张的情况,导致种苗培育面积无序发展,育苗面积与栽培面积比逐年增加,育苗企业亏损面扩大,不利于紫菜产业的稳定。紫菜的种苗培育技术急需向机械化、智能化方向发展以提高育苗效率,而其中种苗培养基质的筛选,以及突破贝壳基质的制约因素而开发新型基质,是解决工厂化育苗的关键环节。
1953-1954年,日本藻类学家黑木宗尚和我国藻类学家曾呈奎几乎同时完成了甘紫菜(Neopyropia tenera,曾用名Porphyra tenera)生活史的研究,为紫菜的人工育苗打下理论基础[2],此后曾有自由丝状体(Free-living conchocelis)采苗[3]、单孢子采苗[4]、紫菜叶状体细胞酶法采苗[5]等无基质育苗技术出现,均因采苗量达不到生产要求而未被市场接受。目前紫菜种苗产业仍采用基质培养技术,且贝壳是唯一的培养基质,天然贝壳由95%-99%的碳酸钙(方解石、文石、球霰石及非晶态)和1%-5%的蛋白质(糖蛋白、多糖、几丁质和脂质等)构成[6],种苗以贝壳丝状体(Shell conchocelis[7])形式生长于贝壳内层。这与贝壳丝状体的特殊生长方式有关,紫菜果孢子附着于贝壳内层表面,萌发形成丝状体后钻入贝壳生长[8],而硅藻、蓝藻等杂藻不能钻入贝壳,因此生产培养中可通过简单的清洗贝壳表面加以纯化,从而可以大规模培养贝壳丝状体。相反,悬浮培养的自由丝状体常因杂藻而导致污染难以去除[9]。此外,贝壳丝状体生长于贝壳内层表面一定深度,受光较为均匀,可以大量同步形成“双分”,保障了短期内大规模采苗的要求。
文蛤(Meretrix meretrix)、牡蛎、三角帆蚌(Hyriopsis cumingii)和扇贝的贝壳是4种广泛应用的紫菜种苗培养基质,适宜紫菜丝状体生长且较易获取[10]。Heo等[11]研究认为牡蛎壳的紫菜丝状体接种效率高于扇贝壳和文蛤壳。除贝壳外,也有研究表明蛋壳可作为紫菜种苗培养的基质[12]。但目前对紫菜种苗培养技术研究主要聚焦于培养的环境因子上,如光照强度、光周期与培养水温等[13-15],以及黄斑病[16, 17]等病害防治方面,未见对贝壳培育性能的系统性研究。因此,本研究选取不同基质材料,如文蛤、近江牡蛎(Ostrea rivularis)壳、三角帆蚌壳、虾夷扇贝壳(Patinopecten yessoensis)壳、海月蛤(Placuna placenta)壳、鸡蛋壳、珍珠等生物合成基质,以及方解石原石、霰石原石、几丁质碎片与壳聚糖薄膜等与贝壳成分相关的非生物基质,拟通过比较分析,研究多种基质对条斑紫菜贝壳丝状体着生、生长与壳孢子放散的影响,筛选最适培养基质,为贝壳替代基质的研究打下科学基础。
1 材料与方法 1.1 材料条斑紫菜自由丝状体取自国家级紫菜种质库Y-9101品系,文蛤壳、近江牡蛎壳、三角帆蚌壳、虾夷扇贝壳由如东华通水产品有限公司提供,海月蛤壳、鸡蛋壳、珍珠、方解石原石、霰石原石从市场购买,几丁质(Lot.G7TDKRJ)由东京化成工业株式会社生产,高黏度壳聚糖(Lot.C11029612)由上海麦克林生化科技有限公司生产。
1.2 仪器光照培养箱(MGZ-120B-3,上海丙林电子科技有限公司);生物显微镜[E800,尼康仪器(上海)有限公司];光谱闪烁照度计(SFIM-300,杭州远方光电信息股份有限公司);扫描电子显微镜(JSM-6510,日本电子株式会社)。
1.3 方法 1.3.1 丝状体接种与培养将文蛤壳、近江牡蛎壳、三角帆蚌壳、虾夷扇贝壳、海月蛤壳、鸡蛋壳、珍珠、方解石原石和霰石原石清洗干净,其中鸡蛋壳放入有效氯含量5%(m∶V)的84消毒液中浸泡12 h,使鸡蛋壳乳突层与蛋壳内侧的壳膜层纤维分离[18],用镊子将壳膜层清除干净。壳聚糖加入2%(V∶V)乙酸配置成5%(V∶V)壳聚糖溶液,将5%壳聚糖溶液倒入培养皿自然晾干形成壳聚糖薄膜,冲洗至pH中性。将条斑紫菜自由丝状体打碎成40-60 μm小段,分别接种于上述培养基质上,接种密度为150 ind./cm2,将每种贝壳各3枚、鸡蛋壳碎片3枚(每枚约10 cm2)、珍珠5粒放入培养盒培养,共设置4组平行。将方解石原石、霰石原石各3块、壳聚糖薄膜3张、碎片状几丁质1 g放入培养盒中共同培养,设置培养条件为光照强度(12.5±1.0) μmol/(m2·s),培养温度16℃,海水盐度27‰,光照周期12D∶12L。
1.3.2 着生密度与着生效率的测量接种后每周用生物显微镜观察丝状体着生情况,接种6周后贝壳等基质表面藻斑肉眼清晰可见,统计藻斑数量,计算着生密度(着生密度=藻斑数/贝壳面积),从而计算出着生效率(着生效率=着生密度/接种密度×100%)。
1.3.3 贝壳丝状体长度的测量接种2周起通过测量藻斑直径计算水平生长面积(藻斑近似圆形),至藻斑生长交连到一起时停止测量。分别于第55天与第100天将贝壳等基质沿着藻斑中心处纵切,采用扫描电镜测量丝状体纵向生长长度。
1.3.4 贝壳丝状体壳孢子放散测量为了研究不同培养基质中贝壳丝状体壳孢子的放散水平,接种120 d后,分别取每种贝壳基质各1枚、珍珠5粒、鸡蛋壳碎片1枚(约10 cm2),置于50 mL海水中培养,设置4组平行。培养温度16℃,光照条件为7:00-12:30光强(31.3±1) μmol/(m2·s),12:30-18:30光强(6.3±1.0) μmol/(m2·s),18:30至次日7:00黑暗。连续20 d测定单位面积培养基质的日放散量[19],每天中午镜检壳孢子放散量后,清洗贝壳并更换海水。通过测量各种基质的接种面积(珍珠接种面积近似半球形),计算不同基质中壳孢子的日放散效率[壳孢子的日放散效率=壳孢子的日放散量/基质接种面积,spores/(cm2·d)]。
1.3.5 实验数据处理各组实验数据采用GraphPad Prism 7 (GraphPad Software Inc.,美国)进行处理。数据显著性分析采用SPSS 22 (IBM,美国)进行单因素方差分析,设置显著水平P < 0.05。
2 结果与分析 2.1 条斑紫菜丝状体着生情况及其不同培养基质微观结构未发现条斑紫菜丝状体在方解石原石、霰石原石上着生。几丁质碎片面积为1-12 mm2,浸入海水后逐渐软化,表面未发现丝状体附着。条斑紫菜丝状体一端附着于壳聚糖薄膜表面,呈自由丝状体样向外生长,并未钻入薄膜内部,藻丝有少量单侧分枝,且分枝处无明显隆起[图 1(a)]。而条斑紫菜丝状体着生于文蛤壳等5种贝壳基质以及鸡蛋壳和珍珠基质上,并向外生长与向内钻入生长,其中向外生长呈自由丝状体样,与壳聚糖薄膜表面生长的丝状体无异;向内钻入基质中,主分枝多于2条,向四周呈辐射生长,侧枝多呈对生,且多出现不定形隆起。在贝壳基质和珍珠基质中,条斑紫菜丝状体着生后先于基质表层生长后钻入内部[图 1: (b)-(g)],而在鸡蛋壳中,丝状体着生后即钻入内部,呈弥散状[图 1(h)]。

|
| 图 1 条斑紫菜贝壳丝状体着生于不同培养基质的显微图 Fig. 1 Micrographs of N.yezoensis shell conchocelis grown in different culture substrates |
通过扫描电镜对基质纵切面结构和丝状体在基质中生长的痕迹进行观测,三角帆蚌壳、文蛤壳和珍珠外层由排列密集且整齐的细小文石多边形板片相互叠加构成[图 2: (a)-(d)]。这3种基质剪切时断裂面整齐。近江牡蛎壳、虾夷扇贝壳和海月蛤壳由许多细长的菱形方解石板条层层叠加构成,切面在水平方向呈细条状纹路[图 2: (e)-(f)],剪切时易产生多层滑动断裂。条斑紫菜贝壳丝状体在这6种基质内大多集中在基质的表层,且更容易发育为孢子囊枝,下层的贝壳丝状体数量较少,且呈营养藻丝形态纵向生长。鸡蛋壳主要分为两层结构,分别是蛋壳内侧的乳突层和蛋壳外侧的栅栏层,乳突层厚度约为100 μm,蛋壳厚度约为300-400 μm [图 2(g)]。两层结构的表层均分布大量贝壳丝状体,且藻斑内外发生重叠,显示丝状体穿透蛋壳生长。
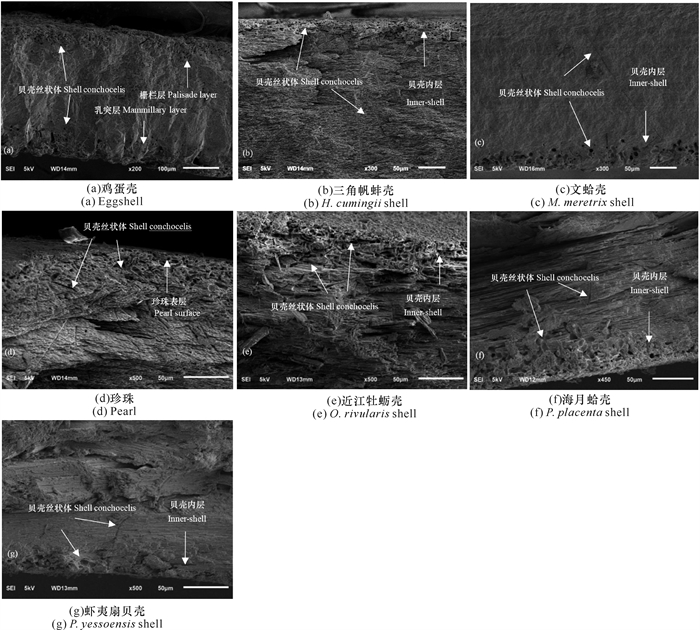
|
| 图 2 不同条斑紫菜贝壳丝状体培养基质切面扫描电镜图 Fig. 2 SEM photograph of different N.yezoensis shell conchocelis culture substrates sections |
2.2 不同培养基质中条斑紫菜贝壳丝状体的着生效率
丝状体在近江牡蛎壳与鸡蛋壳上着生效率最大,分别为(4.5±0.6)%、(4.2±0.6)%(P≥0.05),其次为虾夷扇贝壳与三角帆蚌壳,在珍珠基质上的着生效率最低,为(1.7±0.6)%(图 3)。
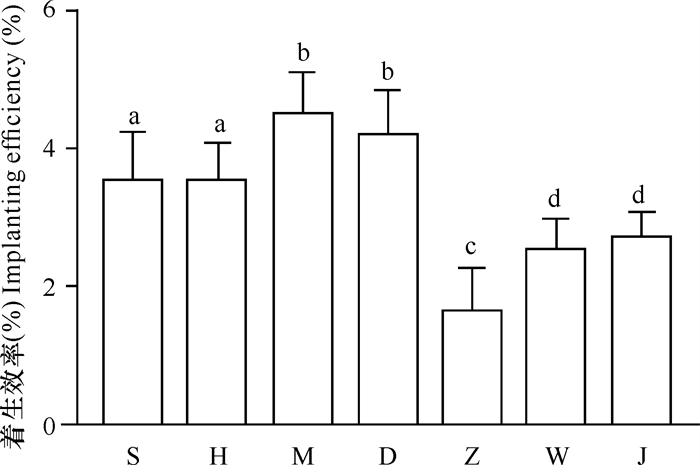
|
| S:虾夷扇贝壳; H:三角帆蚌壳; M:近江牡蛎壳; D:鸡蛋壳; Z:珍珠; W:文蛤壳; J:海月蛤壳。相同小写字母表示不同组间差异未达显著水平(P≥0.05) S: P.yessoensis shell; H: H.cumingii shell; M: O.rivularis shell; D: Eggshell; Z: Pearl; W: M.meretrix shell; J: P.placenta shell.The same lowercase letters indicate that there is no significant difference between groups (P≥0.05) 图 3 不同基质中条斑紫菜贝壳丝状体的着生效率 Fig. 3 Implanting efficiency of N.yezoensis shell conchocelis in different substrates |
2.3 不同培养基质中条斑紫菜贝壳丝状体的分布
接种两周后丝状体开始钻入基质中并形成贝壳丝状体。在三角帆蚌、海月蛤、近江牡蛎、虾夷扇贝和文蛤等贝壳基质中贝壳丝状体于第4周水平生长速率最快,生长速率均超过1 000 μm/周,第6至第10周水平生长速率较慢,平均生长速率为321-429 μm/周。蛋壳基质中,贝壳丝状体在第3至第9周的平均水平生长速率为297 μm/周,第10周生长速率最快,达768 μm/周。珍珠基质中,贝壳丝状体在第3至第8周水平生长速率较慢,平均为317 μm/周,第9周生长速率最快,达736 μm/周。在三角帆蚌壳、近江牡蛎壳和文蛤壳中,贝壳丝状体前10周的平均水平生长速率为63.5 μm/d (P≥0.05);其次为虾夷扇贝壳,为(59.5±10.6) μm/d;鸡蛋壳中贝壳丝状体的水平生长速率最慢,为(39.9±6.9) μm/d(图 4)。
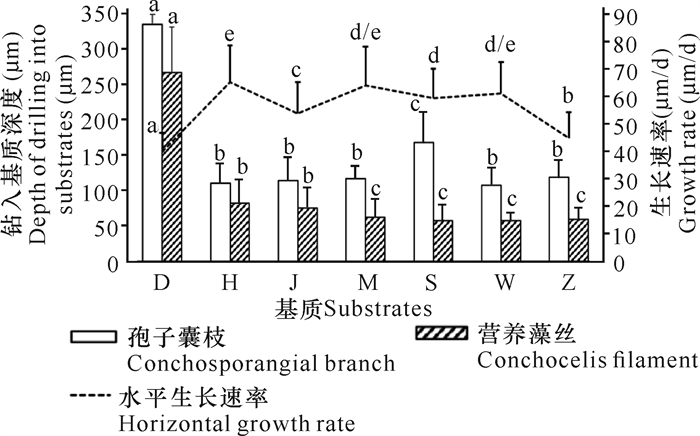
|
| S:虾夷扇贝壳; H:三角帆蚌壳; M:近江牡蛎壳; D:鸡蛋壳; Z:珍珠; W:文蛤壳; J:海月蛤壳。相同小写字母表示不同组间差异未达显著水平(P≥0.05) S: P.yessoensis shell; H: H.cumingii shell; M: O.rivularis shell; D: Eggshell; Z: Pearl; W: M.meretrix shell; J: P.placenta shell.The same lowercase letters indicate that there is no significant difference between groups (P≥0.05) 图 4 不同基质中条斑紫菜贝壳丝状体钻入基质深度及水平生长速率 Fig. 4 Depth and horizontal growth rate of N.yezoensis shell conchocelis in different substrates |
营养藻丝阶段,贝壳丝状体在鸡蛋壳中钻入的深度最深,达(267.4±60.1) μm,其次为三角帆蚌壳与海月蛤壳,分别为(82.1±35.1) μm、(75.9±37.3) μm,而在近江牡蛎壳、虾夷扇贝壳、文蛤壳以及珍珠中的钻入深度基本相同(P≥0.05)(图 4)。
第13周,贝壳丝状体由营养藻丝发育为孢子囊枝后继续生长,孢子囊枝在鸡蛋壳中的钻入深度最深,穿透蛋壳生长,达(334.9±15.0) μm;其次为虾夷扇贝壳,钻入深度为(168.5±44.8) μm;孢子囊枝在三角帆蚌壳、海月蛤壳、近江牡蛎壳、文蛤壳和珍珠中的钻入深度基本一致,为(113.9±27.9) μm(P≥0.05)(图 4)。
2.4 不同培养基质对条斑紫菜壳孢子放散的影响贝壳丝状体壳孢子前6 d平均日放散量均较低,后14 d平均日放散量差异较大,其中文蛤壳基质壳孢子日放散量最大,达624 spores/(cm2·d),其次为鸡蛋壳和海月蛤壳,分别达360 spores/(cm2·d)、223 spores/(cm2·d),三角帆蚌壳基质壳孢子日放散量最小,为41 spores/(cm2·d) (图 5)。
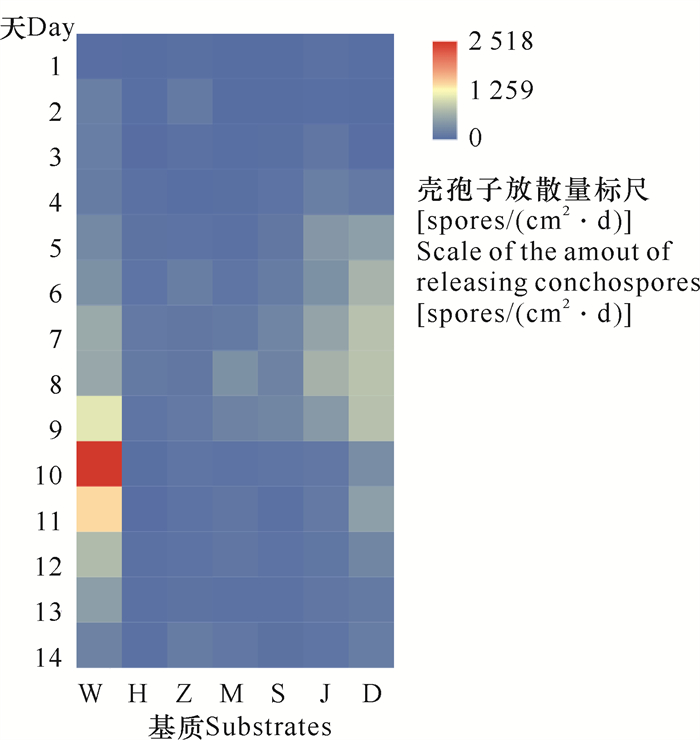
|
| S:虾夷扇贝壳;H:三角帆蚌壳;M:近江牡蛎壳;D:鸡蛋壳;Z:珍珠;W:文蛤壳;J:海月蛤壳 S: P.yessoensis shell; H: H.cumingii shell; M: O.rivularis shell; D: Eggshell; Z: Pearl; W: M.meretrix shell; J: P.placenta shell 图 5 不同基质中条斑紫菜贝壳丝状体壳孢子放散量 Fig. 5 Release amount of conchospores of N.yezoensis shell conchocelis in different substrates |
3 讨论
紫菜种苗可采用平铺或吊挂的方式培养,由于不同贝壳的成分、结构以及质地有差别,导致贝壳丝状体的生长与壳孢子放散量存在较大的差异。本研究中文蛤壳、近江牡蛎壳、三角帆蚌壳、虾夷扇贝壳、海月蛤壳、鸡蛋壳和珍珠等7种丝状体培养基质均为常见的天然材料,主要成分均为碳酸钙,以及少量几丁质和蛋白质,贝壳丝状体在7种基质中的生长及发育水平差异明显,可能与培养基质的结构、碳酸钙结晶方式、晶体排列方式和有机成分等因素有关。Oaki等[20]对鸡蛋壳、贝壳珍珠层、海绵骨骼、珊瑚和有孔虫等5种不同生物矿物材料的纳米结构进行研究,发现其均由纳米晶粒聚合形成。从基质的结构及结晶方式来看,文蛤壳和三角帆蚌壳内侧的珍珠层均由文石晶体组成[21];珍珠外侧的珍珠层也是由文石晶体组成;虾夷扇贝壳的内层由文石晶体组成,厚度为250-300 μm[22];牡蛎壳的内层由方解石晶体形态构成[23];鸡蛋壳主要分为乳突层和栅栏层,其中的碳酸钙主要以方解石形态存在[24];而海月蛤壳为99%细长的菱形方解石条板构成的单叶微结构。从晶体排列方式来看,Cain等[25]测得鸡蛋壳中栅栏层的方解石晶体有着一致的取向性,晶体轴和蛋壳表面的垂直方向有16°-28°的倾斜角度,但是乳突层的晶体取向则是随机的;虾夷扇贝壳内层的方解石晶体具有相同的倾斜角度;海月蛤壳具有独特的透光性,可见光总透射率高达80%,这是因为其每个方解石板条衍射为单晶[26]。本研究中鸡蛋壳、虾夷扇贝壳、近江牡蛎壳和海月蛤壳的培养层为方解石结晶形式,文蛤壳、珍珠和三角帆蚌壳属于文石结晶形式。丝状体在这两种结晶形式的天然基质中均能发育为贝壳丝状体。
三角帆蚌、文蛤、牡蛎与虾夷扇贝的贝壳常用于紫菜育苗产业,这4种贝壳基质的结构及硬度均有所差异(表 1)。本研究显示,在上述4种贝壳中,贝壳丝状体在三角帆蚌、文蛤与近江牡蛎的贝壳中水平生长速率高于虾夷扇贝壳,生长深度低于虾夷扇贝(P≥0.05)。文蛤壳中孢子放散水平显著高于其他3种贝壳,三角帆蚌壳最低,因此条斑紫菜壳孢子放散水平不能由水平生长速率和生长深度直接反映,还可能与培养基质的硬度等物理量有关。
| 名称 Names |
贝壳内层结构 Structure of the inner shells |
贝壳内层硬度(GPa) Hardness of the inner shells (GPa) |
| 文蛤壳 M.meretrix shell |
珍珠层[18] Nacreous layer[18] |
约3.76[27] Approximately 3.76[27] |
| 牡蛎壳 Oyster shell |
珍珠层[28]/棱柱层[29](有争议) Nacreous layer[28]/Prismatic layer[29](Controversial) |
1.36[30] |
| 三角帆蚌壳 H.Cumingii shell |
珍珠层[31] Nacreous layer[31] |
5.1[32] |
| 虾夷扇贝壳 P.yessoensis shell |
角钢状纤维[22]/珍珠层[33](有争议) Angle steel shaped fiber[22]/Nacreous layer[33](Controversial) |
3[32] |
贝壳因其面积小、内表面不平整的特点,导致紫菜种苗培育过程中清洗、铺摆工序耗费大量人力与时间,且其易翻覆,降低了采苗效率,因此具有较高平整度与组装水平的贝壳替代基质是未来紫菜种苗基质发展的方向。本研究选取了与贝壳内层相同晶体结构的方解石原石、霰石原石,以及与贝壳内层具有共同成分的壳聚糖薄膜、几丁质碎片进行同步培养,未发现条斑紫菜丝状体生长于其中,仅在壳聚糖薄膜表面着生,并向外以自由丝状体形态生长,与钻入生物合成基质的贝壳丝状体形态有明显差异。从生物合成基质的有机成分分析,文蛤壳的有机质成分主要为几丁质、富含丙氨酸的不可溶蛋白质、富含甘氨酸和天冬氨酸等酸性氨基酸的可溶性蛋白等;牡蛎壳中含有几丁质、糖蛋白、珍珠蛋白、天冬氨酸、丝氨酸、谷氨酸和甘氨酸等[34-37];三角帆蚌壳和珍珠的珍珠层文石结晶间的有机质主要是几丁质纤维和类丝素蛋白,还含有甘氨酸和丙氨酸等[37];鸡蛋壳中的有机质主要为蛋白质、糖蛋白、蛋白多糖[38],这些天然生物基质中均含有1%-5%的有机成分[39-43],因此紫菜丝状体的着生与贝壳丝状体的形成可能与基质中的有机成分有关。
4 结论条斑紫菜丝状体可在生物合成基质与壳聚糖薄膜表面着生并向外呈自由丝状体样生长,向内只在生物合成基质中形成贝壳丝状体,并发育至放散壳孢子,未发现生长于壳聚糖薄膜内,且未在方解石原石、霰石原石与几丁质碎片内部着生。贝壳丝状体在近江牡蛎壳与鸡蛋壳中着生效率最高,分别达(4.5±0.6)%、(4.2±0.6)%;在三角帆蚌、近江牡蛎和文蛤贝壳中水平生长速率最大,平均为63.5 μm/d(P≥0.05);在鸡蛋壳中纵向生长最深,达(334.9±15.0) μm;在文蛤贝壳中的壳孢子放散量最高,其次为鸡蛋壳。因此,除了常用于紫菜育苗生产的文蛤壳、近江牡蛎壳、三角帆蚌壳与扇贝壳外,鸡蛋壳较为适宜贝壳丝状体的着生、生长与壳孢子放散。
| [1] |
陆勤勤, 周伟, 邓银银. 条斑紫菜栽培的经济效益与生态效益概述[J]. 中国水产, 2016(1): 53-54. DOI:10.3969/j.issn.1002-6681.2016.01.026 |
| [2] |
何培民, 张泽宇, 张学成, 等. 海藻栽培学[M]. 北京: 科学出版社, 2018.
|
| [3] |
王素娟, 沈怀舜. 条斑紫菜自由丝状体无性繁殖系快速培养及其养殖[J]. 上海水产大学学报, 1993, 2(1): 1-5. |
| [4] |
李世英, 夏自孚. 关于用冷藏条斑紫菜进行大面积采单孢子苗的试验报告[J]. 海洋科学, 1982(6): 36-38. |
| [5] |
沈颂东. 条斑紫菜细胞培养与酶法育苗的工艺优化[D]. 青岛: 中国海洋大学, 2000.
|
| [6] |
陈士勇, 王令充, 嵇晶, 等. 双壳类贝壳的应用研究进展[J]. 中国海洋药物, 2011, 30(1): 58-64. |
| [7] |
水产名词审定委员会. 水产名词[M]. 北京: 科学出版社, 2002.
|
| [8] |
朱建一, 严兴洪, 丁兰平, 等. 中国紫菜原色图集[M]. 北京: 中国农业出版社, 2017.
|
| [9] |
张美如. 条斑紫菜种质扩繁与保存中污染控制技术研究[D]. 南京: 南京农业大学, 2010.
|
| [10] |
许璞, 张学成, 王素娟, 等. 中国主要经济海藻的繁殖与发育[M]. 北京: 中国农业出版社, 2013.
|
| [11] |
HEO J S, PARK E J, SOOK H M, et al. Effect of sh-ell-type, light and temperature on the shell infiltration of free-living conchocelis of three Pyropia species[J]. Korean Journal of Fisheries and Aquatic Sciences, 2021, 54(1): 23-30. |
| [12] |
黄丽琼. 利用蛋壳培养优良品种[J]. 福建水产, 1982(6): 44. |
| [13] |
KIM J H, CHIO S J, LEE S. Effects of temperature and light on photosynthesis and growth of red alga Pyropia dentata (Bangiales, Rhodophyta) in a conchocelis phase[J]. Aquaculture, 2019, 505: 167-172. DOI:10.1016/j.aquaculture.2019.02.058 |
| [14] |
魏家慧, 李国梁, 汪文俊, 等. 条斑紫菜丝状体不同发育时期对光照和温度的光合适应能力[J]. 渔业科学进展, 2020, 41(6): 115-124. |
| [15] |
孔晓锐. 环境因子对条斑紫菜壳孢子附着、萌发及幼苗生长的影响[D]. 青岛: 中国海洋大学, 2012.
|
| [16] |
YANG R, LIU Q Q, HE Y Y, et al. Isolation and iden-tification of Vibrio mediterranei 117-T6 as a pathogen associated with yellow spot disease of Pyropia (Bangiales, Rhodophyta)[J]. Aquaculture, 2020, 526: 735372. DOI:10.1016/j.aquaculture.2020.735372 |
| [17] |
ZHU J K, XU M Y, LIU Q Q, et al. Bacteriophage the-rapy on the conchocelis of Pyropia haitanensis (Rhodophyta) infected by Vibrio mediterranei 117-T6[J]. Aquaculture, 2021, 531: 735853. DOI:10.1016/j.aquaculture.2020.735853 |
| [18] |
陈道海, 霍颖娴. 13种双壳类贝壳的扫描电镜观察[J]. 动物学杂志, 2015, 50(1): 122-130. |
| [19] |
付春辉, 严兴洪, 黄林彬, 等. 条斑紫菜(Porphyra ye-zoensis)选育品系壳孢子的放散量与耐高温性研究[J]. 海洋与湖沼, 2011, 42(3): 460-466. |
| [20] |
OAKI Y, KOTACHI A, MIURA T, et al. Bridged nan-ocrystals in biominerals and their biomimetics: Classical yet modern crystal growth on the nanoscale[J]. Advanced Functional Materials, 2006, 16(12): 1633-1639. DOI:10.1002/adfm.200600262 |
| [21] |
邵惠萍, 吴静怡, 罗建英, 等. 三角帆蚌贝壳珍珠层动态微结构及其特异的虹彩效应[J]. 安庆师范学院学报(自然科学版), 2020, 26(2): 87-92. |
| [22] |
林艾光, 丁晓非, 谢忠东, 等. 虾夷扇贝贝壳的微观结构及与功能相关性(英文)[J]. 硅酸盐学报, 2010, 38(3): 504-509. |
| [23] |
陈文韬. 牡蛎壳组成特性及其综合利用研究[D]. 福州: 福建农林大学, 2013.
|
| [24] |
FOULKES R H, PARSONS J, SCHUKNECHT H F. X-Ray diffraction of otoliths and egg shells of bird and reptile[J]. American Naturalist, 1958, 92(866): 319. DOI:10.1086/282042 |
| [25] |
CAIN C J, HEYN A N J. X-Ray diffraction studies of the crystalline structure of the avian egg shell[J]. Biophysical Journal, 1964, 4(1): 23-39. DOI:10.1016/S0006-3495(64)86767-9 |
| [26] |
LI L, ORTIZ C. Pervasive nanoscale deformation twinning as a catalyst for efficient energy dissipation in a bioceramic armour[J]. Nature Materials, 2014, 13(5): 501-507. DOI:10.1038/nmat3920 |
| [27] |
段婷婷, 汪得功, 王吉辉, 等. 生物材料和超硬陶瓷材料的显微压痕对比分析研究[J]. 化工新型材料, 2019, 47(6): 168-170, 175. |
| [28] |
YOON G L, KIM B T, KIM B O, et al. Chemical mechanical characteristics of crushed oyster-shell[J]. Waste Management, 2003, 23(9): 825-834. DOI:10.1016/S0956-053X(02)00159-9 |
| [29] |
邹秋月, 杨萍, 王燕, 等. 牡蛎壳煅烧物对刚果红的吸附研究[J]. 化工技术与开发, 2010, 39(6): 48-50. DOI:10.3969/j.issn.1671-9905.2010.06.014 |
| [30] |
于洋. 生物方解石微观力学性能的纳米压痕试验研究[D]. 长春: 吉林大学, 2017.
|
| [31] |
ZHANG Z, ZHU J, CHU Y J, et al. Correlation between microstructure and failure mechanism of Hyriopsis cumingii shell structure[J]. Journal of Bionic Engineering, 2019, 16(5): 869-881. DOI:10.1007/s42235-019-0102-8 |
| [32] |
范存才. 贝壳材料的多级结构及力学性能实验研究[D]. 北京: 中国科学院大学, 2015.
|
| [33] |
CHEN B, PENG X, WANG J G, et al. Laminated microstructure of Bivalve shell and research of biomimetic ceramic/polymer composite[J]. Ceramics International, 2004, 30(7): 2011-2014. DOI:10.1016/j.ceramint.2003.12.169 |
| [34] |
ALBECK S, ADDADI I, WEINER S. Regulation of calcite crystal morphology by intracrystalline acidic proteins and glycoproteins[J]. Connective Tissue Research, 1996, 35(1/4): 365-370. |
| [35] |
MIYAMOTO H, MIYASHITA T, OKUSHIMA M, et al. A carbonic anhydrase from the nacreous layer in oyster pearls[J]. Proceedings of the National Academy of Sciences, 1996, 93(18): 9657-9660. DOI:10.1073/pnas.93.18.9657 |
| [36] |
ALBECK S, WEINER S, ADDADI L. Polysaccharides of intracrystalline glycoproteins modulate calcite crystal growth in vitro[J]. Chemistry-A European Journal, 1996, 2(3): 278-284. DOI:10.1002/chem.19960020308 |
| [37] |
LEVI-KALISMAN Y, FALINI G, ADDADI L, et al. Structure of the nacreous organic matrix of a bivalve mollusk shell examined in the hydrated state using Cryo-TEM[J]. Journal of Structural Biology, 2001, 135(1): 8-17. DOI:10.1006/jsbi.2001.4372 |
| [38] |
段忠意. 鸡蛋壳超微结构与晶体结构的测定及全基因组关联分析[D]. 北京: 中国农业大学, 2017.
|
| [39] |
NYS Y, GUYOT N. Egg formation and chemistry[M]. Cambridge: Woodhead Publishing Limited, 2011.
|
| [40] |
邵荷生, 张清. 金属的磨料磨损与耐磨材料[M]. 北京: 机械工业出版社, 1988.
|
| [41] |
邵浩彬, 朱军, 周琦, 等. 三角帆蚌贝壳的微结构及尺寸变化特征[J]. 复合材料学报, 2019, 36(10): 2398-2406. |
| [42] |
CHEN B, PENG X, WANG J G, et al. Laminated microstructure of Bivalva shell and research of biomimetic ceramic/polymer composite[J]. Ceramics International, 2003, 30(7): 2011-2014. |
| [43] |
ZHANG G S, XIE X D. Utrastructure and formation theory of nacre shells[J]. Journal of Mineralogy and Petrology, 2000, 20(1): 11-16. |



