2. 青岛市大型海藻工程技术研究中心,山东青岛 266104
2. Qingdao Macroalgae Engineering Technology Research Center, Qingdao, Shandong, 266104, China
坛紫菜(Pyropia haitanensis)属于红藻门(Rhodophyta)红毛藻科(Bangiaceae)紫菜属(Pyropia),主要分布在浙江、福建和广东等南方沿海一带,是我国大规模养殖的重要经济海藻之一。坛紫菜营养丰富、味道鲜美,具有很高的食用价值;同时富含多糖、藻红蛋白、脂氧合酶等生物活性物质,使其在医药保健领域具有良好的开发潜力[1-3]。近年来全球气候变暖,秋、冬季海水降温过程延缓,造成南方养殖坛紫菜的病烂发生率显著上升,加之受台风等灾害天气的影响,坛紫菜养殖筏架经常被大面积摧毁,坛紫菜产业损失巨大。因此,在北方沿海开展坛紫菜的养殖和示范推广,对拓展坛紫菜的养殖空间,促进坛紫菜养殖业的可持续健康发展具有重要意义。
营养盐尤其是氮、磷元素是紫菜生长的限制要素,氮、磷的缺乏会导致紫菜营养失调,直接影响紫菜的生长发育和营养品质。当前,关于坛紫菜对氮、磷营养盐浓度变化的生理响应机制已有一些相关报道,如柳佩娟等[4]、周巍巍等[5]研究坛紫菜在低氮、磷胁迫下的生理响应机制,为耐低氮、磷品系的选育提供了依据;孟庆俊等[6]探究氮、磷浓度,不同化合态氮和氮磷比等营养盐因子对坛紫菜氮、磷吸收的影响;秦梅等[7]报道高浓度氨氮抑制坛紫菜的生长和光合作用;付阳阳等[8]研究氮磷比对坛紫菜叶状体生长和单性生殖发生的影响。海水营养盐含量存在明显的区域特征和季节变化[9],而北方海区的营养盐浓度相对较低。为满足坛紫菜生长需要,可通过施肥增加海水中营养盐浓度,但氮、磷加富对坛紫菜的生长和营养成分的影响规律鲜见报道。因此,研究不同氮、磷浓度条件下坛紫菜的生长状况及其营养价值,对坛紫菜养殖环境的选择及探究坛紫菜生长环境的适应性等均具有重要意义。
本研究拟通过实验生态学方法,对不同营养盐条件下养殖的山东长岛坛紫菜的生长及营养成分的变化进行测定和分析,旨在探究营养盐加富条件下坛紫菜对营养盐的响应特点,以期为在北方沿海推广坛紫菜的健康养殖提供理论基础。
1 材料与方法 1.1 材料过滤的天然海水:海水盐度为30.5,pH值为7.5,溶解无机氮(Dissolved Inorganic Nitrogen,DIN)浓度为20.286 μmol·L-1(含15.643 μmol·L-1 NO3--N,0.500 μmol·L-1 NO2--N,4.143 μmol·L-1 NH4+-N),PO43--P浓度为0.968 μmol·L-1。
坛紫菜:2019年12月从山东长岛海域养殖区(37°90′ N,120°75′ E)采集,藻体用海水反复清洗去除泥沙及杂质后,置于室内循环水箱中,在8℃、光照强度80 μmol·m-2·s-1、光暗周期为12 h的条件下,用过滤的天然海水持续充气培养,每日干露3-5 h,5 d后用于实验。
1.2 营养盐加富培养方法从预培养的藻体中选取生长良好、形态较一致的个体,随机放入试验用的50 L循环水箱中,培养密度约0.5 g·L-1(鲜重)。以培养液的氮、磷浓度为控制变量,共设计6组实验培养坛紫菜,包括1组对照组和5组试验组(表 1)。对照组(CK)的培养液为过滤的天然海水,记为基础培养液。实验组是在基础培养液的基础上,使用DIN溶液(NO3--N、NH4+-N、NO2--N的浓度比为5∶5∶1)和KH2PO4分别加富氮、磷浓度至特定值。其中,试验组①的培养液DIN和PO43--P的终浓度分别为50 μmol·L-1、3.13 μmol·L-1; 在此基础上,试验组②、③、④、⑤培养液的氮、磷浓度依次加富2,4,8,12倍。坛紫菜培养条件同第1.1节,氮、磷加富培养5 d后,将培养液更换为过滤的天然海水,再继续培养至20 d,期间每5 d更换一次培养液(过滤的天然海水)。每组试验进行3次重复,在第20天对坛紫菜生长及营养成分指标进行测定。
| 试验号 Number of test |
氮、磷浓度 Concentrations of nitrogen and phosphorus |
加富倍数 Enrichment multiples |
| CK | 过滤的天然海水 Filtered natural seawater |
不适用 Not applicable |
| 试验组① Test group ① |
50 μmol·L-1 DIN+3.13 μmol·L-1 PO43--P |
1 |
| 试验组② Test group ② |
100 μmol·L-1 DIN+6.25 μmol·L-1 PO43--P |
2 |
| 试验组③ Test group ③ |
200 μmol·L-1 DIN+12.5 μmol·L-1 PO43--P |
4 |
| 试验组④ Test group ④ |
400 μmol·L-1 DIN+25.0 μmol·L-1 PO43--P |
8 |
| 试验组⑤ Test group ⑤ |
600 μmol·L-1 DIN+37.5 μmol·L-1 PO43--P |
12 |
1.3 比生长速率的测定
分别称量藻体鲜质量,按公式(1)计算其比生长速率(Specific Growth Rate,SGR)[10]。
| $ {\rm{SGR}}\left( \% \right) = \left[ {{{\left( {{W_t}/{W_0}} \right)}^{1/t}} - 1} \right] \times 100\% , $ | (1) |
式中:Wt为实验中期或结束时鲜藻体质量,g;W0为实验开始时鲜藻体质量,g;t为培养时间,d。
1.4 氮、磷吸收速率的测定在实验的第5天分别测定培养液中NO3--N、NO2--N、NH4+-N和PO43--P含量,测定方法依据《海洋调查规范第4部分:海水化学要素调查》(GB/T 12763.4-2007)和《水质总磷的测定钼酸铵分光光度法》(GB 11893-1989)中的实验方法。按公式(2)计算吸收速率V。
| $ V = \left[ {\left( {{S_0} - {S_t}} \right) \cdot {V_0}} \right]/\left( {t \cdot G} \right), $ | (2) |
式中:V为吸收速率,μmol·g-1·h-1;S0、St分别为取样时间间隔的起始和结束时培养液中氮、磷的浓度,μmol·L-1;V0为待测定的培养液体积,L;t为取样的时间间隔,h;G为实验起始时鲜藻体质量,g。
1.5 光合色素含量的测定叶绿素a (Chlorophyll a,Chl-a)和类胡萝卜素(Carotenoid,Car)含量的测定参照Jensen[11]的方法。取0.1 g新鲜藻体研磨成匀浆状,加入10 mL丙酮,然后置于黑暗处4℃抽提12 h。在4℃、5 000 r·min-1条件离心10 min并吸取上清液,用丙酮定容至15 mL。以丙酮作为空白对照,分别测定450 nm、666 nm和730 nm波长处的吸光值。分别按公式(3)和公式(4)计算叶绿素a和类胡萝卜素的含量(单位为mg·g-1):
| $ {\rm{Chl}} - a = \left( {O{D_{666}} - O{D_{730}}} \right) \times V \times 10/(890 \times G), $ | (3) |
| $ {\rm{Car}} = O{D_{450}} \times V \times 10/(2500 \times G), $ | (4) |
式中: OD为吸光值;V为定容后的溶液体积,mL;G为实验起始时鲜藻体质量,g。
1.6 藻胆蛋白含量的测定藻红蛋白(Phycoerythrin,PE)和藻蓝蛋白(Phycocyanin,PC)含量按照Siegelman等[12]的方法进行测定。取0.2 g新鲜藻体研磨成匀浆状,加入0.1 mol·L-1的磷酸盐缓冲液定容至10 mL,然后置于黑暗处4℃抽提12 h,离心取上清液分别测定波长455 nm、564 nm、592 nm、618 nm和645 nm处的吸光值。藻红蛋白和藻蓝蛋白含量(单位为mg·g-1)分别按照公式(5)和公式(6)进行计算。
| $ \begin{array}{l} \;\;\;\;\;\;\;{\rm{PE}} = \left[ {\left( {O{D_{564}} - O{D_{592}}} \right) - \left( {O{D_{455}} - O{D_{592}}} \right) \times } \right.\\ 0.2] \times 0.12 \times V/G, \end{array} $ | (5) |
| $ \begin{array}{l} \;\;\;\;\;\;{\rm{PC}} = \left[ {\left( {O{D_{618}} - O{D_{645}}} \right) - \left( {O{D_{592}} - O{D_{645}}} \right) \times } \right.\\ 0.2] \times 0.15 \times V/G, \end{array} $ | (6) |
式中: OD为吸光值;V为定容后的溶液体积,mL;G为实验起始时鲜藻体质量,g。
1.7 营养成分的测定基本营养成分的测定:水分采用直接干燥法测定(GB 5009.3-2016),粗蛋白用凯氏定氮法测定(GB 5009.5-2016),粗脂肪用索式抽提法测定(GB 5009.6-2016),灰分用马弗炉灰化法测定(GB 5009.4-2016)。
氨基酸的测定按照GB 5009.124-2016的方法进行。样品经10 mL 6 mol·L-1 HCl充氮气水解24 h后,用日立L-8900全自动氨基酸分析仪测定17种氨基酸;另取样品用10 mL 5 mol·L-1 NaOH水解,用前述相同型号仪器测定色氨酸的含量。
脂肪酸的测定按照GB 5009.168-2016的方法进行。样品酸水解后,加入内标甘油三酯和十一烷酸,以乙醚萃取脂质,然后于甲醇中以三氟化硼转化为脂肪酸甲酯,用气相色谱(安捷伦GC6890)分析。
1.8 氨基酸营养评价方法根据联合国粮农组织/世界卫生组织(FAO/WHO)建立的氨基酸评分模式[13]和以鸡蛋蛋白质为理想蛋白质的化学评分模式[14],分别按公式(7)和公式(8)计算氨基酸评分(Amino Acid Score,AAS)和化学评分(Chemical Score,CS)。
| $ {\rm{AAS}}({\rm{\% }}) = \frac{{{\rm{aa}}}}{{{\rm{A}}{{\rm{A}}_{({\rm{FAO}}/{\rm{wHO}})}}}} \times 100{\rm{\% }}, $ | (7) |
| $ {\rm{CS}}({\rm{\% }}) = \frac{{{\rm{aa}}}}{{{\rm{A}}{{\rm{A}}_{{\rm{Egg}}}}}} \times 100{\rm{\% }}, $ | (8) |
式中:aa为样品蛋白质中某种必需氨基酸含量,AA(FAO/WHO)为FAO/WHO模式中蛋白质相应某种必需氨基酸含量,AAEgg为鸡蛋蛋白模式中蛋白质相应某种必需氨基酸含量。
1.9 数据分析采用SPSS 13.0软件对实验数据进行统计分析,并采用单因素方差分析(One-way ANOVA)的Duncan法比较不同组间的差异,显著性水平为P < 0.05。采用Origin 9.0进行绘图分析。
2 结果与分析 2.1 比生长速率的变化如图 1所示,培养20 d时,氮、磷浓度加富倍数越高,藻体SGR越低。其中,氮、磷浓度分别为50 μmol·L-1、3.13 μmol·L-1时(试验组①),藻体SGR显著高于对照组(P < 0.05);氮、磷浓度加富到2倍时(试验组②),藻体SGR与对照组无显著差异(P>0.05);但氮、磷浓度加富倍数为4,8,12时(试验组③、试验组④和试验组⑤),藻体SGR比对照组分别下降9.7%、31.5%和57.9%,表明坛紫菜的生长受到明显抑制。
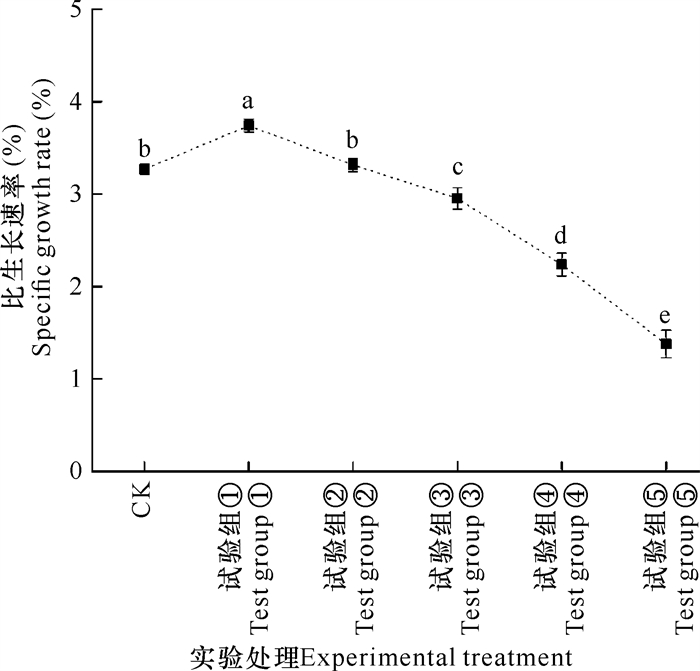
|
| 图 1 不同氮、磷浓度对坛紫菜比生长速率的影响 Fig. 1 Effects of different N, P concentrations on specific growth rate of P.haitanensis |
2.2 氮、磷吸收速率的变化
图 2所示为加富倍数对坛紫菜吸收氮、磷的影响。氮、磷浓度加富培养5 d时,随着氮、磷浓度的增加,藻体对DIN的吸收速率均呈逐渐上升的趋势,其中NO3--N、NH4+-N、NO2--N的最大吸收速率分别为10.11 μmol·g-1·h-1、12.55 μmol·g-1·h-1、0.53 μmol·g-1·h-1;而PO43--P的吸收速率则呈先逐渐升高后下降的趋势,其中在氮、磷浓度加富8倍(DIN 400 μmol·L-1,PO43--P 25 μmol·L-1, 试验组④)时,达到最大吸收速率1.33 μmol·g-1·h-1。不同浓度氮、磷加富下,坛紫菜对NO3--N和NH4+-N的吸收速率明显高于NO2--N,且与对照组相比均存在显著性差异(P < 0.05)。当氮、磷浓度加富倍数≤2时,坛紫菜对NO3--N的吸收速率略高于NH4+-N,但两者间无显著差异;氮、磷浓度加富倍数≥4时,坛紫菜对NH4+-N的吸收速率明显高于NO3--N,表明在不同氮、磷浓度下,坛紫菜对氮的吸收具有选择性。
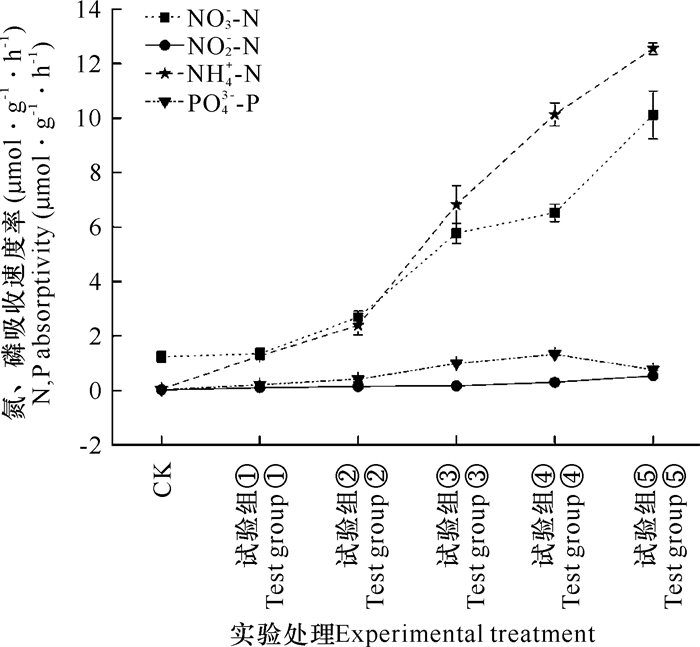
|
| 图 2 坛紫菜对不同形态氮和磷吸收速率的比较 Fig. 2 Comparison of different forms of N and P absorptivity rates in P.haitanensis |
2.3 光合色素含量的变化
如图 3所示,在不同氮、磷浓度加富倍数下,坛紫菜叶绿素a、类胡萝卜、藻红蛋白和藻蓝蛋白含量的变化趋势类似,均在加富倍数为1(DIN 50 μmol·L-1,PO43--P 3.13 μmol·L-1)时最高,含量分别为0.56 mg·g-1、0.12 mg·g-1、0.14 mg·g-1、0.20 mg·g-1。当氮、磷加富倍数≤4时,4种光合色素含量均显著高于对照组;氮、磷加富倍数≥8时,所有光合色素的含量均显著降低,其中加富倍数为12 (DIN 600 μmol·L-1,PO43--P 37.5 μmol·L-1)时,叶绿素a、类胡萝卜、藻红蛋白和藻蓝蛋白的含量比对照分别下降51.32%、28.17%、28.49%和39.43%。
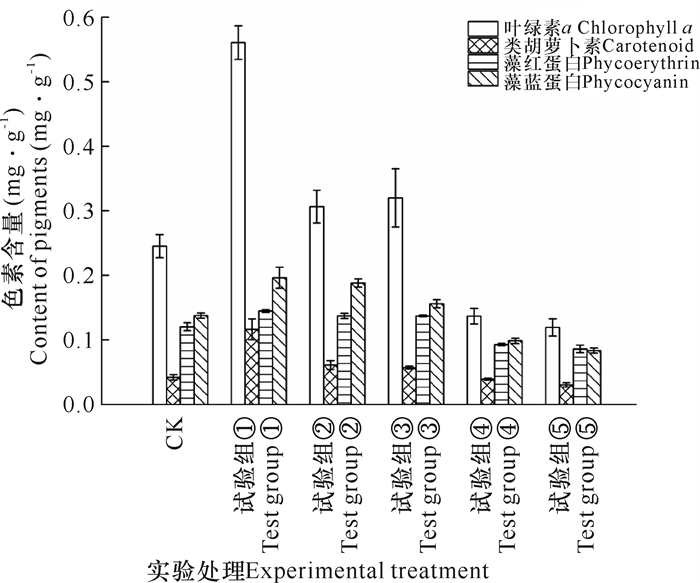
|
| 图 3 不同氮、磷浓度对坛紫菜光合色素含量的影响 Fig. 3 Effects of different N, P concentrations on photosynthetic pigments of P.haitanensis |
2.4 基本营养成分分析
如表 2所示,在氮、磷加富培养后,坛紫菜粗蛋白的含量均显著高于对照组,但随着加富倍数的增加呈下降趋势。坛紫菜粗脂肪的含量则在氮、磷加富培养后大多数显著降低,其中在氮、磷浓度加富倍数为1 (DIN 50 μmol·L-1,PO43--P 3.13 μmol·L-1)时最低。此外,氮、磷加富使得坛紫菜的灰分显著高于对照组(P < 0.05),且含量随氮、磷加富倍数的升高而逐渐降低。
| 氮、磷浓度 加富倍数 Enrichment multiple N, P concentrations |
成分Components | ||
| 粗蛋白 Crude protein |
粗脂肪 Crude fat |
灰分 Ash |
|
| CK | 21.95±0.51f | 1.90±0.11a | 24.62±0.22d |
| 1 | 49.42±1.05a | 1.30±0.10d | 35.83±1.10a |
| 2 | 37.35±0.78b | 1.54±0.06c | 28.12±0.64b |
| 4 | 30.95±0.64c | 1.68±0.07b | 26.24±0.50c |
| 8 | 26.60±0.52d | 1.78±0.14a | 26.18±0.78c |
| 12 | 23.70±0.43e | 1.40±0.17cd | 26.24±0.34c |
| 注: 同列不同小写字母表示差异显著(P<0.05) Note: Different lowercase letters in the same column indicate significant differences at the 0.05 probability level | |||
2.5 氨基酸组成的变化
在氮、磷加富培养后, 坛紫菜18种氨基酸的组成与含量变化如表 3所示。其中,坛紫菜色氨酸的含量低于分析方法的最低检出限值;其余17种氨基酸中除异亮氨酸、酪氨酸和胱氨酸的含量在氮、磷浓度较高组中比对照组略低外,其他氨基酸的含量在氮、磷加富后均显著升高,且均在加富倍数为1 (DIN 50 μmol·L-1,PO43--P 3.13 μmol·L-1)时氨基酸含量最高。此外,氨基酸总量(Total Amino Acid,TAA)随氮、磷加富倍数的增加而升高,依次比对照组增加112.66%、72.69%、42.01%、25.12%和13.90%;必需氨基酸(Essential Amino Acid,EAA)、非必需氨基酸(Nonessential Amino Acid,NEAA)和呈味氨基酸(Delicious Amino Acids,DAA)的变化趋势基本一致,均在氮、磷加富培养后显著升高,且随加富倍数的增加而下降;DAA/TAA值则随氮、磷浓度的升高呈先上升后下降的趋势,在氮、磷浓度加富4倍(DIN 200 μmol·L-1,PO43--P 12.5 μmol·L-1)时达到最高值;而EAA/TAA值和EAA/NEAA值在氮、磷加富培养后显著低于对照组。
| 氨基酸 Amino acid |
氮、磷浓度加富倍数 Enrichment multiple N, P concentrations |
|||||
| CK | 1 | 2 | 4 | 8 | 12 | |
| 谷氨酸 Glu# |
1.54 | 4.42 | 3.97 | 3.08 | 2.62 | 2.36 |
| 天冬氨酸 Asp# |
1.74 | 4.00 | 3.07 | 2.81 | 2.36 | 2.12 |
| 丙氨酸 Ala# |
2.62 | 5.17 | 4.50 | 3.98 | 3.09 | 2.79 |
| 亮氨酸 Leu* |
1.69 | 3.58 | 2.86 | 2.31 | 2.09 | 1.92 |
| 缬氨酸 Val* |
1.28 | 2.42 | 1.96 | 1.63 | 1.41 | 1.30 |
| 甘氨酸 Gly# |
1.33 | 2.50 | 1.96 | 1.72 | 1.47 | 1.44 |
| 赖氨酸 Lys* |
1.18 | 2.17 | 1.75 | 1.58 | 1.31 | 1.30 |
| 精氨酸 Arg |
1.18 | 2.25 | 1.69 | 1.58 | 1.36 | 1.20 |
| 苏氨酸 Thr* |
0.77 | 2.25 | 1.80 | 1.49 | 1.31 | 1.25 |
| 丝氨酸 Ser# |
0.72 | 2.33 | 1.80 | 1.49 | 1.36 | 1.25 |
| 脯氨酸 Pro# |
1.23 | 2.33 | 1.85 | 1.45 | 1.41 | 1.25 |
| 苯丙氨酸 Phe* |
1.18 | 2.42 | 2.06 | 1.54 | 1.41 | 1.30 |
| 异亮氨酸 Ile* |
1.23 | 2.42 | 1.69 | 1.22 | 1.20 | 1.15 |
| 酪氨酸 Tyr |
1.13 | 2.17 | 1.69 | 1.27 | 1.31 | 1.11 |
| 组氨酸 His |
0.26 | 0.52 | 0.49 | 0.37 | 0.33 | 0.32 |
| 胱氨酸 Cys |
0.72 | 1.25 | 1.06 | 0.63 | 0.73 | 0.53 |
| 蛋氨酸 Met* |
0.35 | 0.64 | 0.58 | 0.45 | 0.42 | 0.36 |
| 色氨酸 Ser* |
— | — | — | — | — | — |
| 氨基酸总量 TAA |
20.14 | 42.83 | 34.78 | 28.60 | 25.20 | 22.94 |
| 必需氨基酸总量 EAA |
7.68 | 15.89 | 12.70 | 10.23 | 9.16 | 8.58 |
| 非必需氨基酸 NEAA |
12.46 | 26.93 | 22.08 | 18.38 | 16.04 | 14.36 |
| 呈味氨基酸 DAA |
9.18 | 20.75 | 17.14 | 14.52 | 12.30 | 11.20 |
| EAA/TAA | 38.14 | 37.11 | 36.51 | 35.75 | 36.36 | 37.41 |
| EAA/NEAA | 61.65 | 59.00 | 57.51 | 55.65 | 57.13 | 59.76 |
| DAA/TAA | 45.57 | 48.45 | 49.29 | 50.78 | 48.83 | 48.83 |
| 注:*为必需氨基酸,#为呈味氨基酸,—为未检出 Note: * means essential amino acids, # means delicious amino acids, — means not detected | ||||||
采用氨基酸评分和化学评分相结合的方式评估氮、磷加富后坛紫菜营养价值的变化,结果如表 4所示。两种评价模式均表明Met为坛紫菜的第一限制性氨基酸。由AAS评分模式可知,Leu、Val、Ile、Phe+Tyr大多数高于FAO/WHO氨基酸标准模式; Lys和Thr在不同氮、磷浓度下略低于FAO/WHO氨基酸质量分数的要求,其中Lys除在氮、磷浓度加富12倍(DIN 600 μmol·L-1, PO43--P 37.5 μmol·L-1)时略有升高外,其余氮、磷加富组均低于对照组; 而Thr在氮、磷加富后均显著升高。由CS评分模式可知,Phe+Tyr高于CS模式中鸡蛋蛋白中相应的氨基酸质量分数,不同浓度氮、磷浓度下差异较小; Thr在氮、磷加富后显著升高,Ile则略有下降。
| 必需氨基酸 Essential amino acids |
评分标准 Scoring model |
评分标准模式中氨基酸的 含量(mg·g-1 N) Content of amino acids in the scoring model (mg·g-1 N) |
评分(%) Score (%) | |||||
| CK | 试验组① Test group ① |
试验组② Test group ② |
试验组③ Test group ③ |
试验组④ Test group ④ |
试验组⑤ Test group ⑤ |
|||
| 亮氨酸Leu | AAS | 440 | 109.52 | 103.00 | 108.65 | 105.91 | 111.85 | 115.25 |
| CS | 534 | 90.24 | 84.87 | 89.52 | 87.27 | 92.16 | 94.96 | |
| 缬氨酸Val | AAS | 310 | 117.76 | 98.60 | 105.66 | 106.11 | 107.16 | 110.42 |
| CS | 410 | 89.04 | 74.55 | 79.89 | 80.23 | 81.02 | 83.49 | |
| 赖氨酸Lys | AAS | 340 | 98.78 | 80.60 | 85.92 | 94.06 | 90.46 | 100.67 |
| CS | 441 | 76.16 | 62.14 | 66.24 | 72.52 | 69.75 | 77.62 | |
| 苏氨酸Thr | AAS | 250 | 87.62 | 113.83 | 120.40 | 120.61 | 123.03 | 131.85 |
| CS | 292 | 75.01 | 97.46 | 103.08 | 103.27 | 105.34 | 112.88 | |
| 苯丙氨酸+酪氨酸 Phe+Tyr |
AAS | 380 | 172.93 | 152.55 | 165.41 | 149.08 | 168.36 | 166.81 |
| CS | 565 | 116.31 | 102.60 | 111.25 | 100.27 | 113.23 | 112.19 | |
| 异亮氨酸Ile | AAS | 250 | 140.19 | 122.26 | 113.31 | 98.68 | 113.19 | 121.70 |
| CS | 331 | 105.88 | 92.34 | 85.58 | 74.53 | 85.49 | 91.92 | |
| 蛋氨酸Met | AAS | 220 | 45.14 | 36.89 | 44.26 | 41.53 | 44.74 | 43.22 |
| CS | 386 | 25.73 | 21.02 | 25.23 | 23.67 | 25.50 | 24.63 | |
3 讨论
2019年9-12月,笔者课题组对山东长岛紫菜养殖区的海水氮、磷浓度进行了监测(表 5)。按照郭卫东等[15]提出的近海海水富营养化评价模式(Potential Eutrophication Assessment Model,PEAM)分析该养殖区9、10月DIN含量, 结果均低于14.28 μmol·L-1,属于贫营养级,11月和12月则属于中度营养级。研究表明,养殖海区氮、磷缺乏会导致坛紫菜营养失调,直接影响藻体的健康生长和发育而发生“绿变病”[4, 16]。本研究所用坛紫菜色泽正常、生长良好,表明该养殖区紫菜栽培没有出现明显的胁迫效应。当氮、磷浓度分别加富至50 μmol·L-1和3.13 μmol·L-1时,坛紫菜藻体的生长速度加快,表现为SGR值显著升高。但是,当氮、磷浓度加富倍数≥4时,藻体生长减缓,说明氮、磷浓度过高会对藻体的生长产生一定的抑制作用。
| 日期Date | 氮、磷含量(μmol·L-1) Contents of N, P(μmol·L-1) |
|||
| NH4+-N | NO3--N | NO2--N | PO43--P | |
| 2019-09-10 | 4.64 | 4.43 | 0.29 | 1.61 |
| 2019-10-05 | 6.57 | 3.50 | 1.93 | 1.29 |
| 2019-10-26 | 5.29 | 1.86 | 0.71 | 2.58 |
| 2019-11-12 | 8.71 | 9.21 | 2.07 | 1.61 |
| 2019-12-13 | 10.21 | 7.36 | 0.86 | 1.29 |
藻类的生长主要靠光合作用来驱动,光合色素的含量不仅能反映出光合作用效率,也能作为紫菜品质选育方面的重要指标之一[17]。坛紫菜的光合色素主要包括叶绿素a、类胡萝卜素和藻胆蛋白。叶绿素a和类胡萝卜素含量决定了藻体对光子的吸收能力,直接影响藻体的光能利用[18, 19],而藻胆蛋白除了可以吸收和传递能量之外,还可以作为细胞中的“贮存蛋白”,充当有机氮储存库[20, 21]。本研究中,当氮、磷浓度加富倍数≤4 (DIN 200 μmol·L-1, PO43--P 12.5 μmol·L-1)时,坛紫菜藻体的光合色素含量均表现出较高水平,表明适当的氮、磷加富培养有助于藻体对光能的捕获和传导,从而提高藻体的生长速率。但是,当氮、磷浓度过高(加富倍数≥8)时,光合色素含量显著性下降,原因可能有两点:一是高浓度的氮、磷胁迫抑制色素合成相关酶的活性,阻碍光合色素的合成;二是高浓度的氮消耗了谷氨酰胺合成酶和ATP,阻碍捕光色素蛋白复合体的合成,进而导致叶绿素a、类胡萝卜素及藻胆蛋白与之结合受阻,降低光合色素的含量[22]。
紫菜营养成分受紫菜品种、养殖模式和养殖水域环境等诸多因素的影响[23, 24]。本研究通过分析氮、磷加富培养下坛紫菜的营养成分,发现坛紫菜粗蛋白质、粗脂肪、灰分和氨基酸含量与氮、磷浓度的变化显著相关。在氮、磷加富培养后,坛紫菜粗蛋白的含量均有不同程度的升高,这可能是因为水体中氮浓度的增加提高了坛紫菜藻体对氮的吸收速率,从而促进蛋白质的合成。与对照组相比,氮、磷浓度加富使得坛紫菜粗脂肪的含量有所下降,灰分含量显著升高。此外,坛紫菜氨基酸总量在氮、磷加富培养后为22.94-42.83%,变化幅度较大,且显著高于对照组。根据1973年FAO/WHO推荐的模式界定,理想蛋白质的氨基酸组成中必需氨基酸占总氨基酸的比值(EAA/TAA)应在40%以上,必需氨基酸和非必需氨基酸的比值(EAA/NEAA)应在60%以上。本研究中,EAA/TAA均低于40%;EAA/NEAA在对照组中满足要求,但在氮、磷加富培养后出现不同程度的下降,降至60%以下。可见氮、磷加富培养下的坛紫菜蛋白质质量略有降低。呈味氨基酸占总氨基酸的比值(DAA/TAA)则有所升高,表明坛紫菜在氮、磷加富培养后鲜味有所提升。氨基酸组成评价的两种评分模式均显示,在不同氮、磷浓度下坛紫菜几种必需氨基酸的评分发生不同的变化,进一步表明氮、磷加富培养对坛紫菜蛋白质的构成产生显著影响。
4 结论综上所述,适当浓度的氮、磷加富培养,可以显著加快坛紫菜的生长,提高其品质。由于本实验是在室内精密控制条件下的培养实验,与近海开放海域养殖可能存在一定差异,因此在生产中需结合养殖海区的本底营养盐浓度,进一步进行现场原位培养加富实验,以达到最优生长、提高品质的目的。
| [1] |
NIU J F, WANG G C, ZHOU B C, et al. Purification of R-phycoerythrin from Porphyra haitanensis (Bangiales, Rhodophyta) using expanded bed absorption[J]. Journal of Phycology, 2007, 43(6): 1339-1347. DOI:10.1111/j.1529-8817.2007.00401.x |
| [2] |
ZHU Z J, QIAN F J, YANG R, et al. A lipoxygenase from red alga Pyropia haitanensis, a unique enzyme catalyzing the free radical reactions of polyunsaturated fatty acids with triple ethylenic bonds[J]. Plos One, 2015, 10(2): e0117351. DOI:10.1371/journal.pone.0117351 |
| [3] |
刘亮, 钟云凯, 曹少谦, 等. 紫菜多糖抗氧化活性及体外免疫调节作用研究[J]. 核农学报, 2016, 30(12): 2355-2362. DOI:10.11869/j.issn.100-8551.2016.12.2355 |
| [4] |
柳佩娟, 纪德华, 谢潮添, 等. 坛紫菜耐低氮磷品系选育的研究[J]. 集美大学学报(自然科学版), 2009, 14(2): 109-114. DOI:10.3969/j.issn.1007-7405.2009.02.001 |
| [5] |
周巍巍, 谢潮添, 陈昌生, 等. 低氮、磷胁迫对坛紫菜叶状体生理生化特征的影响[J]. 水产学报, 2011, 35(4): 543-550. |
| [6] |
孟庆俊, 林少珍, 项彬彬, 等. 营养盐可得性对坛紫菜氮磷吸收、生长及藻红蛋白含量的影响[J]. 上海海洋大学学报, 2010, 19(2): 214-218. |
| [7] |
秦梅, 陈斌斌, 邹定辉. 大气CO2浓度升高缓解高浓度NH4+对坛紫菜(Porphyra haitanensis)生理特性的胁迫作用[J]. 生态科学, 2014, 33(5): 832-838. |
| [8] |
付阳阳, 丁洪昌, 林琪, 等. 光强、温度和N/P比对坛紫菜叶状体单性生殖发生的影响[J]. 水产学报, 2019, 43(3): 104-114. |
| [9] |
张海波, 刘珂, 王丽莎, 等. 渤海中部营养盐赋存形态季节变化及其对营养盐库的影响[J]. 生态学报, 2020, 40(15): 5424-5432. |
| [10] |
TROELL M, HALLING C, NILSSON A, et al. Inte-grated marine cultivation of Gracilaria chilensis (Gracilariales, Rhodophyta) and salmon cages for reduced environmental impact and increased economic output[J]. Aquaculture, 1997, 156(1/2): 45-61. |
| [11] |
JENSEN A. Chlorophylls and carotenoids[M]//HEL-LEBUST J A, CRAIGIE J S, eds. Handbook of phycological methods: Physiological and biochemical methods. Cambridge: Cambridge University Press, 1978: 61-69.
|
| [12] |
SIEGELMAN H W, KYCIA J H. Algal biliproteins[M]//HELLEBUST J A, CRAIGIE J S, eds. Handbook of phycological methods: Physiological and biochemical methods. Cambridge: Cambridge University Press, 1978: 71-79.
|
| [13] |
FAO/WHO. Energy and protein requirement. Report of joint FAO/WHO[R]. Geneva: WHO, 1973: 52-63.
|
| [14] |
中国预防医学科学院营养与食品卫生研究所. 食物成分表(全国代表值)[M]. 北京: 人民卫生出版社, 1991: 28-37.
|
| [15] |
郭卫东, 章小明, 杨逸萍, 等. 中国近岸海域潜在性富营养化程度的评价[J]. 台湾海峡, 1998, 17(1): 64-70. |
| [16] |
KAKINUMA M, COURY D A, NAKAMOTO C, et al. Molecular analysis of physiological responses to changes in nitrogen in a marine macroalga, Porphyra yezoensis (Rhodophyta)[J]. Cell Biology and Toxicology, 2008, 24(6): 629-639. DOI:10.1007/s10565-007-9053-7 |
| [17] |
黄秋, 左正宏, 李勇斌, 等. 60Co-γ诱变坛紫菜的海区栽培选育及品质性状初步分析[J]. 台湾海峡, 2006, 25(2): 250-255. DOI:10.3969/j.issn.1000-8160.2006.02.015 |
| [18] |
KATO M, ARUGA Y. Comparative studies on the growth and photosynthesis of the pigmentation mutants of Porphyra yezoensis in laboratory culture[J]. The Japanese Journal of Phycology, 1984, 32: 333-347. |
| [19] |
史修周, 徐燕, 梁艳, 等. 坛紫菜藻胆蛋白及叶绿素a的测定与分析[J]. 集美大学学报(自然科学版), 2008, 13(3): 221-226. DOI:10.3969/j.issn.1007-7405.2008.03.006 |
| [20] |
HANNACH G. Spectral light absorption by intact bla-des of Porphyra abbottae (Rhodophyta): Effects of environmental factors in culture[J]. Journal of Phycology, 1989, 25(3): 522-529. DOI:10.1111/j.1529-8817.1989.tb00258.x |
| [21] |
钟晨辉, 韩军军, 唐隆晨, 等. 不同光质LED光源对坛紫菜单性叶状体的生长发育及生理指标的影响[J]. 水产学报, 2019, 43(4): 895-906. |
| [22] |
BECK T, FELLER U. Ammonium-stimulated potassium release from Lemna minor L.grown on a medium containing nitrate as N-source[J]. Aquatic Botany, 1991, 39(3): 255-266. |
| [23] |
杨少玲, 戚勃, 杨贤庆, 等. 中国不同海域养殖坛紫菜营养成分差异分析[J]. 南方水产科学, 2019, 15(6): 75-80. |
| [24] |
陈胜军, 于娇, 胡晓, 等. 汕头地区不同采收期坛紫菜营养成分分析与评价[J]. 核农学报, 2020, 34(3): 539-546. |



