2. 中国科学院烟台海岸带研究所,海岸带环境过程与生态修复重点实验室,山东烟台 264003;
3. 国家海洋局北海预报中心,山东青岛 266061
2. Key Laboratory of Coastal Environmental and Ecological Remediation, Yantai Institute of Coastal Zone Research, Chinese Academy of Science, Yantai, Shandong, 264003, China;
3. North China Sea Marine Forecasting Center of State Oceanic Administration, Qingdao, Shandong, 266061, China
低氧(Hypoxia)是指水体中溶解氧(Dissolved Oxygen,DO)浓度低于2 mg/L的现象[1]。截至2008年,全球近岸低氧区已达到400多处,总面积达到245 000 km2,且呈不断增加的趋势,低氧已成为重要的海洋灾害之一,严重影响到海洋生态系统健康和稳定性,阻碍了近岸生态环境的可持续发展[2]。我国早在1988年就观测到长江口存在低氧现象,2003-2007年现场调查表明东海海域存在大范围的低氧区[3, 4],近年来在辽东湾、小清河口、辽河口、乳山湾等海域也发现不同程度的低氧区[5-7]。
近岸海域底层缺氧成因与海水中的物理和生物化学过程紧密相关,其中水体层化和底层水体中有机质的降解耗氧是两个主要影响因素[8-12]。此外,水体富营养化[13-15]、温室效应导致的水温上升,突变和灾难性天气导致水生植物光合作用减弱以致产氧量降低[4, 16-18]等也加剧了水体中的低氧现象。水生动物遭受低氧胁迫时,在行为、生长生存、生理生化、发育繁殖等方面均表现异常,常见的如主动离开低氧环境、生长速度减慢、生殖力下降、呼吸代谢过程的变化、胚胎和性腺发育受阻等[19-26]。低氧胁迫对贝类、鱼类等的影响研究已开展较多,而对棘皮动物尤其是光棘球海胆Mesocentrotus nudus的影响研究仅有少量报道。已有研究发现,低氧组的光棘球海胆性腺生长和总摄食量明显低于常氧组[27];缺氧可导致光棘球海胆发育异常,引起应激反应和抗氧化反应[28];持续缺氧的光棘球海胆维持了基础代谢率,但与常氧条件下的相比,它们的摄食、性腺发育和钙化率较低[29]。
光棘球海胆自然分布于西北太平洋沿岸海域,包括朝鲜半岛、日本北部、俄罗斯远东地区及我国的山东和辽东半岛[30],主要生活在藻类丛生的岩礁或砾石海底,喜食海带和裙带菜等大型藻类。光棘球海胆是棘皮动物中的重要经济物种之一,具有较高的食用价值和极好的药用功能,这刺激了海胆的需求量,市场供不应求,其增养殖规模不断扩大[31]。此外,光棘球海胆主要的自然分布区和养殖区——山东及辽东半岛沿海也常受季节性低氧困扰。但目前关于低氧胁迫对光棘球海胆行为、形态、存活和生理机能的影响尚未见报道,因此迫切需要了解低氧对光棘球海胆的影响方式和程度。本研究为明确低氧胁迫对光棘球海胆行为和存活的影响,选用3种不同规格的光棘球海胆个体,通过模拟两种低氧胁迫条件,分析3种规格光棘球海胆在行为、形态、存活、半致死时间(Median Lethal Time,LT50)和超氧化物歧化酶(Superoxide Dismutase,SOD)活力等方面的表现,探讨不同低氧条件对光棘球海胆的影响,为自然海域海胆种群维持以及海胆养殖业的健康发展提供科学依据。
1 材料与方法 1.1 试验材料光棘球海胆实验个体购于威海荣城映波海胆育苗场,带回实验室玻璃缸(水体体积0.027 cm3)中暂养,海水盐度35‰,温度22℃,持续充氧,每日投喂足量干海带(清水泡开后饲喂)、换水并清理缸底杂质。适应7 d后选择健康具活力的个体用于试验,其中大规格海胆平均体质量(91.41±3.31) g、中规格海胆(60.79±3.42) g、小规格海胆(4.15±0.18) g。实验过程中不同海胆的投放密度分别为小规格海胆555只/m3,大、中规格各370只/m3。
1.2 低氧胁迫对光棘球海胆半致死时间影响的急性实验对于小规格海胆,设置1个对照组和2个试验组(DO浓度为0.5 mg/L,2.0 mg/L),每组设3个平行;对于中、大规格海胆,各设置1个对照组和3个试验组(DO浓度为0.5 mg/L,2.0 mg/L,3.0 mg/L),每组设3个平行。通过向海水中充入不同速率的氮气和空气来控制不同溶氧水平。实验过程中每天定时测量记录海水的溶氧值和温度,及时对溶氧值进行微调。记录每组光棘球海胆在不同时间点的生长和存活情况,并计算半致死时间。半致死时间是指动物急性毒性试验中,不同浓度药物使受试动物出现半数死亡的时间,用LT50表示。
1.3 低氧胁迫对光棘球海胆SOD指标影响的实验实验开始前,中规格海胆预养一周。实验的溶氧梯度及组别设置同1.2节,每组设置3个平行。实验持续96 h,前24 h为低氧胁迫实验,后72 h为解除胁迫后的恢复实验。通过向养殖缸充氧达到胁迫解除。测定酶活力的取样时间为胁迫开始后的6 h、12 h、24 h和复氧后的6 h、12 h、24 h、48 h、72 h,每个时间点取3只海胆。实验全程不投喂。海胆的SOD活力按照商业化的试剂盒(北京索莱宝科技有限公司)使用说明进行测定,当黄嘌呤氧化酶偶联反应体系中抑制百分率为50%时,反应体系中的SOD酶活力定义为一个酶活力单位(U)。
1.4 数据分析本实验采用半致死时间指标来衡量不同溶解氧对光棘球海胆的影响程度。根据实验过程记录的海胆死亡个体数计算出死亡率,将死亡率换算成概率单位,与低氧暴露时间的对数值拟合,得到低氧胁迫的暴露时间与死亡率的线性表达式(1)[32],再用式(1)反算不同溶解氧条件下的半致死时间(LT50)。
| $ Y = a \times \mathit{lg}T + b $ | (1) |
式中:Y为不同的死亡率对应的概率单位;T为每只试验海胆的死亡时间(h);a为回归方程的斜率;b为回归方程的截距。
采用Matlab软件作图,采用SPSS 20.0统计软件进行海胆个体死亡率随低氧胁迫时间的相关性分析(显著性水平取P<0.01)。两个低氧组不同时间的SOD活力采用Kruskal-Wallis秩和检验(P<0.05差异有统计学意义),数据以平均值±标准误表示。
2 结果与分析 2.1 低氧胁迫对光棘球海胆形态和行为的影响3种规格海胆的形态和行为变化在实验初期、中期和末期均存在明显差异,以0.5 mg/L低氧胁迫实验为例:①初期(0-17 h)表现为尚能适应:形态上,海胆管足出现少量卷曲,几个小时之后全部弯曲,仅依靠少数管足支撑以贴在缸壁上;行为上,海胆个体均移动至水体与空气界面,时间延长后仍保持原位不动,即表现出移动至有氧区域的行为适应。②中期(17-40.5 h)表现为勉强存活:形态上,海胆管足卷曲更为严重,有少量棘变白色,多只海胆出现棘向下低垂的现象。随时间延长,海胆身上更多的棘开始逐渐变白,壁上有许多断掉的管足,棘开始脱落;行为上,有的个体开始因管足支撑力不足导致贴壁位置下降,甚至滑落至缸底。同时滑落至缸底的海胆仍在努力向上移动以获取更多氧气。该阶段海胆表现为反复掉落又爬上缸壁,用仅剩的管足贴壁。仅少数(5根以下)管足可用,活力变弱。③末期(40.5-42 h)表现为濒死、死亡:形态上,海胆棘几乎全部脱落,逐渐死亡;行为上,海胆活力越来越差,管足吸附性已经无法对抗水流,被冲至缸底的一侧。仅在外物触碰时棘缓慢挪动,个体几乎不动,随时间延长, 外物触碰时也无反应。
低氧胁迫下可观察到4种较为明显的海胆形态变化:海胆部分管足失活、管足吸附力明显下降,无法支撑身体[图 1(a)];管足变短、卷曲[图 1(b)];棘状态变差,位置较正常状态有所下落[图 1(c)];棘大量掉落[图 1(d)]。

|
| 图 1 光棘球海胆在低氧胁迫下的形态变化 Fig. 1 Morphological changes of sea urchin individuals under hypoxia stress |
2.2 低氧暴露时间与光棘球海胆死亡率
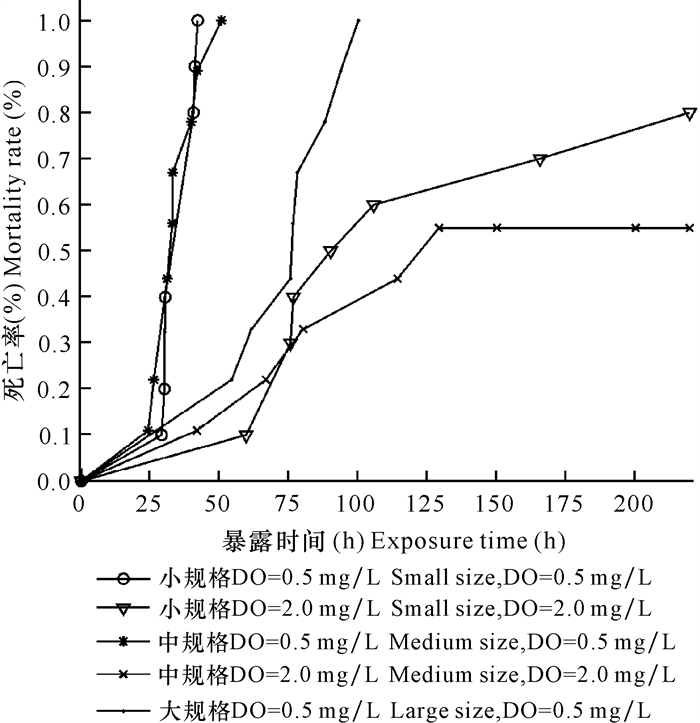
判断海胆个体死亡的标准为棘全部收起且部分脱落,用外物轻微触碰海胆时棘依然不动,围口膜凸出且颜色变淡。在不同低氧条件下,随着暴露时间的延长,海胆逐渐死亡,但最终死亡率不同。其中,在DO 2.0 mg/L低氧胁迫下,小规格和中规格海胆仅部分个体死亡,剩余个体随胁迫时间延长出现对低氧的耐受而不再死亡;大规格海胆个体存活状态则一直较好,无死亡发生。3.0 mg/L溶解氧条件下,中、大规格海胆个体状态也一直保持较好,无死亡发生。
3种规格的海胆在0.5 mg/L和2.0 mg/L两种低氧胁迫水平下,个体死亡率随低氧暴露时间的延长呈显著性差异(P<0.01)(表 1)。其中,小规格海胆对低氧的耐受力最低,随暴露时间延长,死亡最快,0.5 mg/L组42 h内个体死亡率达100%,但2.0 mg/L组219.5 h内死亡率才达到80%,之后一直到300 h都不再有新增死亡个体;中规格海胆对低氧胁迫的耐受力高于小规格海胆,0.5 mg/L组50.58 h内个体死亡率为100%,2.0 mg/L组129.08 h内的死亡率为55%,之后一直到300 h都不再有新增死亡个体;大规格海胆对低氧胁迫的耐受力最高,0.5 mg/L组100 h内个体死亡率达到100%,2.0 mg/L组所有个体存活(图 2)。
| 海胆规格 Size of sea urchin |
暴露时间(h) Exposure time (h) |
死亡率(%) Mortality rate (%) |
|||
| 0.5 mg/L | 2.0 mg/L | 0.5 mg/L | 2.0 mg/L | ||
| 小Small | 29 | 59.5 | 10 | 10 | |
| 30 | 75.5 | 20 | 30 | ||
| 30.25 | 76.5 | 40 | 40 | ||
| 40.5 | 90 | 80 | 50 | ||
| 41 | 105.5 | 90 | 60 | ||
| 42 | 165.5 | 100 | 70 | ||
| 219.5 | 80 | ||||
| 中Medium | 24.17 | 41.75 | 11 | 11 | |
| 26.17 | 66.58 | 22 | 22 | ||
| 31 | 80.08 | 44 | 33 | ||
| 32.83 | 114.08 | 56 | 44 | ||
| 33 | 129.08 | 67 | 55 | ||
| 39.67 | 78 | ||||
| 41.83 | 89 | ||||
| 50.58 | 100 | ||||
| 大Large | 54.25 | 300 | 22 | 0 | |
| 61.42 | 33 | ||||
| 75.42 | 40 | ||||
| 76.42 | 56 | ||||
| 78 | 67 | ||||
| 87.92 | 78 | ||||
| 93.58 | 89 | ||||
| 100 | 100 | ||||
|
| 大规格海胆在2.0 mg/L低氧暴露下所有个体存活,图中未展示 All the large size of sea urchin individuals survived exposure to 2.0 mg / L hypoxia, not shown in the figure 图 2 不同处理组低氧暴露时间和海胆个体死亡率 Fig. 2 Hypoxia exposure time and individual mortality rate of sea urchin in different treatment groups |
2.3 低氧胁迫下光棘球海胆的半致死时间
在DO 0.5 mg/L和DO 2.0 mg/L低氧胁迫下,3种规格光棘球海胆的半致死时间均不相同(表 2),DO浓度为0.5 mg/L时,小规格光棘球海胆(幼胆)的LT50为34.02 h,中规格的LT50为31.64 h,大规格的LT50为70.50 h;DO浓度为2.0 mg/L时,小规格光棘球海胆(幼胆)的LT50延长至107.15 h,中规格的LT50延长至120.88 h。
| 海胆规格 Size of sea urchin |
溶解氧浓度(mg/L) Dissolved oxygen concentration (mg/L) |
拟合方程 Fitting equation |
决定系数R2 Coefficient of determination R2 |
半致死时间(LT50) Median lethal time (LT50) |
| 小Small | 0.5 | P(C)=13.868X-16.242 | 0.918 5 | 34.02 |
| 2.0 | P(C)=3.2259X-1.5486 | 0.856 9 | 107.15 | |
| 中Medium | 0.5 | P(C)=9.7548X-9.635 | 0.973 1 | 31.64 |
| 2.0 | P(C)=2.7228X-0.6698 | 0.983 5 | 120.88 | |
| 大Large | 0.5 | P(C)=8.006X-9.7964 | 0.912 8 | 70.50 |
2.4 中规格光棘球海胆体腔液SOD活力的变化
0.5 mg/L和2.0 mg/L两种低氧胁迫水平下,中规格光棘球海胆体腔液的SOD活力值在低氧和复氧24 h前的两个实验阶段均呈现显著性差异(Kruskal-Wallis秩和检验,P<0.05)(表 3),而对照组(常氧)海胆的SOD活力值在上述两个实验阶段保持恒定为(6.76±0.17) U/mL。进一步分析发现,两种低氧胁迫水平下,海胆SOD活力值呈现不同的变化过程,具体表现为DO 0.5 mg/L低氧胁迫下,SOD活力值在6 h内轻微下降,至12 h呈上升趋势,之后至24 h剧烈下降,而复氧后6 h内SOD活力值明显升高,之后至72 h呈降低趋势(48 h数据判断为异常值);DO 2.0 mg/L低氧胁迫下,SOD活力值在6 h内明显下降,6 h之后至24 h呈逐渐上升趋势,24 h检测值以及复氧后SOD活力值与对照组(常氧)无明显差异(复氧24 h数据判断为异常值)。
| 实验阶段 Experimental stage |
SOD活力值(U/mL) SOD activity value (U/mL) |
|
| 0.5 mg/L | 2.0 mg/L | |
| 低氧6 h Hypoxia treatment for 6 h |
5.24±0.15* | 2.48±0.14* |
| 低氧12 h Hypoxia treatment for 12 h |
6.93±0.08* | 4.12±0.17* |
| 低氧24 h Hypoxia treatment for 24 h |
1.83±0.06* | 7.09±0.23 |
| 复氧6 h Reoxygenation treatment for 6 h |
4.07±0.07* | 6.55±0.22 |
| 复氧12 h Reoxygenation treatment for 12 h |
3.61±0.07* | 7.38±0.23 |
| 复氧24 h Reoxygenation treatment for 24 h |
1.54±0.06* | 1.53±0.13 |
| 复氧48 h Reoxygenation treatment for 48 h |
15.45±0.12* | 5.62±0.20 |
| 复氧72 h Reoxygenation treatment for 72 h |
0.85±0.06* | 6.02±0.21 |
| 注:*P<0.05 Note: *P<0.05 | ||
3 讨论
海水中的DO是决定底栖生物群落分布的关键因素[33]。海洋低氧会造成群落中低氧敏感种消亡,同时利于低氧耐受种生存,进而改变群落组成[34-36],如切萨皮克湾水体发生低氧时,大型底栖动物的丰度及生物量都低于正常情况[34]。长期的低氧甚至会形成低氧区,使一些物种丧失栖息地[37]。而一些对低氧耐受程度高的物种,如多毛类可作为低氧指示物种用于生态系统健康评估[38]。生物群落结构、栖息地、迁移方式和垂直分布都与水体的溶解氧有密切关系,低氧发生后渔业产量以及建立在生态系统服务上的旅游经济也会受到波及[35, 39]。海胆作为中国近海常见的底栖生物具有重要的生态地位,是海洋碳循环及食物网不可缺少的一部分。此外,光棘球海胆作为经济物种也是中国和日本重要的水产养殖品种。我国光棘球海胆主要的自然分布区和养殖区(山东及辽东半岛)常常受到季节性低氧的影响,因此研究低氧胁迫对光棘球海胆行为、形态和存活的影响,对于深入了解自然海区光棘球海胆种群维持以及海胆养殖业的健康发展都具有重要的理论和实际意义。
低氧环境胁迫下,水生生物具有不同的应对行为,如游泳能力较强的鱼类会主动游离低氧区[19],栉孔扇贝也通过壳的快速闭合推动自身运动游离低氧区[40],而一些动物则通过各种方法努力维持氧气供应[13],如锦鲫通过降低临界游泳速度和活跃代谢率来应对低氧变化[41]。本研究观察到低氧胁迫下各实验组光棘球海胆的活力都有所下降,可能与锦鲫拥有相似的应对低氧策略,这有待进一步的生理分析来证实。相对而言,大部分底栖动物运动性差,这使它们常常面对低氧的长时间胁迫,一些低氧敏感种甚至永久性消失[35],严重低氧时会造成生物的大规模死亡,进而演化成为低氧死亡区[42]。运动能力相对较弱的棘皮动物以及一些埋栖型软体动物等无法规避低氧区,会通过其他途径获取更多的氧气,如某些埋栖型双壳类会向浅层移动,或将自身水管尽量伸展以获取底层水体中更多的氧气。同属棘皮动物门的海蛇尾面对低氧胁迫时,依靠腕部力量托举体盘以到达溶氧更高的水域,同时减少不必要的运动来降低能量消耗[43]。另有研究发现,低氧胁迫后仿刺参的移动距离显著降低[44]。
本研究发现,低氧胁迫初期,3种规格光棘球海胆在管足仍能支撑身体的前提下,均缓慢移动离开缸底,移动至水气交界处以获取更多的氧气,部分身体裸露出水面,且保持原位不动。随着低氧暴露时间的延长,3种规格海胆的活力都逐渐下降,管足失去吸附力, 即不再有运动能力,身体相继落到缸底部,且活力下降速度与个体大小和溶氧水平明显相关。而常氧状态下的海胆个体在整个实验过程中均在水面之下自然分布。上述行为特征都揭示了不同规格的海胆应对低氧胁迫的能力存在差异。
为掌握海胆在低氧胁迫下,不同规格个体的低氧暴露时间与死亡率之间的关系,探究海胆经过长时间低氧暴露后是否存在对低氧胁迫的适应,本研究还分析了随低氧暴露时间延长,海胆个体的死亡率变化。随着低氧暴露时间的延长,3种规格的光棘球海胆个体死亡率逐渐上升,DO 0.5 mg/L低氧胁迫下海胆个体死亡率都达到了100%,而DO 2.0 mg/L低氧胁迫下死亡率均低于100%,其中大、中、小3种规格海胆的死亡率分别为0、55%和80%,且低氧后期未死亡海胆个体的活力有所回升,大规格海胆甚至全部存活。因此,推测在DO 2.0 mg/L低氧胁迫下,随低氧暴露时间的持续,海胆个体可以产生不同程度的耐受和适应。本研究发现,光棘球海胆在DO 2.0 mg/L低氧胁迫下所产生的轻微适应也符合预期。值得注意的是,中、大规格光棘球海胆在DO 3.0 mg/L低氧胁迫下虽然活力减弱,但并无死亡现象。这对水产养殖的规划具有一定的指导意义。在近年来海洋低氧现象愈发严重的背景下,低氧面积的扩大是短期内不可避免的趋势,相比其他低氧耐受性差的经济物种,光棘球海胆可作为溶解氧亏损区(DO浓度≥3 mg/L)养殖品种的另一选择。
半致死时间是研究生物对生态因子耐受情况的重要指标,低氧条件下生物达到半致死率所经历的时间即低氧半致死时间[45],通常被作为该种生物耐受低氧能力的重要参数。光棘球海胆是重要的经济物种且在海藻床生态系统中拥有不可或缺的生态地位[46]。若自然或养殖环境中海胆面临持续的低氧,造成半数海胆死亡,将会严重影响种群稳定性,进而对海洋食物网结构造成严重影响。然而在近年来近海低氧海域不断扩大的背景下,关于低氧胁迫对光棘球海胆半致死时间影响的研究仍较少。本研究结果表明,在两种低氧胁迫水平下,大规格海胆低氧耐受能力均强于中、小规格海胆,且0.5 mg/L的低氧对海胆的影响明显大于2.0 mg/L。在0.5 mg/L的低氧条件下,中、小规格海胆的半致死时间差异较小,而在2.0 mg/L的低氧条件下,中规格海胆半致死时间(120.88 h)高于小规格海胆半致死时间(107.15 h)。这与刺参耐受低氧的研究结果一致,即大规格刺参耐低氧的能力高于小规格刺参[47]。Eerkes-Medrano等[48]在研究中也发现,相比于成体,潮间带中10种无脊椎动物的幼体对低氧的耐受能力更弱,幼体对低氧环境的敏感性更强。不同物种对低氧的耐受力不同,如贝类对低氧的耐受一般强于棘皮动物[49],在2.0 mg/L的低氧条件下菲律宾蛤仔的存活率为100%[44],而棘皮动物对低氧的耐受能力也比某些甲壳类强[50],如刀额新对虾Metapenaeus ensis在溶氧条件为0.5 mg/L时的半致死时间为6.65 h[21],显著低于本研究结果。
SOD是一种含金属的抗氧化酶,广泛存在于动植物与微生物界。1969年SOD的生物学功能首次被揭示,它对清除氧自由基、保护细胞免受氧化损伤有重要作用[51]。近年来,在水生动物抗逆性的研究中也常采用SOD活力的变化来表征动物抗氧化系统的应对情况,如沼泽红假单胞菌Rhodopseudomonas palustris可以显著提高皱纹盘鲍Haliotis discus hannai幼鲍的SOD活性(P<0.05)[52]、苯并芘(BaP)暴露对仿刺参Apostichopus japonicus幼参SOD活力影响显著[53]、低氧胁迫对珠龙趸幼鱼组织SOD含量影响显著(P<0.05)[54]。本研究发现两种溶解氧条件下,SOD活力在不同低氧胁迫阶段均显著低于对照组(P<0.05),说明光棘球海胆的抗氧化系统功能会因低氧胁迫而降低。在严重低氧(0.5 mg/L)胁迫下,光棘球海胆SOD活力随低氧胁迫时间延长而显著降低,即使复氧后也不能恢复至正常水平,原因可能是严重的低氧已损伤海胆的抗氧化系统,使其无法恢复。需要注意的是,在复氧48 h时,SOD活力急剧增加至(15.45±0.12) U/mL,这极有可能是异常值。而在2.0 mg/L的低氧条件下,复氧后SOD活力逐渐恢复至正常水平,这与刺参在低氧胁迫下SOD活力的研究结论一致[47, 55]。本研究结果中SOD的变化看不出明显规律,这可能需要结合光棘球海胆抗氧化系统的其他指标一起分析[47, 56],有待后续的研究。
4 结论在DO 0.5 mg/L和DO 2.0 mg/L低氧胁迫下,海胆行为表现异常,低氧初期海胆表现为管足活力下降、吸附力降低,移动能力变弱,同时伴随棘脱落,随着低氧暴露时间延长,海胆各项活动能力进一步减弱,直至死亡;在DO 3.0 mg/L条件下,中、大规格海胆无死亡现象。3种规格海胆死亡率随低氧暴露时间延长都有所增加,其中在DO 0.5 mg/L胁迫下,3种规格海胆最终的死亡率都达到100%,但在DO 2.0 mg/L胁迫下,随低氧胁迫时间的延长,3种规格海胆都对低氧胁迫表现出不同程度的适应,很少死亡。3种规格海胆的LT50在0.5 mg/L和2.0 mg/L两种低氧胁迫水平下存在差异,DO 0.5 mg/L胁迫下,大规格海胆的LT50为70.50 h,中规格为34.64 h,小规格为34.02 h;DO 2.0 mg/L胁迫下,中规格海胆的LT50延长至120.88 h,小规格海胆的LT50延长至107.15 h。中规格海胆在两种低氧胁迫水平下,体内的SOD活力均发生明显变化,说明低氧胁迫已影响到光棘球海胆的抗氧化系统。
根据实验结论以及和其他相关研究的对比,在此提出对光棘球海胆自然种群维持和海胆养殖业应对低氧的3点建议:①在自然水域和养殖水域,可通过观察海胆的行为特征,即个体所处水体的位置、棘与管足的情况等来估计当前水体溶氧情况,若出现多只海胆向浅水处移动并靠近水面、棘低垂等现象,则应注意是否出现水体低氧状况;②由于中、小规格海胆对低氧的耐受力弱于大规格海胆,因此有必要为中、小规格海胆准备具增氧设备的暂养池,当海胆长到大规格时可以在溶氧值合适的近岸水域饲养;③由于光棘球海胆在溶解氧亏损区具有较强适应能力以及适应性,在低氧高发的近岸海域(DO值3.0 mg/L以上水域),可以考虑用其代替其他对氧敏感的经济物种开展养殖。
| [1] |
CONLEY D J, BJÖRCK S, BONSDORFF E, et al. Hy-poxia-related processes in the Baltic Sea[J]. Environmental Science and Technology, 2009, 43: 3412-3420. DOI:10.1021/es802762a |
| [2] |
DIAZ R J, ROSENBERG R. Spreading dead zones and consequences for marine ecosystems[J]. Science, 2008, 321(5891): 926-929. DOI:10.1126/science.1156401 |
| [3] |
ZHU Z Y, WU H, LIU S M, et al. Hypoxia off the Changjiang (Yangtze River) estuary and in the adjacent East China Sea: Quantitative approaches to estimating the tidal impact and nutrient regeneration[J]. Marine Pollution Bulletin, 2017, 125(1/2): 103-114. |
| [4] |
CHEN C C, GONG G C, SHIAH F K. Hypoxia in the East China Sea: One of the largest coastal low-oxygen areas in the world[J]. Marine Environmental Research, 2007, 64(4): 399-408. DOI:10.1016/j.marenvres.2007.01.007 |
| [5] |
孟春霞, 邓春梅, 姚鹏, 等. 小清河口及邻近海域的溶解氧[J]. 海洋环境科学, 2005(3): 25-28. DOI:10.3969/j.issn.1007-6336.2005.03.007 |
| [6] |
李艳云, 王作敏. 大辽河口和辽东湾海域水质溶解氧与COD、无机氮、磷及初级生产力的关系[J]. 中国环境监测, 2006(3): 70-72. DOI:10.3969/j.issn.1002-6002.2006.03.023 |
| [7] |
冉祥滨, 臧家业, 韦钦胜, 等. 乳山湾邻近海域低氧现象及成因浅析[J]. 海洋科学进展, 2012, 30(3): 347-356. DOI:10.3969/j.issn.1671-6647.2012.03.005 |
| [8] |
王巧宁, 颜天, 周名江. 近岸和河口低氧成因及其影响的研究进展[J]. 海洋环境科学, 2012, 31(5): 775-778. |
| [9] |
王焕卿, 冯巍巍, 蔡宗岐, 等. 山东近海海水COD与BOD相关性研究[J]. 广西科学, 2021, 28(2): 125-129. |
| [10] |
王丽芳, 戴民汉, 翟惟东. 近岸、河口缺氧区域的主要生物地球化学耗氧过程[J]. 厦门大学学报(自然科学版), 2007(S1): 33-37. |
| [11] |
罗琳, 李适宇, 王东晓. 珠江河口夏季缺氧现象的模拟[J]. 水科学进展, 2008(5): 729-735. DOI:10.3321/j.issn:1001-6791.2008.05.019 |
| [12] |
NIXON, SCOTT W. Coastal marine eutrophication: A definition, social causes, and future concerns[J]. Ophelia, 1995, 41(1): 199-219. DOI:10.1080/00785236.1995.10422044 |
| [13] |
WU R S S. Hypoxia: from molecular responses to ecosystem responses[J]. Marine Pollution Bulletin, 2002, 45(1-12): 35-45. DOI:10.1016/S0025-326X(02)00061-9 |
| [14] |
李斌, 刘保良, 陈旭阳, 等. 基于海洋生态在线监测浮标数据的钦州湾藻华过程研究[J]. 广西科学, 2021, 28(1): 30-36. |
| [15] |
朱冬琳, 陈波, 牙韩争, 等. 广西近海污染物输运模拟研究[J]. 广西科学, 2019, 26(6): 669-675. |
| [16] |
STRAMMA L, JOHNSON G C, SPRINTALL J, et al. Expanding oxygen-minimum zones in the tropical oceans[J]. Science, 2008, 320(5876): 655-658. DOI:10.1126/science.1153847 |
| [17] |
SANFORD L P, SELLNER K G, BREITBURG D L. Covariability of dissolved oxygen with physical processes in the summertime Chesapeake Bay[J]. Journal of Marine Research, 1990, 48(3): 567-590. DOI:10.1357/002224090784984713 |
| [18] |
BELL G W, EGGLESTON D B, WOLCOTT T G. Behavioral responses of free-ranging blue crabs to episodic hypoxia.l.movement[J]. Marine Ecology Progress Series, 2003, 259: 215-255. DOI:10.3354/meps259215 |
| [19] |
WANNAMAKER C M, RICK J A. Effects of hypoxia on movements and behavior of selected estuarine organisms from the south eastern United States[J]. Journal of Experimental Marine Biology and Ecology, 2000, 249(2): 145-163. DOI:10.1016/S0022-0981(00)00160-X |
| [20] |
SANDBERG E. Does oxygen deficiency modify the fun-ctional responses of Saduria entomon (Isopoda) to Bathyporeia pilosa (Amphipoda)[J]. Marine Biology, 1997, 129(3): 499-504. DOI:10.1007/s002270050190 |
| [21] |
WU R S S, ZHOU B S, RANDALL D J, et al. Aquatic hypoxia is an endocrine disruptor and impairs fish reproduction[J]. Environmental Science and Technology, 2003, 37: 1137-1141. DOI:10.1021/es0258327 |
| [22] |
SHANG E H H, WU R S S. Aquatic hypoxia is a teratogen and affects fish embryonic development[J]. Environmental Science and Technology, 2004, 38: 4763-4767. DOI:10.1021/es0496423 |
| [23] |
GLASS M L, ANDERSEN N A, KRUHFFER M, et al. Combined effects of environmental PO2 and temperature on ventilation and blood gases in the carp Cyprinus carpio L[J]. Journal of Experimental Biology, 1990, 148: 1-17. |
| [24] |
叶双, 黄来旺, 崔琳, 等. 20℃下急性缺氧胁迫对红耳龟糖类代谢和抗氧化防御系统的影响[J]. 水生生物学学报, 2011, 35(6): 1005-1011. |
| [25] |
李黎, 曹振东, 付世建. 环境缺氧(Hypoxia)及其对鱼类影响的研究进展[J]. 现代渔业信息, 2005, 6(20): 6-8. |
| [26] |
KECKEIS H, BAUER E, KAMLER E. Effects of reduced oxygen level on the mortality and hatching rate of Chondrostoma nasua embryos[J]. Journal of Fish Biology, 1996, 49(3): 430-440. |
| [27] |
CHRISTIANSEN J S, SⅡKAVUOPIO S I. The relationship between feed intake and gonad growth of single and stocked green sea urchin (Strongylocentrotus droebachiensis) in a raceway culture[J]. Aquaculture, 2007, 262(1): 163-167. DOI:10.1016/j.aquaculture.2006.09.043 |
| [28] |
LEE G S, HWANG J I, CHUNG Y J, et al. Effects of hypoxia on the fertilization and early development of Sea Urchin, Strongylocentrotus nudus[J]. Journal of the Korea Academia-Industrial Cooperation Society, 2012, 13(8): 3785-3791. DOI:10.5762/KAIS.2012.13.8.3785 |
| [29] |
LOW N H N, MICHELI F. Short-and long-term impacts of variable hypoxia exposures on kelp forest sea urchins[J]. Scientific Reports, 2020, 10(1): 2632. |
| [30] |
王波. 大连紫海胆的生物学特性及培养殖[J]. 齐鲁渔业, 1996(1): 25-27. |
| [31] |
由香莉. 黄、东海海胆分类学研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2003.
|
| [32] |
张亦然, 杜秋成, 王远铭, 等. 总溶解气体过饱和含沙水体对齐口裂腹鱼影响的实验研究[J]. 水利学报, 2014, 45(9): 1029-1037. |
| [33] |
LAINE A O, ANDERSIN A B, LEINIOE S, et al. Stratification-induced hypoxia as a structuring factor of macrozoobenthos in the open Gulf of Finland (Baltic Sea)[J]. Journal of Sea Research, 2007, 57(1): 65-77. |
| [34] |
DAUER D M. Biological criteria, environmental health and estuarine macrobenthic community structure[J]. Marine Pollution Bulletin, 1993, 26: 249-257. |
| [35] |
DIAZ R J, ROSENBERG R. Marine benthic hypoxia: A review of its ecological effects and the behavioural response of benthic macrofauna[J]. Oceanography and Marine Biology, 1995, 33: 245-303. |
| [36] |
JOSEFSON A B, WIDBOM B. Differential response of benthic macrofauna and meiofauna to hypoxia in the Gullmar Fjord basin[J]. Marine Biology, 1988, 100(1): 31-40. |
| [37] |
CRAIG J K, CROWDER L B, HENWOOD T A. Spatial distribution of brown shrimp (Farfantepenaeus aztecus) on the northwestern Gulf of Mexico shelf: Effects of abundance and hypoxia[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(6): 1295-1308. |
| [38] |
COOK A A, LAMBSHEAD P J, HAWKINS L E, et al. Nematode abundance at the oxygen minimum zone in the Arabian Sea[J]. Deep Sea Research Part Ⅱ Topical Studies in Oceanography, 2000, 47(1): 75-85. |
| [39] |
ROSENBERG R, NILSSON H C, DIAZ R J. Response of benthic fauna and changing sediment redox profiles over a hypoxic gradient-science direct[J]. Estuarine, Coastal and Shelf Science, 2001, 53(3): 343-350. |
| [40] |
李峤. 经济贝类对低氧耐受性的研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2019.
|
| [41] |
付世建, 李秀明, 赵文文, 等. 不同溶氧水平下锦鲫的运动和代谢适应对策[J]. 重庆师范大学学报(自然科学版), 2010, 27(3): 14-18, 26. |
| [42] |
LEVINGS C D. Demersal and benthic communities in Howe Sound basin and their responses to dissolved oxygen deficiency[J]. Canadian Technical Report of Fisheries and Aquatic Science, 1980, 951: 27. |
| [43] |
LEVINGS S G, CHAN H Y, LIU C C, et al. Effect of prolonged hypoxia on food consumption, respiration, growth and reproduction in marine scavenging gastropod Nassarius festivus[J]. Marine Pollution Bulletin, 2008, 57(6-12): 280-286. |
| [44] |
周晓梦, 张秀梅, 李文涛. 温度和溶解氧对仿刺参存活、代谢及运动能力的影响[J]. 水产学报, 2018, 42(8): 1209-1219. |
| [45] |
HAHN E D, SOYER R. Probit and logit models: Diff-erences in the multivariate realm[D]. Washington DC: The George Washington University, 2005: 1-14.
|
| [46] |
张立斌. 几种典型海域生境增养殖设施研制与应用[D]. 青岛: 中国科学院研究生院(海洋研究所), 2010.
|
| [47] |
周晓梦, 张秀梅, 李文涛. 高温和低氧胁迫对两种规格刺参半致死时间及生理机能的影响[J]. 中国水产科学, 2018, 25(1): 60-73. |
| [48] |
EERKES-MEDRANO D, MENGE B A, SISLAK C, et al. Contrasting effects of hypoxic conditions on survivorship of planktonic larvae of rocky intertidal invertebrates[J]. Marine Ecology-Progress Series, 2013, 478(3): 139-151. |
| [49] |
MILLER D, POUCHER S, COIRO L. Determination of lethal dissolved oxygen levels for selected marine and estuarine fishes, crustaceans, and a bivalve[J]. Marine Biology, 2002, 140(2): 287-296. |
| [50] |
宋宗岩. 刺参养殖与溶解氧的关系分析[J]. 水产养殖, 2009, 30(12): 15-16. |
| [51] |
CORD J M, FRIDOVICH I. Superoxide dismutase, an enzymatic function for erythrocuperin[J]. Journal of Biological Chemistry, 1969, 244: 6049-6055. |
| [52] |
张瑞标. 沼泽红假单胞菌对皱纹盘鲍幼鲍生长性能、抗氧化能力及非特异性免疫的影响[J]. 饲料研究, 2021, 44(16): 43-47. |
| [53] |
陶文卿. 苯并芘(BaP)对仿刺参(Apostichopus japonicus)幼参毒性效应的研究[D]. 烟台: 烟台大学, 2021.
|
| [54] |
陈恺琳, 马鹏生, 黄建盛, 等. 低氧胁迫对珍珠龙趸幼鱼组织超氧化物歧化酶SOD含量的影响[J]. 江西水产科技, 2021(4): 16-18. |
| [55] |
郑慧, 李彬, 荣小军, 等. 盐度和溶解氧对刺参非特异性免疫酶活性的影响[J]. 渔业科学进展, 2014, 35(1): 118-124. |
| [56] |
管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响[J]. 河北大学学报(自然科学版), 2010, 30(3): 301-306. |



