2. 广西大学林学院,广西森林生态与保育重点实验室,广西南宁 530004;
3. 广西科学院生态环境研究所,广西南宁 530007
2. Guangxi Key Laboratory of Forest Ecology and Conservation, Forestry College, Guangxi University, Nanning, Guangxi, 530004, China;
3. Institute of Eco-Environmental Research, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
我国岩溶地貌面积约为3.44×106 km2,约占国土总面积的1/3,集中分布于我国西南地区[1]。西南地区岩溶森林生态系统结构和功能复杂多样,为人类提供了大量的木质和非木质林产品,在维护生态安全、维持生物多样性、减缓自然灾害、保障农业生产条件等方面有举足轻重的作用[2, 3]。由于受碳酸盐岩坚硬、可溶性强、洞穴缝隙发育等特性和雨热同季的季风气候等的影响,岩溶地区形成了地表、地下双层水文地质结构,难以蓄水、保水[4]。此外,碳酸盐岩成土物质先天不足,土壤资源匮乏,土层浅薄,土壤富钙而偏碱性,土被不连续,从而限制岩溶山地植被生产力,具有明显的生态脆弱性[5, 6]。此外,受人类长期高强度活动的影响,西南地区广袤的岩溶森林植被退化为次生的灌木林和灌草丛,甚至有1.296×105 km2演变为石漠化景观,且每年以1.8%的速度递增[7],严重影响该区域的乡村振兴、美丽中国和生态文明建设目标的实现。因此,岩溶植被恢复和石漠化的综合治理不仅成为国家重大需求方向,也是恢复生态学研究的热点[8, 9]。
中国政府高度重视岩溶植被恢复和石漠化的综合治理,对岩溶地区的生态保护修复实施了一系列重大生态工程[10]。在岩溶森林恢复过程中,封山育林被证明是经济、有效的途径之一[5]。目前,对岩溶森林自然恢复的研究主要集中在植物群落组成[11, 12]、群落生物量和碳储量变化[13, 14]、土壤理化性质演变[15]等方面,而对岩溶植被恢复过程中地上植物群落与土壤微生物群落的关联分析较少[16, 17]。土壤微生物是土壤元素生物地球化学循环的主要参与者,在维持生态系统功能中发挥不可替代的作用[16, 18],同时也是评价土壤生态系统恢复的重要指标。不同的植物群落往往分布着不同的土壤微生物群落[19]。由于缺乏对岩溶森林恢复过程中植物与土壤微生物多样性的综合研究,至今对岩溶森林恢复的生态过程及机制仍缺乏深入的了解,对岩溶地区森林的恢复能否促进整个生态系统修复缺乏认识,因此难以对恢复过程进行科学管理和调控。本文以岩溶森林恢复过程中的草丛(HL)、灌丛(SL)、灌乔林(SAF)、次顶极乔林(SCAF)和顶极乔林(CAF)为研究对象,探究植物多样性与土壤微生物多样性的关联性,分析森林恢复过程中,植物与土壤微生物多样性耦合变化规律及驱动因素,进一步明确岩溶地区森林的恢复能否促进整个生态系统的修复,为岩溶森林生态保护修复和科学管理提供理论依据。
1 材料与方法 1.1 研究区域概况研究区域位于广西南宁市马山县(23°24′-24°02′ N,107°41′-108°29′ E),境内岩溶地貌发育,是广西石漠化严重的地区之一。地处南亚热带季风气候区,年均气温21.3℃,最高气温38.9℃,最低气温-0.7℃;年均降水量1 667.1 mm,最高2 063 mm,最低1 245.8 mm;雨量充沛,但分布不均,夏季多暴雨,春秋少雨,易造成干旱;相对湿度76%;年平均无霜期343 d。土壤主要以碳酸盐岩发育的石灰土为主,石粒含量高,质地黏重,土层浅薄,岩基裸露度大,土壤pH呈弱碱性。植被分区属于南亚热带季雨林化常绿阔叶林地带、桂中石山青冈仪花青檀林区[20],原生顶极植被以青冈栎Cyclobalanopsis glauca、海红豆Adenanthera microsperma、青檀Pteroceltis tatarinowii、小果化香Platycarya glandulosa、仪花Lysidice rhodostegia等为优势的常绿落叶阔叶混交林[20, 21]。这类原生森林几乎荡然无存,已退化为各种次生或人工植被[11]。
1.2 样地设置与群落调查2019年5月,在对马山县岩溶区植被进行全面踏查和明确封育年限的基础上,选择封育5 a的草丛(HL)、封育15 a的灌丛(SL)、封育25 a的灌乔林(SAF)、封育35 a的次顶极乔林(SCAF)和封育55 a的顶极乔林(CAF)为研究对象[11, 12],在5个恢复阶段的典型群落中分别建立9个固定观测样方(20 m×20 m)。记录每个样方中胸径≥2 cm的个体的种名、胸径、树高、盖度;在各样方中随机设置4个5 m×5 m的中样方用于灌木层物种种类、个体数、高度和盖度的调查,在中样方中各设置1个2 m×2 m的小样方用于草本层物种种类、个体数、高度和盖度的调查。不同恢复阶段群落样地概况见表 1。
| 恢复阶段 Restoration stage | 海拔(m)
Elevation (m) |
坡向 Aspect |
坡度(°)
Slope (°) |
岩石裸露率(%)
Bare rock rate (%) |
优势种 Dominant species |
| 草丛 HL |
204 | 西北 Northwest |
35 | 83.70 | 兰香草Caryopteris incana,青蒿Artemisia caruifolia,胜红蓟Ageratum conyzoides |
| 灌丛 SL |
273 | 北 North |
40 | 60.57 | 黄荆Vitex negundo,蔓草虫豆Cajanus scarabaeoides |
| 灌乔林 SAF |
263 | 北 North |
39 | 45.40 | 青冈栎Cyclobalanopsis glauca,光叶海桐Pittosporum glabratum |
| 次顶极乔林 SCAF |
280 | 西北 Northwest |
35 | 24.17 | 青冈栎Cyclobalanopsis glauca,苦木Picrasma quassioides海红豆Adenanthera microsperma |
| 顶极乔林 CAF |
261 | 南 South |
28 | 41.03 | 青冈栎Cyclobalanopsis glauca,海红豆Adenanthera microsperma,南酸枣Choerospondias axillaris |
1.3 土壤样品采集与分析
在每个20 m×20 m的样方中随机设置9个采样点,用内径为8.5 cm的不锈钢土钻钻取0-10 cm土层的样品,将每个样方采集的9管土样混合均匀,去除根系、石砾等,过2 mm孔径筛,分成3份,分别用于土壤理化性质测定(自然风干),土壤微生物生物量碳、氮、磷含量及酶活性测定(4℃冰箱保存),土壤微生物群落物种组成的分析(冷冻干燥)。
采用环刀法测定土壤容重(Soil Bulk Density,SBD)、总孔隙度(Soil Total Porosity,STP)、毛管孔隙度(Soil Capillary Porosity,SCP)、非毛管孔隙度(Soil Non-capillary Porosity,SNCP);采用重量法测定土壤含水量(Soil Water Content,SWC);土壤pH值采用水土比(2.5∶1)电位法测定。土壤有机碳(Soil Organic Carbon,SOC)含量采用重铬酸钾外加热法测定,土壤全氮(Total Nitrogen, TN)含量采用凯氏定氮法测定,土壤全磷(Total Phosphorus,TP)含量采用酸溶-钼锑抗比色法测定,土壤全钾(Total Potassium,TK)含量采用火焰光度法测定。有效氮(Available Nitrogen,AN)含量采用氯化钾溶液浸提法测定,速效磷(Available Phosphorus,AP)含量采用0.5 mol·L-1 NaHCO3法测定,速效钾(Available Potassium,AK)含量采用乙酸铵浸提法测定。土壤交换性钙(Exchangeable Calcium,ECa)、交换性镁(Exchangeable Magnesium,EMg)含量采用乙酸铵交换-原子吸收分光光度法测定[22]。
采用氯仿熏蒸-K2SO4浸提法(Chloroform Fumigation Extraction Method,CFE)测定土壤微生物生物量碳(Microbial Biomass Carbon,MBC)、氮(Microbial Biomass Nitrogen,MBN)含量[23, 24];土壤微生物生物量磷含量(Microbial Biomass Phosphorus,MBP)采用氯仿熏蒸-NaHCO3浸提-钼锑抗显色法测定[24, 25]。采用微孔板荧光法测定与碳获取相关的β-1, 4-葡萄糖苷酶(β-1, 4-glucosidase,BG)、与氮获取相关的β-1, 4-N-乙酰葡糖氨糖苷酶(β-1, 4-N-acetylglucosaminidase,NAG)、与磷获取相关的酸性磷酸酶(Acid Phosphatase,ACP)的活性[26]。
1.4 土壤微生物群落物种组成的测定采用磷脂脂肪酸法(Phospholipid Fatty Acid, PLFA)测定土壤微生物群落的组成[27]。选取percent>1%的特征微生物进行分析,其中革兰氏阳性菌生物标记为i14∶0、a15∶0、i15∶0、i16∶0、a17∶0、i17∶0,革兰氏阴性菌为16∶1ω7c、cy17∶0、18∶1ω5c、18∶1ω7c、cy19∶0,放线菌为10Me16∶0、10Me18∶0,真菌为18∶1ω9c、18∶2ω6c,丛枝菌根真菌为16∶1ω5c[28, 29]。
1.5 数据统计分析植物群落物种多样性指数和土壤微生物群落PLFA多样性指数的计算公式为
| $ \begin{array}{l} {\rm{物种丰富度指数}}\left( R \right)R = S, \\ {\rm{Shannon-Wiener指数}}\left( {H'} \right)H' = - \sum\limits_{i = 1}^s {{P_i}\ln {P_i}} , \\ {\rm{Simpson指数}}\left( D \right)D = 1 - \sum\limits_{i = 1}^s {P_i^2} , \\ {\rm{Pielou均匀度指数}}\left( J \right)J = H'/\ln S, \end{array} $ |
式中,在植物群落中,S为样方出现的植物物种数;在土壤微生物群落中,S为样方中检测到的PLFA标记种数。Pi=ni/N,表示样方中第i个种(PLFA标记)的个体数ni占所有个体总数N的比例。
采用单因素方差分析(One-way ANOVA)检验不同恢复阶段土壤理化性质、土壤微生物生物量碳氮磷、群落物种多样性、土壤微生物群落PLFA多样性指数的差异显著性,采用最小显著性差异法(Least Significant Difference,LSD)进行多重比较(P < 0.05)。以上分析采用SPSS 19.0 (SPSS,Inc,Chicago,IL)分析,数据绘图由Sigmaplot 11.0软件完成。
在R3.5.2中采用一元线性回归分析群落物种多样性指数与土壤微生物群落物种多样性指数间的关系。在R3.5.2中采用piecewiseSEM程序包[30]构建植物群落物种组成、多样性、土壤理化性质、土壤微生物生物量、土壤微生物群落组成及多样性的结构方程模型。其中植物群落物种组成以群落整体的物种组成主成分分析第一轴(PC1)的数据表征,植物多样性用群落物种丰富度指数、Shannon-Wiener指数主成分分析第一轴(PC1)的数据表征,土壤物理性质用包含SWC、SBD、SCP、SNCP、STP主成分分析第一轴(PC1)的数据表征,土壤化学性质用包含pH、SOC、TN、TP、C∶N、C∶P、N∶P、TK、AN、AP、AK、ECa、EMg主成分分析第一轴(PC1)的数据表征,主成分分析采用vegan程序包进行。土壤微生物生物量及酶活性则构建相应的指数,首先计算每个变量的Z分数,每个样方土壤微生物生物量(或酶活性) 3个变量的Z得分平均值即为该样方的微生物生物量(或酶活性)指数。Z分数计算公式为
| $ {Z_{ij}} = {\rm{ }}({x_{ij}} - {\mu _j})/{\sigma _j}, $ |
式中,Zij为样方i第j种土壤微生物生物量(或酶活性)的Z分数,xij为样方i第j种微生物生物量(或酶活性)的实际测量值,μj为第j种土壤微生物生物量(或酶活性)在所有调查样方中的平均值,σj为第j种土壤微生物生物量(或酶活性)在所有调查样方中的标准差。
2 结果与分析 2.1 土壤性质不同恢复阶段的土壤性质存在显著差异(表 2)。土壤物理性质中,土壤含水量(SWC)随进展演替先增加,在SAF达到峰值(32.57±5.25)%后有所降低;土壤容重(SBD)在SAF达到谷值(0.71±0.15)g·cm-3,在演替后期则显著上升(P < 0.05);土壤毛管孔隙度(SCP)和总孔隙度(STP)的变化规律一致,随着演替的进行,在SL阶段达到峰值后缓慢降低;土壤非毛管孔隙度(SNCP)随进展演替升高,在SCAF达到峰值(26.10±4.21)%后,在CAF阶段显著降低(P < 0.05)。
| 变量 Variable |
恢复阶段Restoration stage | ||||
| HL | SL | SAF | SCAF | CAF | |
| SWC (%) | 28.15±3.94a | 32.16±1.74ab | 32.57±5.25b | 32.47±2.02b | 30.91±5.15ab |
| SBD (g·cm-3) | 1.05±0.11c | 0.89±0.08b | 0.71±0.15a | 0.87±0.07b | 0.93±0.09b |
| SCP (%) | 53.49±6.32ab | 57.64±6.59b | 48.74±6.06a | 47.29±7.10a | 47.55±5.82a |
| SNCP (%) | 15.77±2.04a | 20.99±5.20b | 22.99±4.77bc | 26.10±4.21c | 19.73±4.90b |
| STP (%) | 69.26±6.39a | 78.62±4.05b | 71.73±8.28ab | 73.39±8.93ab | 67.28±6.54a |
| pH | 7.51±0.29d | 7.35±0.31cd | 6.80±0.34b | 7.08±0.32bc | 6.45±0.27a |
| SOC (g·kg-1) | 28.73±4.29a | 39.82±9.00b | 47.95±5.30c | 49.88±6.53c | 49.11±4.33c |
| TN (g·kg-1) | 3.66±0.55a | 3.79±0.41a | 5.13±0.56b | 5.60±0.82b | 5.63±0.44b |
| TP (g·kg-1) | 1.10±0.16a | 1.25±0.11b | 1.32±0.09b | 1.36±0.09b | 1.38±0.12b |
| TK (g·kg-1) | 12.73±1.74a | 12.61±2.22a | 14.21±0.16b | 15.62±0.88c | 16.73±1.26c |
| AN (mg·kg-1) | 18.44±7.29a | 21.90±7.27a | 30.59±11.81b | 39.08±7.11b | 37.09±2.09b |
| AP (mg·kg-1) | 9.72±1.82a | 11.28±1.37ab | 11.50±1.39ab | 11.58±2.63ab | 12.06±3.28b |
| AK (mg·kg-1) | 82.55±4.56a | 86.15±3.15a | 90.47±5.68b | 91.61±3.02b | 93.69±3.44b |
| ECa (cmol·kg-1) | 17.63±2.69a | 16.89±3.43a | 22.69±3.57b | 20.70±1.90ab | 23.02±5.17b |
| EMg (cmol·kg-1) | 0.90±0.06a | 1.36±0.24b | 1.53±0.26b | 1.84±0.12c | 1.38±0.33b |
| C∶N | 7.88±0.71a | 10.49±1.88b | 9.42±1.16ab | 9.00±1.29a | 8.76±0.82a |
| C∶P | 26.48±4.06a | 31.81±6.26b | 36.48±3.61b | 36.54±3.92b | 35.89±4.06b |
| N∶P | 3.36±0.38b | 3.03±0.15a | 3.89±0.29c | 4.09±0.41c | 4.09±0.18c |
| MBC (mg·kg-1) | 425.53±51.05a | 602.96±68.52b | 749.07±79.23c | 1 015.36±46.69e | 901.95±75.29d |
| MBN (mg·kg-1) | 61.26±16.96a | 116.75±31.37b | 200.46±32.16c | 310.45±11.90e | 242.55±26.60d |
| MBP (mg·kg-1) | 18.81±1.64a | 22.28±1.82a | 26.30±1.74b | 26.79±1.69b | 28.23±1.80b |
| BG (nmol·g-1·h-1) | 36.93±6.07a | 47.61±8.71b | 54.98±11.74bc | 63.74±7.44c | 60.50±9.12c |
| NAG (nmol·g-1·h-1) | 16.13±4.02a | 19.59±4.44a | 26.07±8.17b | 30.58±8.15b | 30.22±6.32b |
| ACP (μmol·g-1·h-1) | 144.19±13.95a | 148.93±14.99a | 154.14±15.43ab | 157.95±16.57ab | 164.50±15.66b |
| 注:同行不同小写字母表示不同恢复阶段差异显著(P < 0.05)
Note: Different lowercase letters in the same row indicate significant differences at different recovery stages (P < 0.05) | |||||
随着进展演替的进行,SOC、TN、TP、TK、AN、AP、AK、ECa、C∶P、N∶P、MBP、BG、NAG、ACP含量随之增加。EMg含量则表现为随进展演替而增加,在SCAF达到峰值(1.84±0.12) cmol·kg-1后显著降低(P < 0.05)。土壤pH值比较特殊,基本上是持续递减,最低值出现在CAF阶段,其值为(6.45±0.27)。不同恢复阶段MBC、MBN含量变化规律相似,以HL阶段最低,随着进展演替而显著增加,至SCAF达到峰值,进入CAF阶段又显著下降(P < 0.05),但仍显著高于HL、SL和SAF (P < 0.05)。
2.2 不同恢复阶段植物群落的物种多样性随着进展演替的进行,群落的物种多样性也发生显著变化(图 1),群落的物种丰富度显著增加,至SCAF达到峰值后,在CAF阶段又有所下降;而群落的Shannon-Wiener指数、Simpson指数和Pielou均匀度指数的变化规律相似,呈先降低后增加再降低的趋势,均在SL阶段达到谷值,在SCAF阶段达到峰值。方差分析表明,HL的物种丰富度显著低于其他4个阶段(P < 0.05),SCAF显著高于其他4个阶段(P < 0.05),而其余3个阶段间差异不显著(P>0.05);前期3个阶段的Shannon-Wiener指数差异不显著(P>0.05),均显著低于演替后期的2个阶段(P < 0.05);SCAF阶段的Simpson指数显著高于SL和SAF (P < 0.05),而与其余2个阶段间差异不显著(P>0.05);HL、SCAF及CAF三者间均匀度指数差异不显著(P>0.05),均显著高于SL和SAF (P < 0.05),而SAF显著高于SL(P < 0.05)。
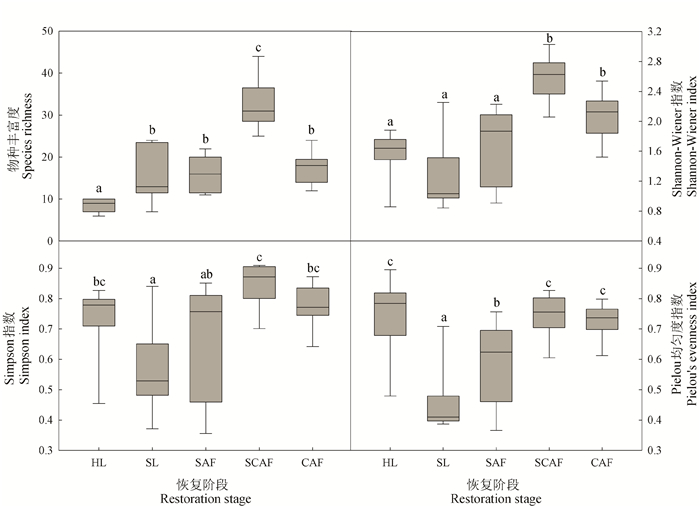
|
| 不同小写字母表示不同恢复阶段间差异显著(P < 0.05) Different lowercase letters indicate significant differences at different recovery stages (P < 0.05) 图 1 不同恢复阶段植物群落的多样性特征 Fig. 1 Plant diversity in communities at different restoration stages |
2.3 不同恢复阶段土壤微生物群落多样性
不同恢复阶段土壤微生物群落PLFA多样性指数存在显著差异(图 2)。PLFA丰富度为22.33-23.67,CAF阶段的PLFA丰富度显著高于其他4个阶段(P < 0.05),而其他4个阶段间差异不显著(P>0.05)。Shannon-Wiener指数和Simpson指数均随进展演替呈先平缓降低后快速升高的趋势,演替后期2个阶段的Shannon-Wiener指数和Simpson指数无显著差异(P>0.05),并显著高于SAF (P < 0.05),而SAF又显著高于演替早期的2个阶段(P < 0.05)。Pielou均匀度指数也随进展演替而升高,演替后期2个阶段的Pielou均匀度指数无显著差异(P>0.05),且显著高于前3个阶段(P < 0.05),而前3个阶段间差异不显著(P>0.05)。
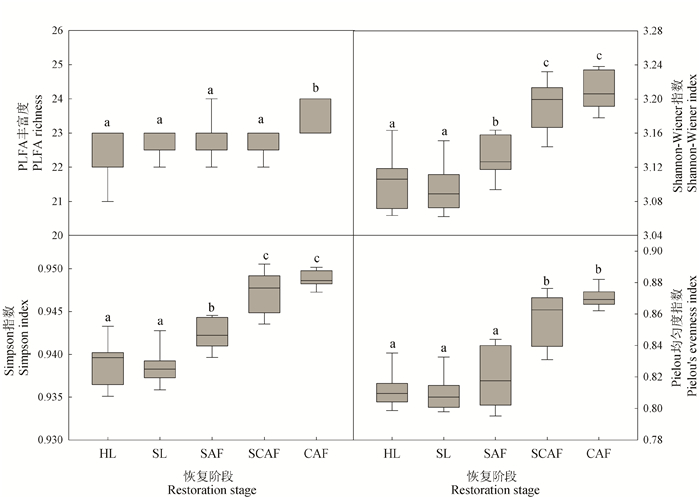
|
| 不同小写字母表示不同恢复阶段间差异显著(P < 0.05) Different lowercase letters indicate significant differences at different recovery stages (P < 0.05) 图 2 不同恢复阶段土壤微生物群落多样性指数 Fig. 2 Diversity indices of soil microbial communities at different restoration stages |
2.4 不同恢复阶段植物和土壤微生物群落多样性的关联
由图 3可知,除物种丰富度指数外,不同恢复阶段植物群落与土壤微生物群落同一多样性指数两两间均呈显著的线性相关关系,均表现为土壤微生物群落物种多样性指数随植物群落多样性指数的增加而增加。这表明随着进展演替的进行,植物、土壤微生物群落的Shannon-Wiener指数、Simpson指数、Pielou均匀度指数具有正协同关系。
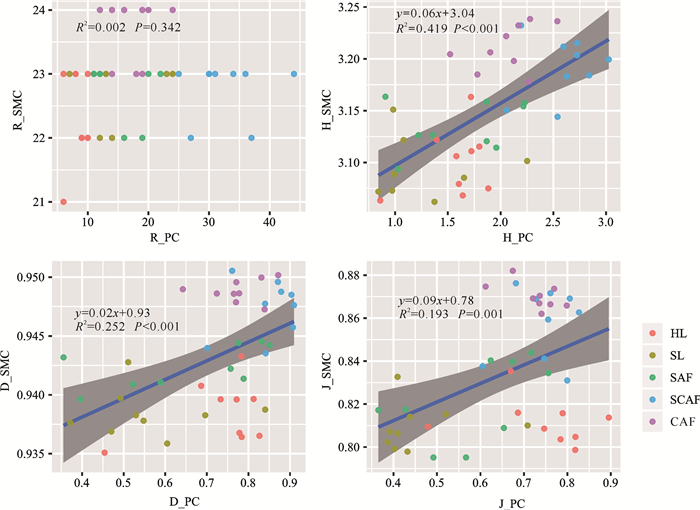
|
| R_PC:植物群落物种丰富度指数;H_PC:植物群落Shannon-Wiener指数;D_PC:植物群落Simpson指数;J_PC:植物群落Pielou均匀度指数;R_SMC:土壤微生物群落PLFA丰富度指数;H_SMC:土壤微生物群落Shannon-Wiener指数;D_SMC:土壤微生物群落Simpson指数;J_SMC:土壤微生物群落Pielou均匀度指数 R_PC: Richness of plant community; H_PC: Shannon-Wiener index of plant community; D_PC: Simpson index of plant community; J_PC: Pielou′s envenness index of plant community; R_SMC: PLFA richness of soil microbial community; H_SMC: Shannon-Wiener index of soil microbial community; D_SMC: Simpson index of soil microbial community; J_SMC: Pielou′s envenness index of soil microbial community 图 3 不同恢复阶段植物群落物种多样性与土壤微生物群落物种多样性的关联 Fig. 3 Correlation between plant community and soil microbial community diversity at different restoration stages |
2.5 生物和非生物因子对土壤微生物群落多样性的调控路径
结构方程模型结果表明,土壤微生物群落多样性90%的变异可由进展演替过程中植物群落物种组成和多样性、土壤微生物生物量、土壤酶活性、土壤微生物组成、土壤理化性质的影响来解释(图 4)。模型适配度良好,拟合结果为Fisher′s C=5.476,P=0.484。由图 4可知,进展演替并不直接显著影响土壤微生物组成(β=0.08, P=0.705)和多样性(β=0.10, P=0.423),而是通过影响植物群落物种组成(β=0.48, P < 0.001),进而影响土壤微生物群落物种组成(β=0.42, P=0.004),最终影响土壤微生物多样性(β=0.28, P=0.007)。进展演替虽然能直接显著影响植物群落物种组成(β= 0.48, P < 0.001)、多样性(β=0.36, P=0.014)、土壤物理性质(β=0.32, P=0.031)、土壤化学性质(β=0.82, P < 0.001)及酶活性(β=0.58, P=0.004),但这些因子对土壤微生物群落多样性的影响不显著。此外,结构方程模型还揭示了植物群落物种组成与多样性间的显著正相关关系(β=0.53, P < 0.001),植物群落多样性和土壤物理性质间的负相关关系(β=-0.31, P < 0.020)。
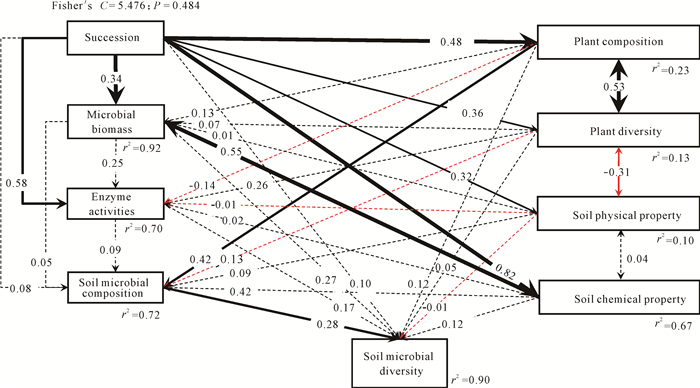
|
| 图 4 植被演替过程中生物和非生物因子对植物以及土壤微生物群落多样性影响的结构方程模型 Fig. 4 Structural equation modeling (SEM) of the effects of biotic and abiotic factors on the diversity of plant and soil microbial communities during vegetation succession |
3 讨论 3.1 岩溶地区森林恢复对群落物种多样性的影响
物种多样性是反映群落组织水平、森林结构、动态演替等方面的重要指标,在森林恢复过程中发挥着举足轻重的作用。长期以来,人们普遍认为随着岩溶植被的进展演替,群落的物种多样性呈递增趋势,且以演替的后期阶段最高[31-35]。本研究结果与上述结果基本一致,但群落物种多样性的峰值并不是出现在演替的后期阶段(本研究为顶极乔林阶段),而是出现在森林恢复后的次顶极乔林阶段。这是因为在群落演替初期,森林环境尚未形成,立地光照强烈,特别是岩溶地区生境恶劣,只有阳性、耐旱的物种才能生存,因此此时群落的多样性较低;随着进展演替和森林恢复,森林环境逐渐形成,生境条件不断得到改善,到次顶极乔林阶段,阳性、中性和耐阴性物种混生在一起,物种多样性达到最大;当进入顶极乔林阶段,群落环境的异质性降低,同质性增加,不适应森林环境的阳性物种逐渐消失于林下,使顶极乔林的群落物种多样性下降,这一结果与中性理论一致[36-38]。
3.2 岩溶地区森林恢复对土壤微生物群落物种多样性的影响土壤微生物生物量碳、氮、磷的高低是衡量土壤生物肥力的重要指标,成为研究和评价植被进展演替过程中土壤微生物调控功能的重要参数[39-41],并受地上植被类型的强烈影响[42]。有研究表明,峡谷型喀斯特土壤MBC含量明显低于北亚热带高原型喀斯特和中亚热带峰丛洼地型喀斯特[43, 44],土壤MBN含量明显低于高原型喀斯特,与峰丛洼地型喀斯特相近[43],而土壤MBP含量高于高原型喀斯特,介于峰丛洼地型喀斯特之间。在本研究中,不同恢复阶段土壤MBC、MBN、MBP含量分别为425.53-1 015.36 mg·kg-1,61.26-310.45 mg·kg-1,18.81-28.23 mg·kg-1,其中土壤MBC和MBN明显高于高原型喀斯特和中亚热带峰丛洼地型喀斯特,而土壤MBP含量相近。这是因为南亚热带喀斯特峰丛洼地气温较高,降水量较丰富,特别是森林的恢复有利于土壤微生物活性增强和维持较高的微生物生物量[45]。叶莹莹等[46]研究表明,喀斯特峰丛洼地土壤MBC、MBN含量整体表现为随植被的进展演替而增加,这与本研究结果一致。
杨泽良等[47]研究发现,桂西北喀斯特不同植被演替阶段土壤微生物群落碳源利用PLFA丰富度指数、物种丰富度指数、Pielou均匀度指数均表现为原生林>次生林>灌丛>草地。在本研究中,不同恢复阶段土壤微生物群落PLFA多样性指数存在显著差异,随着森林的形成,PLFA丰富度指数、Shannon-Wiener指数、Simpson指数和Pielou均匀度指数均明显增加,森林恢复阶段各指数显著高于森林尚未恢复阶段,且森林恢复之前的各阶段间和森林恢复后的各阶段间差异不显著(P>0.05),这与杨泽良等[47]的研究结果一致。
本研究还发现,进展演替过程中土壤微生物生物量、酶活性、土壤养分、植物群落组成和多样性的共同影响可解释土壤微生物群落多样性90%的变异。进展演替通过影响植物群落物种组成,进而影响土壤微生物群落物种组成,最终影响土壤微生物多样性。这表明随着植被的进展演替,群落的植物组成发生显著变化,植物的多样性增加,作为土壤微生物碳源基质的植物凋落物、根系分泌物和土壤有机质的质量和数量也同步发生改变和相应增加,使土壤微生物群落的结构发生显著变化,土壤微生物物种多样性增加。吴求生等[48]研究也表明,不同小生境类型和土壤有机质对土壤微生物群落多样性和分布具有显著影响。
3.3 岩溶地区森林恢复对植物和土壤微生物群落多样性关联的影响植物与土壤微生物关系密切,两者形成了植物-微生物共生体系统。Zak等[49]研究发现,植物群落物种数量与土壤微生物群落PLFA含量相关,随着植物物种丰富度增加,土壤中细菌与放线菌的PLFA含量下降,而真菌的PLFA含量上升。植物物种结构多样性、丰富度与土壤细菌群落的功能代谢多样性和代谢活性成正比[50]。在喀斯特山区的研究也发现,沿草丛、灌丛、次生林、原生林的顺向演替,植物多样性指标与土壤微生物生物量碳、真菌和细菌关系密切[51]。谭秋锦等[52]从植被因子与微生物因子的相关分析发现,植被与微生物性状间的相互关系达到极显著水平,植被因子中的植物磷与细菌呈正相关,而Simpson指数与细菌呈负相关;植物Shannon-Wiener指数与微生物多样性指数呈正相关关系,而与微生物丰富度呈负相关关系。本研究中,随着进展演替和森林的形成,植物群落与土壤微生物群落的Shannon-Wiener指数、Simpson指数、Pielou均匀度指数均具有正协同关系。这与本研究中,随着森林恢复,植物多样性增加,群落内物种生态位分化越来越合理,群落稳定性增强[53],土壤理化性质明显改善,SOC、TN、TP、TK、AN、AP、AK以及土壤MBC、MBN、MBP含量显著增加的结果吻合。可见,植物与土壤微生物在生态系统中共同调控着土壤养分的有效性与分配[54, 55],植物与土壤微生物的共同作用对维持整个生态系统的稳定性具有重要意义[56, 57]。
4 结论岩溶地区森林恢复过程中植物群落多样性、土壤理化性质和土壤微生物群落多样性具有高度正协同关系(土壤pH除外)。随着森林恢复,植物群落的物种丰富度显著增加,SOC、TN、TP、TK、AN、AP、AK、ECa、EMg含量以及土壤MBC、MBN和MBP含量显著增加。相关分析表明,不同恢复阶段植物群落与土壤微生物群落Shannon-Wiener指数、Simpson指数、Pielou均匀度指数间均呈显著的线性相关关系。结构方程模型揭示,土壤养分、土壤微生物生物量、酶活性、植物群落组成和多样性可共同解释土壤微生物群落多样性90%的变异。岩溶地区森林的恢复能够促进整个生态系统的恢复,因此在石漠化生态系统修复中加快森林的恢复至关重要。
| [1] |
袁道先. 我国西南岩溶地区的石漠化问题[C]//中国国际科学技术合作协会. 中国—欧盟荒漠化综合治理研讨会论文集. 北京: 中国国际科学技术合作协会, 2003: 150-160.
|
| [2] |
靳芳, 鲁绍伟, 余新晓, 等. 中国森林生态系统服务功能及其价值评价[J]. 应用生态学报, 2005, 16(8): 1531-1536. DOI:10.3321/j.issn:1001-9332.2005.08.029 |
| [3] |
王克林, 岳跃民, 陈洪松, 等. 科技扶贫与生态系统服务提升融合的机制与实现途径[J]. 中国科学院院刊, 2020, 35(10): 1264-1272. |
| [4] |
蒋忠诚, 罗为群, 邓艳, 等. 岩溶峰丛洼地水土漏失及防治研究[J]. 地球学报, 2014, 35(5): 535-542. |
| [5] |
温远光, 陈放, 吴庆标, 等. 中国石漠化的综合治理技术与效果[C]//中国国际科学技术合作协会. 中国—欧盟荒漠化综合治理研讨会论文集. 北京: 中国国际科学技术合作协会, 2003: 202-209.
|
| [6] |
侯文娟, 高江波, 彭韬, 等. 结构-功能-生境框架下的西南喀斯特生态系统脆弱性研究进展[J]. 地理科学进展, 2016, 35(3): 320-330. |
| [7] |
国家林业和草原局. 中国岩溶地区石漠化状况公报[EB/OL]. (2018-12-14)[2021-05-05]. http://www.forestry.gov.cn/main/195/20181214/104340783851386.html.
|
| [8] |
韩会庆, 苏志华. 喀斯特生态系统服务研究进展与展望[J]. 中国岩溶, 2017, 36(3): 352-358. |
| [9] |
何霄嘉, 王磊, 柯兵, 等. 中国喀斯特生态保护与修复研究进展[J]. 生态学报, 2019, 39(18): 6577-6585. |
| [10] |
王克林, 岳跃民, 陈洪松, 等. 喀斯特石漠化综合治理及其区域恢复效应[J]. 生态学报, 2019, 39(20): 7432-7440. |
| [11] |
温远光, 雷丽群, 朱宏光, 等. 广西马山岩溶植被年龄序列的群落特征[J]. 生态学报, 2013, 33(18): 5723-5730. |
| [12] |
陆志成, 温远光, 周晓果, 等. 封育年限对岩溶植被组成和土壤肥力修复的影响[J]. 广西植物, 2019, 39(8): 1016-1028. |
| [13] |
谭秋锦. 峡谷型喀斯特不同生态系统植被与土壤的耦合关系[D]. 南宁: 广西大学, 2014.
|
| [14] |
黄宗胜, 喻理飞, 符裕红, 等. 茂兰退化喀斯特森林植被自然恢复中生态系统碳吸存特征[J]. 植物生态学报, 2015, 39(6): 554-564. |
| [15] |
吴平, 薛建辉. 典型喀斯特地区3种人工林对土壤理化和微生物特性的影响[J]. 南京林业大学学报(自然科学版), 2015, 39(5): 67-72. |
| [16] |
HU P L, XIAO J, ZHANG W, et al. Response of soil microbial communities to natural and managed vegetation restoration in a subtropical karst region[J]. Catena, 2020, 195: 104849. DOI:10.1016/j.catena.2020.104849 |
| [17] |
张彧娜, 周晓果, 温远光, 等. 喀斯特地区三种人工林土壤微生物群落结构特征[J/OL]. 广西植物, 2021, 1-17[2021-07-01]. http://kns.cnki.net/kcms/detail/45.1134.Q.20210511.0907.002.html.
|
| [18] |
PRESCOTT C E, GRAYSTON S J. Tree species influence on microbial communities in litter and soil: Current knowledge and research needs[J]. Forest Ecology and Management, 2013, 309: 19-27. DOI:10.1016/j.foreco.2013.02.034 |
| [19] |
TEMPLER P H, FINDLAY S, LOVETT G. Soil microbial biomass and nitrogen transformations among five tree species of the Catskill Mountains, New York, USA[J]. Soil Biology and Biochemistry, 2003, 35(4): 607-613. DOI:10.1016/S0038-0717(03)00006-3 |
| [20] |
《广西森林》编辑委员会. 广西森林[M]. 北京: 中国林业出版社, 2001.
|
| [21] |
王献溥, 郭柯, 温远光. 广西植被志要[M]. 北京: 高等教育出版社, 2014.
|
| [22] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
|
| [23] |
VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
| [24] |
林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010.
|
| [25] |
吴金水, 肖和艾, 陈桂秋, 等. 旱地土壤微生物磷测定方法研究[J]. 土壤学报, 2003, 40(1): 70-78. DOI:10.3321/j.issn:0564-3929.2003.01.010 |
| [26] |
SAIYA-CORK K R, SINSABAUGH R L, ZAK D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315. DOI:10.1016/S0038-0717(02)00074-3 |
| [27] |
FROSTEGÅRD Å, TUNLID A, BÅÅTH E. Microbial biomass measured as total lipid phosphate in soils of different organic content[J]. Journal of Microbiological Methods, 1991, 14(3): 151-163. DOI:10.1016/0167-7012(91)90018-L |
| [28] |
BAI Y H, ZHA X, CHEN S F. Effects of the vegetation restoration years on soil microbial community composition and biomass in degraded lands in Changting County, China[J]. Journal of Forestry Research, 2020, 31(4): 1295-1308. DOI:10.1007/s11676-019-00879-z |
| [29] |
YAN Y J, DAI Q H, HU G, et al. Effects of vegetation type on the microbial characteristics of the fissure soil-plant systems in karst rocky desertification regions of SW China[J]. Science of the Total Environment, 2020, 712: 136543. DOI:10.1016/j.scitotenv.2020.136543 |
| [30] |
LEFCHECK J S. Piecewise SEM: Piecewise structural equation modelling in R for ecology, evolution, and systematics[J]. Methods in Ecology and Evolution, 2016, 7(5): 573-579. DOI:10.1111/2041-210X.12512 |
| [31] |
曾馥平, 彭晚霞, 宋同清, 等. 桂西北喀斯特人为干扰区植被自然恢复22年后群落特征[J]. 生态学报, 2007, 27(12): 5110-5119. DOI:10.3321/j.issn:1000-0933.2007.12.020 |
| [32] |
宋同清, 彭晚霞, 曾馥平, 等. 桂西北喀斯特人为干扰区植被的演替规律与更新策略[J]. 山地学报, 2008, 26(5): 597-604. DOI:10.3969/j.issn.1008-2786.2008.05.014 |
| [33] |
穆彪, 杨立美, 张莉. 喀斯特植被恢复过程的群落演替特征[J]. 西南大学学报(自然科学版), 2008, 30(6): 91-95. |
| [34] |
刘玉国, 刘长成, 魏雅芬, 等. 贵州省普定县不同植被演替阶段的物种组成与群落结构特征[J]. 植物生态学报, 2011, 35(10): 1009-1018. |
| [35] |
温培才, 王霖娇, 盛茂银. 西南喀斯特高原峡谷石漠化生态系统植物群落特征及其与土壤理化性质的关系[J]. 四川农业大学学报, 2018, 36(2): 175-184. |
| [36] |
KALACSKA M, SANCHEZ-AZOFEIFA G A, CALVO-ALVARADO J C, et al. Species composition, similarity and diversity in three successional stages of a seasonally dry tropical forest[J]. Forest Ecology and Management, 2004, 200(1/3): 227-247. |
| [37] |
HUBBELL S P. Neutral theory in community ecology and the hypothesis of functional equivalence[J]. Functional Ecology, 2005, 19(1): 166-172. DOI:10.1111/j.0269-8463.2005.00965.x |
| [38] |
LIEBSCH D, GOLDENBERG R, MARQUES M C M. Florística e estrutura de comunidades vegetais em uma cronoseqüência de Floresta Atlântica no Estado do Paraná, Brasil[J]. Acta Botanica Brasilica, 2007, 21(4): 983-992. DOI:10.1590/S0102-33062007000400023 |
| [39] |
ARUNACHALAM A, PANDEY H N. Ecosystem restoration of jhum fallows in Northeast India: Microbial C and N along altitudinal and successional gradients[J]. Restoration Ecology, 2003, 11(2): 168-173. DOI:10.1046/j.1526-100X.2003.00013.x |
| [40] |
HARRIS J A. Measurements of the soil microbial community for estimating the success of restoration[J]. European Journal of Soil Science, 2003, 54(4): 801-808. DOI:10.1046/j.1351-0754.2003.0559.x |
| [41] |
徐惠风, 刘兴土, 白军红. 长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究[J]. 水土保持学报, 2004, 18(3): 115-117, 122. DOI:10.3321/j.issn:1009-2242.2004.03.029 |
| [42] |
朱志建, 姜培坤, 徐秋芳. 不同森林植被下土壤微生物量碳和易氧化态碳的比较[J]. 林业科学研究, 2006, 19(4): 523-526. DOI:10.3321/j.issn:1001-1498.2006.04.022 |
| [43] |
鹿士杨, 彭晚霞, 宋同清, 等. 喀斯特峰丛洼地不同退耕还林还草模式的土壤微生物特性[J]. 生态学报, 2012, 32(8): 2390-2399. |
| [44] |
张利青, 彭晚霞, 宋同清, 等. 云贵高原喀斯特坡耕地土壤微生物量C、N、P空间分布[J]. 生态学报, 2012, 32(7): 2056-2065. |
| [45] |
DEVI N B, YADAVA P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, North-east India[J]. Applied Soil Ecology, 2006, 31(3): 220-227. DOI:10.1016/j.apsoil.2005.05.005 |
| [46] |
叶莹莹, 刘淑娟, 张伟, 等. 喀斯特峰丛洼地植被演替对土壤微生物生物量碳、氮及酶活性的影响[J]. 生态学报, 2015, 35(21): 6974-6982. |
| [47] |
杨泽良, 任建行, 况园园, 等. 桂西北喀斯特不同植被演替阶段土壤微生物群落多样性[J]. 水土保持研究, 2019, 26(3): 185-192. |
| [48] |
吴求生, 龙健, 李娟, 等. 茂兰喀斯特森林小生境类型对土壤微生物群落组成的影响[J]. 生态学报, 2019, 39(3): 1009-1018. |
| [49] |
ZAK D R, HOLMES W E, WHITE D C, et al. Plant diversity, soil microbial communities, and ecosystem function: Are there any links?[J]. Ecology, 2003, 84(8): 2042-2050. DOI:10.1890/02-0433 |
| [50] |
肖辉林, 郑习健. 植物多样性对土壤微生物的影响[J]. 生态环境学报, 2001, 10(3): 238-241. DOI:10.3969/j.issn.1674-5906.2001.03.019 |
| [51] |
杜虎, 彭晚霞, 宋同清, 等. 桂北喀斯特峰丛洼地植物群落特征及其与土壤的耦合关系[J]. 植物生态学报, 2013, 37(3): 197-208. |
| [52] |
谭秋锦, 宋同清, 彭晚霞, 等. 峡谷型喀斯特不同生态系统的土壤微生物数量及生物量特征[J]. 生态学报, 2014, 34(12): 3302-3310. |
| [53] |
李婷婷, 容丽, 王梦洁, 等. 黔中喀斯特次生林主要物种的生态位及种间联结性动态变化[J]. 热带亚热带植物学报, 2021, 29(1): 9-19. |
| [54] |
RICHARDSON A E, BAREA J M, MCNEILL A M, et al. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J]. Plant and Soil, 2009, 321(1/2): 305-339. |
| [55] |
SPOHN M, KUZYAKOV Y. Distribution of microbial and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation-Coupling soil zymography with 14C imaging[J]. Soil Biology and Biochemistry, 2013, 67: 106-113. DOI:10.1016/j.soilbio.2013.08.015 |
| [56] |
MARIOTTE P, MEHRABI Z, BEZEMER T M, et al. Plant-soil feedback: Bridging natural and agricultural sciences[J]. Trends in Ecology & Evolution, 2018, 33(2): 129-142. |
| [57] |
JIA P, LIANG J L, YANG S X, et al. Plant diversity enhances the reclamation of degraded lands by stimulating plant-soil feedbacks[J]. Journal of Applied Ecology, 2020, 57(7): 1258-1270. DOI:10.1111/1365-2664.13625 |



