2. 广西壮族自治区中国科学院广西植物研究所,广西植物功能物质研究与利用重点实验室,广西桂林 541006
2. Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
罗汉果Siraitia grosvenorii为葫芦科多年生藤本植物的果实,是桂林名贵土特产,也是国家卫生部公布的首批药食同源中药材。罗汉果的民间药用历史已达300多年,具有清热润肺、利咽开音、滑肠通便等功效。现代药理研究发现罗汉果还具有抗肿瘤、抗哮喘、抗氧化、保肝、降糖、调节免疫等活性,罗汉果皂苷是主要的活性成分。罗汉果皂苷是以罗汉果苷Ⅴ为主要成分的罗汉果提取物,是一种高甜度混合物。自1975年美国学者Lee[1]首次报道罗汉果中的高甜味成分以来,学者们已经从中发现了40多个皂苷成分,包括罗汉果苷Ⅰ (Mogroside Ⅰ)、罗汉果苷ⅡE (Mogroside ⅡE)、罗汉果苷Ⅲ(Mogroside Ⅲ)、罗汉果苷ⅢE (Mogroside ⅢE)、罗汉果苷Ⅳ(Mogroside Ⅳ)、罗汉果苷Ⅴ(Mogroside Ⅴ)、11-氧化-罗汉果苷Ⅴ(11-oxomogroside Ⅴ)、罗汉果新苷(Neomogroside)和赛门苷Ⅰ (Siamenoside Ⅰ)等。其中罗汉果苷Ⅴ是成熟罗汉果中含量最高的成分,其甜度是蔗糖甜度的300倍左右[2, 3]。
罗汉果皂苷具有甜度高、热量低、安全等特点[4, 5],被广泛用作食品和饮料的甜味剂[6],《食品安全国家标准食品添加剂使用标准》(GB 2760-2014)规定其可不限量添加到各类食品中,是唯一可添加进婴幼儿食品的甜味剂,成为甜味剂市场的新宠。目前,桂林吉福思罗汉果有限公司和桂林莱茵生物科技股份有限公司是罗汉果皂苷生产的龙头企业,两家公司的产品通过了美国FDA的GRAS认证,成功进入美国市场,已获得20多个国家的市场准入。在全球减糖大趋势下,《健康中国行动(2019-2030年)》提倡,到2030年我国人均每日添加糖摄入量不高于25 g[6],罗汉果皂苷具有巨大的市场潜力。
如今罗汉果皂苷已应用于乳品饮料、固体饮料、调味料、糖果等食品行业中,如果罗汉果皂苷仅作为单一的甜味剂使用,就极大辜负了罗汉果“东方神果”的美誉。因此,本文对罗汉果皂苷的结构特点、形成规律、结构与甜度的关系、功效、体内代谢和产物分布特征以及大健康产品开发利用现状进行综述,重点介绍最近从罗汉果中发现的新皂苷成分,以及过去5年开发的罗汉果大健康产品,并对罗汉果进一步研究的领域和前景提出建议。
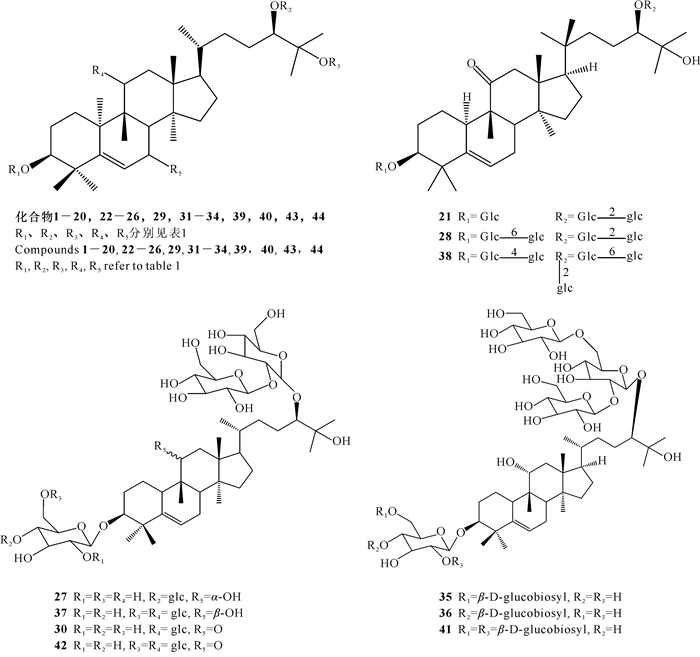
1 罗汉果皂苷成分 1.1 化合物的结构本文在Li等[7]2014年报道的罗汉果中葫芦烷型四环三萜的化学成分基础上,补充了近5年新的化合物20,21,27 - 30,35 - 38和41 - 44。罗汉果皂苷为葫芦烷三萜皂苷,根据苷元上连接葡萄糖单位数量不同,可分为一糖苷—六糖苷,目前已确定结构的一糖苷有6种,二糖苷7种,三糖苷8种,四糖苷9种,五糖苷8种,六糖苷6种(表 1,图 1)。其中11-oxomogroside ⅢE和11-oxomogroside Ⅳ(21,28),11-oxomogroside Ⅴ(38),7-oxomogroside ⅢE和7-oxomogroside Ⅳ(20,29)以及罗汉果苷ⅥA (Mogroside ⅥA)和罗汉果苷ⅥB (Mogrosides ⅥB)(43,44)为Niu等[8]从罗汉果的粗提取物中分离出来7种新型罗汉果皂苷。Lu等[9]总结了7种新型葫芦素苷(化合物27,30,35 - 37,41,42)。另外,Zhou等[10]利用LC-MS初步鉴定出罗汉果苷Ⅰ、罗汉果苷ⅠE1(Mogroside ⅠE1)、罗汉果苷ⅠA1(Mogroside ⅠA1)和罗汉果苷Ⅱ异构体,二羟基罗汉果苷Ⅱ、二羟基罗汉果苷Ⅲ、二羟基罗汉果苷Ⅳ和二羟基罗汉果苷Ⅴ,羟基罗汉果苷Ⅱ、羟基罗汉果苷Ⅲ、羟基罗汉果苷Ⅳ和羟基罗汉果苷Ⅴ,羟基罗汉果苷Ⅲ异构体,二脱水罗汉果苷Ⅱ和二脱水罗汉果苷Ⅲ,脱水罗汉果苷Ⅱ和脱水罗汉果苷Ⅲ异构体,说明罗汉果中还存在新的皂苷成分,其具体结构还需进一步确定。
| 序号 No. |
化合物 Compounds |
R1 | R2 | R3 | R4 | R5 | 分子式 Molecular formula |
来源 Source |
文献 References |
| 1 | Mogrol | H | H | H | α-OH | H2 | C30H52O4 | 果实Fruit | [7] |
| 2 | 11-oxomogrol | H | H | H | =O | H2 | C30H50O4 | 水解产物 Hydrolysis product |
[7] |
| 3 | Mogroside ⅠA1 | H | glc | H | H2 | H2 | C36H62O9 | 果实Fruit | [7] |
| 4 | Mogroside ⅠE1 | glc | H | H | α-OH | H2 | C36H62O9 | 果实Fruit | [7] |
| 5 | 11-oxomogroside ⅠA1 | H | glc | H | =O | H2 | C36H60O9 | 果实Fruit | [7] |
| 6 | 11-oxomogroside ⅠE1 | glc | H | H | =O | H2 | C36H60O9 | 果实Fruit | [7] |
| 7 | Mogroside ⅡA1 | H |  |
H | α-OH | H2 | C42H72O14 | 果实Fruit | [7] |
| 8 | Mogroside ⅡA2 | 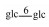 |
H | H | α-OH | H2 | C42H72O14 | 水解产物 Hydrolysis product |
[7] |
| 9 | Mogroside ⅡE | glc | glc | H | α-OH | H2 | C42H72O14 | 果实Fruit | [7] |
| 10 | Mogroside ⅡB | glc | H | glc | α-OH | H2 | C42H72O14 | 果实Fruit | [7] |
| 11 | 11-oxomogroside ⅡA1 | H |  |
H | =O | H2 | C42H70O14 | 果实Fruit | [7] |
| 12 | 11-oxomogroside ⅡE | glc | glc | H | =O | H2 | C42H70O14 | 未成熟果 Unripe fruit |
[7] |
| 13 | 7-oxomogroside ⅡE | glc | glc | H | α-OH | =O | C42H70O15 | 果实Fruit | [7] |
| 14 | Mogroside Ⅲ | glc | 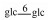 |
H | α-OH | H2 | C48H82O19 | 果实Fruit | [7] |
| 15 | Mogroside ⅢA1 | H | 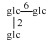 |
H | α-OH | H2 | C48H82O19 | 果实Fruit | [7] |
| 16 | Mogroside ⅢA2 |  |
glc | H | α-OH | H2 | C48H82O19 | 果实Fruit | [7] |
| 17 | Mogroside ⅢE | glc |  |
H | α-OH | H2 | C48H82O19 | 果实Fruit | [7] |
| 18 | 11-oxomogroside Ⅲ | glc | 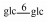 |
H | =O | H2 | C48H80O19 | 未成熟果 Unripe fruit |
[7] |
| 19 | 11-deoxymogroside Ⅲ | glc | 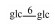 |
H | H2 | H2 | C48H82O18 | 果实Fruit | [7] |
| 20 | 7-oxomogroside ⅢE | glc | 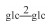 |
H | OH | H | C48H80O20 | 果实Fruit | [8] |
| 21 | 11-oxomogroside ⅢE | glc | 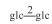 |
H | H | =O | C48H80O19 | 果实Fruit | [8] |
| 22 | Siamenoside Ⅰ | glc | 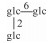 |
H | α-OH | H2 | C54H92O24 | 果实Fruit | [7] |
| 23 | Grosmomoside Ⅰ | glc | 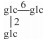 |
H | α-OH | H2 | C54H92O24 | 果实Fruit | [7] |
| 24 | Mogroside ⅣA | 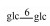 |
 |
H | α-OH | H2 | C54H92O24 | 果实Fruit | [7] |
| 25 | Mogroside ⅣE | 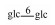 |
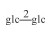 |
H | α-OH | H2 | C54H92O24 | 果实Fruit | [7] |
| 26 | 11-oxomogroside ⅣA | 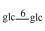 |
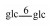 |
H | =O | H2 | C54H90O24 | 果实Fruit | [7] |
| 27 | Iso-o-mogroside ⅣE | H | glc | H | H | α-OH | C54H92O24 | 果实Fruit | [9] |
| 28 | 11-oxomogroside Ⅳ |  |
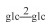 |
H | =O | H | C54H90O24 | 果实Fruit | [8] |
| 29 | 7-oxomogroside Ⅳ |  |
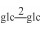 |
H | OH | H | C54H90O25 | 果实Fruit | [8] |
| 30 | 11-oxo-siamenoside Ⅰ | H | H | H | glc | =O | C54H90O24 | 果实Fruit | [9] |
| 31 | Mogroside Ⅴ | 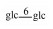 |
 |
H | α-OH | H2 | C60H102O29 | 果实Fruit | [7] |
| 32 | Isomogroside Ⅴ | 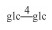 |
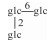 |
H | α-OH | H2 | C60H102O29 | 果实Fruit | [7] |
| 33 | 11-oxomogroside Ⅴ | 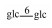 |
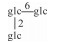 |
H | =O | H2 | C60H100O29 | 果实Fruit | [7] |
| 34 | 7-omogroside Ⅴ |  |
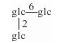 |
H | α-OH | =O | C60H100O30 | 果实Fruit | [7] |
| 35 | 11-deoxymogroside Ⅴ | β-D-glu | H | H | =O | H | C60H102O28 | 果实Fruit | [9] |
| 36 | 11-deoxyisomogroside Ⅴ | H | β-D-glu | H | OH | H | C60H102O28Na | 果实Fruit | [9] |
| 37 | 11-epi-mogroside Ⅴ | H | H | glc | glc | β-OH | C60H102O29 | 果实Fruit | [9] |
| 38 | 11-oxoisomogroside Ⅴ | 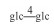 |
 |
H | =O | H | C60H100O29 | 果实Fruit | [8] |
| 39 | Neomogroside | 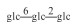 |
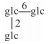 |
H | α-OH | H2 | C66H112O34 | 鲜果Fresh fruit | [7] |
| 40 | Mogroside Ⅵ | 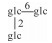 |
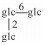 |
H | α-OH | H2 | C66H112O34 | 果实Fruit | [7] |
| 41 | 11-deoxymogroside Ⅵ | β-D-glu | H | β-D-glu | OH | =O | C66H113O33 | 果实Fruit | [9] |
| 42 | 11-oxo-mogroside Ⅵ | H | H | glc | glc | =O | C66H110O34 | 果实Fruit | [9] |
| 43 | Mogroside ⅥA |  |
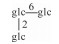 |
H | OH | =O | C66H112O34 | 果实Fruit | [8] |
| 44 | Mogroside ⅥB |  |
 |
H | OH | =O | C66H112O34 | 果实Fruit | [8] |
|
| 图 1 罗汉果三萜类化合物结构 Fig. 1 Structure of the triterpenoid compounds from Siraitia grosvenorii |
1.2 皂苷成分在果实中的形成规律
通过对不同生长时期的罗汉果进行定量及指纹图谱分析发现,罗汉果雌花子房中并不含罗汉果皂苷,但授粉后24 h内即可检测出罗汉果苷ⅡE,该成分为前30 d幼果的主要成分。罗汉果苷Ⅲ在30 d后开始出现并在30-55 d达到最高含量,45 d左右逐渐出现罗汉果苷ⅣA(Mogroside ⅣA)和罗汉果苷ⅣE (Mogroside ⅣE),其含量在55-70 d内达到峰值,罗汉果苷Ⅴ在50 d后产生,70 d以后成为主要甜味成分,果实开始成熟[11]。由于气候影响,不同产地或不同授粉时间段罗汉果成熟所需时间也有所差异。为保证罗汉果充分成熟,罗汉果果实的最佳采收时期为授粉85 d以后,其他研究也得出类似的结论[12, 13]。
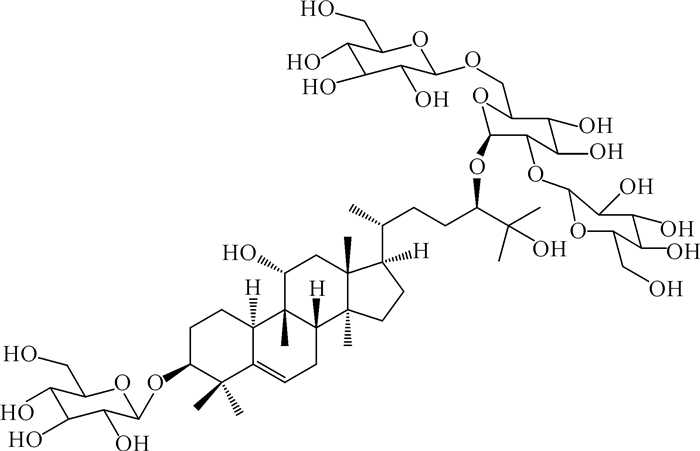
1.3 皂苷成分结构特点与甜度的关系从罗汉果中分离出的三萜皂苷化合物有共同的罗汉果醇苷元结构[10α-cucurbit-5-ene-3β, 11α, 24(R), 25-tetraol],连接1-6个葡萄糖糖基单元(图 1)表现出无味、苦味、甜味的味道差异。罗汉果皂苷结构与甜度的关系取决于葡萄糖糖基的数量、连接位置,苷元部分11位的功能团[14, 15]等。随着糖基数量的增加,罗汉果皂苷由无味变苦味,再逐渐变甜。罗汉果苷ⅠA1(Mogroside ⅠA1)、罗汉果苷ⅡE (Mogroside ⅡE)、罗汉果苷ⅢE (Mogroside ⅢE)和罗汉果苷Ⅲ(Mogroside Ⅲ)等由于葡萄糖糖基数量少于4个,呈无味或苦味。研究发现11位α-OH化合物的糖苷味道甜[16],而11位羰基化系列的糖苷甜度降低,例如罗汉果苷Ⅴ(Mogroside Ⅴ)的甜度约是蔗糖的300倍,11-氧化-罗汉果苷Ⅴ(11-oxomogroside Ⅴ)却只是蔗糖的84倍(表 2)。另外,葡萄糖基的连接方式也是影响甜度的因素之一,目前发现赛门苷Ⅰ (Siamenoside Ⅰ)具有4个葡萄糖基单元,其甜度却高于具有5个糖基的罗汉果苷Ⅴ。由于其他皂苷成分在果实中含量较低且其甜度还未有相关研究,赛门苷Ⅰ是目前发现的最甜的成分,但其在天然果实中的含量远远低于罗汉果苷Ⅴ,因此罗汉果苷Ⅴ才是目前能商业化应用的主要成分。羊学荣等[17]利用酶水解方式可促使罗汉果苷Ⅴ转化成赛门苷Ⅰ (图 2),这或许是另一条应用途径。
| 化合物 Compounds |
成熟果 Ripe fruit |
未成熟果 Unripe fruit |
与5%蔗糖溶液相比的甜度特性 Sweetness characteristics compared with 5% sucrose solution |
| 20-hydroxy-11-oxomogroside ⅠA1 | Ο | 无味Tasteless | |
| 11-oxomogroside ⅡE | Ο | 苦味Bitter taste | |
| 11-oxomogroside ⅠA1 | Ο | Ο | 无味Tasteless |
| Mogroside ⅠA1 | Ο | 无味Tasteless | |
| Mogroside ⅢE | Ο | 无味Tasteless | |
| Mogroside ⅡE | Ο | Ο major | 苦味Bitter taste |
| Mogroside Ⅲ | Ο | Ο major | 有点苦味A little bitter |
| Mogroside ⅣA | Ο | Ο | 甜味Sweet taste |
| Mogroside Ⅴ | Ο major | Ο | 300倍300 times |
| 11-oxomogroside Ⅲ | Ο | 无味Tasteless | |
| 11-deoxymogroside Ⅲ | Ο | 无味Tasteless | |
| 11-oxomogroside ⅣA | Ο | 甜味Sweet taste | |
| Mogroside Ⅳ | Ο | 392倍392 times | |
| Siamenoside Ⅰ | Ο | 563倍563 times | |
| 11-oxomogroside Ⅴ | Ο | 84倍84 times | |
| Mogroside Ⅵ | Ο | 甜度低于罗汉果苷ⅤSweetness lower than that of Mogroside Ⅴ | |
| 注:O代表含氧;O major代表主要含氧 Note: O represents oxygen contained; O major represents the main content is oxygen |
|||
|
| 图 2 塞门苷Ⅰ的结构 Fig. 2 Sructure of Siamenoside Ⅰ |
2 生物活性 2.1 抗氧化活性
活性氧(Reactive Oxygen Species,ROS)和自由基会对人体健康造成一定的损害,也会引发癌症、冠状动脉疾病、动脉粥样硬化、炎症和衰老等疾病[18]。据报道,罗汉果是一种天然抗氧化剂[19],罗汉果苷Ⅴ和11-氧化-罗汉果苷Ⅴ对ROS和导致DNA损伤的自由基有明显的清除能力[20, 21]。混合皂苷产品(罗汉果苷Ⅴ、罗汉果苷Ⅱ和罗汉果苷Ⅲ)和罗汉果苷Ⅴ分别对DPPH自由基显示出有效的抗氧化或清除活性,其半抑制浓度(50% Inhibitory Concentration, IC50)值分别为0.95 mg/mL和0.43 mg/mL[22]。Liu等[20]研究发现罗汉果提取物清除DPPH和ABTS自由基的IC50值分别为1 118.1 μg/mL和1 473.2 μg/mL,有望成为对抗糖尿病并发症的抗糖药。Wuttisin等[23]采用不同溶剂提取罗汉果,其提取物抗氧化活性优于市售的丁基化羟基甲苯(BHT),可对罗汉果的抗氧化作用机理深入探究。
2.2 抗炎作用罗汉果已被用于治疗咳嗽和其他呼吸系统疾病,如哮喘、急性肺损伤和肺纤维化。罗汉果提取物及罗汉果苷的抗炎活性有助于镇咳和祛痰。据报道,罗汉果苷ⅢE和罗汉果苷Ⅴ已对小鼠表现出抗炎作用[24, 25]。罗汉果苷为TLR4受体激动剂,对肺纤维化具有保护作用[24]。罗汉果苷Ⅴ可减轻肺纤维化、过敏性哮喘和肺部炎症等疾病[26, 27]。Liu等[28]通过代谢组学阐明罗汉果苷Ⅴ对肺部炎症的调控代谢途径,表明罗汉果苷Ⅴ改善了Ovalbumin (OVA)诱导的肺部炎症,为罗汉果苷Ⅴ对肺部炎症的保护机制药理学和临床研究奠定了基础。Li等[29]的研究结果表明罗汉果苷Ⅴ通过阻断RAW264.7细胞中丝氨酸/苏氨酸激酶1 (AKT1)磷酸化,抑制脂多糖诱导的环氧合酶2 (COX-2)表达、ROS产生和HO-1的过表达,发挥抗炎作用,AKT1是罗汉果苷Ⅴ缓解炎症的潜在特异性靶点。
2.3 抑制肥胖肥胖是一种普遍存在的疾病,但其病因尚不清楚。国际肥胖特别工作组(IOTF)的报告表明,肥胖是世界范围内观察到的与生活方式相关的主要疾病。过量食用高热量食物会刺激脂肪组织过度生长并导致肥胖。目前已开发药物来抑制食欲、抑制胰脂肪酶或抑制α-葡萄糖等以控制肥胖, 但长期服用这些药物会对健康造成不良影响,如肠胃功能紊乱[20]。San等[30]通过体外分析罗汉果总苷、罗汉果苷Ⅳ和罗汉果苷Ⅴ对胰脂肪酶的影响,发现它们对胰脂肪酶活性有显著的抑制作用。
2.4 降血糖罗汉果提取物和罗汉果苷均通过降低餐后血糖水平和改善胰岛素抵抗,表现出抗高血糖或抗糖尿病作用[31]。罗汉果可作为肥胖和糖尿病患者的替代糖,也可降低脂多糖[28, 32],通过升高胰岛素、降低α-葡萄糖苷酶活性和胰腺损伤,达到降血糖的目的[33, 34],然而其详细机制仍有待探索。罗汉果的抗糖尿病活性主要归因于罗汉果苷及其衍生物,包括罗汉果苷ⅠA1、罗汉果苷ⅠE1、罗汉果苷ⅡE、罗汉果苷ⅣE、罗汉果Ⅴ和塞门苷Ⅰ[35, 36]。其中罗汉果苷Ⅴ、罗汉果苷Ⅳ、罗汉果苷Ⅲ和塞门苷Ⅰ,通过抑制麦芽糖酶活性发挥抗高血糖作用,其IC50值分别为18.02 mg/mL、13.51 mg/mL、1.54 mg/mL和1.25 mg/mL[37, 38]。Zhang等[39]首次提出肠道微生物群及其代谢产物可能是罗汉果苷发挥抗高血糖作用的靶点,其中罗汉果苷尤其是低糖苷可降低T2DM大鼠的血糖和胰岛素。Liu等[40]通过研究逆转录PCR和蛋白质印迹法分析证实了罗汉果苷Ⅴ可减轻胰岛素抵抗并增加糖原,从而降低血糖。Liu等[41]发现向糖尿病小鼠补充高剂量的罗汉果苷提取物时,胰岛素抵抗被减弱,同时血脂的异常得到改善,其机制是激活肝脏AMPK信号实现降血糖。因此,建议在罗汉果降血糖功能方面进行更多的研究,以确定罗汉果苷抗糖尿病作用的具体机制。
3 罗汉果皂苷在体内的代谢产物及分布特点中药体内过程研究是沟通中药化学研究和体内生物活性研究的桥梁。近年来研究学者对罗汉果皂苷的体内外代谢过程进行了研究,为阐明其体内药效物质基础及作用机制提供了依据。Xu等[42]研究表明,罗汉果苷Ⅴ的代谢途径为去糖基化、羟基化、脱氢、异构化、糖基化和甲基化,阐明了罗汉果皂苷类成分及其代谢产物在大鼠粪、尿、血、心、肝、脾、肺、肾、胃、小肠和大肠等样品中的分布情况。卢凤来等[43]研究发现罗汉果苷Ⅴ在人的肠道菌群的代谢途径主要为糖苷化和脱糖反应。Bhusari等[44]在人体肠道粪便匀浆中检测罗汉果苷的代谢产物,发现罗汉果苷Ⅰ、罗汉果苷ⅢE、罗汉果苷Ⅴ和罗汉果苷Ⅴ异构体具有共同的代谢过程,其在24 h内代谢为罗汉果醇。罗汉果苷Ⅲ可被人肠内细菌生物转化为罗汉果苷ⅡA1和罗汉果醇。在大鼠体内消化酶和肠道微生物群作用下,罗汉果苷Ⅴ不同程度去糖基化的产物为赛门苷Ⅰ、罗汉果苷ⅣE、罗汉果苷ⅢE、罗汉果苷ⅢA1、罗汉果苷ⅡE、罗汉果苷ⅡA2、11-氧化罗汉果ⅡE和罗汉果醇[44]。罗汉果苷的药物代谢途径包括Ⅰ期和Ⅱ期,Ⅰ期以水解和氧化反应为主,代谢产物主要为罗汉果苷Ⅱ、罗汉果苷Ⅲ和罗汉果醇[9]。
4 罗汉果在大健康产品方面的开发利用罗汉果皂苷作为一种高甜、低热的功能性天然甜味剂,是肥胖症、高血压、糖尿病、心脏病等需要低热量食品和不适合吃蔗糖人群最好的甜味剂,可广泛应用到大健康食品中。目前罗汉果苷甜味剂已获得20多个国家的市场准入,使用罗汉果苷甜味剂的产品已超过2 000种,雀巢、可口可乐和星巴克等知名品牌竞相将罗汉果苷甜味剂用于其已有产品的改良以及新产品开发中。在全球各国正在实施的减糖计划驱动下,罗汉果有望成为一款源自中国的全球知名甜味剂。在国内,罗汉果已被开发为众多大健康产品,如罗汉果素润喉片、清凉润喉片、罗汉果银花含片、罗汉果止咳糖浆、罗汉果桂花茶、鲜罗汉果颗粒、罗汉果珍珠菊花精、罗汉果珍珠蛇舌草精、罗汉果珍珠田七花精、罗汉果人参茶、夏桑菊冲剂、罗汉果汁粉、罗汉果龟苓膏等。
4.1 乳品饮料罗汉果作为甜味剂逐渐被应用到乳品饮料中,使其成为风味更佳、低糖低脂、营养价值更高的健康饮品。Abdel-Hamid等[45]研究表明在益生菌酸奶中添加2%罗汉果提取物,可提高抗氧化和抗菌活性,说明罗汉果提取物可作为膳食补充剂开发出高营养价值的新型乳制品。刘咏霖等[46]研制的代糖型罗汉果皂苷凝固型酸奶具有低糖、低热量且健康等优点,被各类人群尤其是糖尿病人所接受。罗汉果提取物也可用来降低脱脂巧克力牛奶中的糖分[47]。
4.2 罗汉果饮料基于人们对健康饮食的追求,零糖零脂型饮料广受喜爱,以罗汉果为原料制备复合饮料的研究受到了研究者的广泛关注,如以罗汉果、菊花、铁皮石斛作为研究对象,制得罗汉果菊花茶和罗汉果铁皮石斛复合饮料,其口感和香气品质俱佳[48, 49];酸杨桃罗汉果复合饮料和罗汉果山楂叶茶饮料,酸甜适中,香气浓郁,口感柔和,热量较低且营养健康[50, 51];罗汉果复合饮料(罗汉果∶干柠檬片∶金桔干=4∶1.5∶1.5)澄清透明,色泽风味佳[52]。
4.3 罗汉果酒罗汉果发酵酒因其独特的风味及较高的营养价值而受到广泛的研究。罗汉果酒以鲜罗汉果、无皂苷浓缩的罗汉果汁、鲜罗汉果浆和罗汉果为原料制得,不仅具有罗汉果的风味和香味,而且酒液凉,口感醇厚,酸甜适中[53-55]。以罗汉果和葡萄柚为原料可制成罗汉果葡萄柚酒[56],为罗汉果深加工开辟了一条新途径,同时也丰富了酒的种类。
4.4 罗汉果类零食人们对健康饮食的追求也逐步体现在日常食品中,如蛋糕、巧克力、软糖和果冻等。以罗汉果和魔芋粉为原料制得的慕斯蛋糕质地细腻、口感俱佳[57];在巧克力中加入罗汉果混合物后,其产品脂肪与复合碳水化合物含量低,对胰岛素抵抗和糖尿病患者均有益[58];在果冻中加入罗汉果浓缩液,可使其保水性良好、口感清甜、香气宜人且富有弹性,提高食用体验感[59];将罗汉果浸膏添加到软糖,香甜可口,咀嚼性好,低糖低热量且药用价值高[60]。
4.5 其他大健康产品蔡玉玲等[61]研制了低盐低糖功能型发酵香肠,添加罗汉果皂苷后产品色泽、口感及风味最佳。熊瑶等[62]研制的低糖型奶茶粉,糖尿病人、肥胖人均宜食用。刘素连等[63]用罗汉果复合饮料原料粉研制了一种新型固体饮料——罗汉果复合饮料泡腾片,保留了原饮料风味,且崩解迅速、呈弱酸性、香甜可口。王孝方等[64]研究开发具有清咽功能的纯中药保健食品“双果枇杷含片”,绿色安全,可长期服用。吴承起[65]以炙甘草6 g和罗汉果15 g制成甘草罗汉果饮,具有和中缓急,化痰润喉之功效,也可用作药膳食疗辅助应对新冠变异病毒。
5 展望目前50%以上的罗汉果用于提取罗汉果皂苷和制作甜味剂,虽然开发了很多相关产品,但多数产品只利用了罗汉果皂苷的甜味性,其功能性没有得到充分开发与利用。因此要加强产品的功效学研究,注重开发功能型、高端的大健康产品,并科学指导消费者食用。罗汉果皂苷具有高甜、低热等特点,而且相比于其他天然甜味剂,它的口感更接近蔗糖,更容易被消费者接受。不过罗汉果皂苷也还存在一定的后苦味,今后可通过生产工艺优化去除影响口感的成分,或通过多种甜味剂复合使用等方法改善口感。
| [1] |
LEE C H. Intense sweetener from Lo Han Kuo (Momordica grosvenori)[J]. Experientia, 1975, 31(5): 533-534. DOI:10.1007/BF01932442 |
| [2] |
LI D, IKEDA T, MATSUOKA N, et al. Cucurbitane glycosides from unripe fruits of Lo Han Kuo (Siraitia grosvenorii)[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(10): 1425-1428. DOI:10.1248/cpb.54.1425 |
| [3] |
ZHANG H Y, YANG H H, ZHANG M, et al. Identification of flavonol and triterpene glycosides in Luo-Han-Guo extract using ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Journal of Food Composition and Analysis, 2012, 25(2): 142-148. DOI:10.1016/j.jfca.2011.09.004 |
| [4] |
PHILIPPE R N, DE MEY M, ANDERSON J, et al. Biotechnological production of natural zero-calorie sweeteners[J]. Current Opinion in Biotechnology, 2014, 26: 155-161. DOI:10.1016/j.copbio.2014.01.004 |
| [5] |
PAWAR R S, KRYNITSKY A J, RADER J I. Sweeteners from plants-with emphasis on Stevia rebaudiana (Bertoni) and Siraitia grosvenorii (Swingle)[J]. Analytical and Bioanalytical Chemistry, 2013, 405(13): 4397-4407. DOI:10.1007/s00216-012-6693-0 |
| [6] |
陆婉瑶, 赵芸, 张思聪, 等. 食糖与代糖的博弈及发展趋势分析[J]. 甘蔗糖业, 2021, 50(3): 80-93. DOI:10.3969/j.issn.1005-9695.2021.03.016 |
| [7] |
LI C, LIN L M, SUI F, et al. Chemistry and pharmacology of Siraitia grosvenorii: A review[J]. Chinese Journal of Natural Medicines, 2014, 12(2): 89-102. DOI:10.1016/S1875-5364(14)60015-7 |
| [8] |
NIU B, KE C Q, LI B H, et al. Cucurbitane glucosides from the crude extract of Siraitia grosvenorii with moderate effects on PGC-1α promoter activity[J]. Journal of Natural Products, 2017, 80(5): 1428-1435. DOI:10.1021/acs.jnatprod.6b01086 |
| [9] |
LU F L, YAN X J, XU X L, et al. Phytochemicals from Siraitia grosvenorii: New minor compounds and advances in pharmacological activities[J]. EC Pharmacology and Toxicology, 2019, 7(3): 195-204. |
| [10] |
ZHOU G, WANG M, LI Y, et al. Comprehensive analysis of 61 characteristic constituents from Siraitiae fructus using ultrahigh-pressure liquid chromatography with time-of-flight mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 125: 1-14. DOI:10.1016/j.jpba.2016.03.010 |
| [11] |
李典鹏, 陈月圆, 潘争红, 等. 不同生长日龄罗汉果甙类成分变化研究[J]. 广西植物, 2004, 24(6): 546-549. DOI:10.3969/j.issn.1000-3142.2004.06.013 |
| [12] |
LU F L, LI D P, FU C M, et al. Studies on chemical fingerprints of Siraitia grosvenorii fruits (Luo Han Guo) by HPLC[J]. Journal of Natural Medicines, 2012, 66(1): 70-76. DOI:10.1007/s11418-011-0555-5 |
| [13] |
卢凤来, 刘金磊, 黄永林, 等. 不同生长时期罗汉果高效液相指纹图谱研究[J]. 食品科学, 2010, 31(18): 283-287. |
| [14] |
MATSUMOTO K, KASAI R, OHTANI K, et al. Minor cucurbitane-glycosides from fruits of Siraitia grosvenorii (Cucurbitaceae)[J]. Chemical and Pharmaceutical Bulletin, 1990, 38(7): 2030-2032. DOI:10.1248/cpb.38.2030 |
| [15] |
KAISER R, MATSUMOTO K, NIE R L, et al. Glycosides from Chinese medicinal plant, Hemsleyapanacis-scandens and structure-taste relationship of cucurbitane-glycosides[J]. Chemical and Pharmaceutical Bulletin, 1988, 36(1): 234-243. DOI:10.1248/cpb.36.234 |
| [16] |
SURI S, KATHURIA D, MISHRA A, et al. Phyto- chemical composition and pharmacological impact of natural non-calorie sweetener-monk fruit (Siraitia grosvenorii): A review[J]. Nutrition & Food Science, 2020, 51(6): 897-910. |
| [17] |
羊学荣, 卢凤来, 王磊, 等. 酶水解百分之五十罗汉果皂苷Ⅴ方法学研究[J]. 广西植物, 2015, 35(6): 812-816, 898. |
| [18] |
LEPHART E D. Skin aging and oxidative stress: Equ- ol's anti-aging effects via biochemical and molecular mechanisms[J]. Ageing Research Reviews, 2016, 31: 36-54. DOI:10.1016/j.arr.2016.08.001 |
| [19] |
YAN J, HUANG X P, ZHU W W. Simultaneous determination of antioxidant properties and total phenolic content of Siraitia grosvenorii by near infrared spectroscopy[J]. Journal of Food Measurement and Characterization, 2020, 14(4): 2300-2309. DOI:10.1007/s11694-020-00477-2 |
| [20] |
LIU H S, WANG C C, QI X Y, et al. Antiglycation and antioxidant activities of mogroside extract from Siraitia grosvenorii (Swingle) fruits[J]. Journal of Food Science and Technology, 2018, 55(5): 1880-1888. DOI:10.1007/s13197-018-3105-2 |
| [21] |
WANG K, ZHU Z R, PAN Y M, et al. Study on antioxidant activity of different solvents extracts of the stem of Siraitia grosvenorii[J]. Science and Technology of Food Industry, 2008, 29(3): 57-62. |
| [22] |
WANG L, YANG Z M, LU F L, et al. Cucurbitane gly- cosides derived from mogroside ⅡE: Structure-taste relationships, antioxidant activity, and acute toxicity[J]. Molecules, 2014, 19(8): 12676-12689. DOI:10.3390/molecules190812676 |
| [23] |
WUTTISIN N, BOONSOOK W. Total phenolic, fla- vonoid contents and antioxidant activity of Siraitia grosvenorii fruits extracts[J]. Food and Applied Bioscience Journal, 2019, 7(3): 131-141. |
| [24] |
SHI D F, ZHENG M Z, WANG Y M, et al. Protective effects and mechanisms of mogroside Ⅴ on LPS-induced acute lung injury in mice[J]. Pharmaceutical Biology, 2014, 52(6): 729-734. DOI:10.3109/13880209.2013.867451 |
| [25] |
TAO L J, YANG J Y, CAO F Y, et al. Mogroside ⅢE, a novel anti-fibrotic compound, reduces pulmonary fibrosis through toll-like receptor 4 pathways[J]. Journal of Pharmacology and Experimental Therapeutics, 2017, 361(2): 268-279. DOI:10.1124/jpet.116.239137 |
| [26] |
SONG J L, QIAN B, PAN C L, et al. Protective activity of mogroside Ⅴ against ovalbumin-induced experimental allergic asthma in Kunming mice[J]. Journal of Food Biochemistry, 2019, 43(9): e12973. DOI:10.1111/jfbc.12973 |
| [27] |
FARRAIA M, RUFO J C, PACIÊNCIA I, et al. Metabolic interactions in asthma[J]. European Annals of Allergy and Clinical Immunology, 2019, 51(5): 196-205. DOI:10.23822/EurAnnACI.1764-1489.101 |
| [28] |
LIU Y S, WANG J, GUAN X, et al. Mogroside Ⅴ reduce OVA-induced pulmonary inflammation based on lung and serum metabolomics[J]. Phytomedicine, 2021, 91: 153682. DOI:10.1016/j.phymed.2021.153682 |
| [29] |
LI Y, ZOU L, LI T, et al. Mogroside Ⅴ inhibits LPS-induced COX-2 expression/ROS production and overexpression of HO-1 by blocking phosphorylation of AKT1 in RAW264.7 cells[J]. Acta Biochimica Et Biophysica Sinica, 2019, 51(4): 365-374. DOI:10.1093/abbs/gmz014 |
| [30] |
SAN B S, CHEN Y P, WANG Y B, et al. Anti-obesity effects of mogrosides extracted from the fruits of Siraitia grosvenorii (Cucurbitaceae)[J]. African Journal of Pharmacy and Pharmacology, 2012, 6(20): 1492-1501. |
| [31] |
SUZUKI Y A, MURATA Y, INUI H, et al. Triterpene glycosides of Siraitia grosvenori inhibit rat intestinal maltase and suppress the rise in blood glucose level after a single oral administration of maltose in rats[J]. Journal of Agricultural and Food Chemistry, 2005, 53(8): 2941-2946. DOI:10.1021/jf0478105 |
| [32] |
万艳娟, 吴军林, 吴清平. 功能性甜味剂罗汉果甜苷的生理功能及食品应用研究进展[J]. 食品与发酵科技, 2015, 51(5): 51-56. |
| [33] |
GONG X, CHEN N, REN K, et al. The fruits of Siraitia grosvenorii: A review of a Chinese food-medicine[J]. Frontiers in Pharmacology, 2019, 10: 1400. DOI:10.3389/fphar.2019.01400 |
| [34] |
WAN Y J, WU J L, WU Q. A review of the hypoglycemic activity of Siraitia Grosvenorii[J]. Food Research and Development, 2016, 37(11): 188-191. |
| [35] |
MURATA Y, OGAWA T, SUZUKI Y A, et al. Digestion and absorption of Siraitia grosvenorii triterpenoids in the rat[J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(3): 673-676. DOI:10.1271/bbb.90832 |
| [36] |
ZHANG Y, ZHOU G, PENG Y, et al. Anti-hyperglycemic and anti-hyperlipidemic effects of a special fraction of Luohanguo extract on obese T2DM rats[J]. Journal of Ethnopharmacology, 2020, 247: 112273. DOI:10.1016/j.jep.2019.112273 |
| [37] |
LI F, YANG F M, LIU X, et al. Cucurbitane glycosides from the fruit of Siraitia grosvenorii and their effects on glucose uptake in human HepG2 cells in vitro[J]. Food Chemistry, 2017, 228: 567-573. DOI:10.1016/j.foodchem.2017.02.018 |
| [38] |
SHEN Y, LIN S, HAN C, et al. Rapid identification and quantification of five major mogrosides in Siraitia grosvenorii (Luo-Han-Guo) by high performance liquid chromatography-triple quadrupole linear ion trap tandem mass spectrometry combined with microwave-assisted extraction[J]. Microchemical Journal, 2014, 116: 142-150. DOI:10.1016/j.microc.2014.04.014 |
| [39] |
ZHANG Y L, PENG Y, ZHAO L J, et al. Regulating the gut microbiota and SCFAs in the faeces of T2DM rats should be one of antidiabetic mechanisms of mogrosides in the fruits of Siraitia grosvenorii[J]. Journal of Ethnopharmacology, 2021, 274: 114033. DOI:10.1016/j.jep.2021.114033 |
| [40] |
LIU X, ZHANG J, LI Y, et al. Mogroside derivatives exert hypoglycemics effects by decreasing blood glucose level in HepG2 cells and alleviates insulin resistance in T2DM rats[J]. Journal of Functional Foods, 2019, 63: 103566. DOI:10.1016/j.jep.2021.114033 |
| [41] |
LIU H S, QI X Y, YU K, et al. AMPK activation is involved in hypoglycemic and hypolipidemic activities of mogroside-rich extract from Siraitia grosvenorii(Swingle) fruits on high-fat diet/streptozotocin-induced diabetic mice[J]. Food & Function, 2019, 10(1): 151-162. |
| [42] |
XU F, LI D P, HUANG Z C, et al. Exploring in vitro, in vivo metabolism of mogroside Ⅴ and distribution of its metabolites in rats by HPLC-ESI-IT-TOF-MSn[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 115: 418-430. DOI:10.1016/j.jpba.2015.07.024 |
| [43] |
卢凤来, 黄振聪, 颜小捷, 等. 罗汉果皂苷Ⅴ在人工胃液中的稳定性和体外代谢研究[J]. 广西植物, 2015, 35(6): 792-795. |
| [44] |
BHUSARI S, RODRIGUEZ C, TARKA J S M, et al. Comparative in vitro metabolism of purified mogrosides derived from monk fruit extracts[J]. Regulatory Toxicology and Pharmacology, 2021, 120: 104856. DOI:10.1016/j.yrtph.2020.104856 |
| [45] |
ABDEL-HAMID M, ROMEIH E, HUANG Z, et al. Bioactive properties of probiotic set-yogurt supplemented with Siraitia grosvenorii fruit extract[J]. Food Chemistry, 2020, 303: 12540. DOI:10.1016/j.foodchem.2019.125400 |
| [46] |
刘咏霖, 张可欣. 罗汉果甜苷在酸奶中的代糖作用及其应用前景展望[J]. 中国乳业, 2021(7): 109-113. |
| [47] |
LI X E, LOPETCHARAT K, DRAKE M A. Parents' and children's acceptance of skim chocolate milks sweetened by monk fruit and stevia leaf extracts[J]. Journal of Food Science, 2015, 80(5): S1083-S1092. DOI:10.1111/1750-3841.12835 |
| [48] |
林君, 潘嫣丽, 陆璐, 等. 罗汉果菊花茶饮料工艺[J]. 食品工业, 2021, 42(11): 117-121. |
| [49] |
林君, 何梅媚, 赵琤, 等. 铁皮石斛罗汉果复合饮料的研制[J]. 轻工科技, 2021, 37(9): 5-7, 10. |
| [50] |
戴梓茹, 唐婷婷, 张晨晓, 等. 酸杨桃罗汉果复合饮料的研制[J]. 粮食与油脂, 2020, 33(11): 43-46. DOI:10.3969/j.issn.1008-9578.2020.11.014 |
| [51] |
莫伟娟, 郭婷, 段振华, 等. 罗汉果味山楂叶茶饮料的研制[J]. 保鲜与加工, 2020, 20(6): 51-57. DOI:10.3969/j.issn.1009-6221.2020.06.009 |
| [52] |
张锐锐, 王晶晶, 林家逊, 等. 罗汉果复合饮料的研制[J]. 食品研究与开发, 2020, 41(4): 136-140. |
| [53] |
李思思, 李俊, 何星存, 等. 无甜苷罗汉果汁发酵制备果酒的研究[J]. 食品研究与开发, 2018, 39(3): 65-70. DOI:10.3969/j.issn.1005-6521.2018.03.012 |
| [54] |
李蜜月, 黄燕, 谢永富, 等. 溶菌酶介入下发酵型罗汉果酒的制备和风味[J]. 中国食品添加剂, 2021, 32(3): 20-27. |
| [55] |
李佳, 赵华, 李燕. 罗汉果白酒调味液的工艺研究[J]. 中国食品添加剂, 2018(1): 153-158. DOI:10.3969/j.issn.1006-2513.2018.01.015 |
| [56] |
高本杰, 韩娜娜, 邱磊, 等. 罗汉果葡萄柚酒的研制[J]. 食品研究与开发, 2017, 38(12): 88-92. DOI:10.3969/j.issn.1005-6521.2017.12.019 |
| [57] |
洪文龙, 许俊齐, 桑梓莹, 等. 响应面法优化罗汉果、魔芋粉慕斯蛋糕配方研究[J]. 粮食与饲料工业, 2021(5): 32-36. |
| [58] |
HEINE J. Process for making a chocolate food product: US2017/0215452 A1[P/OL]. 2017-05-23[2021-12-31]. https://www.freepatentsonline.com/9655374.html.
|
| [59] |
贤欢, 冯婉怡, 罗进, 等. 桂花罗汉果保水果冻的研制[J]. 食品与发酵科技, 2021, 57(3): 103-107. |
| [60] |
刘亚男, 谢林娟, 许有瑞. 芒果软糖配方的优化研究[J]. 轻工科技, 2021, 37(5): 13-16, 25. |
| [61] |
蔡玉玲, 王伟, 倪来学. 低盐低糖功能型发酵香肠加工工艺研究[J]. 肉类工业, 2021(5): 11-15. DOI:10.3969/j.issn.1008-5467.2021.05.002 |
| [62] |
熊瑶, 何安乐, 刘庚贵, 等. 基于天然甜味剂低糖型奶茶粉的制备工艺研究[J]. 企业科技与发展, 2021(5): 55-57, 60. DOI:10.3969/j.issn.1674-0688.2021.05.019 |
| [63] |
刘素连, 张锐锐, 许有瑞. 罗汉果复合饮料泡腾片的研制[J]. 食品科技, 2020, 45(1): 154-160. |
| [64] |
王孝方, 张金秋, 丁艳霞, 等. 保健食品"双果枇杷含片"研究与开发[Z/OL]. (2021-12-30)[2021-12-31]https://kns.cnki.net/KCMS/detail/detail.aspx?dbname=SNAD&filename=SNAD000001909418.
|
| [65] |
吴承起. 药膳食疗辅助应对新冠变异病毒[J]. 食品与生活, 2021(6): 61. |



