2. 广西中医药大学, 广西中药药效研究重点实验室, 广西南宁 530200;
3. 成都中医药大学药学院, 四川成都 611137
2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medica, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China;
3. Faculty of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu, Sichuan, 611137, China
类风湿性关节炎(Rheumatoid Arthritis, RA)是一种慢性、系统性、自身免疫性炎症疾病,主要攻击滑膜关节,进而导致关节破坏、关节畸形和功能丧失等障碍疾病,这是造成劳动力丧失和残疾的主要原因,严重危害人类健康[1, 2]。在我国,RA总患病率为0.32%-0.36%[3]。目前临床上常用于类风湿性关节炎的药物为非甾体抗炎、甾体激素等[4],均存在诸多不良反应。RA在中医属“痹证”范畴,其病由人体正气不足、脏腑功能失调、风湿寒热燥等外邪入侵,痰瘀气滞,气血运行不畅所引起[5]。中医药具有疗效好、依赖性低、副作用少等优点,利用其治疗RA疾病已成为研究热点[6]。
厚藤(Ipomoea pes-caprae)为旋花科(Convolvulaceae)番薯属(Ipomoea)植物,是我国常用海洋中药材,具有祛风除湿、消痈散结、拔毒消肿的功效,在民间应用广泛。现代药理研究报道,厚藤具有抗炎、免疫调节、抗氧化等功效[7]。目前,厚藤抗RA作用的研究报道较少,本文探讨厚藤提取物(Ipomoea pes-caprae Extract, IPE)对Ⅱ型胶原诱导关节炎(Collagen-induced Arthritis, CIA)模型大鼠的治疗作用,为临床应用及产品开发提供研究基础。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雄性SD大鼠,6周龄,体质量160-200 g,由湖南斯莱克景达实验动物有限公司提供,动物许可证号SCXK (湘) 2019-0004。动物饲养于温度(23±2)℃、湿度50%-60%、12 h/12 h昼夜交替光照的环境中,自由进食饮水。动物实验经广西中医药大学动物伦理委员会批准(批准号DW20190418-015)。
1.1.2 药材厚藤采自广西防城港市北仑河口国家级自然保护区,经广西中医药大学韦松基教授鉴定为旋花科植物厚藤(Ipomoea pes-caprae (L.)Sweet)的全草。
1.1.3 药品及试剂牛Ⅱ型胶原(CⅡ, 美国Chondrex,批号:190578),弗氏不完全佐剂(IFA, 美国Chondrex,批号:190572),弗氏完全佐剂(CFA, 美国Chondrex,批号:190447),雷公藤多苷(江苏美通制药公司,批号:200401),PGE2 ELISA Kit (Bioswamp生物科技有限公司,批号:RA20013),RF ELISA Kit (上海酶联生物科技有限公司,批号:ml525301),CRP ELISA Kit (上海酶联生物科技有限公司,批号:ml038253)。
1.1.4 仪器CPA225D万分之一天平(德国赛多利斯科学仪器北京公司),HDM-500型恒温电热套(江苏天由发展有限公司),Hei-VAP型旋转蒸发仪(德国Heidolph公司),TGL-16M型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),M200PRO型酶标仪[帝肯(上海)贸易有限公司]。
1.2 方法 1.2.1 厚藤提取物的制备称取厚藤全草2.5 kg,切成约10 cm粗段,加水提取2次,第1次加12倍量水,第2次加10倍量水,煮沸后再煎30 min,用200目纱布过滤,合并药液,55℃减压浓缩至稠膏,取提取物稠膏,稀释至相应灌胃浓度进行实验。
1.2.2 动物分组、模型复制及给药60只大鼠经适应性喂养5 d后,按体质量随机选取8只作为空白组,其余52只大鼠用于复制模型。造模时,将牛Ⅱ型胶原(CⅡ)溶液与等体积弗氏完全佐剂(CFA)混合乳化后,除空白组外,其余组大鼠取背部脊柱两侧和尾根部皮内注射配置好的胶原乳剂0.1 mL,共0.3 mL。初次免疫第7 d,将CⅡ溶液与等体积弗氏不完全佐剂(IFA)混合乳化后,在大鼠右侧踝关节皮下注射0.1 mL进行第2次免疫。空白对照组于相同部位注射等量生理盐水。造模24 d后,挑选造模成功(关节炎指数AI≥3)的大鼠,根据炎症指数随机分为5组,即模型组,阳性组,厚藤提取物高、中、低剂量组,每组8只。
厚藤提取物高、中、低剂量组分别按2.271 2,1.135 6,0.567 8 g/kg鼠重(分别相当于人每日服生药材120,60,30 g)灌胃,阳性对照组按9 mg/kg鼠重给予雷公藤多苷混悬液(加蒸馏水配制成0.6 mg/mL雷公藤多苷混悬液)灌胃,空白组和模型对照组给予等体积的纯化水,每次灌胃容量按1.5 mL/100 g鼠重给予。每日1次,连续21 d。
1.2.3 大鼠情况观察自给药起,每日观察并记录大鼠活动情况、精神状况、皮毛光泽度、大小便等变化。
1.2.4 踝关节肿胀度测定造模前,在每只大鼠踝关节测量处用马克笔进行画线标记,确保每次测量位置一致。经2次免疫后,每3 d采用2-3 mm宽纸条和透明软尺,固定测量大鼠右后足踝关节0.5 mm处的关节周径。踝关节肿胀度=(致炎后关节周径-致炎前初始周径)/致炎前初始周径。
1.2.5 足跖肿胀度测定大鼠经2次免疫后,每3 d用数显游标卡尺测量大鼠右后足跖厚度,足趾肿胀度=(致炎后足跖厚度-致炎前足跖厚度)/致炎前足跖厚度。
1.2.6 关节炎症指数评价根据关节炎症评分与计数的标准[8](表 1),对大鼠进行关节炎指数评分(总分为四足评分之和)。
| 评分值 Score value |
症状 Symptoms |
| 0 | 正常 No evidence of erythema and swelling |
| 1 | 踝关节或脚掌中部有红斑或轻度肿胀 Erythema or mild swelling confined to the mid-foot (tarsals) or ankle joint |
| 2 | 踝关节至脚掌中部有红斑和肿胀 Erythema and swelling extending from the ankle to the foot |
| 3 | 踝关节和足跖关节有红斑和中度肿胀 Erythema and moderate swelling extending from the ankle to the metatarsal joints |
| 4 | 踝关节至脚有红斑和严重肿胀 Erythema and severe swelling encompass the ankle, foot and digits |
1.2.7 血清中PGE2、RF、CRP含量测定
末次给药后,大鼠禁食不禁水12 h。采集血液标本前,用10%水合氯醛按0.3 mL/100 g鼠重腹腔注射使各组大鼠麻醉,腹主动脉取血,室温放置2 h,3 000 r/min离心10 min,吸出血清,于-80℃低温冰箱保存待测。采用ELISA试剂盒按照说明书检测各组大鼠血清中前列腺素E2(Prostaglandin E2, PGE2)、类风湿因子(Rheumatoid Factor, RF)、C-反应蛋白(C-reaction Protein, CRP)表达情况。
1.2.8 滑膜组织病理分析腹主动脉取血后,截取大鼠的踝关节,剔除表面皮肤和肌肉,置于4%多聚甲醛溶液中固定3 d后,换入新的固定液继续固定4 d,将踝关节用PBS清洗3次,继而用纯化水清洗3次,将踝关节转移至20倍体积的脱钙液中脱钙,脱钙液每周更换1次,4-6周时用针刺、钳夹的方法检查脱钙情况,待针刺无阻力感时终止脱钙,将组织脱水、石蜡包埋、切片,经切片脱蜡后进行HE染色。
1.2.9 数据处理实验数据以均值±标准差(x±s)表示,用Graphpad Prism 8.0统计软件处理,组间比较采用t检验。
2 结果与分析 2.1 大鼠后肢肿胀情况观察大鼠后肢踝关节肿胀情况如图 1所示。空白组(图 1a)大鼠活动自如,无关节炎症现象,毛发顺滑光亮,饮食、大小便正常。模型组(图 1b)大鼠踝关节肿胀严重,以右后足踝关节肿胀最为明显,行动迟缓,毛发枯萎且色泽暗淡,精神逐渐萎靡,进食减少。给予厚藤提取物干预后,大鼠踝关节肿胀程度得到减轻。
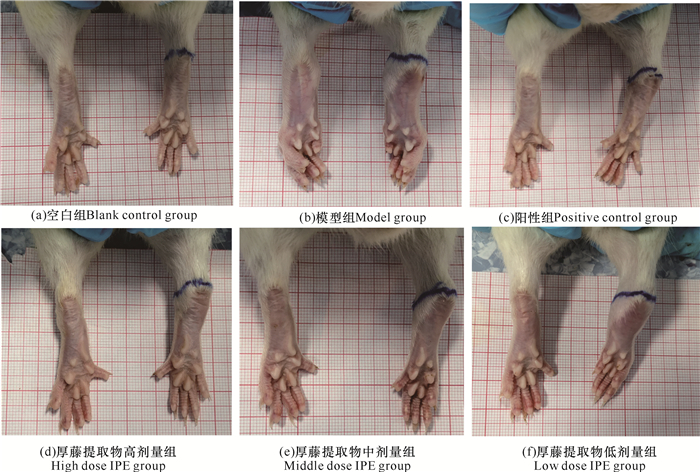
|
| 图 1 各组大鼠后肢肿胀情况 Fig. 1 Hindlimb swelling of rats in each group |
2.2 厚藤提取物对CIA大鼠踝关节肿胀度的影响
由表 2可知,各组造模大鼠踝关节肿胀度与空白组相比均显著提高(P < 0.01)。各治疗组与模型组相比均无显著性差异(P>0.05),其中,厚藤提取物高剂量组有减轻踝关节肿胀度的趋势。厚藤提取物高、中、低剂量组与阳性组比较,无统计学意义(P>0.05)。
| 给药天数 Administration days(d) |
空白组 Blank control group |
模型组 Model group |
阳性组 Positive control group |
厚藤提取物高剂量组 High dose IPE group |
厚藤提取物中剂量组 Middle dose IPE group |
厚藤提取物低剂量组 Low dose IPE group |
| 0 | 0.070±0.054 | 0.479±0.189## | 0.499±0.134## | 0.466±0.144## | 0.487±0.138## | 0.529±0.120## |
| 3 | 0.028±0.052 | 0.402±0.146## | 0.414±0.101## | 0.379±0.125## | 0.422±0.139## | 0.441±0.112## |
| 6 | 0.005±0.056 | 0.355±0.138## | 0.364±0.083## | 0.322±0.125## | 0.383±0.152## | 0.408±0.118## |
| 9 | 0.028±0.072 | 0.352±0.133## | 0.381±0.111## | 0.328±0.121## | 0.378±0.157## | 0.392±0.091## |
| 12 | 0.035±0.057 | 0.353±0.126## | 0.366±0.105## | 0.315±0.109## | 0.361±0.169## | 0.379±0.113## |
| 15 | 0.052±0.062 | 0.376±0.109## | 0.395±0.082## | 0.334±0.093## | 0.383±0.152## | 0.379±0.092## |
| 18 | 0.055±0.060 | 0.376±0.107## | 0.376±0.083## | 0.328±0.087## | 0.368±0.146## | 0.363±0.095## |
| 注:与空白组比较##P < 0.01 Note: ##P < 0.01 compared with blank control group | ||||||
2.3 厚藤提取物对CIA大鼠足跖肿胀度的影响
厚藤提取物对CIA大鼠足跖肿胀度的影响结果如表 3所示。与空白组相比,各组造模大鼠足跖肿胀度均显著提高(P < 0.01)。与模型组相比,厚藤提取物各治疗组在给药18 d后,随着给药浓度的升高,足跖肿胀度有逐渐下降的趋势,但各组间无显著性差异(P>0.05)。厚藤提取物各组与阳性组比较,均无显著性差异(P>0.05)。
| 给药天数 Administration days (d) |
空白组 Blank control group |
模型组 Model group |
阳性组 Positive control group |
厚藤提取物高剂量组 High dose IPE group |
厚藤提取物中剂量组 Middle dose IPE group |
厚藤提取物低剂量组 Low dose IPE group |
| 0 | 0.056±0.036 | 0.606±0.332## | 0.550±0.194## | 0.571±0.270## | 0.582±0.280## | 0.631±0.246## |
| 3 | 0.059±0.027 | 0.535±0.309## | 0.489±0.161## | 0.458±0.306## | 0.506±0.265## | 0.609±0.281## |
| 6 | 0.070±0.029 | 0.493±0.273## | 0.523±0.194## | 0.420±0.282## | 0.476±0.261## | 0.519±0.292## |
| 9 | 0.067±0.029 | 0.516±0.264## | 0.505±0.203## | 0.442±0.286## | 0.431±0.279## | 0.521±0.304## |
| 12 | 0.072±0.033 | 0.494±0.270## | 0.409±0.220## | 0.397±0.285## | 0.399±0.318## | 0.484±0.312## |
| 15 | 0.073±0.025 | 0.480±0.251## | 0.415±0.200## | 0.412±0.286## | 0.411±0.297## | 0.484±0.299## |
| 18 | 0.078±0.028 | 0.485±0.249## | 0.394±0.198## | 0.369±0.273## | 0.381±0.298## | 0.458±0.293## |
| 注:与空白组比较##P < 0.01 Note: ##P < 0.01 compared with blank control group | ||||||
2.4 厚藤提取物对CIA大鼠关节炎症指数的影响
由图 2可知,与空白组相比,各组造模大鼠关节炎指数显著升高(P < 0.01)。与模型组相比,阳性组、厚藤提取物高剂量组在给药15 d后关节炎症指数降低(P < 0.05),厚藤提取物中剂量组在给药18 d后关节炎症指数降低(P < 0.05)。与阳性组相比,厚藤提取物各治疗组均无统计学意义(P>0.05)。
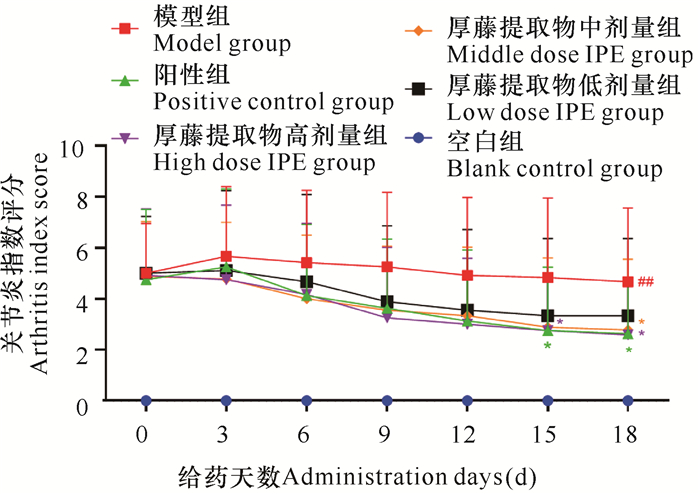
|
| 与空白组比较##P < 0.01;与模型组比较*P < 0.05 ##P < 0.01 compared with blank control group; *P < 0.05 compared with model group 图 2 给药后大鼠关节炎症指数评价变化 Fig. 2 Evaluation changes of joint inflammation index in rats after administration |
2.5 厚藤提取物对CIA大鼠血清中PGE2、RF、CRP表达的影响
由表 4可知,模型组大鼠与空白组相比,血清中PGE2、RF、CRP水平均显著升高(P < 0.01)。与模型组相比,各给药组能显著降低RF水平(P < 0.01);除厚藤提取物低剂量组外,厚藤提取物高、中剂量组能显著降低PGE2、CRP水平(P < 0.05,P < 0.01)。与阳性组相比,厚藤提取物低剂量组血清中PGE2含量明显升高(P < 0.05),厚藤提取物各组RF含量均显著升高(P < 0.01),而CRP含量无显著性差异(P>0.05)。
| 组别Group | PGE2 (pg/mL) | RF (IU/mL) | CRP (ng/mL) |
| 空白组 Blank control group |
92.92±28.93 | 78.97±16.82 | 2 662±78.43 |
| 模型组 Model group |
152.2±23.25## | 184.4±12.99## | 2 901±82.93## |
| 阳性组 Positive control group |
103.9±19.98** | 83.73±8.943** | 2 679±152.2** |
| 厚藤提取物高剂量组 High dose IPE group |
99.41±26.76** | 101.7±8.560**ΔΔ | 2 709±113.2** |
| 厚藤提取物中剂量组 Middle dose IPE group |
121.9±31.90* | 141.6±10.37**ΔΔ | 2 755±168.8* |
| 厚藤提取物低剂量组 Low dose IPE group |
133.3±20.38Δ | 154.2±18.62**ΔΔ | 2 794±131.2 |
| 注:与空白组比较##P < 0.01;与模型组相比*P < 0.05,**P < 0.01;与阳性组相比ΔP < 0.05,ΔΔP < 0.01 Note: ##P < 0.01 compared with blank control group; *P < 0.05, **P < 0.01 compared with model group; ΔP < 0.05,ΔΔP < 0.01 compared with positive control group | |||
2.6 厚藤提取物对CIA大鼠滑膜组织病理变化的影响
大鼠踝关节病理切片结果如图 3所示。光学显微镜下,空白组踝关节组织软骨结构完整,骨层清晰,关节面光滑,软骨细胞分布均匀,软骨内无血管和神经,骨小梁较宽,骨髓腔中细胞分布密集、无空旷区;滑膜结构清晰完整,衬里层由单层或双层滑膜细胞组成,排列疏松且部分不连续,滑膜组织无炎性细胞浸润及纤维组织增生。模型组软骨和软骨下层骨组织受侵蚀,见局部软骨细胞严重减少,部分软骨细胞坏死,见软骨细胞着色较深,胞质溶解,排列紊乱,软骨层及软骨下层骨组织形成纤维裂隙,裂隙间大量毛细血管增生形成血管翳,较多炎性细胞浸润,见核呈圆形深染的淋巴细胞和核呈杆状或分叶状的中性粒细胞,骨组织中见大量的纤维组织填充,可见核呈长椭圆形的成纤维细胞增生。与模型组相比,厚藤提取物低剂量组踝关节组织病变程度相差不大,厚藤提取物中剂量组踝关节组织病变程度相对有所减轻,阳性组和厚藤提取物高剂量组踝关节组织病变程度得到明显减轻。

|
| 图 3 厚藤提取物对CIA大鼠踝关节病理切片的影响 Fig. 3 Effect of I.pes-caprae extracts on pathological sections of ankle joint in CIA rats |
3 讨论
厚藤作为一种常用海洋中药,现代研究表明,厚藤中含有树脂糖苷类、黄酮类、酚酸类等成分,具有抗炎、镇痛、免疫调节、抗肿瘤等多种药理活性[7]。本课题组前期研究发现,厚藤水提物具有抗急性痛风性关节炎(Acute Gouty Arthris, AGA)作用[9],AGA与RA都属于风湿病,归属于中医“痹证、痹病”等范畴,本研究旨在探讨厚藤提取物对CIA大鼠的治疗作用。
CIA大鼠关节肿胀和炎症指数评价是反映病程的主要指标,进而评定药物的治疗效果。实验结果表明,与模型组相比,厚藤提取物各治疗组的踝关节肿胀度、足跖肿胀度有减轻的趋势但无显著性差异(P>0.05),厚藤提取物高、中剂量组可降低CIA大鼠关节炎症评分指数。在实验过程中,造模大鼠发病时间、病情程度不一。首次免疫时将CⅡ和CFA混合乳化后,在大鼠背部两侧及尾根部3点皮内注射,造成大鼠后期出现不同肿胀情况,部分大鼠两后足均出现肿胀现象,个别大鼠出现前肢肿胀;第2次免疫时,选择大鼠右后足进行注射免疫。因此,在实验期间造模大鼠普遍为右后足严重肿胀,其余足不同程度肿胀。在给药前,按炎症评分指数(大鼠四足评分之和)分层随机分组,踝关节肿胀度、足跖肿胀度测量部位为大鼠右后足;给药后,大鼠右后足肿胀消退缓慢,而继发性肿胀消退较快。与模型组比较,厚藤提取物各治疗组大鼠炎症指数评分明显降低,而踝关节肿胀度、足跖肿胀度降低但无显著性差异(P>0.05)。
RA病情发生与多种细胞因子密切相关。在RA模型中,PGE2发挥着关键作用,炎性因子PGE2可以增强单核细胞和中性粒细胞的趋化性,刺激淋巴细胞的增殖和细胞因子的释放[10],PGE2过度表达可使血管舒张,微循环通透性增加,加重渗出与水肿,诱导软骨破坏,从而加重RA炎症反应[11, 12]。RF作为一种特异性抗体,由RA产生,RF表达升高,可加重患者器官功能的损伤[13]。CRP最早在肺炎球菌感染病人中发现,属于急性期蛋白,在发生炎症、组织损失时,表达水平迅速上升,在临床上常被用作诊断炎性反应、免疫防御功能的标志物[14, 15]。RF和CRP与RA疾病发展密切相关,可作为诊断和判定RA严重程度的指标[16, 17]。
4 结论本研究评价了厚藤提取物对CIA模型大鼠的抗炎作用,结果显示,厚藤提取物对CIA大鼠有减轻肿胀、缓解滑膜炎症状的作用,其对CIA大鼠关节的保护作用可能是通过降低血清中PGE2、RF、CRP表达水平,从而抑制炎症反应,其具体分子作用机制还需深入探究。
| [1] |
SCOTT D L, WOLFE F, HUIZINGA T W J. Rheumatoid arthritis[J]. Lancet, 2010, 376: 1094-1108. DOI:10.1016/S0140-6736(10)60826-4 |
| [2] |
REWATKAR P V, KOKIL G R, VERMA A, et al. Rheumatoid arthritis: A new challenge in coming era[J]. Mini-Reviews in Medicinal Chemistry, 2010, 10(2): 98-107. DOI:10.2174/138955710791185136 |
| [3] |
刘义, 李枝锋, 李坤正, 等. 中西医结合方法应用于类风湿性关节炎的研究[J]. 临床医药文献电子杂志, 2019, 6(4): 29. |
| [4] |
CHENG X L, LIU X G, WANG Q, et al. Anti-inflammatory and anti-arthritic effects of Guge Fengtong Formula: In vitro and in vivo studies[J]. Chinese Journal of Natural Medicines, 2015, 13(11): 842-853. DOI:10.1016/S1875-5364(15)30088-1 |
| [5] |
娄玉钤, 李满意. "风湿病"的病名源流[J]. 风湿病与关节炎, 2013, 2(1): 37-41. |
| [6] |
李冀, 李想, 高彦宇. 中医药治疗类风湿性关节炎研究进展[J]. 辽宁中医药大学学报, 2019, 21(12): 5-8. |
| [7] |
冯小慧, 邓家刚, 秦健峰, 等. 海洋中药厚藤的化学成分及药理活性研究进展[J]. 中草药, 2018, 49(4): 955-964. |
| [8] |
SONG H P, LI X, YU R, et al. Phenotypic characterization of type Ⅱ collagen-induced arthritis in Wistar rats[J]. Experimental and Therapeutic Medicine, 2015, 10(4): 1483-1488. DOI:10.3892/etm.2015.2667 |
| [9] |
侯小涛, 韦棪婷, 夏中尚, 等. 基于血清药物化学的厚藤治疗急性痛风性关节炎质量标志物研究[J]. 中草药, 2021, 52(9): 2638-2652. |
| [10] |
ABDOLLAHZAD H, AGHDASHI M A, JAFARABADI M A, et al. Effects of coenzyme Q10 supplementation on inflammatory cytokines (TNF-α, IL-6) and oxidative stress in rheumatoid arthritis patients: A randomized controlled trial[J]. Archives of Medical Research, 2015, 46(7): 527-533. |
| [11] |
许锦虹, 罗苗, 姜海琴, 等. 榼藤对牛Ⅱ型胶原诱导的类风湿性关节炎大鼠的治疗作用研究[J]. 中南民族大学学报: 自然科学版, 2021, 40(1): 32-38. |
| [12] |
WANG L F, WANG N, ZHAO Q, et al. Pectolinarin inhibits proliferation, induces apoptosis, and suppresses inflammation in rheumatoid arthritis fibroblast-like synoviocytes by inactivating the phosphatidylinositol 3 kinase/protein kinase B pathway[J]. Journal of Cellular Biochemistry, 2019, 120(9): 15202-15210. |
| [13] |
盛长健, 屈彬, 方长水. 补肾抗痹汤对类风湿性关节炎患者关节功能及ESR、RF、CRP水平的影响[J]. 现代医学与健康研究电子杂志, 2020, 4(21): 69-71. |
| [14] |
LIANG C, LI J, LU C, et al. HIF1α inhibition facilitates Leflunomide-AHR-CRP signaling to attenuate bone erosion in CRP-aberrant rheumatoid arthritis[J]. Nature Communications, 2019, 10(1): 4579. DOI:10.1038/s41467-019-12163-z |
| [15] |
刘晶, 唐晓红, 李孜. C反应蛋白与肾脏疾病发病机制的研究进展[J]. 中国中西医结合肾病杂志, 2019, 20(9): 837-839. |
| [16] |
左瑞庭, 孟庆良, 马俊福, 等. 加味五痹汤联合甲氨蝶呤对寒湿痹阻型类风湿关节炎患者的临床疗效[J]. 时珍国医国药, 2020, 31(10): 2436-2439. |
| [17] |
陈泽宇, 王健敏. 来氟米特联合依那西普治疗类风湿性关节炎的效果及对患者血沉、C反应蛋白及类风湿因子水平的影响[J]. 中国医学创新, 2020, 17(33): 14-17. |



