华重楼(Paris polyphylla var.chinensis)为百合科(Liliaceae)重楼属(Paris)多年生草本植物,具有清热解毒、消肿止痛、凉肝定惊等功效,是我国传统名贵中药材[1, 2]。华重楼对生长环境要求高,且生长缓慢,种子从发芽到药用,一般需10年以上[3]。研究表明,药用植物产生的黄酮、生物碱、萜类等次级代谢产物,在生长过程中很容易释放到土壤中,从而引起植物根际土壤理化性质的改变,导致根际土壤微生物和土壤酶活性的变化[4]。华重楼长时间的单一化种植及次级代谢产物的逐年累积极易引发连作障碍,从而导致华重楼的品质和产量难以得到保障,严重影响华重楼的产量及产业发展。因此,在栽培生产中有针对性地选择合适的微生物肥料科学合理施肥,维持栽培地土壤理化性状和有益微生物群体、数量的平衡,是华重楼人工栽培成功的关键[5, 6]。
目前,已有多位学者多方面报道华重楼的人工施肥研究。郑钦方等[7]在华重楼施肥时以腐熟的有机肥为主,辅施叶面肥,不施化肥。李伟等[8]则以充分腐熟的厩肥(如羊粪)混合史丹利复合肥为主要肥料。刘哲等[9]研究不同梯度水平氮、磷、钾肥对华重楼根茎产量和品质的影响,结果表明,氮、磷、钾肥配施有利于华重楼根茎的增重率、总皂苷含量和浸出物含量的提高。而有关华重楼栽培中微生物菌肥的应用却鲜有报道,选择何种类型的菌肥有待进一步研究。微生物菌肥是一类含有特定微生物活体的肥料,通过微生物的生命活动及代谢产物促使农作物得到特定施肥效应,具有应用效果好、保护环境、对作物增产增效、安全无毒等优点[10-12],因而在农业上应用范围不断扩大。但由于现阶段仍存在菌种效能不稳定且肥效短期不明显、肥料种类少等问题[13],尤其是许多珍稀濒危中药材仍未有稳定高效的微生物菌肥种类,从而导致我国中药材产业种植技术落后、品质退化、农药残留等问题日益突出。因此,开展我国传统特色中药材微生物菌肥的研究工作十分有意义。研究表明,微生物菌肥可以改良土壤微生态结构[13, 14],从而提高土壤肥力[15-17]与肥料利用效率[18, 19],促进中药材生长,提高中药材的产量和品质[20-23],目前在农业生产特别是经济作物栽培上得到广泛应用。根际土壤微生物群落多样性可敏感地反映出植物的生长、繁殖以及代谢活动的变化[24],施加菌肥后,根际土壤微生物必然会发生变化,根际微生物的组成和结构变化对植物的生长发育、营养吸收和抗逆性等都会产生影响。同时,由于多方面的作用,土壤理化性质也可能发生相应的改变。因此,研究根际土壤微生物群落结构及土壤理化性质的变化可以快速推测出所用菌肥对华重楼生长的影响。
本研究选用两种常用的微生物菌肥,内含的微生物菌种分别为枯草芽孢杆菌(Bacillus subtilis)和解淀粉芽孢杆菌(B.amyloliquefaciens)[25]。枯草芽孢杆菌是芽孢杆菌属中的一种革兰氏阳性菌,其分泌的脂肽类、抗菌蛋白、酚类及多烯类等抗菌物质具有抑制病原真菌的效果[26, 27];解淀粉芽孢杆菌对植物病原菌具有很强的抑制力,其产生的酶类、脂肽类抗生素、生物表面活性素、聚酮类化合物和抑菌蛋白,在生物防治应用中对植物病原真菌、细菌、病毒、线虫的抑制起主要作用,同时能够促进植物根系及植株生长,并具有诱导植物产生系统抗性的能力,从而减少病害的发生[28-30]。本研究通过高通量测序技术分析使用不同菌肥后华重楼根际土壤微生物的变化,筛选出适合华重楼生长的微生物菌肥种类,为华重楼的人工栽培技术提供理论依据。
1 材料与方法 1.1 植物材料以引种至广西植物研究所内1年半、根茎刻痕数为5个的华重楼为实验材料。
1.2 微生物菌肥类型枯草芽孢杆菌:水剂,有效活菌数≥10亿/g;解淀粉芽孢杆菌:粉剂,有效活菌数≥10亿/g,含有机质≥65%。
1.3 实验设计2019年3-10月完成田间实验,选取长势一致的华重楼,分为4个处理组,每个处理组种植30株。处理组1 (J1):仅施用枯草芽孢杆菌,施用浓度为6 g/m2,施用方式为兑水灌根;处理组2 (J2):仅施用解淀粉芽孢杆菌,施用浓度为120 g/m2, 施用方式为拌土围根;处理组3 (J3):两种微生物菌肥混施,其中枯草芽孢杆菌施用浓度为6 g/m2, 施用方式为兑水灌根,解淀粉芽孢杆菌施用浓度为120 g/m2, 施用方式为拌土围根;处理组4 (J4):不施菌肥,为对照处理组。各处理3次重复,施肥后按常规方法管理。
1.4 土壤样品采集与处理当年11月于每个处理组随机选取华重楼10株,抖去根系上附着颗粒较大的土壤,收集根系以及附着的土壤即为根际土,将混合均匀的根际土壤放入无菌塑料袋中,用标签记录采样的信息,放入户外保鲜箱后立即带回实验室,每个采样点3次重复。采集的土壤一份置于-80℃下保存,用于土壤DNA提取及后续的细菌16S rDNA和真菌18S rDNA测序;一份室内自然风干,研磨,过2 mm筛,用于土壤理化性质测定。
1.5 测定方法土壤理化性质测定参照《土壤农化分析》[31],测定项目和方法如下:全氮TN (凯氏定氮法)、全磷TP(钼锑显色法)、全钾TK (火焰光度法或原子吸收分光光度法)、土壤有机碳TOC (重铬酸钾水合加热法)、铵态氮A和硝态氮N (定氮仪法)、速效磷AP(盐酸-氟化铵法)、速效钾AK (浸提+原子吸收法)和pH值。
土壤微生物DNA提取和测序:使用土壤基因组DNA快速抽提试剂盒[生工生物工程(上海)股份有限公司]提取土壤微生物总DNA,DNA送到上海美吉生物医药科技有限公司进行测序。整个测序流程包括PCR扩增,PCR产物的混样、纯化,文库的构建。对细菌V3-V4区进行扩增,引物采用338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)。扩增程序如下:95℃预变性3 min;95℃变性30 s,53℃退火30 s,72℃延伸45 s,持续28个循环周期;72℃延伸10 min。对真菌V5-V7区进行扩增,引物采用SSU0817F(5′-TTAGCATGGAATAATRRAATA-GGA-3′)和1196R (5′-TCTGGACCTGGTGAGTTTCC-3′),扩增程序如下:95℃预变性3 min;95℃变性30 s,53℃退火30 s,72℃延伸45 s,持续37个循环周期;72℃延伸10 min。本研究利用Illumina平台进行测序。
1.6 微生物组测序数据质控与分析对测序得到的原始数据进行拼接质控,得到有效数据。采用Uparse软件平台进行操作分类单元(Operational Taxonomic Units,OTU)聚类和物种信息分析。OTU聚类步骤如下:(1)对优化序列提取非重复序列,便于降低分析中间过程冗余计算量;(2)去除没有重复的单序列;(3)按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列;(4)将所有优化序列map至OTU代表序列,选出与代表序列相似性在97%以上的序列,生成OTU表格。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。
1.7 华重楼根际土壤微生物组成分析基于测序的数据,利用R语言工具生成土壤微生物群落柱形图(Bar图);利用Mothur软件分析随机抽样下的Alpha多样性指数来反映微生物群落的丰富度和多样性,包括Ace、Chao、Simpson和Shannon指数。Ace和Chao指数反映群落中物种的数量,衡量群落的丰富度;Simpson和Shannon指数受样品群落的物种丰富度和均匀度影响,反映群落的多样性。Ace、Chao和Shannon指数越大,Simpson指数越小,说明样品的物种多样性越高。Venn图可用于统计多组或多个样本中所共有和独有的OTU数目,采用R语言工具和作图生成。
1.8 华重楼根际土壤微生物群落结构差异性分析利用Beta多样性对不同样品微生物群落间的物种多样性进行比较分析,探索不同样品间群落组成的相似性或差异性。用Qiime计算Beta多样性距离矩阵,然后用R语言作图画树。
1.9 数据处理采用单因素方差分析进行差异显著性检验,显著性水平设置为0.05,用最小显著性差异法(Least Significant Difference,LSD)进行多重比较分析,以上分析在SPSS 21.0软件上运行,用Excel 2010进行数据整理和统计。
2 结果与分析 2.1 施用菌肥后土壤微生物群落组成差异分析 2.1.1 施用菌肥后细菌群落组成差异分析华重楼土壤样品中共检测出细菌23门57纲125目185科284属525种,各实验样地细菌门(Phylum)和纲(Class)水平的群落结构如图 1所示。从门水平上(图 1a)看,根际土壤中主要优势菌门为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)。在门水平上,与对照组(J4)相比,施加枯草芽孢杆菌(J1)使变形菌门、放线菌门的丰度升高,酸杆菌门、绿弯菌门丰度降低;而施加解淀粉芽孢杆菌(J2)则会降低变形菌门、放线菌门的丰度,使酸杆菌门、绿弯菌门丰度增加。另外,所有施加菌肥的处理组均会显著降低芽单胞菌门(Gemmatimonadetes)的丰度,而使厚壁菌门(Firmicutes)的丰度增加。枯草芽孢杆菌比解淀粉芽孢杆菌更利于厚壁菌门的生长,但两种菌肥同施(J3)会引起厚壁菌门丰度下降。通过纲分类层次(图 1b)统计,根际土壤中以放线菌纲(Actinobacteria)、γ-变形菌纲(Gamma-proteobacteria)及α-变形菌纲(Alpha-proteobacteria)为优势菌纲。

|
| 图 1 在门(a)、纲(b)水平上华重楼根际土壤细菌的相对丰度 Fig. 1 Relative abundance of bacteria in the rhizosphere of P.polyphylla var.chinensis at phylum (a) and class (b) level |
2.1.2 施用菌肥后真菌群落组成差异分析
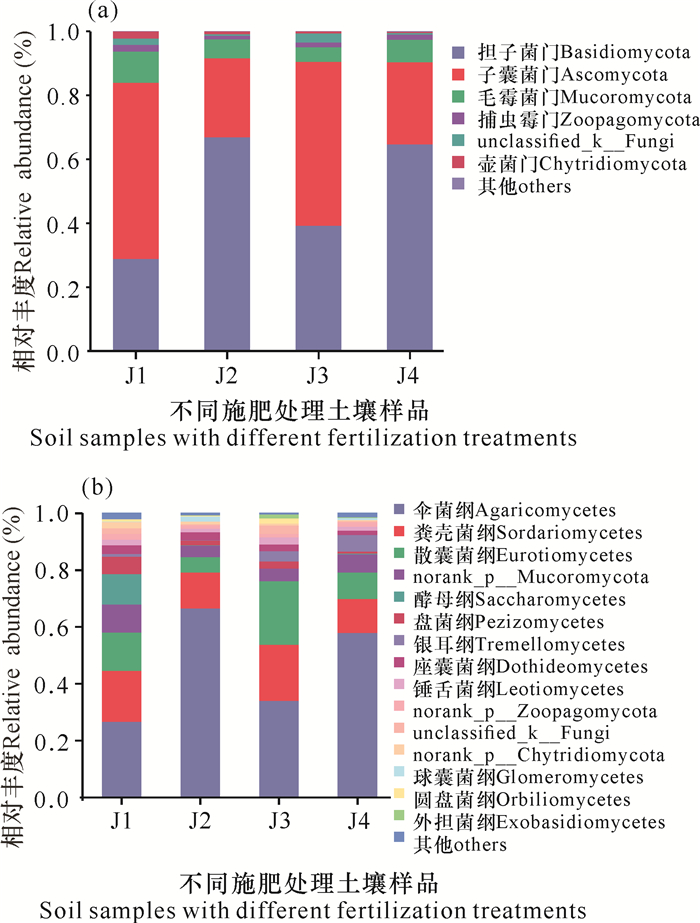
华重楼土壤样品中共检测出真菌8门26纲54目66科69属82种,各处理组真菌门和纲水平的群落结构如图 2所示。从门水平上(图 2a)看,土壤中的真菌主要由担子菌门(Basidiomycota)、子囊菌门(Ascomycota)与毛霉门(Mucoromycota)组成。在门水平上,与对照组(J4)相比,施加枯草芽孢杆菌(J1)后担子菌门的丰度显著降低,同时子囊菌门丰度显著增加,单施解淀粉芽孢杆菌(J2)则对担子菌门及子囊菌门丰度影响不大。两种菌肥混施(J3)时,同样会引起担子菌门丰度显著下降、子囊菌门丰度显著提高,但幅度相对单施枯草芽孢杆菌有所下降,表明混施时枯草芽孢杆菌对担子菌门和子囊菌门丰度的变化起主要作用,解淀粉芽孢杆菌可以缓解枯草芽孢杆菌对担子菌门和子囊菌门的作用。枯草芽孢杆菌对毛霉菌门的生长有促进作用,而解淀粉芽孢杆菌则会抑制毛霉菌门的生长,二者混施时,会导致毛霉菌门丰度显著下降。在纲水平上(图 2b),以伞菌纲(Agaricomycetes)、粪壳菌纲(Sordariomycetes)和散囊菌纲(Eurotiomycetes)为优势菌纲。其中,施加枯草芽孢杆菌会显著降低伞菌纲的丰度,但会促进粪壳菌纲和散囊菌纲真菌的生长;而解淀粉芽孢杆菌则可以显著提高伞菌纲真菌的丰度,抑制散囊菌纲真菌的生长。
|
| 图 2 在门(a)、纲(b)水平上华重楼根际土壤真菌的相对丰度 Fig. 2 Relative abundance of fungi in the rhizosphere of P.polyphylla var.chinensis at phylum (a) and class (b) level |
2.2 施用菌肥后土壤微生物群落的多样性差异分析 2.2.1 施用菌肥后细菌群落的多样性差异分析
供试土壤样品的细菌群落丰度指数(Ace,Chao)和多样性指数(Simpson,Shannon)如表 1所示。在丰度方面,单施枯草芽孢杆菌(J1)与两种菌肥混施(J3)处理组细菌的Ace、Chao指数均低于对照组(J4),表明这两种处理方式可能抑制了细菌的生长,造成细菌数量(丰度)显著降低(P < 0.05),单施枯草芽孢杆菌的抑菌效果更为明显。而单施解淀粉芽孢杆菌(J2)时,土壤中Ace、Chao指数均为最高,表明施加解淀粉芽孢杆菌可以促进土壤中细菌的生长,但与对照组相比差异不显著(P>0.05)。
| 处理组 Treatment groups |
细菌Bacteria | 真菌Fungi | |||||||
| Ace指数 Ace index |
Chao指数 Chao index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
Ace指数 Ace index |
Chao指数 Chao index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
||
| J1 | 1 291.26±31.85c | 1 309.73±35.74c | 6.04±0.07b | 0.017 1±0.000 2a | 126.64±7.64a | 125.14±13.71a | 3.50±0.07a | 0.049 4±0.000 2d | |
| J2 | 2 219.01±57.76a | 2 247.67±30.61a | 6.58±0.07a | 0.003 4±0.000 2b | 117.83±11.30a | 125.33±19.56a | 2.29±0.06d | 0.313 1±0.000 3a | |
| J3 | 1 802.93±55.77b | 1 842.20±23.30b | 6.59±0.08a | 0.002 9±0.000 2c | 111.04±12.86a | 100.60±14.86a | 2.95±0.08c | 0.110 6±0.000 4b | |
| J4 | 2 208.99±43.67a | 2 218.05±43.69a | 6.55±0.05a | 0.003 2±0.000 2bc | 136.93±13.28a | 142.00±24.32a | 3.11±0.06b | 0.083 2±0.000 4c | |
| 注:同列中数值后面的不同小写字母表示差异显著(P < 0.05) Note: Different lowercase letters behind numeric values in the same column indicate significant differences (P < 0.05) | |||||||||
在多样性方面,施加枯草芽孢杆菌后,土壤中细菌Shannon指数较对照组显著下降(P < 0.05),而Simpson指数则显著升高(P < 0.05),表明单施枯草芽孢杆菌会导致土壤中细菌种类减少,细菌多样性降低。而施加解淀粉芽孢杆菌(J2)与两种菌肥混施(J3)的处理组中,Shannon指数和Simpson指数与对照组相比差异不显著(P>0.05),表明这两种处理方式并未造成细菌物种种类的变化。
2.2.2 施用菌肥后真菌群落的多样性差异分析供试土壤样品的真菌群落丰度指数(Ace,Chao)和多样性指数(Simpson,Shannon)亦如表 1所示。在丰度方面,各施加菌肥的处理组根际土壤中真菌Ace、Chao指数均比对照组低,表明施加菌肥会抑制真菌的生长,造成真菌数量下降,导致真菌丰富度降低,但各处理组间真菌丰度差异不显著(P>0.05)。
在多样性方面,施加枯草芽孢杆菌后真菌Shannon指数高于对照组,且是4个处理组中最高的,而Simpson指数则是最低的,表明施加枯草芽孢杆菌后土壤真菌物种数量增多,真菌多样性升高。施加解淀粉芽孢杆菌与两种菌肥混施的处理组中真菌Shannon指数均小于对照组,而Simpson指数与对照组相比有所增加,表明真菌物种数量减少,多样性降低。
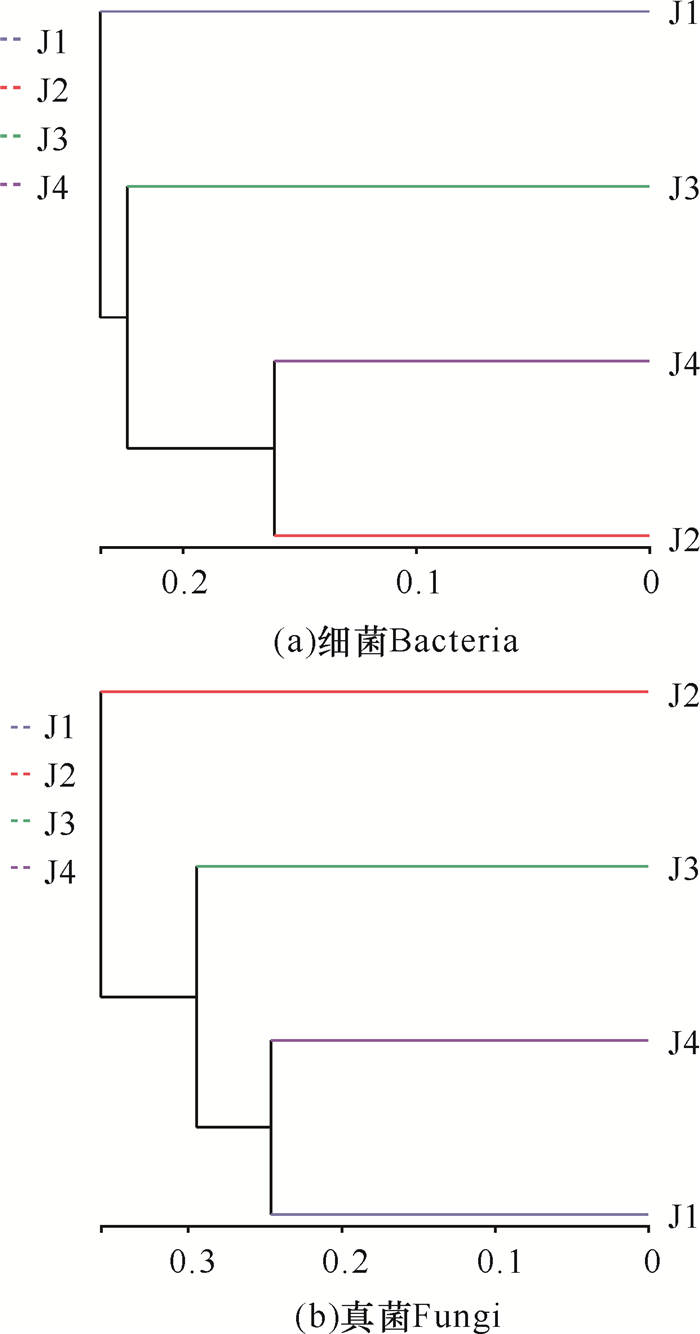
2.3 施用菌肥后土壤微生物Beta多样性差异分析细菌聚类分析(图 3a)结果显示,根际土壤中的细菌划分为3个类群:单施解淀粉芽孢杆菌土壤(J2)和不施肥土壤(J4)、单施枯草芽孢杆菌土壤(J1)、两种菌肥混施土壤(J3),表明单施解淀粉芽孢杆菌时细菌组成与对照组相近,各组之间的距离则表明单施枯草芽孢杆菌时细菌群落构成变化最大。真菌聚类分析(图 3b)结果显示,真菌也划分为3个类群:单施枯草芽孢杆菌土壤(J1)和不施肥土壤(J4),单施解淀粉芽孢杆菌土壤(J2)、两种菌肥混施土壤(J3),表明单施枯草芽孢杆菌时真菌群落结构与对照组相近,而各组之间的距离则表明单施解淀粉芽孢杆菌时真菌群落构成变化最大。综上可知,枯草芽孢杆菌主要影响华重楼根际土壤中细菌的组成,而解淀粉芽孢杆菌则主要影响真菌的组成。
|
| 图 3 不同施肥处理根际土壤微生物UPGMA聚类分析 Fig. 3 UPGMA cluster analysis of microorganisms in rhizosphere soil under different fertilization treatments |
2.4 施用菌肥后土壤微生物群落的相关性差异分析
在97%的相似度下聚类,得到各处理组土壤样品的OTU数。从表 2可知,各土壤样品的细菌OTU数均高于真菌OTU数。各施肥处理组中,单施解淀粉芽孢杆菌(J2)细菌OTU数略高于对照组,而单施枯草芽孢杆菌(J1)和两种菌肥混施(J3)土壤中细菌OTU数与对照组(J4)相比分别下降36.08%和14.08%。各处理组真菌OTU数较对照组均有降低,其中两种菌肥混施处理组真菌OTU数降幅最大,下降约35.11%;单施解淀粉芽孢杆菌(J2)处理组下降约18.32%;单施枯草芽孢杆菌下降约8.40%。上述结果说明,两种菌肥混施对真菌OTU数目会产生叠加的抑制效果。
| 处理组 Treatment groups |
细菌(V3-V4区) OTU数 OTU number of bacteria (V3-V4) |
真菌(V5-V7区) OTU数 OTU number of fungi (V5-V7) |
| J1 | 1 258 | 120 |
| J2 | 1 989 | 107 |
| J3 | 1 691 | 85 |
| J4 | 1 968 | 131 |
从细菌OTU韦恩图(图 4a)可知,经不同施肥处理的华重楼根际土壤共有的细菌OTU数为846个,分别占各处理组总OTU数的67.25%、42.53%、50.03%和42.99%;J1、J2、J3和J4特有的细菌OTU数分别为47,138,109和134个,分别占各处理组总OTU数的3.74%、6.94%、6.45%和6.81%,说明枯草芽孢杆菌对细菌的影响大于解淀粉芽孢杆菌,解淀粉芽孢杆菌土壤中的细菌组成与不施肥处理组更接近。
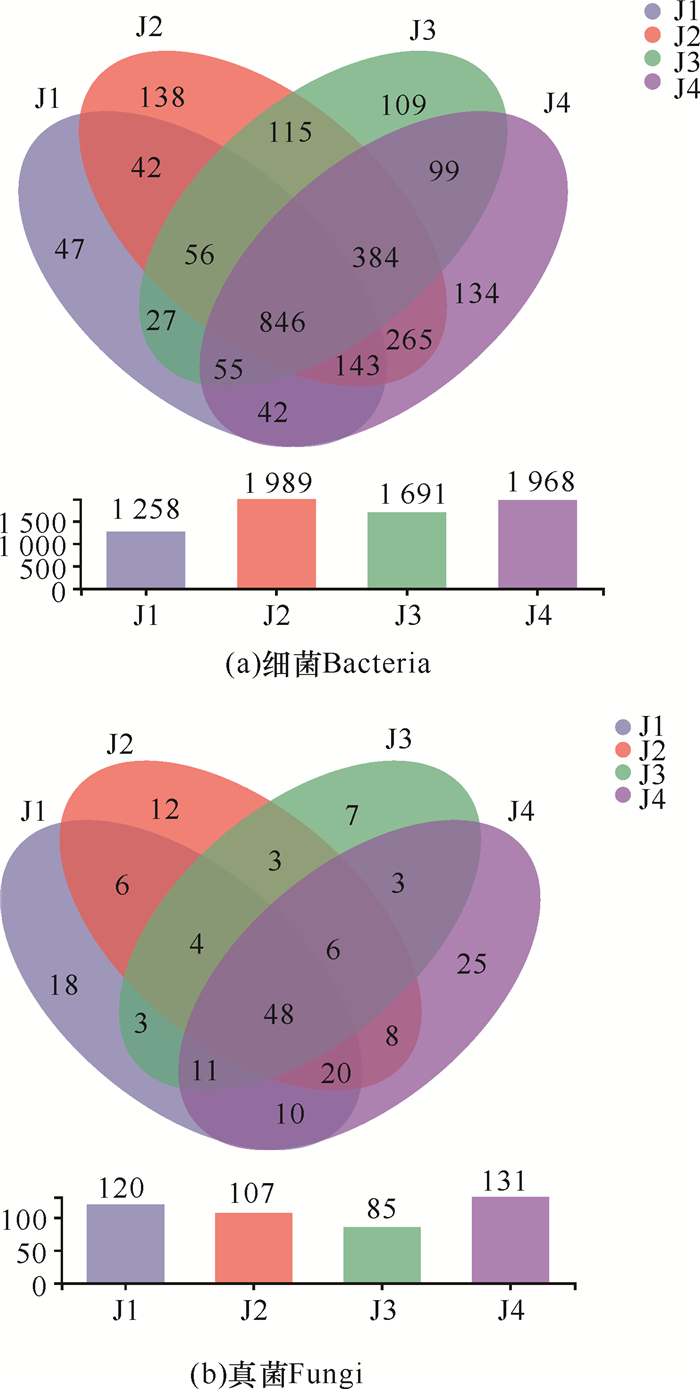
|
| 图 4 不同施肥处理根际土壤细菌和真菌OTU韦恩图 Fig. 4 Venn diagram of bacteria and fungi OTU in the rhizosphere soil under different fertilization treatments |
从真菌OTU韦恩图(图 4b)可以看出,各处理组共有的真菌OTU数为48个,分别占各处理组总OTU数的40.00%、44.86%、56.47%和36.64%;J1、J2、J3和J4特有的真菌OTU数分别为18,12,7和25个,分别占各处理组总OTU数的15.00%、11.21%、8.24%和19.08%。经施肥后各处理组特有的真菌OTU数均比对照组低,且两种菌肥混施时下降最多。枯草芽孢杆菌处理组(J1)土壤中真菌组成与不施肥处理组更为接近,两种菌肥处理比单一菌肥处理对真菌组成影响更大。
经不同施肥处理的华重楼根际土壤共有的细菌OTU数为846个,未施肥土壤中特有的细菌OTU数为134个,分别占未施肥土壤细菌总OTU数的42.99%和6.81%;而各处理组共有的真菌OTU数为48个,未施肥土壤中特有的真菌OTU数为25个,分别占未施肥土壤真菌总OTU数的36.64%和19.08%。对照组土壤中共有真菌OTU比例低于细菌,而特有真菌OTU比例高于细菌,表明施肥后根际土壤真菌OTU类型变化比细菌大。
2.5 施用菌肥对华重楼根际土壤理化性质的影响对不同施肥处理的华重楼根系土壤中的全氮(TN)、全磷(TP)、全钾(TK)、土壤有机碳(TOC)、铵态氮(A)、硝态氮(N)、速效磷(AP)和速效钾(AK)等指标进行测定(表 3),并根据1980年全国第2次土壤普查养分分级标准[32]进行评价。由表 3可知,J4样地土壤中除TN和TK处于缺乏状态外,TP、TOC、AK及AP均处于较丰以上水平,pH值为6.14,适宜华重楼生长。与对照组(J4)相比,施加菌肥后TK、TOC、N及AK水平显著下降(P < 0.05),而pH值显著上升(P < 0.05)。其中,施用枯草芽孢杆菌(J1)和两种菌肥混施(J3)处理组中TN含量显著下降至极缺水平,特别是两种菌肥混施时TN含量与对照组相比下降66.15%;而施加解淀粉芽孢杆菌后TN含量显著上升(P < 0.05),约为未施肥处理组的2倍。另外,两种菌肥混施还会使AP含量显著降低(P < 0.05),TP含量也有下降,但未达显著水平(P>0.05)。综合比较后发现,两种菌肥混施时,土壤理化性质中除pH值显著上升外,其余指标均显著下降,且TN、TP、TOC、A、N、AP及AK均为各处理组中最低水平;单施枯草芽孢杆菌时,TP、AP及pH值较对照组有所上升;而单施解淀粉芽孢杆菌时,TK含量最低,TN、TP、AP及pH值较对照组有所上升,其中TN、AP及pH值为各处理组中最高水平。
| 处理组 Treatment groups |
全氮TN (g/kg) |
全磷TP (g/kg) |
全钾TK (g/kg) |
有机碳TOC (g/kg) |
铵态氮A (mg/kg) |
硝态氮N (mg/kg) |
速效磷AP (mg/kg) |
速效钾AK (mg/kg) |
pH值 pH value |
| J1 | (0.43±0.06F)c | (0.99±0.13B)a | (4.37±0.22F)b | (22.27±2.08C)b | (43.88±2.30)a | (90.80±5.67)b | (85.80±6.52A)a | (262.95±28.20A)b | (6.51±0.07)b |
| J2 | (1.22±0.15C)a | (0.97±0.11B)a | (3.97±0.17F)c | (22.53±2.72C)b | (45.84±2.74)a | (104.40±13.11)b | (94.76±6.91A)a | (180.00±13.08B)c | (6.92±0.07)a |
| J3 | (0.22±0.04F)d | (0.76±0.11B)a | (4.17±0.16F)bc | (21.94±1.40C)b | (35.12±1.26)b | (88.40±11.57)b | (59.16±5.71A)c | (138.55±13.09C)d | (6.87±0.05)a |
| J4 | (0.65±0.11E)b | (0.94±0.04B)a | (5.78±0.11E)a | (32.05±2.74B)a | (43.36±1.14)a | (129.20±11.04)a | (72.70±7.86A)b | (361.45±17.44A)a | (6.14±0.02)c |
| 注:同列中数值后面的不同字母A,B,C,D,E,F分别表示土壤养分评价水平:丰富、较丰、中等、较缺、缺乏和极缺。同列中数值后面的不同小写字母表示差异显著(P < 0.05) Note: Letters A, B, C, D, E and F behind numeric values in the same column respectively indicates the level of soil nutrient evaluation: Rich, richer, medium, deficient, more deficient and extremely deficient.The different lowercase letters behind numeric values in the same column indicate significant differences (P < 0.05) | |||||||||
3 讨论 3.1 不同微生物菌肥对华重楼根际土壤微生物的影响
土壤微生物数量和活性是衡量土壤质量的重要指标之一,土壤微生物的种类和数量可以作为评价土壤肥力的指标[33]。本研究发现,枯草芽孢杆菌和解淀粉芽孢杆菌对华重楼根际土壤中细菌与真菌的影响不同。枯草芽孢杆菌会显著抑制华重楼根际土壤中细菌的生长,引起细菌丰富度和多样性显著降低;同时对真菌的生长也有一定抑制作用,造成真菌总体丰富度略有降低,但显著增加真菌物种的数量,提高真菌物种的多样性,这与高吉坤[34]、樊胜南等[35]的研究结果有所差异。解淀粉芽孢杆菌对华重楼根际土壤中细菌无显著影响,与枯草芽孢杆菌混施时还可以缓和其对细菌丰度的影响,同时提高细菌的多样性。胡基华等[36]研究发现,解淀粉芽孢杆菌能显著降低土壤中真菌数量,而本研究中解淀粉芽孢杆菌虽未能显著降低土壤中真菌个体数量,但却显著降低土壤中真菌的物种数量。造成上述差异的原因可能与菌肥施用浓度、施用组合和施用方式有关。于会丽等[37]研究发现,随着微生物菌肥用量增加,土壤微生物活性和多样性指数呈先增加后降低的趋势。黎妍妍等[38]研究结果表明,不同菌肥施用方式对烟株根际土壤真菌群落结果有显著影响,拌土围根、米糠+拌土围根这两种方式均可显著提高烟株根际土壤真菌的数量和群落多样性。因此,在实际生产栽培中应根据华重楼根际土壤微生物的状况,正确选择适宜的微生物菌肥浓度、组合及施用方式。
3.2 不同微生物菌肥对华重楼根际土壤理化性质的影响土壤养分是土壤质量的重要指标之一,合理的养分含量对植物生长至关重要[39]。土壤酸化会引起连作障碍,而连作障碍又会导致中药材低产、低质、低效[40]。毛玉东等[41]研究发现,华重楼根茎总皂苷含量随土壤pH值升高而增加,并建议在华重楼人工栽培中,土壤pH值应控制在中性范围(6.50-7.50)内。本研究中与不施肥组相比,施加两种菌肥后所有处理组根际土壤的pH值显著上升,说明施加微生物菌肥可预防连作障碍的发生,同时也可将土壤的pH调节至更适合华重楼生长的水平。微生物菌肥可以促进植物的营养吸收,使植物品质改善,从而使产量提高[42]。本研究中,施加两种微生物菌肥后土壤中TK、TOC、A、N及AK等水平显著下降,可能是微生物菌肥可促进华重楼根系对这些营养元素的吸收,从而导致碳、氮、钾元素在土壤中的含量减少,尤其以两种菌肥混施时,促进营养吸收效果最好。而单施解淀粉芽孢杆菌时,土壤中TN含量显著上升,可能是解淀粉芽孢杆菌促进了固氮菌类的生长,从而使土壤中的氮素含量显著增加[43]。也有研究表明,微生物菌肥在分解有机质时需要合成蛋白质,从而需要一定量的氮素,因此土壤中必须保证含有充足的有机质和氮肥, 如果土壤营养含量不足,可能会造成一定程度的脱肥[44],这也可能是导致施肥后部分营养元素下降的原因。目前关于微生物菌肥与植物、根际土壤理化性质的作用机理尚不明确,仍有待进一步研究。
4 结论本研究表明,枯草芽孢杆菌和解淀粉芽孢杆菌对华重楼根际土壤微生物群落结构和多样性影响不同,施加微生物菌肥后会引起根际土壤理化性质发生显著变化。施用本研究浓度的枯草芽孢杆菌会引起细菌丰富度和多样性下降而真菌群落多样性显著升高,促使土壤由髙肥力的“细菌型”向低肥力的“真菌型”转变,可能会增加病虫害发生的概率,导致作物产量及质量下降等负面影响;施用解淀粉芽孢杆菌对细菌丰富度和多样性影响不显著,却能显著降低真菌的多样性;两种菌肥混施还能中和枯草芽孢杆菌对细菌的抑制作用,提升细菌的多样性,这为今后的研究提供了思路和方向。本研究结果为进一步探索适合华重楼人工栽培的微生物菌肥奠定了基础,有助于促进华重楼的可持续利用及产业的发展。
| [1] |
汤海峰, 赵越平, 蒋永培. 重楼属植物的研究概况[J]. 中草药, 1998, 29(12): 839-842. DOI:10.3321/j.issn:0253-2670.1998.12.022 |
| [2] |
袁理春, 陈翠, 杨丽云, 等. 滇重楼根状茎繁殖诱导初报[J]. 中药材, 2004, 27(7): 477. DOI:10.3321/j.issn:1001-4454.2004.07.005 |
| [3] |
李运昌. 滇重楼的无性繁殖[J]. 云南植物研究, 1986, 8(4): 429-435. |
| [4] |
NIHORIMBERE V, ONGENA M, SMARGIASSI M, et al. Beneficial effect of the rhizosphere microbial community for plant growth and health[J]. Biotechnology Agronomy and Society and Environment, 2011, 15(2): 327-337. |
| [5] |
苏泽春, 王泽清, 李兆光, 等. 云南重楼的高产优质栽培技术初探[J]. 江西农业学报, 2015, 27(1): 61-65. DOI:10.3969/j.issn.1001-8581.2015.01.017 |
| [6] |
杨永红, 戴丽君, 何昆鸿, 等. 土壤营养与人工栽培滇重楼品质相关性评价[J]. 中药材, 2012, 35(10): 1557-1561. |
| [7] |
郑钦方, 肖聪颖, 周文斌, 等. 雪峰山七叶一枝花栽培技术研究[J]. 时珍国医国药, 2016, 27(5): 1220-1221. |
| [8] |
李伟, 陈国典, 周永强, 等. 伏牛山区栎类林下套种七叶一枝花技术[J]. 河南林业科技, 2020, 40(2): 49-50, 56. DOI:10.3969/j.issn.1003-2630.2020.02.015 |
| [9] |
刘哲, 钟海蓉, 威则日沙, 等. 氮, 磷, 钾配施对华重楼根茎的产量和有效成分含量的影响[J]. 中草药, 2019, 50(24): 6103-6113. DOI:10.7501/j.issn.0253-2670.2019.24.027 |
| [10] |
张淑花, 周利军, 贾森. 生物菌肥对中型土壤动物群落结构的影响[J]. 河南农业科学, 2019, 48(8): 68-73. |
| [11] |
朱丹, 张磊, 韦泽秀, 等. 菌肥对青稞根际土壤理化性质以及微生物群落的影响[J]. 土壤学报, 2014, 51(3): 627-637. |
| [12] |
阎世江, 李照全, 张治家. 生物菌肥的研究现状与应用[J]. 北方园艺, 2017(5): 189-192. |
| [13] |
李钦, 王引权, 彭桐, 等. 微生物菌肥的研究进展及其在中药材生产中的应用[J]. 农业与技术, 2020, 40(19): 1-4. |
| [14] |
SUTTON-GRIER A E, HO M, RICHARDSON C J. Organic amendments improve soil conditions and denitrification in a restored riparian wetland[J]. Wetlands, 2009, 29(1): 343-352. DOI:10.1672/08-70.1 |
| [15] |
DEBSKA B, DLUGOSZ J, PIOTROWSKA-DLUGOSZ A, et al. The impact of a biofertilizer on the soil organic matter status and carbon sequestration results from a field-scale study[J]. Journal of Soils and Sediments, 2016, 16(10): 2335-2343. DOI:10.1007/s11368-016-1430-5 |
| [16] |
ASERI G K, JAIN N, PANWAR J, et al. Biofertilizers improve plant growth, fruit yield, nutrition, metabolism and rhizosphere enzyme activities of Pomegranate (Punica granatum L.) in Indian Thar Desert[J]. Scientia Horticulturae, 2008, 117(2): 130-135. DOI:10.1016/j.scienta.2008.03.014 |
| [17] |
TRILLAS M I, CASANOVA E, COTXARRERA L, et al. Composts from agricultural waste and the Trichoderma asperellum strain T-34 suppress Rhizoctonia solani in cucumber seedlings[J]. Biological Control, 2006, 39(1): 32-38. DOI:10.1016/j.biocontrol.2006.05.007 |
| [18] |
牛玮浩. 人参菌肥对人参生长及根际微生态的影响[D]. 烟台: 鲁东大学, 2017.
|
| [19] |
张晟. 微生物肥料对枸杞种植地土壤生态特征及理化性质的影响[J]. 林业科技通讯, 2018(3): 71-72. |
| [20] |
祝英, 彭轶楠, 巩晓芳, 等. 不同微生物菌剂对当归苗生长及根际土微生物和养分的影响[J]. 应用与环境生物学报, 2017, 23(3): 511-519. |
| [21] |
马红红, 陈宝燕, 杨涛, 等. 不同施肥方式对伊贝母生长及土壤养分的影响[J]. 新疆农业科学, 2017, 54(2): 281-288. |
| [22] |
CAMPRUBI A, ESTAUN V, NOGALES A, et al. Response of the grapevine rootstock Richter 110 to inoculation with native and selected arbuscular mycorrhizal fungi and growth performance in a replant vineyard[J]. Mycorrhiza, 2008, 18(4): 211-216. DOI:10.1007/s00572-008-0168-3 |
| [23] |
PÉREZ-PIQUERES A, EDEL-HERMANN V, ALABOUVETTE C, et al. Response of soil microbial communities to compost amendments[J]. Soil Biology & Biochemistry, 2006, 38(3): 460-470. |
| [24] |
HIRSCH P R, MAUCHLINE T H, CLARK I M. Culture-independent molecular techniques for soil microbial ecology[J]. Soil Biology & Biochemistry, 2010, 42(6): 878-887. |
| [25] |
任建国, 王益, 刘红美, 等. 菌肥拌种对太子参生长及品质的影响[J]. 江苏农业科学, 2019, 47(7): 116-120. |
| [26] |
戴美松, 王月志, 蔡丹英, 等. 我国微生物菌肥登记现状及其在果树减肥增效中的应用[J]. 浙江农业科学, 2021, 62(2): 241-246. |
| [27] |
张彩凤. 生防菌枯草芽孢杆菌的研究进展[J]. 现代农村科技, 2015(21): 47. DOI:10.3969/j.issn.1674-5329.2015.21.039 |
| [28] |
闫杨, 刘月静, 陈芳. 枯草芽孢杆菌的应用现状概述[J]. 生物学教学, 2019, 44(2): 2-3. DOI:10.3969/j.issn.1004-7549.2019.02.001 |
| [29] |
王世伟, 王卿惠, 翟丽萍, 等. 解淀粉芽胞杆菌抗真菌活性研究进展[J]. 中国微生态学杂志, 2020, 32(8): 971-978, 982. |
| [30] |
吕前前, 赵兴刚, 王东东, 等. 解淀粉芽孢杆菌BaA-007鉴定及其对苹果腐烂病的抑制作用[J]. 园艺学报, 2020, 47(10): 1895-1904. |
| [31] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 14.
|
| [32] |
易海艳, 马刘峰, 林宁, 等. 新疆叶尔羌河流域棉田土壤养分分析与评价[J]. 江苏农业科学, 2015, 43(7): 393-396. |
| [33] |
焦晓丹, 吴凤芝. 土壤微生物多样性研究方法的进展[J]. 土壤通报, 2004, 35(6): 789-792. DOI:10.3321/j.issn:0564-3945.2004.06.026 |
| [34] |
高吉坤, 曹旭, 于丽萍, 等. 枯草芽孢杆菌B29对黄瓜根际土壤微生物的影响[J]. 安徽农业科学, 2013, 41(7): 2922-2923, 2947. DOI:10.3969/j.issn.0517-6611.2013.07.041 |
| [35] |
樊胜南, 喻国辉, 陈燕红, 等. 枯草芽孢杆菌TR21可湿性粉剂对香蕉根际土壤微生物的影响[J]. 广东农业科学, 2018, 45(10): 68-73. |
| [36] |
胡基华, 李晶, 张淑梅, 等. 解淀粉芽孢杆菌TF28对设施连作黄瓜根际土壤酶活性和微生物的调节[J]. 江苏农业科学, 2020, 48(7): 152-156. |
| [37] |
于会丽, 徐国益, 徐变变, 等. 施用生物菌肥对桃园土壤养分及微生物功能多样性的影响[J]. 干旱地区农业研究, 2020, 38(6): 91-97. |
| [38] |
黎妍妍, 王林, 彭五星, 等. 解淀粉芽孢杆菌施用方式对烟株根际土壤真菌群落的影响[J]. 中国烟草科学, 2020, 41(4): 1-6. |
| [39] |
郭萍, 文庭池, 董玲玲, 等. 施肥对土壤养分含量、微生物数量和酶活性的影响[J]. 农业现代化研究, 2011, 32(3): 362-366. DOI:10.3969/j.issn.1000-0275.2011.03.025 |
| [40] |
周芳, 曹国璠, 李金玲, 等. 药用植物连作障碍机制及其缓解措施研究进展[J]. 山地农业生物学报, 2019, 38(3): 67-72. |
| [41] |
毛玉东, 梁社往, 何忠俊, 等. 土壤pH对滇重楼生长, 养分含量和总皂甙含量的影响[J]. 西南农业学报, 2011, 24(3): 985-989. DOI:10.3969/j.issn.1001-4829.2011.03.031 |
| [42] |
武兴友. 微生物菌肥对农业生产的影响及研究趋势分析[J]. 中国果菜, 2018, 38(4): 9-11, 15. |
| [43] |
康林玉, 刘周斌, 欧立军, 等. 土壤微生物促进作物生长发育研究进展[J]. 湖南农业科学, 2017, 3(7): 113-116. |
| [44] |
褚义红. 不同微生物菌肥对温室生菜生长、品质、产量及氮素积累的影响[D]. 呼和浩特: 内蒙古农业大学, 2014.
|



