2. 广西科学院, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynethesis Chemistry, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
目前,我国耕地土壤重金属污染形势严峻,污染面积大,且污染重金属种类多、含量高,全国重金属污染耕地约2 000 hm2,约占全国总耕地面积的16.7%,部分污染严重的耕地,重金属含量可高达安全限值的100倍[1]。重金属污染物的生物毒性大,易与化肥、农药以及抗生素等有机物结合,生成更具毒性的有机金属化合物,极大影响并危害生物体正常生长。再者,重金属污染物吸附在土壤颗粒上,既降低土壤微生物活性、抑制植物根系对营养元素吸收,也极易被农作物吸收富集[2, 3]。基于重金属污染物的迁移、富集特性,生物体中的重金属浓度可能倍增至生境中的上万倍,而重金属沿食物链逐级进入人体内并长期富集积累后,会对人体产生巨大危害,如铅污染会对人体的造血、神经和消化系统有较明显伤害[4],会导致人体四肢酸痛、贫血、神经系统器质性疾病、肝/肾损伤、心血管器质性疾病、智力下降(特别是儿童)及中枢神经和造血系统的损伤等[5];镉污染可能会导致人体的消化系统遭受破坏,肾、肝功能失调,骨质疏松,人体器官致癌致畸[6];六价铬污染会损伤人体呼吸系统,破坏人体细胞中DNA致使细胞畸变[7];铜污染会使人体出现恶心、呕吐、胃烧灼感等症状,重者会出现腹痛、吐血、溶血性黄疸、贫血、肝大、血红蛋白尿、急性肾功能衰竭和尿毒症[7];人类食用钴污染的食品,轻者脱发,重者会引起血液系统疾病[8]。
修复重金属污染的耕地土壤,能有效地将污染源遏制在食物链最底端,其主要途径有去除化和固定(或稳定)化。去除化是将土壤中的重金属污染物提取出去;固定(或稳定)化是改变土壤中重金属的存在形态,以消除生物毒性[9]。其中,微生物修复作为固定(或稳定)化技术中的研究热点,主要是利用微生物对重金属的亲合、吸附、转化效应,降低土壤中重金属的有效浓度。微生物治理法具有成本低、效率高,一般不需要停耕,可进行原位修复,能改善土壤环境、提升土壤肥力等优势;但该方法同时具有对重金属固定性有限、代谢能力不佳、微生物流失或被吞噬等缺点[1, 10, 11]。因此,寻找耐受力强、适用范围广的微生物类型,可对微生物在实际应用中的强化和联合修复工作提供更好的帮助。
假单胞菌群是一类活跃在植物根际的革兰氏阴性菌,能产生多种抗生素,改善植物营养,促进植物生长,降解土壤中有毒物质及起防病杀虫作用等[12]。Wang等[13]研究发现,荧光铜绿假单胞菌Pseudomonas aeruginosa CW-96-1在有氧培养过程中,可以通过沉淀硫化镉去除溶液中99%以上的Cd2+。Pramanik等[14]发现一株Pseudomonas sp.K32对Cd2+、Pb2+和As3+高度耐受,在Cd2+胁迫下表现出固氮和溶磷能力且能产生生长素IAA,促进水稻(Oryza sativa)幼苗生长,同时,对多种植物病原真菌有显著抑制作用及产生大量的功能酶。Liu等[15]研究发现,内生Pseudomonas putida RE02可定植在白三叶(Trifolium repens)根际和根内,对镉、铬和铅金属高度耐受,且能促进植物发芽,提高土壤肥力。Mokrani等[16]研究发现,两株固氮假单胞菌Pseudomonas azotoformans对Cd2+和Pb2+有很强耐受性,且能拮抗多种植物病原菌。此外,鉴于红树林处于海水与淡水交互的特殊地带,其沉积物中富含有机质,且具有一定的厌氧性和还原性,进而可以结合更多的重金属,使其成为重金属污染物的“汇”[17]。故本研究从红树林土壤中分离假单胞菌群,并对其开展重金属耐受活性研究,旨在获得对多种重金属都有高耐受活性的菌株,并检测菌株的修复能力,为微生物修复技术研究提供数据参考。
1 材料与方法 1.1 材料 1.1.1 红树林土壤样本2021年8月初从广西钦州茅尾海红树林保护区(108°36′14″ E,21°44′53″ N)中采集3处土壤样本,待潮水退至最低潮时,从最靠近海端的红树林往回随机采集(每处间隔5 m),样品采集深度为0.5 m,将样品均装于密封袋,于4℃低温保藏备用。
1.1.2 培养基(1) 分离/纯化培养基:2216E固体培养基(青岛高科技工业园海博生物有限公司);改良ISP2固体培养基(麦芽提取粉2.0 g,酵母提取粉2.0 g,葡萄糖2.0 g,去离子水1 000 mL,海盐25.0 g,琼脂14.0 g)。
(2) 重金属耐受实验培养基:改良ISP2培养基,BE培养基(胰蛋白胨10.0 g,去离子水1 000 mL)。分别用去离子水配制6 400 μg/mL的CoCl2、ZnSO4、CdSO4、CuSO4、Pb(NO3)2和K2Cr2O7溶液,无菌过滤后即为重金属离子标准储备液。
1.2 方法 1.2.1 菌株分离纯化称取2.0 g混合样品装于20 mL无菌海水(添加1%的吐温20),180 r/min摇床处理30 min后,稀释成10-2和10-3浓度的样液备用。取200 μL稀释的样液涂布至2216E固体培养基中,28℃培养7 d,挑取肉眼可见菌落进行纯化培养,记录其形态特征和菌落数,以30% (V/V)甘油-ISP2混合液作为保护剂,将纯化好的菌株制成冻存管保藏于-70℃冰箱。
1.2.2 16S rRNA基因测序和系统发育分析采用chelex-100树脂[18]快速提取细菌的DNA作为PCR模板,并根据Walsh等[19]的方法对其进行PCR扩增。扩增和测序引物均为细菌通用引物27F和1492R,PCR反应条件参照李菲等[20]的方法设定。扩增产物经1%琼脂糖凝胶电泳检测合格后,委托北京擎科新业生物技术有限公司进行测序分析。序列经BioEdit Sequence Alignment Editor软件整理后,利用EzBioCloud数据库(https://www.ezbiocloud.net/)进行在线比对[21];选取同源性最高菌株的序列作为参比对象,运用MEGA 10.0软件,采用Neighbor-Joining法构建系统发育树,Boostrap 1 000次检测各分支的置信值,对各菌株的系统发育地位进行分析[22]。
1.2.3 重金属耐受菌的初筛以改良ISP2或BE固体培养基为基础培养基,分别添加6种重金属离子标准储备液使其终浓度为100 μg/mL,将待测菌株划线于该培养基上,28℃培养5 d,观察其生长状况,并记录其结果。
1.2.4 耐受菌的重金属离子最大耐受浓度根据肉汤稀释法[23]测定重金属离子抑制待测菌株的最小抑菌浓度(Minimum Inhibitory Concentration,MIC),即细菌对重金属最大耐受浓度。各取60 μL重金属离子标准储备液分别加入96孔板的第1列,加入60 μL改良ISP2或EB(Pb2+)液体培养基,混合均匀后,吸取60 μL混合液至第2列孔内,再加入60 μL改良ISP2或EB(Pb2+)液体培养基,混合均匀后,吸取60 μL混合液至第3列孔内,以此类推,稀释至第6列孔内。第1至第6列的重金属离子浓度依次为3 200,1 600,800,400,200及100 μg/mL,第7列加60 μL改良ISP2或EB(Pb2+)液体培养基作为阳性对照,以各浓度下的重金属离子溶液(不加菌)作为阴性对照,每组3个平行。用麦氏比浊管将待试菌株的菌悬液浓度调至约108 CFU/mL,分别加入第1至第7列96孔板中。28℃培养5 d,用酶标仪测定其OD600值。
1.2.5 菌株的重金属耐受基因检测采用1.2.2节的方法提取细菌中的DNA,对重金属耐受基因进行扩增,退火温度均设置为58℃,参数[24, 25]详见表 1。取5 μL扩增产物进行1%琼脂糖凝胶电泳检测,用凝胶成像仪观察结果并拍照。
| 耐受基因 Tolerance genes |
表型特征 Phenotypic characteristics |
引物序列(5′-3′) Primer sequences (5′-3′) |
目的片段 Target fragments (bp) |
| copA | Copper translocating ATPase | F: CGGTCTCTACGAATACCGCTTCAA R: GAAATAGCTCATTGCCGAGGCGTT |
320 |
| czcA | Cobalt/zinc/cadmium efflux protein | F: GTTCACCTTGCTCTTCGCCATGTT R: ACAGGTTGCGGATGAAGGAGATCA |
206 |
| chrR | Chromium resistance protein | F: ATGTCTGATACGTTGAAAGTTGTTA R: CAGGCCTTCACCCGCTTA |
350 |
| copB | Copper binding protein | F: TTCCTGCTCGACCAGTTGGAATAC R: GGTTGGTCAACAGGATGTCGTACT |
364 |
1.2.6 菌株对重金属离子的吸附能力
取活性显著对数生长期菌株分别接种至100 mL改良ISP2培养基中,置于28℃、180 r/min摇床培养2-3 d,用紫外分光光度计测定培养物的OD600值,待其OD600值趋于稳定,用无菌离心管收集全部菌体,8 000 r/min离心10 min,弃上清液, 收集菌体沉淀,用无菌水洗涤3次,用0.9%生理盐水重悬菌体后置于4℃冰箱中保存14-16 h,即可得到休止细胞溶液。将休止细胞溶液置于50 mL离心管(设置3组平行),5 000 r/min离心5 min,收集菌体沉淀,称量湿菌体重量,再用已配制好的重金属离子溶液重悬菌体,重金属离子终浓度为400 mg/L,28℃、180 r/min摇床中振荡培养24 h。以接种前的重金属离子溶液作为对照组,用原子吸收光谱仪测定重金属离子浓度,并计算其吸附率和吸附能力,公式:吸附率=(对照组重金属离子浓度-实验组重金属离子浓度)/空白组重金属离子浓度×100%;吸附能力=溶液体积×(对照组重金属离子浓度-实验组重金属离子浓度)/细胞干重,单位为mg金属/g菌体。
2 结果与分析 2.1 红树林土壤中可培养假单胞菌从广西钦州茅尾海红树林保护区土壤中共获得77株细菌,通过形态、大小、颜色等形态学特征及革兰氏染色进行初步排重,选取42株革兰氏阴性菌进行16S rRNA基因测序,结果共获得23株假单胞菌,并对其构建Neighbour-Joining系统发育树(图 1)。
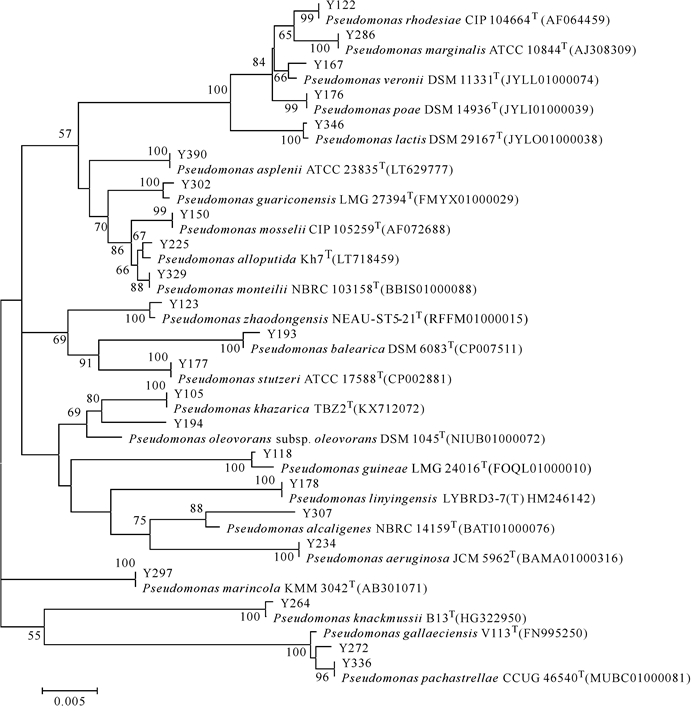
|
| 图 1 土壤中假单胞菌的16S rRNA基因序列N-J系统发育树 Fig. 1 N-J phylogenetic tree of 16S rRNA gene sequence of Pseudomonas in soil |
2.2 假单胞菌的重金属耐受活性初筛结果
23株假单胞菌在各重金属培养基上生长情况如下:能在含100 μg/mL Cu2+,Pb2+,Cr6+,Cd2+,Co2+和Zn2+培养基上生长的假单胞菌分别有16,18,14,10,4和15株;总阳性率分别为69.56%,78.26%,60.87%,43.48%,17.39%和65.22%。其中,Y390,Y193和Y122均不能在各重金属培养基上生长;Y123,Y225,Y167和Y150均在含Co2+培养基上长出少量菌落;Y286和Y336均在含Pb2+和Cr6+培养基上长出少量菌落,在其他重金属培养基上未见菌苔。此外,重金属培养基上生长的菌落形态发生了变化,如Cu2+培养基上,Y234的菌体颜色由浅棕色变为浅绿色,Y272的菌体颜色由微橙色变为褐色,且菌体表面较为干燥;Pb2+培养基上,Y234和Y167的菌体变为橙色,Y272的菌体变为深褐色(图 2)。
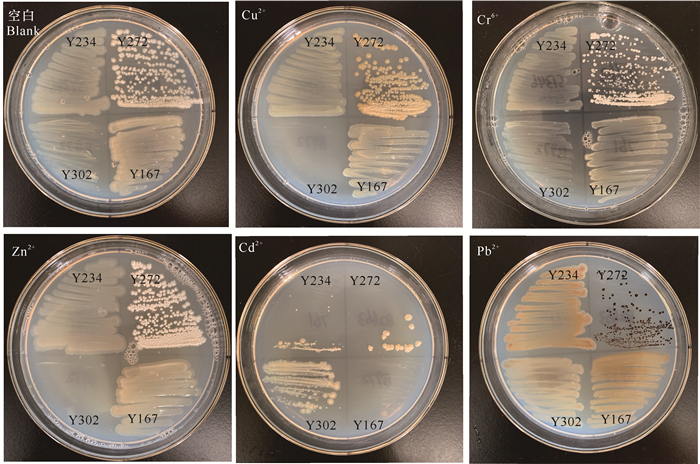
|
| 图 2 4株菌在各重金属培养基上的生长情况 Fig. 2 Growth of four strains on heavy metal mediums |
2.3 菌株的重金属耐受性能
根据初筛结果,选出至少能在一种含有100 μg/mL重金属培养基上生长的假单胞菌18株,进一步摸索各菌株在不同重金属离子中最大耐受浓度。由表 2可知,可耐受800 μg/mL Pb2+的菌株有7株,4株菌对Pb2+的耐受活性可达1 600 μg/mL;耐受Zn2+的假单胞菌有6株,耐受Zn2+浓度在1 600 μg/mL以上;其中,有6株菌对Pb2+和Zn2+均有显著耐受活性,分别为Y234、Y123、Y225、Y167、Y346和Y264。除此之外,对铅和/或锌耐受活性显著的11株菌对其他多种重金属,如Cu2+、Cr6+和Cd2+,也具有一定的耐受性,这可能与其生长的红树林生境有关。生活在被污染土壤中的微生物往往会通过改变自身的生化和结构特征、生理特性和遗传基因等来适应环境,从而产生各种机制应对各种复杂的环境[26],这一特性暗示这些菌株对多种重金属复合污染的水体具有修复潜能。
| 菌株 Strains |
重金属的最小抑菌浓度 Heavy metal MICs (μg/mL) |
耐受表征 Tolerance phenotype |
耐受基因 Tolerance genes |
||||
| Cu2+ | Pb2+ | Cr6+ | Cd2+ | Zn2+ | |||
| Y105 | 200 | 800 | 100 | - | 100 | Pb | copA |
| Y302 | 200 | 800 | 100 | 400 | 200 | Pb | copB, chrR |
| Y118 | 100 | 200 | - | 100 | 100 | copB | |
| Y234 | 400 | 800 | 100 | 100 | 3 200 | Pb, Zn | copB, czcA |
| Y123 | 400 | 1 600 | 200 | - | 1 600 | Pb, Zn | |
| Y178 | 200 | 400 | 200 | 100 | 100 | ||
| Y225 | 200 | 800 | 200 | 200 | 1 600 | Pb, Zn | czcA |
| Y167 | 100 | 800 | - | - | 1 600 | Pb, Zn | |
| Y307 | 100 | 1 600 | - | - | - | Pb | copA |
| Y297 | 200 | 800 | 100 | 100 | 100 | Pb | copA, copB |
| Y272 | 200 | 400 | 100 | - | - | copA | |
| Y150 | 200 | 1 600 | 200 | 100 | 200 | Pb | copA, copB |
| Y194 | 200 | 400 | 200 | - | 100 | ||
| Y346 | - | 1 600 | 100 | 400 | 3 200 | Pb, Zn | |
| Y329 | 100 | 200 | 100 | - | 100 | ||
| Y176 | - | 200 | 100 | 100 | - | ||
| Y177 | 100 | 200 | - | - | 200 | ||
| Y264 | 200 | 800 | 100 | 200 | >3 200 | Pb, Zn | copA, czcA |
| 注:“-”根据初筛结果,故未进行测定 Note: "-" was not determined according to the preliminary screening results | |||||||
对23株假单胞菌进行重金属抗性基因检测(表 2和图 3),最常见的基因是copB(21.74%)、copA(26.09%)、czcA(13.04%)和chrR(4.35%),其中copA和copB基因与铜的抗性有关,czcA基因与镉、锌和钴的抗性有关,chrR基因与铬的抗性有关。综合对假单胞菌在重金属培养基上生长及携带重金属抗性基因分析可知,在9株显示copA和/或copB基因的菌株中,有7株表现出MIC (Cu2+)≥200 μg/mL。在不含copA或copB基因的14株菌中,有4株菌的MIC (Cu2+)≥200 μg/mL,3株菌的MIC(Cu2+)=100 μg/mL。23株假单胞菌中有3株检测出czcA基因,其MIC (Zn2+)≥1 600 μg/mL;其余未检出czcA的假单胞菌中,MIC (Zn2+)≥1 600 μg/mL的有3株,有3株菌的MIC (Zn2+)=200 μg/mL;23株假单胞菌对镉和钴的抗性均不显著,MIC (Cd2+)≤400 μg/mL,MIC (Co2+)≤100 μg/mL。chrR基因仅在Y302中检测到,其MIC (Cr6+)=100 μg/mL,其余未检测出chrR基因的菌株中,有13株菌对Cr6+有一定的耐受性,其MIC (Cr6+)=100-200 μg/mL。
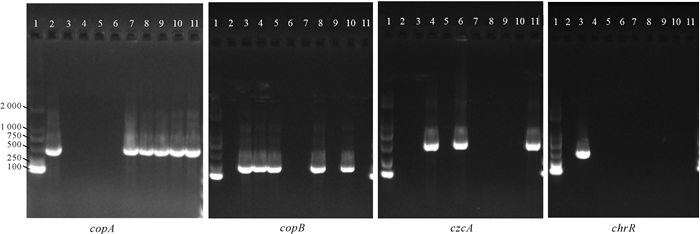
|
| 1-11号孔依次表示Marker,Y105,Y302,Y118,Y234,Y225,Y307,Y297,Y272,Y150和Y264。7条Marker指示带从上至下表示2 000,1 000,750,500,250和100 bp Hole 1-11 represent Marker, Y105, Y302, Y118, Y234, Y225, Y307, Y297, Y272, Y150 and Y264 in sequence.Seven Marker bands represent 2 000, 1 000, 750, 500, 250 and 100 bp from top to bottom 图 3 重金属抗性基因的琼脂糖凝胶电泳图 Fig. 3 Agarose gel electrophoresis of heavy metal tolerance genes |
2.4 菌株对重金属离子的吸附能力
选择11株对铅和/或锌有耐受表征的假单胞菌进行吸附性能测试,在排除明显的仪器导致的测试误差后,获得5株显著吸附Pb2+和/或Zn2+的菌株(图 4)。其中,铅的吸附率排序为Y234>Y346>Y123>Y264>Y225,铅吸附能力排序为Y346>Y234>Y123>Y225>Y264;锌的吸附率排序为Y123>Y264>Y234>Y225>Y346,锌吸附能力排序为Y123>Y234>Y264>Y225>Y346。其余6株菌株对富含Pb2+和/或Zn2+的溶液基本无去除作用(吸附率均在10%以下)。吸附能力是指生物体的吸附量,在相同的菌体质量下,Y346对铅的吸附量最大,其吸附能力最好;Y123对锌的吸附量最大且吸附率最高,其吸附能力最强。
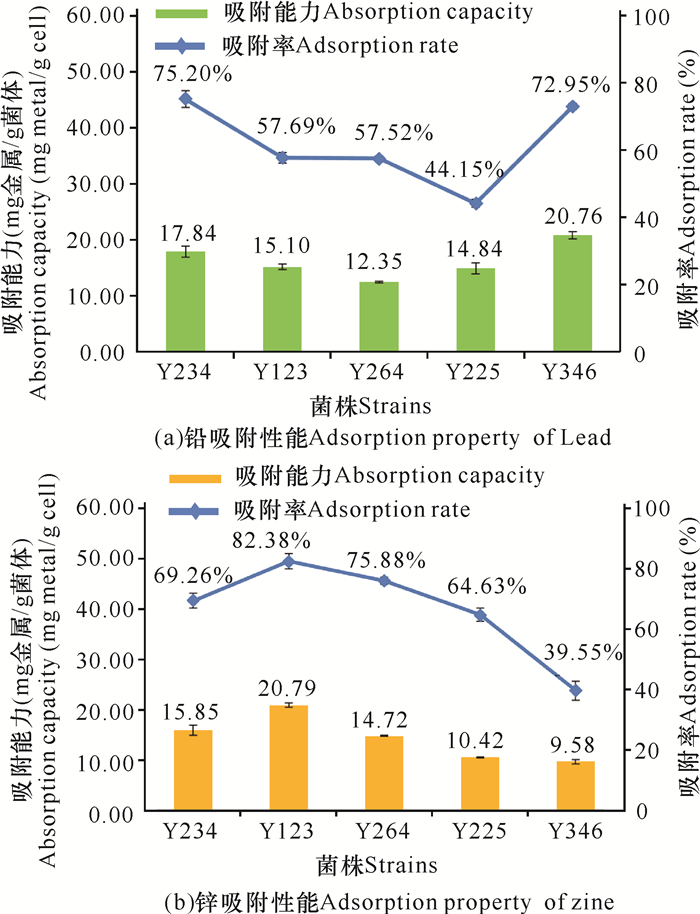
|
| 图 4 5株显著活性菌株的吸附性能 Fig. 4 Adsorption properties of five indigenous active strains |
3 讨论
红树林微生物群落经过长时间进化,形成了特殊的生理代谢系统,在适应生态环境与自我保护的同时,通过通信、觅食等行为机制来适应特殊环境,如盐胁迫、高矿物质组成、强还原性、强酸性、强风、强流、径流、高温、强辐射、频繁的潮汐、缺氧污泥和寡营养等。独特的生境必然会造成其微生物具有独特的生物活性[27]。本研究选取广西钦州茅尾海红树林保护区内土壤作为研究对象,从中共获得23株假单胞菌,其中有18株菌能在多种重金属培养基上生长,11株菌对铅和/或锌的耐受性显著,5株菌对铅和/或锌的吸附能力突出。
耐受基因检测中,部分菌株检测出重金属耐受基因,但其在高浓度重金属培养基上却无法生长,如检测出copA或copB基因的菌株Y307和Y118,其对铜的耐受浓度仅为100 μg/mL;部分检测出czcA基因的菌株对镉和钴的耐受性差。究其原因,可能是在发酵条件下,大部分微生物基因簇是沉默的,后续实验将通过改变培养条件,如培养基成分、温度、盐度、pH、混合培养及表观遗传修饰剂等[28],激活微生物中的沉默基因簇,从而使之表现出较高的重金属耐受性。然而,部分菌株虽然未检出耐受基因,但是在重金属培养基上仍表现出很好的耐受活性,如Y123和Y346,其耐受基因可能存在于细胞质粒中。
吸附能力实验中,有5株假单胞菌表现出良好的铅和/或锌吸附性能,铅和/或锌的吸附率分别为44.15%-75.20%和39.55%-82.38%,吸附能力分别为12.35-20.76 mg金属/g菌体和9.58-20.79 mg金属/g菌体。其中,铜绿假单胞菌Y234具有很强的重金属吸附能力,这与许多报道的结论一致[23, 24, 29],但因其是条件致病菌,且感染免疫力低下人群,易具有多重耐药性及难治疗等因素,因此难以广泛应用于修复重金属污染的环境。重金属固定细菌是通过固定钝化土壤/溶液中的重金属,减少重金属总量或者有效态含量,其作用机制主要有细胞壁吸附[30, 31]、表面络合[32]、细胞内富集[33]和胞外沉淀[34]等。后续将对4株吸附能力好的假单胞菌开展扫描电镜-能谱观察、傅里叶红外光谱及X衍射分析,以研究其作用机理,为更好地开展修复重金属污染环境工作做准备。
4 结论广西钦州茅尾海红树林保护区内土壤富含假单胞菌群资源,且部分菌株的重金属耐受活性显著。其中,菌株Y234、Y123、Y264、Y225和Y346对重金属锌和/或铅表现出良好的吸附特性,在降解有毒物质和改善植物微环境方面具有较大潜力。
| [1] |
李威. 土壤重金属污染危害及微生物修复[J]. 现代农村科技, 2021(8): 99-100. DOI:10.3969/j.issn.1674-5329.2021.08.072 |
| [2] |
ALI H, KHAN E, SAJAD M A. Phytoremediation of heavy metals: Concepts and applications[J]. Chemosphere, 2013, 91(7): 869-881. DOI:10.1016/j.chemosphere.2013.01.075 |
| [3] |
段德超, 于明革, 施积炎. 植物对铅的吸收, 转运, 累积和解毒机制研究进展[J]. 应用生态学报, 2014, 25(1): 287-296. |
| [4] |
陈世川. 土壤中铅污染的危害与治理[J]. 广西节能, 2020(4): 26-27. DOI:10.3969/j.issn.1004-1230.2020.04.016 |
| [5] |
张小俊. 土壤重金属污染及其危害[J]. 农业开发与装备, 2020(10): 109-110. DOI:10.3969/j.issn.1673-9205.2020.10.052 |
| [6] |
王智斌, 魏万鸿. 食品中重金属污染危害分析与其检测方法研讨[J]. 现代食品, 2020(24): 219-221. |
| [7] |
莫槟华, 黄慧敏, 刘素婷, 等. 微生物治理铬污染的研究进展[J]. 广东化工, 2021, 48(7): 140-141. DOI:10.3969/j.issn.1007-1865.2021.07.053 |
| [8] |
谢洪科, 邹朝晖, 彭选明, 等. 重金属钴污染土壤的修复研究进展[J]. 现代农业科技, 2013(7): 222-223. DOI:10.3969/j.issn.1007-5739.2013.07.152 |
| [9] |
武越. 土壤重金属污染修复技术的研究进展[J]. 化工管理, 2020(31): 51-52. DOI:10.3969/j.issn.1008-4800.2020.31.025 |
| [10] |
钱春香, 王明明, 许燕波. 土壤重金属污染现状及微生物修复技术研究进展[J]. 东南大学学报: 自然科学版, 2013, 43(3): 669-674. |
| [11] |
丁禺乔, 柳晓光. 土壤重金属污染修复技术及展望[J]. 资源节约与环保, 2021(6): 77-78. DOI:10.3969/j.issn.1673-2251.2021.06.043 |
| [12] |
杨海君, 谭周进, 肖启明, 等. 假单胞菌的生物防治作用研究[J]. 中国生态农业学报, 2004, 12(3): 158-161. |
| [13] |
WANG C L, MICHELS P C, DAWSON S C, et al. Cadmium removal by a new strain of Pseudomonas aeruginosa in aerobic culture[J]. Applied & Environmental Microbiology, 1997, 63(10): 4075-4078. |
| [14] |
PRAMANIK K, MANDAL S, BANERJEE S, et al. Unraveling the heavy metal resistance and biocontrol potential of Pseudomonas sp.K32 strain facilitating rice seedling growth under Cd stress[J]. Chemosphere, 2021, 274: 129819. DOI:10.1016/j.chemosphere.2021.129819 |
| [15] |
LIU C, LIN H, LI B, et al. Endophyte Pseudomonas putida enhanced Trifolium repens L.growth and heavy metal uptake: A promising in-situ non-soil cover phytoremediation method of nonferrous metallic tailing[J]. Chemosphere, 2021, 272: 129816. DOI:10.1016/j.chemosphere.2021.129816 |
| [16] |
MOKRANI S, EH NABTI. Heavy metal resistance and bioremediation capacity of rhizospheric strain BioRPaz-3Pseudomonas azotoformans endowed with antifungal activities and multi-abiotic stress tolerance in in vitro trials[J]. SN Applied Sciences, 2020, 2(12): 1-14. DOI:10.1007/s42452-020-03828-2 |
| [17] |
宋超, 巫冷蝉, 李斌, 等. 山口红树林保护区英罗港表层沉积物重金属形态的分布特征[J]. 广西科学, 2020, 27(3): 319-325. |
| [18] |
周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报, 2010, 26(2): 123-125. |
| [19] |
WALSH P S, METZGER D A, HIGUCHI R. Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material[J]. Biotechniques, 1991, 10(4): 506-513. |
| [20] |
李菲, 高程海, 余炼, 等. 川蔓藻内生及根际细菌多样性与抑菌活性研究[J]. 广西植物, 2018, 38(7): 924-933. |
| [21] |
KIM K H, ROH S W, CHANG H W, et al. Nocardioides basaltis sp.nov., isolated from black beach sand[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(1): 42-47. DOI:10.1099/ijs.0.65785-0 |
| [22] |
TAMURA K, PETERSON D, PETERSON N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [23] |
PITONDO-SILVA A, GONCALVES G B, STEHLING E G. Heavy metal resistance and virulence profile in Pseudomonas aeruginosa isolated from Brazilian soils[J]. Apmis, 2016, 124(8): 681-688. DOI:10.1111/apm.12553 |
| [24] |
BOUSKILL N J, BARNHART E P, GALLOWAY T S, et al. Quantification of changing Pseudomonas aeruginosa sodA, htpX and mt gene abundance in response to trace metal toxicity: A potential insitu biomarker of environmental health[J]. FEMS Microbiology Ecology, 2007, 60(2): 276-286. DOI:10.1111/j.1574-6941.2007.00296.x |
| [25] |
HE Y, JIN L L, SUN F J, et al. Antibiotic and heavy-metal resistance of Vibrio parahaemolyticus isolated from fresh shrimps in Shanghai fish markets, China[J]. Environmental Science & Pollution Research, 2016, 23: 15033-15040. |
| [26] |
ABOU-SHANAB R A I, BERKUM P V, ANGLE J S. Heavy metal resistance and genotypic analysis of metal resistance genes in gram-positive and gram-negative bacteria present in Ni-rich serpentine soil and in the rhizosphere of Alyssum murale[J]. Chemosphere, 2007, 68(2): 360-367. DOI:10.1016/j.chemosphere.2006.12.051 |
| [27] |
徐志勇, 冯昭, 徐静. 红树林微生物抗菌活性成分研究进展[J]. 中国抗生素杂志, 2017, 42(4): 241-254. DOI:10.3969/j.issn.1001-8689.2017.04.001 |
| [28] |
朱美林, 王皓天. OSMAC方法在微生物次级代谢产物研究中的应用[J]. 科学技术创新, 2020, 26: 82-83. |
| [29] |
TEITZEL G M, PARSEK M R. Heavy metal resistance of biofilm and planktonic pseudomonas aeruginosa[J]. Applied & Environmental Microbiology, 2003, 69(4): 2313-2320. |
| [30] |
HUANG J H, YUAN F, ZENG G M, et al. Influence of pH on heavy metal speciation and removel from wastewater using micellar-enchanced ultrafiltration[J]. Chemosphere, 2017, 173: 199-206. DOI:10.1016/j.chemosphere.2016.12.137 |
| [31] |
燕传明, 贺卓, 葛占标, 等. 两株重金属抗性细菌对铅镉吸附特性的比较研究[J]. 环境科学学报, 2018, 38(9): 3597-3604. |
| [32] |
PAN X H, CHEN Z, CHEN Y J, et al. The analysis of the immobilization mechanism of Ni(Ⅱ) on Bacillus cereus[J]. Journal of Nanoscience and Nanotechnology, 2011, 11(4): 3597-3603. DOI:10.1166/jnn.2011.3720 |
| [33] |
OSMAN D, WALDRON K J, DENTON H, et al. Copper homeostasis in Salmonella is atypical and copper-CueP is a major periplasmic metal complex[J]. Journal of Biologal Chemistry, 2010, 285(33): 25259-25268. DOI:10.1074/jbc.M110.145953 |
| [34] |
LU W B, SHI J J, WANG C H, et al. Biosorption of lead, copper and cadmium by an indigenous isolate Enterobacter sp.J1 possessing high heavy-metal resistance[J]. Journal of Hazardous Materials, 2006, 134(1/3): 80-86. |



