2. 江苏省海洋生物资源与环境重点实验室, 江苏连云港 222005;
3. 江苏省海洋生物产业技术协同创新中心, 江苏连云港 222005
2. Jiangsu Key Laboratory of Marine Bioresources and Environment, Lianyungang, Jiangsu, 222005, China;
3. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Lianyungang, Jiangsu, 222005, China
右旋糖酐酶是一类特异性水解右旋糖酐中α-1, 6糖苷键的葡聚糖酶,在医药及食品领域应用广泛[1, 2]。在医药领域,利用右旋糖酐酶制备低分子量的右旋糖酐可用于治疗脑梗死、改善病患机体的凝血性能,也可作为代血浆或光学相干断层扫描的造影剂[3-5];右旋糖酐酶还可以水解牙菌斑生物膜中的右旋糖酐,破坏生物膜的网状结构,让细菌无法黏附,从而防治龋齿[6]。在食品领域,利用右旋糖酐酶可以清除制糖过程中所产生的高分子量右旋糖酐,防止机器堵塞并提高得糖率和生产效率[7, 8];也可利用右旋糖酐酶制备低聚异麦芽糖,并作为益生元添加到食品中。
目前已报道产右旋糖酐酶的菌株大多是真菌,虽然酶活较高,但其发酵周期长,作用条件偏酸性,且部分真菌发酵液中含有抗生素或有毒代谢产物,使得该类酶很难应用于口腔护理类产品中。得益于海洋的特殊环境,海洋来源的右旋糖酐酶通常具有生产周期短、最适反应温度低、在中性或偏碱性条件下有很好的活性、无有毒次级代谢产物等特点,因而这类酶在口腔护理方面的研究价值较高[9-11]。
目前有关提升右旋糖酐酶产酶能力的报道已有很多,例如朱慧霞等[12]利用正交试验法将绳状青霉菌产的右旋糖酐酶的酶活力提高约4.4倍;黄瑞杰等[13]通过响应面法提高圆弧青霉的产酶能力,相较于优化前提高30.1%;杨齐等[14]亦是通过响应面法使得腐皮镰刀菌产的右旋糖酐酶酶活力提高1.3倍。单因素法是通过对单一目标因素进行实验安排,找到最优或者近似最优条件。响应面法不仅计算简单,而且可以在寻求最佳发酵条件时对试验中的各个因素进行连续分析,同时还考虑了试验的随机误差。本研究利用单因素法结合响应面法对一株产右旋糖酐酶的海洋细菌THN1进行发酵条件优化,并初步研究该酶的酶学性质,旨在为该酶的进一步研究及应用提供数据支撑。
1 材料与方法 1.1 材料 1.1.1 试剂及样品来源胰蛋白胨和酵母粉购自Oxoid公司,其他试剂购自国药集团化学试剂有限公司。
产右旋糖酐酶的海洋纤维化纤维菌(Cellulosimicrobium cellulans)THN1为本实验室从连云港田湾核电站附近海泥中筛选得到,已保藏于中国典型培养物保藏中心,保藏号为CCTCC M2020430。
1.1.2 培养基2216E固体培养基:胰蛋白胨5 g/L,酵母粉1 g/L,琼脂15 g/L,pH自然,陈海水配置。
LB培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH自然,去离子水配置。
初始产酶培养基:胰蛋白胨5 g/L,酵母粉1 g/L,右旋糖酐T20 10 g/L,pH自然,陈海水配置。
1.2 仪器与设备超净工作台(SW-CJ-1D)购自苏州净化设备有限公司;高压灭菌锅(GI54DWS)和生化培养箱(SPX-250B-Z)购自上海博迅实业有限公司医疗设备厂;恒温摇床(Innova 44R)购自美国Eppendorf公司;酶标仪(1510)和台式离心机(Legend Micro 17R)购自美国Thermo Fisher公司。
1.3 方法 1.3.1 菌株的活化、发酵及粗酶液制备在2216E固体培养基上使用三区划线法对保藏于-80℃冰箱的菌株THN1进行划线,置于37℃培养箱培养48-72 h。挑取单菌落于LB培养基中,30℃培养20 h后,以4%的接种量接种于初始产酶培养基中,30℃培养24 h。将发酵液于10 000 r/min、4℃条件下离心15 min,收集上清液,即为粗酶液。
1.3.2 酶活力测定取50 μL粗酶液,加入150 μL 3%右旋糖酐T20溶液(20 mol/L pH值为7.5的Tris-HCl缓冲液配置),40℃水浴15 min后加入200 μL 3,5-二硝基水杨酸(DNS)终止反应,沸水浴5 min后迅速冷却,加入3 mL去离子水,震荡摇匀,吸取100 μL反应液于540 nm处测定吸光值[15]。对照组为先加DNS再加底物,其他操作同实验组。
酶活力定义:每分钟产生1 μmol还原糖所需要的酶量为一个酶活力单位(U)。
1.3.3 单因素实验将初始产酶培养基中的酵母粉改为1 g/L其他碳源(乳糖、蔗糖、玉米淀粉、麸皮、葡萄糖、糊精、马铃薯淀粉、大麦粉、麦芽糖),其他条件不变,按照1.3.1节方法提取粗酶液并按照1.3.2节方法测定酶活力,确定最佳碳源。
在最佳碳源的基础上,用5 g/L的其他氮源(酵母粉、鱼粉蛋白胨、豆粕、氯化铵、硫酸铵、花生粕、尿素、干酪素、硝酸钠)代替胰蛋白胨,其他条件同上,测定酶活力,确定最佳氮源。
在最优碳源、氮源基础上,分别改变碳源的添加量(1,5,10,15,20 g/L)、氮源添加量(5,8,10,15,20 g/L)、培养温度(15,20,25,30,37,40,45℃)、右旋糖酐T20的添加量(0,1,2,3,4,5,8,10,15 g/L)、初始pH值(5.0,6.0,7.0,7.5,8.0,9.0,10.0)以及NaCl的添加量(0,5,10,15,20,30,40,50 g/L),研究这些因素对菌株THN1产酶的影响。
1.3.4 数据处理每个实验组均做3组平行,每组平行测3组数据,计算酶活力平均值及误差。采用Origin 2018进行统计分析和绘图。
1.3.5 响应面Box-Behnken (BB)实验设计基于单因素实验结果,选取胰蛋白胨添加量(A)、NaCl添加量(B)、初始pH值(C)3个因素,以右旋糖酐酶酶活力(R1)作为响应值,通过Design-Expert 12软件设计实验组合优化发酵条件(表 1)。
| 因素Factors | 水平Levels | ||
| -1 | 0 | 1 | |
| A胰蛋白胨Tryptone (g/L) | 5 | 15 | 25 |
| B NaCl (g/L) | 5 | 15 | 25 |
| C初始pH值 Initial pH value |
6 | 7.5 | 9 |
1.3.6 菌株THN1生长曲线及产右旋糖酐酶时间进程
根据响应面实验,获得产右旋糖酐酶的最优发酵条件,在此条件下培养菌株THN1。期间每2 h取一次发酵液样品,测定样品在波长600 nm处的吸光值,根据1.3.2节的方法测定酶活力。
1.3.7 酶学性质测定最适反应温度及温度稳定性:将粗酶液与底物混合后置于不同温度下(20,25,30,35,40,45,50,55,60℃)反应15 min,测定酶活力,确定该酶的最适反应温度;将粗酶液分别置于30,40,50℃水浴中孵育,每隔1 h取出适量粗酶液,在最适反应温度下测定残余酶活力。
最适pH值及pH稳定性:配置终浓度为50 mmol/L不同pH值(3.0,4.0,5.0,6.0,7.0,7.5,8.0,8.5,9.0)的3%右旋糖酐T20底物,将粗酶液与上述底物混合后,在最适反应温度下测定酶活力,确定该酶的最适反应pH值;在粗酶液中加入终浓度为50 mmol/L的不同pH值(3.0,4.0,5.0,6.0,7.0,7.5,8.0,8.5,9.0)缓冲液放置于4℃冰箱24 h后,在最适反应温度和pH条件下测定残余酶活力。
2 结果与分析 2.1 单因素试验筛选结果由图 1a-h可知,在碳源为麸皮、氮源为胰蛋白胨、麸皮添加量为5 g/L、胰蛋白胨添加量为15 g/L、培养温度为30℃、诱导剂右旋糖酐T20添加量为5 g/L、培养基初始pH值为7.5、NaCl添加量为15 g/L等单因素条件下,菌株THN1产右旋糖酐酶的能力分别达到最优。其中,当改变氮源添加量(5→15 g/L)和NaCl添加量(0→15 g/L),发酵液测得的酶活力分别从0.28 U/mL提升到1.17 U/mL以及从1.79 U/mL提升到2.33 U/mL,菌株THN1产右旋糖酐酶能力均显著提升。
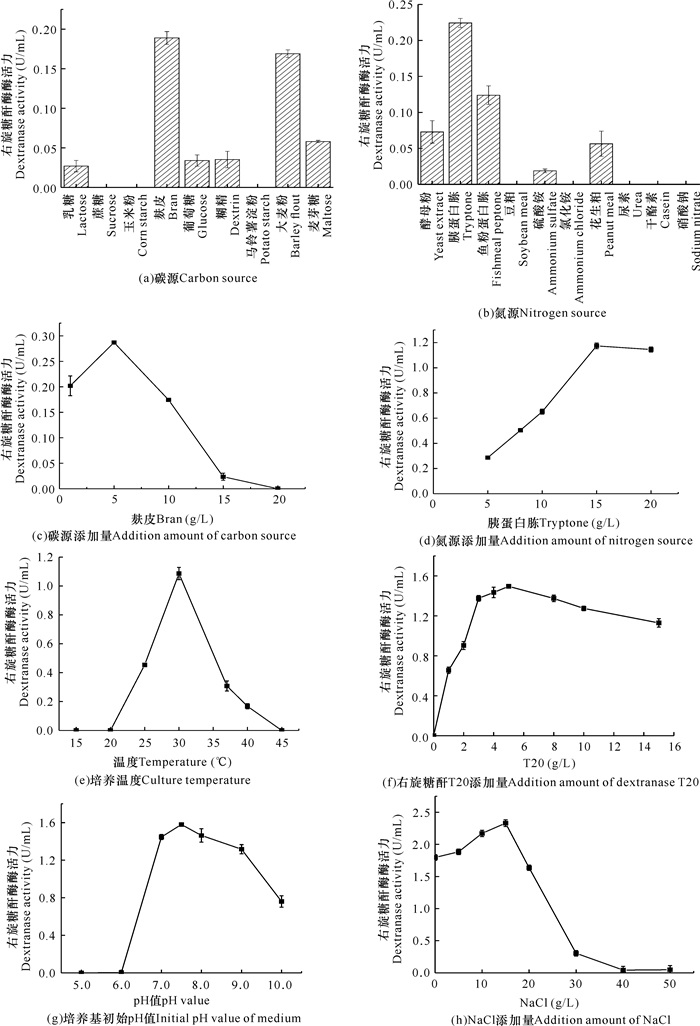
|
| 图 1 各因素对菌株THN1产右旋糖酐酶的影响 Fig. 1 Effect of various factors on the production of dextranase from strain THN1 |
氮源是构成生物体蛋白质、酶、核酸及其他氮素化合物的重要基础物质,因而氮源添加量的选择对微生物生长尤为重要。在本研究中,当氮源添加到一定浓度后,继续添加反而使酶活力降低(图 1d),这与张彦君等[16]以及侯殿志等[17]的研究结果相似。本研究中的右旋糖酐酶产自一株海洋细菌THN1,该菌株有一定的嗜盐性,因此在一定范围内该菌产右旋糖酐酶能力会随着NaCl浓度的增加而增强,但超过峰值后产酶能力急剧下降(图 1h),这与Lai等[15]的研究结果相似。此外,初始pH值会直接影响到微生物的营养吸收以及代谢过程中酶的活性(图 1g)。因此,后续选择胰蛋白胨添加量、NaCl添加量和初始pH值进行响应面实验的优化因素。
2.2 Box-Behnken试验结果根据单因素实验结果,选取胰蛋白胨添加量(A)、NaCl添加量(B)、初始pH值(C) 3个主要影响因素,以右旋糖酐酶酶活力(R1)作为响应值,进行发酵条件响应面优化。试验结果见表 2,建立回归模型如下:
| $ R_{1}=3.21+0.4713 \mathrm{~A}-0.67 \mathrm{~B}+0.9178 \mathrm{C}- \\ 0.293 \mathrm{AB}+0.292 \mathrm{AC}+0.0905 \mathrm{BC}-0.7493 \mathrm{~A}^{2}- \\ 0.8463 \mathrm{~B}^{2}-1.06 \mathrm{C}^{2} 。$ |
| 编号 No. |
因素Factors | 右旋糖酐酶 酶活力 Dextranase activity (R1,U/mL) |
||
| A胰蛋白胨 添加量 Tryptone addition amount (g/L) |
B NaCl添 加量 NaCl addition amount (g/L) |
C初始 pH值 Initial pH value |
||
| 1 | 15 | 25 | 9.0 | 1.73 |
| 2 | 5 | 25 | 7.5 | 0.69 |
| 3 | 25 | 25 | 7.5 | 0.73 |
| 4 | 25 | 15 | 6.0 | 0.68 |
| 5 | 15 | 25 | 6.0 | 0 |
| 6 | 15 | 15 | 7.5 | 3.25 |
| 7 | 25 | 15 | 9.0 | 3.38 |
| 8 | 15 | 5 | 9.0 | 2.42 |
| 9 | 15 | 15 | 7.5 | 2.74 |
| 10 | 5 | 15 | 9.0 | 1.53 |
| 11 | 25 | 5 | 7.5 | 3.12 |
| 12 | 15 | 15 | 7.5 | 3.33 |
| 13 | 15 | 5 | 6.0 | 1.05 |
| 14 | 5 | 5 | 7.5 | 1.92 |
| 15 | 5 | 15 | 6.0 | 0 |
| 16 | 15 | 15 | 7.5 | 3.45 |
| 17 | 15 | 15 | 7.5 | 3.28 |
方差分析(表 3)显示,所建立模型具有极显著性(P=0.000 6),决定系数R2=0.956,失拟项不显著(P=0.125 4),说明试验模型拟合度较好。各因素对产右旋糖酐酶的影响由大到小排序为初始pH值(C)>NaCl添加量(B)>胰蛋白胨添加量(A)。
| 来源 Source |
平方和 Sum of squares |
自由度 Freedom |
均方 Mean squares |
F值 F Value |
P值 P Value |
显著性 Significance |
| 模型 Model |
24.11 | 9 | 2.68 | 16.88 | 0.000 6 | ** |
| A | 1.78 | 1 | 1.78 | 11.20 | 0.012 3 | * |
| B | 3.59 | 1 | 3.59 | 22.63 | 0.002 1 | ** |
| C | 6.74 | 1 | 6.74 | 42.46 | 0.000 3 | ** |
| AB | 0.343 4 | 1 | 0.343 4 | 2.16 | 0.184 8 | |
| AC | 0.341 1 | 1 | 0.341 1 | 2.15 | 0.186 1 | |
| BC | 0.032 8 | 1 | 0.032 8 | 0.206 4 | 0.663 3 | |
| A2 | 2.36 | 1 | 2.36 | 14.90 | 0.006 2 | ** |
| B2 | 3.02 | 1 | 3.02 | 19.00 | 0.003 3 | ** |
| C2 | 4.75 | 1 | 4.75 | 29.94 | 0.000 9 | ** |
| 残差 Residual |
1.11 | 7 | 0.158 7 | |||
| 失拟项 Lack of fit |
0.808 7 | 3 | 0.269 6 | 3.57 | 0.125 4 | |
| 纯误差 Pure error |
0.302 1 | 4 | 0.075 5 | |||
| 总计 Total |
25.22 | 16 | ||||
| 注:*表示显著(P<0.05),**表示极显著(P<0.01) Note: * means significant (P<0.05),** means extremely significant (P<0.01) | ||||||
图 2是各影响因素与右旋糖酐酶酶活力关系的三维响应面图。通过分析得到菌株THN1的最佳产酶条件为胰蛋白胨19.97 g/L,NaCl 10.43 g/L,pH值为8.22,结合回归模型计算得出最大酶活力为3.70 U/mL。为方便实际研究,选取胰蛋白胨20 g/L,NaCl 10 g/L,pH值为8.2进行验证实验,获得右旋糖酐酶酶活力为(3.71 ± 0.01) U/mL,是初始酶活力(0.12 U/mL)的31倍,并且与预测值无显著差异(P>0.05),说明该模型能较好地预测实际发酵情况。
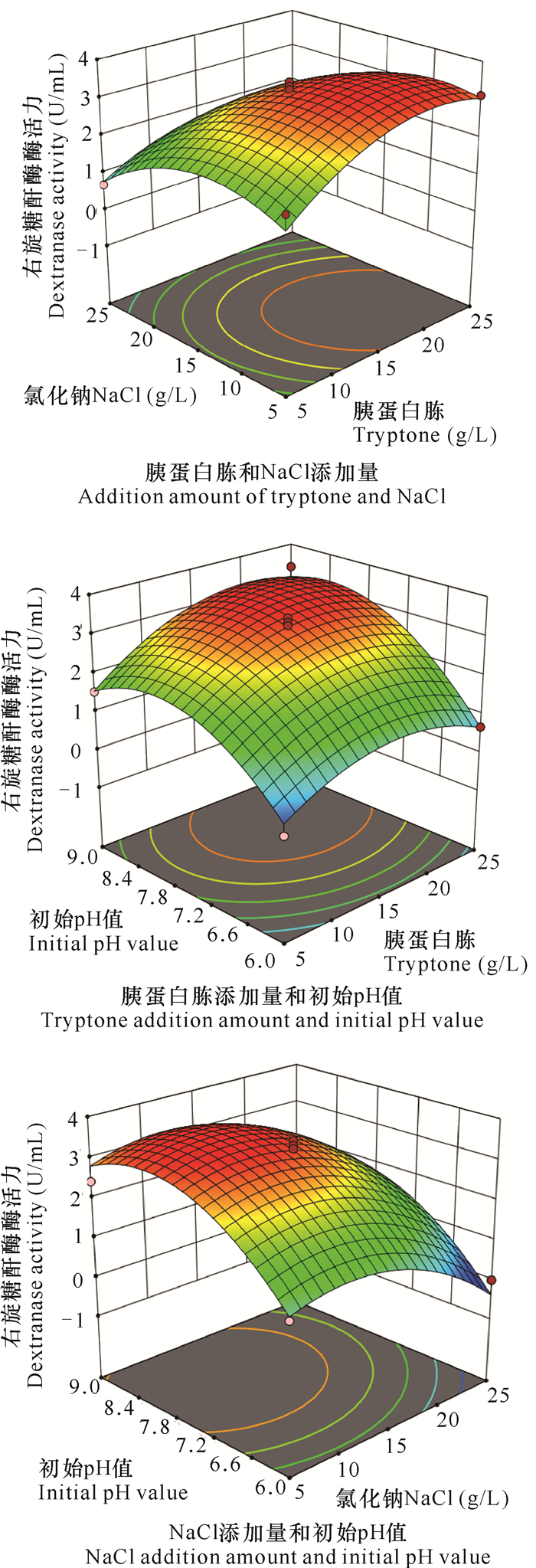
|
| 图 2 胰蛋白胨、NaCl和pH值对菌株THN1产酶影响的响应面 Fig. 2 Response surface plots of effects of interaction between tryptone, NaCl and initial pH value on dextranase producing by strain THN1 |
2.3 菌株THN1细胞生产和产酶时间关系
图 3是菌株THN1在最佳产右旋糖酐酶条件下的生长曲线及产酶时间进程。菌株THN1在发酵12 h后生长进入对数期,在30 h后进入稳定期。在12 h前,右旋糖酐酶酶活力几乎为0;在12-26 h期间,右旋糖酐酶酶活力随着菌体量的增长而提高,并在25 h左右达到最高;在26 h后,右旋糖酐酶酶活力随着发酵时间的增长而呈下降趋势。以上结果表明菌株THN1在培养24 h左右达到最高产酶水平。
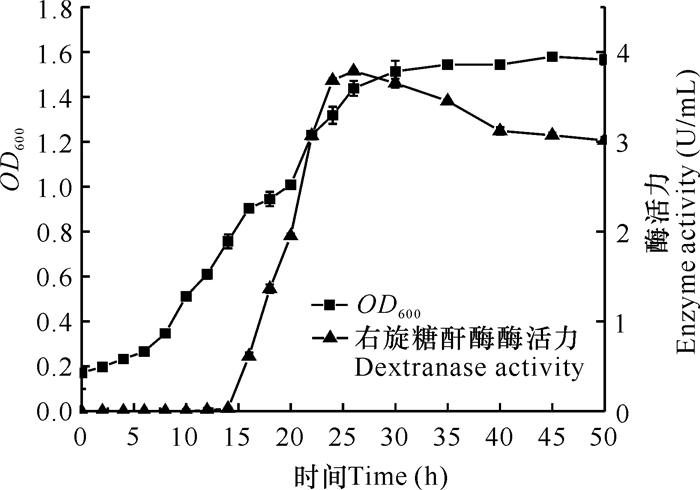
|
| 图 3 菌株THN1细胞生长及产右旋糖酐酶的时间进程曲线 Fig. 3 Time course of the cell growth and dextranase production by strain THN1 |
2.4 酶学性质
如图 4a和4b所示,菌株THN1产右旋糖酐酶的最适反应温度为40℃,在25-50℃时相对酶活力超过70%,在30℃时有较好的温度稳定性,放置5 h基本没有活力损失,这与张宇琪等[18]有关细菌来源右旋糖酐酶的报道一致。菌株THN1产右旋糖酐酶的最适pH值为7.5,在pH值为7.0-9.0条件下能保持60%以上的相对酶活力(图 4c)。此外,右旋糖酐酶在pH值为5.0-9.0条件下放置24 h (4℃),相对酶活力仍能保持50%以上,其中,pH值为5.5的乙酸钠缓冲液、pH值为7.0的磷酸盐缓冲液和pH值为9.0的Tris-HCl缓冲液中均能保持80%以上的相对酶活力(图 4d),表明该酶在中性以及弱碱性条件下稳定性较好。
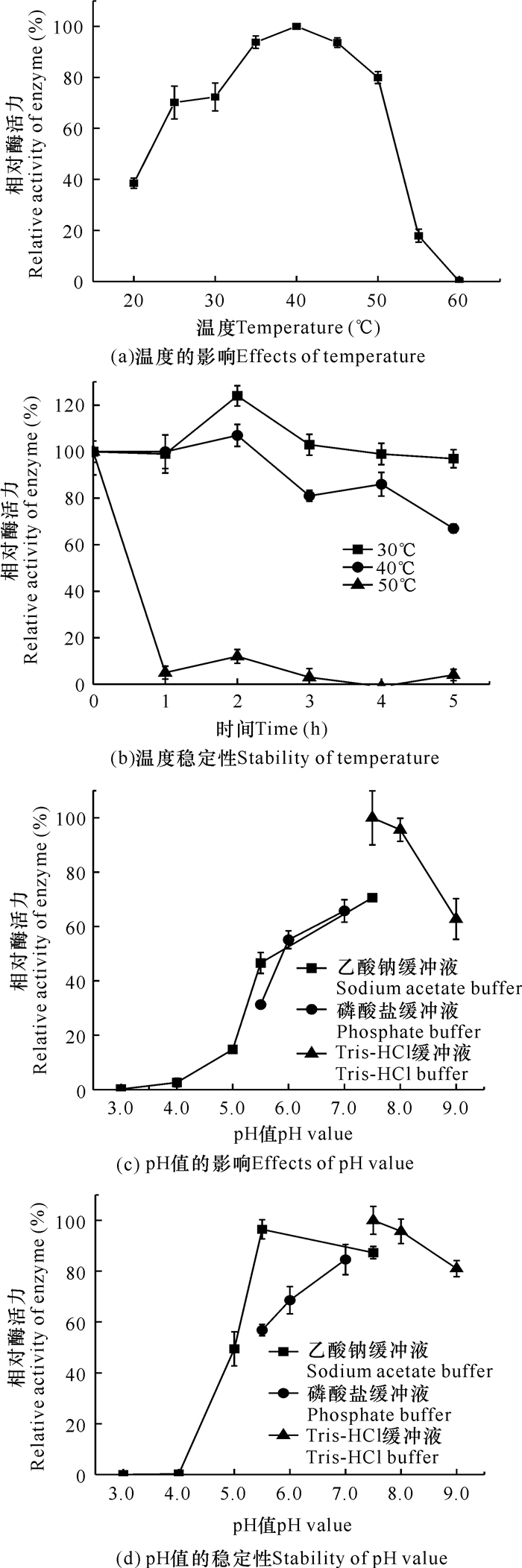
|
| 图 4 菌株THN1右旋糖酐酶酶学性质 Fig. 4 Enzymatic properties of dextranase from strain THN1 |
菌株THN1产右旋糖酐酶的最适温度、pH值分别是40℃和7.5,这与Ren等[10]以及Deng等[19]发现的海洋来源的右旋糖酐酶性质相似。上述文献中均有右旋糖酐酶对牙菌斑生物膜的清除和抑制作用的相关实验。因此,为拓展右旋糖酐酶在口腔护理方面的应用,后续研究可探索THN1右旋糖酐酶对牙菌斑生物膜的抑制和清除效果,以及研究市售口腔护理产品中化学试剂之间对该酶的功效是否存在协同或拮抗作用。
3 结论菌株THN1产右旋糖酐酶的最佳条件为麸皮5 g/L,胰蛋白胨20 g/L,右旋糖酐T20 5 g/L,NaCl 10 g/L,pH值为8.2,陈海水配置,30℃培养24 h,在此条件下右旋糖酐酶的酶活力为(3.71±0.01) U/mL,是初始产酶培养基酶活力的31倍左右,这将有利于右旋糖酐酶生产周期的缩短和生产成本降低。该酶的最适反应温度为40℃,在25-50℃条件下有较好的活性;最适反应pH值为7.5,在30℃和40℃条件下有很好的稳定性,对口腔牙菌斑生物膜的清理具有良好的应用潜能。
| [1] |
常国炜, 黄曾慰, 黎志德, 等. 右旋糖酐酶开发及应用研究进展[J]. 生物技术通报, 2019, 35(6): 196-204. |
| [2] |
VOLKOV P V, GUSAKOV A V, RUBTSOVA E A, et al. Properties of a recombinant GH49 family dextranase heterologously expressed in two recipient strains of Penicillium species[J]. Biochimie, 2019, 157: 123-130. DOI:10.1016/j.biochi.2018.11.010 |
| [3] |
蔡正轩. 疏血通注射液联合低分子右旋糖酐治疗进展性脑梗46例疗效观察[J]. 中医临床研究, 2017, 9(5): 72-73. DOI:10.3969/j.issn.1674-7860.2017.05.037 |
| [4] |
甘微苇. 右旋糖酐蔗糖酶与右旋糖酐酶协同催化制备低聚右旋糖酐与低聚糖的研究[D]. 合肥: 合肥工业大学, 2014.
|
| [5] |
VIJAYVERGIYA R, RATHEESH K J, GUPTA A. Low molecular weight dextran: An alternative to radiographic contrast agent for optical coherence tomography imaging[J]. IHJ Cardiovascular Case Reports, 2017, 1(1): 10-11. DOI:10.1016/j.ihjccr.2017.03.002 |
| [6] |
祖航天, 田小鹏, 胡杰, 等. 产右旋糖酐酶Pseudarthrobacter sp.RN22的筛选、鉴定及酶学性质研究[J]. 食品与发酵工业, 2021, 47(17): 76-83. |
| [7] |
RERNGSAMRAN P, TEMJITPUKDEE P, ASSAVASIRIJINDA N, et al. Cloning, characterization, and heterologous expression of a dextranase gene from Penicillium pinophilum SMCU3-14[J]. ScienceAsia, 2014, 40(6): 405-413. DOI:10.2306/scienceasia1513-1874.2014.40.405 |
| [8] |
钟志才, 马步, 徐杰荣, 等. 葡聚糖酶应用于甘蔗制糖过程的试验研究[J]. 甘蔗糖业, 2014(3): 41-46. DOI:10.3969/j.issn.1005-9695.2014.03.009 |
| [9] |
望魁甲, 王笃强, 廖远平, 等. 重组右旋糖酐酶的表达、纯化及性质研究[J]. 生物化工, 2018, 4(2): 30-35. DOI:10.3969/j.issn.2096-0387.2018.02.008 |
| [10] |
REN W, CAI R H, YAN W L, et al. Purification and characterization of a biofilm-degradable dextranase from a marine bacterium[J]. Marine Drugs, 2018, 16(2): 51. DOI:10.3390/md16020051 |
| [11] |
胡杰, 刘鑫, 祖航天, 等. 产右旋糖酐酶Marinimicrobium sp.G1的筛选、酶性质及产物研究[J]. 食品科技, 2021, 46(5): 25-32. |
| [12] |
朱慧霞, 王雅洁, 邓胜松, 等. 绳状青霉菌发酵产右旋糖酐酶的条件研究[J]. 食品科学, 2010, 31(19): 288-291. |
| [13] |
黄瑞杰, 廖安平, 李媚, 等. 响应面法优化圆弧青霉(CICC-4022)产右旋糖酐酶的培养条件[J]. 食品工业科技, 2019, 40(18): 171-176. |
| [14] |
杨齐, 黄斌良, 吴华德, 等. 右旋糖酐酶生产菌株的分离鉴定及发酵培养基优化[J]. 广西科学, 2021, 28(1): 89-91, 101. |
| [15] |
LAI X H, LIU X, LIU X Q, et al. The marine Catenovulum agarivorans MNH15 and dextranase: Removing dental plaque[J]. Marine Drugs, 2019, 17(10): 592. DOI:10.3390/md17100592 |
| [16] |
张彦君, 魏晋, 周鑫辉, 等. 响应面法优化产内切葡聚糖酶重组大肠杆菌发酵培养基[J]. 四川农业大学学报, 2017, 35(4): 581-586, 606. |
| [17] |
侯殿志, 王晓, 朱延光, 等. 肠膜明串珠菌产右旋糖酐蔗糖酶条件优化[J]. 食品科技, 2016, 41(4): 2-6. |
| [18] |
张宇琪, 张洪斌, 甘微苇, 等. 右旋糖酐酶研究进展[J]. 生物工程学报, 2015, 31(5): 634-647. |
| [19] |
DENG T, FENG Y L, XU L X, et al. Expression, purification and characterization of a cold-adapted dextranase from marine bacteria and its ability to remove dental plaque[J]. Protein Expression and Purification, 2020, 174: 105678. DOI:10.1016/j.pep.2020.105678 |



