2. 广西科学院, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynethesis Chemistry, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
激光拉曼光谱技术在生物活体中的研究是拉曼光谱技术和生物活体检测技术的融合,它不仅继承了这两种技术的优点,且能实现非接触环境下对生物活体组织的原位探测。拉曼光谱是激发光与被测物质作用后产生的一种与激发光频率不同的散射光,该散射光包含丰富的被测物信息,通过对此散射光谱进行研究可以实现被测物的定性定量分析[1]。相较于其他光学检测方法,激光拉曼光谱技术之所以能与生物活体检测技术成功融合是因其有自身的特点及优势:(1)能够提供快速、简单、可重复的无损分析,为生物医学的在线无创检测提供可能性;(2)能够提供物质分子振动、转动方面的信息,实现物质分子水平级的定性分析,对疾病的早期诊断有非常大的意义;(3)拉曼光谱中所含有的特征峰清晰尖锐,适合物质的定量分析,非常有利于临床上对生物体生理指标的监测;(4)相较于其他光学方法,生物组织中的水对拉曼光谱的测量结果影响较小,因此激光拉曼光谱技术非常适合用于研究生物组织。目前,除了生物医学相关领域,激光拉曼光谱技术的应用也已渗透到其他各个领域,例如化学、高分子材料、中草药研究、宝石鉴定,以及比较热门的法医鉴定等[2-5]。近年来,激光拉曼光谱技术在生物医学领域取得了不小的成绩:生物学中有大量利用激光拉曼光谱技术研究蛋白质、核酸、碳水化合物、脂类等生物组织最基本构成物质的文献报道[6-8];医学上,拉曼技术被用于探测由疾病引起的组织、体液或细胞的分子组成变化,是一种强有力的疾病临床诊断工具,可实现疾病的分子水平诊断[9-11]。每两年一次的国际拉曼光谱会议上都会有拉曼光谱在生物医学中应用的专门讨论会,而有关医学和生物样品的学术报告也占有相当大的比例。
生物活体检测是以具有生命的个体为研究对象,分析检测仪器与整个生物活体或局部作用产生的物理或化学现象进而得到检测结果的过程。该检测方法具有无创非侵入性,它之所以成为生物医学研究者最理想的研究手段,是因为它能够在不影响生物机体正常生理和心理环境的情况下,获取真实的原位反馈信息,为相关研究提供精准的信息支持。生物活体检测与激光拉曼光谱技术的成功融合除了上述几点外,还有一个决定性因素即拉曼激发光源。一般常见的拉曼激发光波长有488,514.5,785和1 064 nm 4个波段,对生物活体的研究通常选择785 nm近红外波段的激发光。这是因为生物组织对这个波段的光不会产生大量光吸收现象,因此该光源不会对生物组织造成光损伤。另外,这个波段的光对生物组织有一定的穿透性,激发光能够穿透生物体表皮组织作用到生物体内部(组织、血液)进行活体实验。本文针对拉曼光谱检测在生物活体组织和血液两个方面的应用展开综述。
1 激光技术在生物活体组织中的拉曼光谱检测应用生物组织由细胞构成,而细胞由蛋白质、核酸、脂肪等拉曼信号较强的基本物质构成。疾病的产生往往伴随组织和细胞的恶变,最早体现在蛋白质、核酸、脂肪等基本构成物分子结构构象或数量上的变化,但疾病初期这些变化的临床症状和医学影像表现往往并不明显,因此对于初期症状不太明显的病症检测仍需要寻求一些其他的技术手段和方法来实现早期诊断。激光拉曼光谱技术能够提供物质分子振动、转动方面的信息,是一种灵敏的分子水平的检测方法。20世纪90年代初人们就开始探讨拉曼光谱在生物组织检测中的应用,探究激光拉曼光谱技术能否灵敏地探测出病变组织与正常组织的区别,并在此基础上发展一种快速、灵敏、精确的光学诊断方法。目前,激光拉曼光谱技术对生物组织的检测主要应用在癌症的研究中。癌症是严重威胁人类健康和生命的疾病之一,早发现、早诊断和早治疗是提高癌症患者生存率的有效途径。
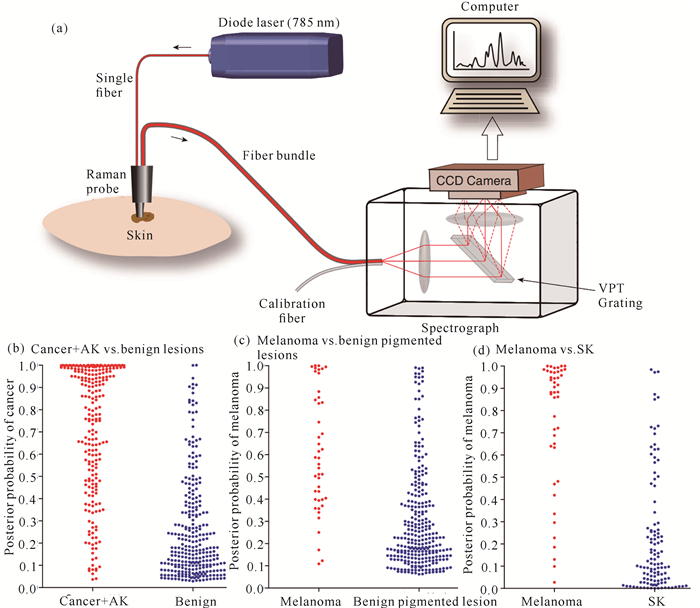
1.1 生物活体组织的拉曼光谱检测在过去的二十多年里,激光拉曼光谱技术对生物离体组织的检测几乎涉及所有器官,包括乳腺、大脑、皮肤、肺、结肠、宫颈、胃、肝、甲状腺、喉以及淋巴系统等[12-17]。研究结果表明,结合一定的化学计量和数学统计方法,该检测方法能够灵敏地判别正常生物组织和异常生物组织,准确率为80%-100%,表明激光拉曼光谱技术不仅对生物离体组织检测具有高准确率,也为其应用于生物活体研究提供了有力的数据和技术支持。以体外实验为依据,拉曼技术在生物活体组织检测中的应用也相继展开。Huang等[18]利用一台激发光波长为785 nm的便携式近红外拉曼光谱仪,成功地获取了人体各部位(前额、脸颊、胸部、腹部、手掌、手背、手指、腿等)皮肤组织的拉曼光谱,研究发现不同区域的皮肤光谱在形状和强度方面都有一定的差异,该结果表明激光拉曼光谱技术可以应用于不同生物组织间的判别和区分。随后,同一课题组的Lui等[19]在此基础上利用激光拉曼光谱技术对皮肤癌的诊断进行相关的活体探究,实验分别获取了皮肤黑素瘤、基底细胞上皮瘤、鳞状细胞上皮癌、日光角化病组织、非典型痣、黑色素痣、蓝痣和脂溢性角化病组织的拉曼光谱(图 1)。结果表明,利用激光拉曼光谱技术对皮肤癌与来自于良性皮肤损伤部位的癌前组织、黑素瘤与色素沉着导致的非黑色素瘤组织、黑素瘤与脂溢性角化病组织3种情况中的不同组织能够实现明显的判别与区分,同时也证实此方法在诊断皮肤癌方面具有很大的潜力。Duraipandian等[15]利用配备有球透镜作为拉曼探测头的近红外拉曼光谱系统对宫颈组织进行活体研究,实验分别获取了宫颈正常组织和宫颈癌前病变组织的拉曼光谱,这两种组织的光谱差异表明拉曼技术用于活体宫颈异常组织的判别是可行的,结合数据统计分析方法可使宫颈癌前诊断准确率达到82.9%,这表明拉曼光谱技术能够在分子水平上实现对宫颈癌前组织快速、无创的临床活体诊断。Schut等[20]利用光纤拉曼技术研究活体小鼠上颚的正常组织、轻度异常组织及口腔鳞状癌组织的光谱,主成分及线性判别的结果显示这3类光谱之间能够明显区分开来,表明激光拉曼光谱技术可以应用于口腔鳞状癌的早期诊断。除上述研究外,激光拉曼光谱技术近年来还应用在其他组织的活体检测中[21-24]。以上研究都表明激光拉曼光谱技术应用于生物活体组织研究的可行性,能够从分子水平上识别发生病变的组织,为临床疾病尤其是癌症的早期诊断提供一种灵敏、可靠的检测手段。
|
| (a) 系统流程图;(b) 皮肤癌、癌前组织与一般皮肤疾病组织;(c) 黑素瘤与色素导致的良性皮肤疾病组织;(d) 黑素瘤与脂溢性角化病组织 (a) Schematic configuration; (b) Skin cancer, pre-cancer tissue and general skin disease tissue; (c) Melanoma and benign pigmented skin diseases; (d) Melanoma and seborrheic keratosis tissue 图 1 拉曼光谱检测活体皮肤组织的系统流程图及不同程度皮肤病的判别区分情况[19] Fig. 1 Schematic configuration of real-time Raman system for skin cancer diagnosis in vivo and posterior probabilities for discriminating[19] |
1.2 生物活体组织的拉曼成像检测
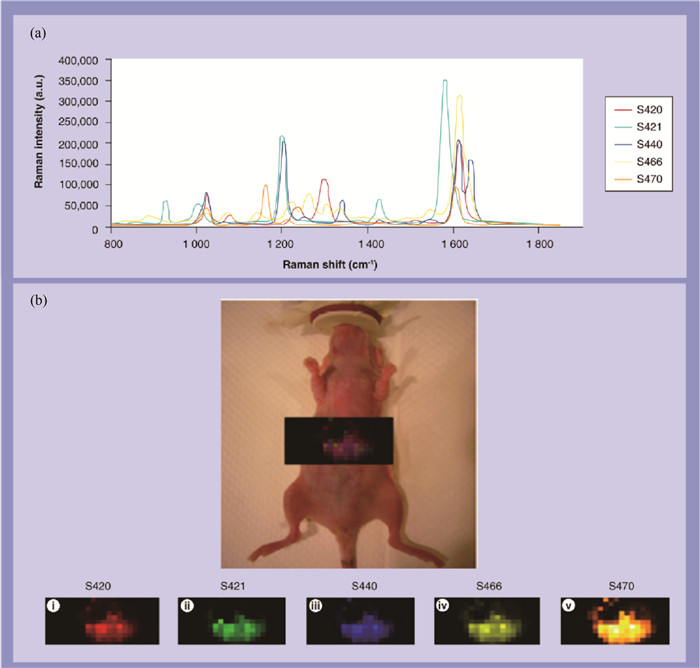
拉曼散射只占据散射光中很小的一部分,因此拉曼光谱的信号往往很弱,不利于物质的定性或定量分析。为了得到高信噪比的拉曼光谱,聚焦在生物组织上的激光光斑直径往往最大也不过几微米,对于直径较小的细胞或者小区域组织测量,光斑能够完全覆盖并得到较为全面的光谱反馈信息,而对于远大于激光光斑覆盖面积的细胞(0.1-50 mm)或组织的光谱获取,这种单点测量技术显然不适合。为了尽可能全面地获取这种大区域面积组织的光谱信息,最初主要是通过在所测组织中选取几个具有代表性的测试点,分别获取其拉曼光谱最后求平均,但这种方法无论从操作手段还是研究结果上都具有片面性。拉曼成像技术的出现成功地解决了这一难题。拉曼成像技术是一种能够进行快速、高精度面扫描的激光拉曼光谱技术,一般在几分钟之内即可获取大面积样品的高分辨拉曼图像[25-27]。近年来拉曼成像技术应用于活体检测的报道也层出不穷。李雪等[28]以活体小鼠为实验模型,利用激光点扫描技术获取小鼠耳组织不同深度的拉曼光谱,依据光谱峰归属表选取光谱中代表血糖(1 125 cm-1)、脂类(1 300 cm-1)、血红蛋白(1 549 cm-1)、蛋白质分子(1 660 cm-1)的特征峰谱带进行峰面积计算,根据峰面积的大小进行灰度成像,得出小鼠耳组织的拉曼成像图。如图 2所示,拉曼成像图可以清晰地显示这些基本物质在小鼠耳朵组织中的空间分布情况。在很多实际应用中,拉曼成像技术更多的是与表面增强拉曼技术相结合应用于肿瘤组织成像、肿瘤边缘区域的明确及肿瘤切除手术的指导。Bohndiek等[29]把4种不同的表面增强纳米粒子以一定的浓度混合注射到小鼠体内进行扩散聚集,在1 h和2 h后分别利用激光线扫描技术对小鼠肝脏区域进行拉曼成像,图像清晰地显示了不同时间段每种纳米粒子在肝脏中的分布情况,这种激光线扫描成像技术的速度比传统点扫描成像快10倍以上,使实时成像技术成为现实,并结合表面增强技术克服了拉曼信号弱这一难题,能够提供更清晰、高分辨率的拉曼成像图,为癌组织的诊断和治疗奠定基础。Zavaleta等[30]将5种不同表面增强拉曼探针静脉注射给活体小鼠,使其靶向吸附小鼠体内肺癌组织并对其进行拉曼成像,如图 3所示。图 3a是注射不同的表面增强拉曼探针后对应的活体小鼠肺部的拉曼光谱图,每种表面增强拉曼探针的标识特异性都能从光谱中体现出来,图 3b成像结果也表明这种多探针方法能够把癌组织区域更清晰地呈现出来,与目前常用于癌症诊断治疗的核磁共振和光声成像相比能够给出更清晰的癌细胞分布范围,比如癌严重区和边缘区。近年来随着激光扫描技术的发展,拉曼成像技术目前已经成功应用于生物活体各个组织器官的诊断和监测,高质量、高分辨率的拉曼成像有望攻破癌细胞切除手术上的难题。

|
| 扫描面积:40×30×15 μm2;像素点:20×15×4,积分时间:5s/光谱。(a)-(d):显微镜下不同深度小鼠耳组织;(e)-(h):利用拉曼光谱1 549 cm-1特征峰得到与(a)-(d)对应的拉曼成像图;(i)-(l):对应拉曼超三维成像图,其中(i)和(m)为立体图,(j)为切面图,(k)和(n)为俯视图,(l)和(o)为侧视图;(m)-(o):拉曼反向普通三维成像图 Scanning area: 40×30×15 μm2; Pixels: 20×15×4;Spectral integration time: 5s.(a)-(d): Ear tissue of mouse at different depths under microscope; (e)-(h): Raman imaging map corresponding to (a)-(d) obtained by Raman spectrum 1 549 cm-1 as characteristic peak; (i)-(l): Corresponding to the Raman ultra-three-dimensional imaging map, where (i) and (m) are the stereograms, (j) is the section diagram, (k) and (n) are the bird's eye view, and (l) and (o) are the lateral view; (m)-(o): Raman reverse ordinary three-dimensional imaging map 图 2 小鼠耳朵组织三维彩色成像图[28] Fig. 2 3D color imaging map of mouse ear tissue [28] |
|
| (a)5种不同拉曼信标分子的表面增强拉曼图谱:S420(红色),S421(绿色),S440(蓝色),S466(黄色),S470(橙色);(b)5种信标分子在小鼠肝脏部位的叠加拉曼成像图 (a)Surface enhanced Raman spectra of five different Raman beacon molecules: S420 (red), S421 (green), S440 (blue), S466 (yellow) and S470 (orange); (b) Superimposed Raman image of five beacon molecules in mouse liver 图 3 多表面增强拉曼探针标记的小鼠肝脏活体成像[30] Fig. 3 Multi-surface enhanced Raman probe labeled in vivo imaging of mouse liver[30] |
2 生物活体血液中的拉曼光谱检测
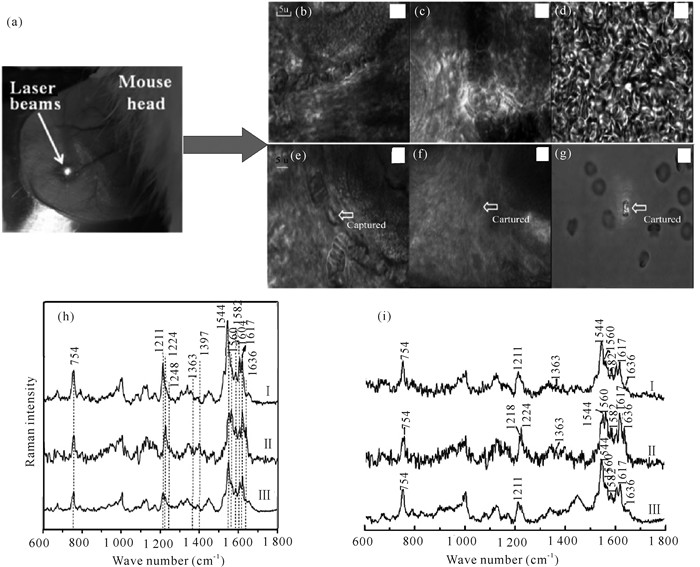
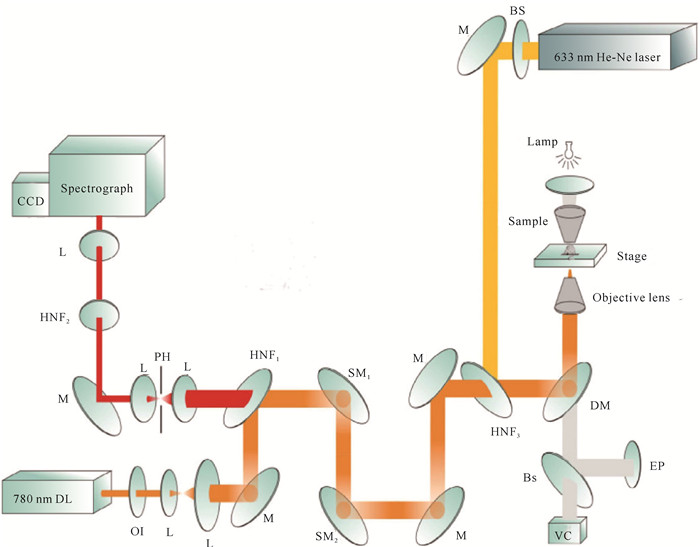
血液是生命的一种特殊宝贵资源,是生命体的重要组成部分,在生命的延续中扮演着非常重要的角色:首先血液作为运输载体把生物机体新陈代谢所需要的养分运送到全身各器官中,并把代谢所产生的废弃物运送到排泄器官进而排出体外,维持着新陈代谢的正常进行;其次,血液还具有维持体温相对恒定,内环境中水、电解质及酸碱度相对平衡的功能;最后,血液中的血细胞、血浆、白细胞等使生物机体具有抵抗和防御疾病的能力[31, 32]。由此可以看出,血液基本参与了机体生命活动的所有过程,且血液中各种成分含量的变化与生命体的健康状况紧密相关。目前,血常规和血液生化分析常作为临床上疾病诊断的主要参考依据,它们都是从生物机体中采取血样,然后把血样送入分析仪器中进行血细胞计数、形态观测及血液中其他代谢产物含量的测定,再根据检测结果判断疾病。但是该检测方法存在以下缺点:(1)检测过程繁琐,不适合连续在线监测,且血液样本在转递和检测过程中存在被污染的可能,进而导致测量结果不准确;(2)需从生物机体中采取血液样本,会给生物机体带来心理和生理上的创伤,且有些疾病检测需要频繁采集血样进行分析,从而使生命机体感到不适,甚至威胁生命安全,同时也会导致检测结果有偏差。因此迫切需要一种无创在线检测血液成分的方法,这也是近年来的国际研究热点,如旋光法、近红外光谱法、微波法等用于血液检测的方法都已有大量相关研究报道,但这些方法多数仍停留在理论研究和离体实验阶段[33-35]。激光拉曼光谱技术以其无创、快速的优势已成功应用于生物活体组织的研究中,在血液方面也已有大量的研究报道。2011年,孟令晶等[36]利用激光拉曼光谱技术分别研究了活体小鼠动脉和静脉血管中的血液及红细胞,结果如图 4所示,激光拉曼光谱技术能够无创穿透外皮肤组织,成功获取活体小鼠体内血液及红细胞的拉曼光谱,且从光谱中可以分析出动脉、静脉血管中血液指标的差异(pH值、去氧态和携氧态),这表明激光拉曼光谱技术可以作为分析血液指标的工具。牛丽媛等[37]利用激光拉曼光谱技术获取活体糖尿病小鼠和正常小鼠白细胞的拉曼光谱并对其进行分析,结果表明患病小鼠和正常小鼠白细胞光谱之间有着非常明显的差异,结合PCA主成分分析法结果可知,其诊断特异性和灵敏度达到98%,表明激光拉曼光谱技术有望发展成为一种通过对血液无损检测来诊断糖尿病的临床诊断工具。Shao等[38]利用激光拉曼光谱技术分别获取了不同血糖情况下活体小鼠血液的拉曼光谱,对光谱中的1 125 cm-1血糖峰强度进行特征分析,发现其随着血糖的变化而变化,且具有良好的线性对应关系,表明激光拉曼光谱技术能够通过对血液的分析实现血糖的无创监测,为临床医学上血糖的快速检测提供多依据参考。另外,本课题组前期也利用激光拉曼光谱技术对生物活体血液成分进行了相关研究[39, 40]:首先,利用该技术建立一种在线检测动脉血液pH值的方法,通过激光拉曼光谱技术获取不同pH环境下生物活体红细胞的拉曼光谱并对其进行分析,发现红细胞光谱中某些参数与胞外环境的pH值之间呈现良好的线性关系,该结果表明激光拉曼光谱技术可以作为一种快速、无创的血液pH值检测手段,满足临床上在疾病治疗以及大型手术过程中对血液pH值在线监测的需求;其次,利用激光拉曼光谱技术监测活体血栓形成过程中动、静脉血液的光谱(图 5,图 6),进而从分子水平上了解血栓形成过程中血液成分的变化及动、静脉血栓形成的区别,为临床上溶栓、抗栓药物的研发及血栓性疾病的治疗提供科学的理论指导。
|
| (a)耳朵组织;(b)耳朵静脉血管;(c)耳朵动脉血管;(d)体外全血;(e)活体中静脉血管红细胞被捕获的图像;(f)活体中动脉血管红细胞被捕获的图像;(g)光镊捕获体外红细胞的图像;(h)对应于(e)-(g)图像中的拉曼图谱;(i)对应于(b)-(d)图像中的拉曼图谱 (a)Ear tissue; (b)Vein vascular of ear; (c)Artery of ear; (d)Microscopic image of whole blood in vitro; (e)Microscopic image of single RBC was trapped by the optical tweezers in vein; (f)Microscopic image of single RBC was trapped by the optical tweezers in artery; (g)Single RBC was trapped by the optical tweezers in vitro; (h)Raman spectrum corresponding to (e)-(g); (i)Raman spectrum corresponding to (b)-(d) 图 4 激光拉曼光谱技术实验中活体小鼠耳朵组织的显微镜图像及对应的拉曼图谱[36] Fig. 4 Microscopic image and Raman spectrum of living mouse ear tissue in laser Raman spectroscopy experiment[36] |
|
| DL:二极管激光器;OI:光隔离器;L:透镜;M:反射镜;HNF1、HNF2、HNF3:陷波滤波片;SM1、SM2:扫描对镜;DM:二向色镜;Bs:分束器;EP:目镜;VC:摄像机;Lamp:光源(560 nm);PH:聚焦小孔;BS:光整形器 DL: Diode laser; OI: Optical isolator; L: Lens; M: Mirror; HNF1, HNF2, HNF3: Holographic notch filter; SM1, SM2: Scanning mirror; DM: Dichroic mirror; Bs: Beam splitter; EP: Eyepiece; VC: Video camera; Lamp: Light source (560 nm); PH: Pine hole; BS: Beam shaper 图 5 血栓诱导及形成过程监测的拉曼光谱系统及元器件清单[40] Fig. 5 Raman spectroscopy system and component list for thrombosis induction and formation monitoring[40] |
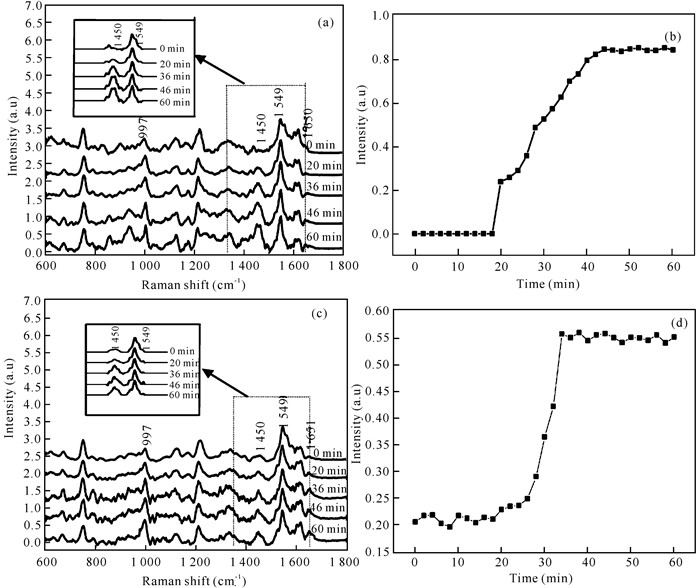
|
| 插图为基线校准和归一化后的图谱 The illustration was the spectra processed by baseline calibration and normalization 图 6 动脉(a)、静脉(c)血栓形成过程中不同阶段对应的血液拉曼图谱及光谱中1 450 cm-1峰相对强度在动脉(b)、静脉(d)血栓形成过程中的变化趋势图[40] Fig. 6 Blood Raman spectra corresponding to different stages in the process of artery (a) and vein (c) thrombus formation and the change trend of relative intensity of 1 450 cm-1 peak during artery (b) and vein (d) thrombus formation[40] |
3 展望
激光拉曼光谱技术能够实现分子级水平的检测,具有实时性、无创性、快速性、特异性等特点,是一种高灵敏度的监测手段。除此之外,激光拉曼光谱技术与活体检测结合能够在生物机体心理和生理不受任何创伤的情况下获取真实的原位探测,其探测结果的客观真实性对于生物医学研究非常有必要。近年来,激光拉曼光谱技术的活体探测已经成功地应用于人体及动物各种组织器官的研究中,其在生物医学检验中的作用也越来越凸显;且有关拉曼光谱的研究也出现了一些新的技术融合,例如表面增强拉曼光谱技术、激光光镊拉曼光谱技术、微流控拉曼光谱技术、荧光/相差显微镜拉曼光谱技术、共振拉曼光谱技术等,这些技术在继承激光拉曼光谱技术优势的基础上,进一步扩大了激光拉曼光谱技术在生物活体研究中的应用范围。但激光拉曼光谱技术在活体检测中的应用也存在很多亟待解决的问题,例如到目前为止还没有一个可供查询特征峰归属的统一的拉曼数据库,生物活体实验中如何排除复杂组织和成分的干扰得到高信噪比的拉曼光谱,活体实验的建模及操作,如何建立针对具体疾病的拉曼检验标准,怎样更好地与现行主流检验体系相融合等。因此,激光拉曼光谱技术在生物活体研究中大面积普及依然任重道远。
| [1] |
LIN C C, KUO M T, CHANG H C. Review: Raman spectroscopy-A novel tool for noninvasive analysis of ocular surface fluid[J]. Journal of Medical and Biological Engineering, 2010, 30(6): 343-354. DOI:10.5405/jmbe.846 |
| [2] |
KIM K, CON S, TAN L Z, et al. Raman spectroscopy study of rotated double-layer graphene: Misorientation-angle dependence of electronic structure[J]. Physical Review Letters, 2012, 108(24): 246103. DOI:10.1103/PhysRevLett.108.246103 |
| [3] |
LEWIS I R, EDWARDS H. Handbook of Raman spectroscopy[M]. Second Edition.Boca Raton: CRC Press, 2013.
|
| [4] |
KRUCHININA M V, GROMOV A A, KRUCHININ V N, et al. Raman spectroscopy of hemoglobin and dielectrophoresis of erythrocytes in the diagnosis of the resistant arterial hypertension[J]. Journal of Biomedical Photonics & Engineering, 2020, 6(2): 020302. DOI:10.18287/JBPE20.06.020302 |
| [5] |
MATOUSEK P, STONE N. Recent advances in the development of Raman spectroscopy for deep non-invasive medical diagnosis[J]. Journal of Biophotonics, 2013, 6(1): 7-19. DOI:10.1002/jbio.201200141 |
| [6] |
MORENO M, RANIERO L, ARISAWA E, et al. Raman spectroscopy study of breast disease[J]. Theoretical Chemistry Accounts, 2010, 125(3): 329-334. |
| [7] |
HUEFNER A, KUAN W L, MASON S L, et al. Serum Raman spectroscopy as a diagnostic tool in patients with Huntington's disease[J]. Chemical Science, 2020, 11(2): 525-533. DOI:10.1039/C9SC03711J |
| [8] |
PAYNE T D, MOODY A S, WOOD A L, et al. Raman spectroscopy and neuroscience: From fundamental understanding to disease diagnostics and imaging[J]. Analyst, 2020, 145(10): 3461-3480. DOI:10.1039/D0AN00083C |
| [9] |
BARNAS E, SKRET-MAGIERLO J, SKRET A, et al. Simultaneous FTIR and Raman spectroscopy in endometrial atypical hyperplasia and cancer[J]. International Journal of Molecular Sciences, 2020, 21(14): 4828. DOI:10.3390/ijms21144828 |
| [10] |
FARIED M, SUGA K, OKAMOTO Y, et al. Membrane surface-enhanced Raman spectroscopy for cholesterol-modified lipid systems: Effect of gold nanoparticle size[J]. ACS Omega, 2019, 4(9): 13687-13695. DOI:10.1021/acsomega.9b01073 |
| [11] |
DING Q Z, SHEIKH A R, PAN W W, et al. In situ monitoring of grape seed protein hydrolysis by Raman spectroscopy[J]. Journal of Food Biochemistry, 2021, 45(4): e13646. DOI:10.1111/jfbc.13646 |
| [12] |
VANNA R, MORASSO C, PICCOTTI F, et al. Raman spectroscopy reveals that biochemical composition of breast microcalcifications correlates with histopathologic features[J]. Cancer Research, 2020, 80(8): 1762-1772. DOI:10.1158/0008-5472.CAN-19-3204 |
| [13] |
ZHANG J, FAN Y M, HE M, et al. Accuracy of Raman spectroscopy in differentiating brain tumor from normal brain Tissue[J]. Oncotarget, 2017, 8(22): 36824-36831. DOI:10.18632/oncotarget.15975 |
| [14] |
ZHAI L N, ADLHART C, SPANO F, et al. Prediction of steam burns severity using Raman spectroscopy on ex vivo porcine skin[J]. Scientific Reports, 2018, 8(1): 6946. DOI:10.1038/s41598-018-24647-x |
| [15] |
DURAIPANDIAN S, ZHENG W, NG J, et al. In vivo diagnosis of cervical precancer using Raman spectroscopy and genetic algorithm techniques[J]. Analyst, 2011, 136(20): 4328-4336. DOI:10.1039/c1an15296c |
| [16] |
鹿绍宇, 王曙光, 刘文婧, 等. 基于拉曼光谱的卵巢癌诊断研究[J]. 光谱学与光谱分析, 2017, 37(6): 1784-1788. |
| [17] |
许智宏, 黄伟, 林多, 等. 鼻咽癌组织拉曼光谱研究进展[J]. 光谱学与光谱分析, 2016, 36(8): 2518-2521. |
| [18] |
HUANG Z W, ZENG H S, HAMAZVI I, et al. Rapid near-infrared Raman spectroscopy system for real-time in vivo skin measurements[J]. Optics Letters, 2001, 26(22): 1782-1784. DOI:10.1364/OL.26.001782 |
| [19] |
LUI H, ZHAO J H, MCLEAN D, et al. Real-time Raman spectroscopy for in vivo skin cancer diagnosis[J]. Cancer Research, 2012, 72(10): 2491-2500. DOI:10.1158/0008-5472.CAN-11-4061 |
| [20] |
SCHUT T B C, WITJES M J H, STERENBORG H J C M, et al. In vivo detection of dysplastic tissue by Raman spectroscopy[J]. Analytical Chemistry, 2000, 72(24): 6010-6018. DOI:10.1021/ac000780u |
| [21] |
MCGREGOR H C, SHORT M A, MCWILIAMS A, et al. Real-time endoscopic Raman spetroscopy for in vivo early lung cancer detection[J]. Journal of Biophotonics, 2017, 10(1): 98-110. DOI:10.1002/jbio.201500204 |
| [22] |
ÉMILEL, DALLAIRE F, YADAV R, et al. Feature engineering applied to intraoperative in vivo Raman spectroscopy sheds light on molecular processes in brain cancer: A retrospective study of 65 patients[J]. The Analyst, 2019, 142(22): 6517-6532. |
| [23] |
URS U, DOUGLAS L, HEINTZELMAN, et al. Near-Infrared Raman spectroscopy for in vivo detection of cervical Precancers[J]. Applied Spectroscopy, 2001, 55(8): 955-959. DOI:10.1366/0003702011953018 |
| [24] |
DESROCHES J, JERMYN M, PINTO M, et al. A new method using Raman spectroscopy for in vivo targeted brain cancer tissue biopsy[J]. Scientific Reports, 2018, 8(1): 1792. DOI:10.1038/s41598-018-20233-3 |
| [25] |
BOURBOUSSON M, SOOMRO I, BALDWIN D, et al. Ex vivo Raman spectroscopy mapping of lung tissue: Label-free molecular characterization of nontumorous and cancerous tissues[J]. Journal of Medical Imaging, 2019, 6(3): 036001. DOI:10.1117/1.JMI.6.3.036001 |
| [26] |
路交, 朱姗姗, 崔笑宇, 等. 拉曼光谱成像技术及其在生物医学中的应用[J]. 中国激光, 2018, 45(3): 70-79. |
| [27] |
GAIFULINA R, NUNN A D G, DRAPER E R C, et al. Intra-operative Raman spectroscopy and ex vivo Raman mapping for assessment of cartilage degradation[J]. Clinical Spectroscopy, 2021(3): 100012. DOI:10.1016/J.CLISPE.2021.100012 |
| [28] |
李雪, 高国明, 牛丽媛, 等. 活体小鼠耳朵的拉曼成像方法研究[J]. 分析化学, 2012, 40(10): 1494-1499. |
| [29] |
BOHNDIEK S E, WAGADARIKAR A A, ZAVALETA C L, et al. A small animal Raman instrument for rapid, wide-area, spectroscopic imaging[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(30): 12408-12413. DOI:10.1073/pnas.1301379110 |
| [30] |
ZAVALETA C L, SMITH B R, WALTON I, et al. Multiplexed imaging of surface enhanced Raman scattering nanotags in living mice using noninvasive Raman spectroscopy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(32): 13511-13516. DOI:10.1073/pnas.0813327106 |
| [31] |
周俊, 张艳春. 血液运输研究现状[J]. 中国输血杂志, 2019, 32(4): 313-316. |
| [32] |
黄峰, 朱卓玲. 模拟血液循环回路的发展[J]. 生物医学工程研究, 2019, 38(2): 256-262. |
| [33] |
ANWAR S, FIRDOUS S. Optical diagnosis of dengue virus infected human blood using Mueller matrix polarimetry[J]. Optics and Spectroscopy, 2016, 121(2): 322-325. DOI:10.1134/S0030400X16080208 |
| [34] |
PARASKEVAIDI M, MORAIS C L M, FREITAS D L D, et al. Blood-based near-infrared spectroscopy for the rapid low-cost detection of Alzheimer's disease[J]. The Analyst, 2019, 143(24): 5959-5964. |
| [35] |
CHOI H, NAYLON J, LUZIO S, et al. Design and in vitro interference test of microwave noninvasive blood glucose monitoring sensor[J]. IEEE Transactions on Microwave Theory and Techniques, 2015, 63(10): 3016-3025. DOI:10.1109/TMTT.2015.2472019 |
| [36] |
孟令晶, 林漫漫, 牛丽媛, 等. 活体小鼠中单个红细胞的拉曼光谱分析[J]. 分析化学, 2011, 39(9): 1394-1399. |
| [37] |
牛丽媛, 林漫漫, 李雪, 等. 活体糖尿病小鼠中单个白细胞的拉曼光谱分析[J]. 激光与光电子学进展, 2012, 49(6): 174-179. |
| [38] |
SHAO J W, LIN M M, LI Y Q, et al. In vivo blood glucose quantification using Raman spectroscopy[J]. PloS One, 2012, 7(10): e48127. DOI:10.1371/journal.pone.0048127 |
| [39] |
LIN M M, XU B, YAO H L, et al. An in vivo quantitative Raman-pH sensor of arterial blood based on laser trapping of Erythrocytes[J]. Analyst, 2016, 141(10): 3027-3032. DOI:10.1039/C5AN02315G |
| [40] |
LIN M M, SHEN A G, YAO H L, et al. Real-time molecular profiling of photochemically induced rat thrombosis in vivo through quantitative Raman analysis of blood[J]. Laser Physics Letters, 2014, 11(11): 115607. DOI:10.1088/1612-2011/11/11/115607 |



