围填海是沿海缓解土地供求矛盾、扩大社会生存和发展空间的途径之一,其带来巨大经济利益的同时,随之产生的负面影响也不容忽视。如围填海改变了区域潮流运动特性,引起泥沙冲淤和污染物迁移规律的变化,对区域生态系统、防洪和航运造成影响[1];项目建设对滩涂造成了侵占,改变了周围海域水动力条件,对海域生态环境和渔业资源造成严重的影响[2]。随着环保意识的提高,人们对围填海的考虑已经越来越慎重[3],对已有的围填海开展了一系列修复措施的研究[4, 5],并提出了相应的对策[3, 6]。
启东长江口围填海工程始于2006年,圈围面积763.13 hm2,2011年于围滩堤坝外侧2 000 m处修建闭合围堤,用海面积47.066 7 hm2,建成超大型综合旅游度假居住区[7],围填工程位于启东市寅阳镇兴垦区外侧东南部沿海。该区域为粉沙淤泥质海岸,北临黄海、南面长江,海域为浅滩、深槽相间,营养物质丰富,是很多鱼类洄游、索饵的重要通道,也是很多贝类、藻类的重要养殖基地。
大型底栖动物生活在海域的底层或近底层,其中大量的鱼类、虾蟹类、软体动物是经济水产的重要组成部分,多毛类是研究环境的重要指示生物[8],对于掌握渔业资源现状和近岸海域生态系统具有重要意义[9]。围填海对海洋底栖动物的影响方面已有部分研究,比如李晓静等[10]围绕渤海湾曹妃甸围填海工程对大型底栖动物群落影响进行分析,认为围填海对该区域底栖动物的种类和群落组成产生影响;袁兴中等[11]对长江口南岸底栖动物群落结果进行调查,分析围垦对该海域生态系统的影响。关于启东长江口围填海后底栖动物的群落组成变化未见报道,本研究利用2019年4月、7-8月围堤外侧海域监测资料,结合历史数据,分析启东长江口围填海后大型底栖动物的季节变化和区域差异,探索围填海后该海域大型底栖动物的变动及影响因子,为近岸海洋生物资源与环境保护、海洋规划及可持续发展提供数据支撑。
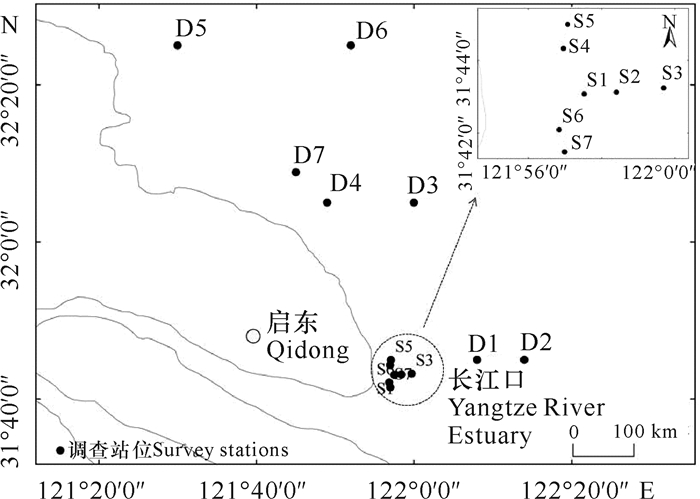
1 材料与方法 1.1 站位布设及样品采集于2019年4月(春季)、2019年7-8月(夏季)在江苏启东长江口围堤外近侧海域(下文称近侧海域)均匀布设7个站位(S),分别位于围堤的北侧、东侧和南侧,在围堤外远侧(下文称远侧海域)向东部和北部辐射的自然渔业水域设置7个站位(D)(图 1)。调查采用取样面积0.1 m2的采泥器采集底泥,每个站位取两次,合并为当站样品,经0.5 mm孔径的网筛分选后用75%的酒精现场固定生物样,带回实验室进行种类鉴定、计数和称重。样品的处理、保存、称重均按照《海洋调查规范》第6部分:《海洋生物调查》(GB/T 12763.6-2007)[12]进行。水温、盐度、pH等环境因子利用YSI (Pro1020)环境监测系统现场同步测定,测定方法按照《海洋监测规范》(GB 17378.4-2007)[13]进行。
|
| 图 1 2019年启东长江口采样站位 Fig. 1 Sampling stations of Qidong Yangtze River Estuary in 2019 |
1.2 群落特征分析
采用优势度指数、多样性指数计算大型底栖动物群落特征,计算公式如下:
优势度指数Y=(ni/N)fi,
Shannon-wiener多样性指数
| $ H' = - \sum\limits_{i = 1}^S {{P_i}{{\log }_2}{P_i}} , $ |
Margalef物种丰富度指数d=(S-1)/log2N,
Pielou物种均匀度指数J′=H′/log2S,
式中,N为采泥样品中所有种类的总个体数;ni为第i种的个体数;fi为i种在各站位出现的频率;S为种类总数;Pi为第i种的数量与样品中总个体数的比值。当物种优势度Y>0.02时,该种为优势种。
大型底栖动物差异显著性分析利用Excel 2010进行,冗余分析(Redundancy Analysis, RDA)排序采用CANOCO 5.0软件,站位图用Arcgis 10.3.1绘制。
2 结果与分析 2.1 种类组成及优势种2019年春、夏季共采集到40种大型底栖动物,其中环节动物和软体动物是主要类群(表 1)。物种数表现为远侧海域(29种)>近侧海域(19种),两个区域的共同种有8种:环节动物5种(加州齿吻沙蚕Nephtys californiensis、小头虫Capitella capitata、异足索沙蚕Lumbrineris heteropoda、长锥虫Haploscoloplos elongatus、中蚓虫Mediomastus sp.),软体动物2种(白带笋螺Terebra dussumieri、伶鼬榧螺Oliva mustelina)、纽形动物1种。春季近侧海域采集到的环节动物和软体动物均是远侧海域的一半,其中加州齿吻沙蚕、异足索沙蚕、中蚓虫、伶鼬榧螺是两个区域的共同种。夏季近侧海域出现的物种组成接近于远侧海域,从单一季节出现的共同种的生态习性来看,近侧海域春、夏季的共同种主要为常见的广温暖水种,这些种类生活在细沙或泥沙质浅海,对底质环境的适应能力较强,而远侧海域春、夏季的共同种组成更为丰富。相同季节的区域间物种数比较,春、夏季均是近侧海域低于远侧海域,但两者之间不存在显著差异(P>0.05)。春、夏季远侧海域的优势种均多于近侧,近侧海域春、夏季共有种为伶鼬榧螺,远侧海域春、夏季共有种为异足索沙蚕,春、夏季的优势种更替均较为明显(表 2)。
| 类群 Groups |
S区域S area | D区域D area | |||
| 春季 Spring |
夏季 Summer |
春季 Spring |
夏季 Summer |
||
| 软体动物Mollusc | 2 | 4 | 4 | 5 | |
| 环节动物Annelida | 6 | 3 | 12 | 9 | |
| 甲壳动物Crustacean | 0 | 1 | 1 | 2 | |
| 其他动物Other animals | 2 | 4 | 2 | 2 | |
| 总物种数Total species | 10 | 12 | 19 | 18 | |
| 类群 Groups |
物种名 Species names |
优势度指数Dominance index | |||
| S-春季 S-Spring |
S-夏季 S-Summer |
D-春季 D-Spring |
D-夏季 D-Summer |
||
| 软体动物Mollusc | 缢蛏Sinonovacula constricta | - | 0.20 | - | - |
| 软体动物Mollusc | 朝鲜笋螺Terebra koreana | - | 0.09 | - | - |
| 软体动物Mollusc | 伶鼬榧螺Oliva mustelina | 0.08 | 0.05 | 0.10 | - |
| 纽形动物Nemertea | 纽虫Nemertea | - | 0.03 | - | - |
| 环节动物Annelida | 异足索沙蚕Lumbrineris heteropoda | - | 0.05 | 0.02 | 0.02 |
| 环节动物Annelida | 加州齿吻沙蚕Nephtys californiensis | 0.16 | - | - | 0.10 |
| 环节动物Annelida | 中蚓虫Mediomastus sp. | 0.07 | - | - | - |
| 环节动物Annelida | 长锥虫Haploscoloplos elongatus | - | - | 0.09 | - |
| 环节动物Annelida | 竹节虫Phasmatidae | - | - | 0.03 | - |
| 软体动物Mollusc | 青蛤Cyclina sinensis | - | - | 0.02 | - |
| 环节动物Annelida | 须鳃虫Cirriformia tentaculata | - | - | - | 0.03 |
| 环节动物Annelida | 树蛰虫Pista cristata | - | - | - | 0.03 |
| 软体动物Mollusc | 小刀蛏Cultellus attenuatus | - | - | - | 0.06 |
| 软体动物Mollusc | 彩虹明樱蛤Moerella iridescens | - | - | - | 0.04 |
2.2 生物密度和生物量
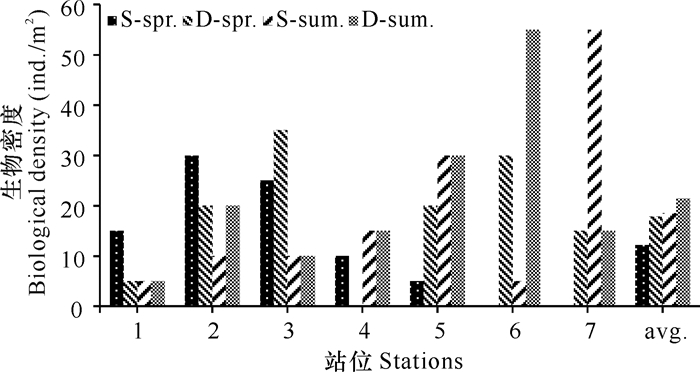
近侧海域春、夏季平均生物密度为15.36 ind./m2,夏季较高,为18.57 ind./m2,其中软体动物的贡献最大,占总平均生物密度的61.54%,其次为环节动物(15.38%)。春季为12.14 ind./m2,其中环节动物贡献最高(76.47%),其次为软体动物(11.76%)。远侧海域两季平均生物密度为19.64 ind./m2,春季为17.86 ind./m2,夏季为21.43 ind./m2,两个航次的大型底栖动物均以环节动物为主要类群,其次是软体动物。生物密度在季节间和区域间差异均不显著(P>0.05)(图 2)。
|
| 图 2 启东长江口大型底栖动物生物密度的分布 Fig. 2 Spatial distributions of macrobenthos density in Qidong Yangtze River Estuary |
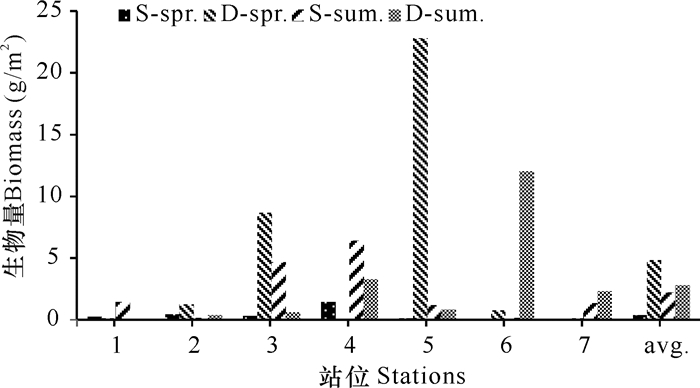
近侧海域春、夏季平均生物量为1.28 g/m2,春季为0.36 g/m2,主要类群是软体动物(52.65%)和环节动物(39.29%);夏季为2.20 g/m2,主要类群是软体动物(65.04%)和环节动物(30.57%)。远侧海域平均生物量为3.80 g/m2,春季为2.51 g/m2,主要类群是软体动物(78.50%)和环节动物(19.09%);夏季平均生物量为1.64 g/m2,主要类群是软体动物(58.14%)、环节动物(23.19%)和甲壳动物(16.80%)。从季节分布来看,夏季近侧海域大型底栖动物的生物量较高,春季较低,季节间差异不显著(P>0.05)。从空间分布来看,近侧海域春、夏季平均生物量低于远侧海域,同期区域间差异性均不显著(P>0.05)(图 3)。
|
| 图 3 启东长江口大型底栖动物生物量的分布 Fig. 3 Spatial distributions of macrobenthos biomass in Qidong Yangtze River Estuary |
2.3 生物多样性指数
近侧海域春、夏季物种香农威尔多样性指数H′、均匀度指数J′和丰富度指数D平均值见表 2,近侧海域的生物多样性指数平均低于远侧海域,3个多样性指数在区域间差异均不显著(P=0.882>0.05、P=0.326>0.05、P=0.378>0.05)。
| 区域-季节 Areas and seasons |
香浓-威尔指数H′ Shannon-wiener index H′ |
Pielou均匀度指数J′ Pielou′s evenness index J′ |
丰富度指数D Abundance index D |
| S-春S-spr. | 1.38±0.80 | 0.65±0.30 | 0.85±0.56 |
| S-夏S-sum. | 2.18±0.76 | 0.75±0.20 | 1.36±0.56 |
| S-平均S-avg. | 1.78±0.70 | 0.70±0.25 | 1.10±0.56 |
| D-春D-spr. | 2.21±1.02 | 0.86±0.35 | 1.70±0.79 |
| D-夏D-sum. | 1.50±0.83 | 0.86±0.35 | 1.20±0.59 |
| D-平均D-avg. | 1.85±0.93 | 0.86±0.35 | 1.45±0.69 |
2.4 大型底栖动物与环境因子相互关系
春、夏季大型底栖动物平均密度之间无显著性差异,故将两季数据合并后与环境因子进行相关性分析,主要大型底栖动物选取出现在2个以上站位的物种[14](表 3)。对大型底栖动物进行除趋势对应分析(Detrended Correspondence Analysis,DCA),得到的梯度长度最大值为2.64,故选用线性的RDA排序法研究群落结构与环境因子的相互关系。图 4为围堤外侧海域大型底栖动物与环境因子的RDA排序结果,站位分布区分比较明显。远侧海域的站位(D)位于RDA排序图的左侧,其中D3、D6、D7与水深呈正相关,这些站点代表种彩虹明樱蛤Moerella iridescens、长锥虫与温度、水深呈正相关,与悬浮物、营养盐呈负相关。近侧海域的站位(S)大部分位于排序图的右侧,其中S1、S2、S3、S6、S7与盐度和pH呈负相关,这些站点代表种白带笋螺、缢蛏、中蚓虫与盐度和pH呈负相关。加州齿吻沙蚕、纽虫与悬浮物、营养盐呈正相关,与水深呈负相关。S4、S5与环境因子的相关性比较小,这两个站点分布在围堤近侧海域的北部,其代表种朝鲜笋螺受环境影响较小。
| 代码 Code |
大型底栖动物 Macrobenthos |
| n1 | 彩虹明樱蛤Moerella iridescens |
| n2 | 加州齿吻沙蚕Nephtys californiensis |
| n3 | 纽虫Nemertea |
| n4 | 异足索沙蚕Lumbrineris heteropoda |
| n5 | 长锥虫Haploscoloplos elongatus |
| n6 | 竹节虫Phasmatidae |
| n7 | 白带笋螺Terebra dussumieri |
| n8 | 朝鲜笋螺Terebra koreana |
| n9 | 缢蛏Sinonovacula constricta |
| n10 | 中蚓虫Mediomastus sp. |
| 注:在2个以上站位出现的物种 Note:Species at more than 2 stations | |

|
| 图 4 启东长江口大型底栖动物群落的RDA排序 Fig. 4 RDA ordination of macrobenthos community in Qidong Yangtze River Estuary |
3 讨论 3.1 种类组成及优势种的变化
底栖动物的生存与海域环境和底质状况有关,底栖动物对于反映海域状况、底质环境的变化和人类扰动等具有重要指示作用[8]。围填海对海域滩涂和近海资源的侵占,造成海域生境改变和栖息地的萎缩[1, 2]。已有研究表明,长江口南岸围垦造成潮滩湿地生境生态功能退化、丧失,致使底栖动物群落结构及多样性发生改变[11]。本研究也发现春、夏季近侧海域大型底栖动物的种类数和优势种均低于远侧海域,由此可以推断,围填海对该区域大型底栖动物种类数的降低和优势种的减少存在一定的影响。当然,也要综合考虑时间尺度、气候环境、捕捞区域、养殖等多重因素[15-17]。也有学者研究发现围填海工程间接降低大型底栖动物的种类数和多样性指数等[18],同时会降低甲壳动物和软体动物的比例,增加环节动物比例,从而改变大型底栖动物群落组成。从本研究的优势种组成可以看出,甲壳动物完全被取代,软体动物和环节动物成为主要优势类群,其中伶鼬榧螺为近侧海域春、夏季的共有优势种,广温性暖水种伶鼬榧螺20年以前在江苏主要栖息在北部海域[16],喜栖息于以细沙或泥沙质浅海,对水深的适应性较强[19],是典型的干扰耐受种, 说明近侧海域的生态环境遭受干扰严重[10]。此外优势种中多为环节动物,可以看出,围垦后大型底栖动物个体小型化明显,在其他围填海区域也初见端倪[10]。
3.2 生物密度和生物量的变化近侧海域和远侧海域平均生物密度分别为15.36,19.64 ind./m2,平均生物量分别为1.28,3.80 g/m2。与同期远侧海域相比,近侧海域的生物密度和生物量略低但差异未达到显著水平,由于主要贡献物种组成略有差异,如春季远侧海域生物量较近侧海域较高,主要是由于D5站位伶鼬榧螺(22.63 g/m2)和D3站位青蛤(3.06 g/m2)的贡献。近侧海域本来属于资源丰富的滩涂潮间带[15],随着围垦后岸线的改变,近侧海域的经济类软体动物逐渐向外迁移或者被小型的生物所取代。相比该区域较近时期的调查结果也可发现该项规律[19],说明围垦对大型底栖动物的分布以及数量等均产生了一定的影响。相比2013年启东近岸海域的研究结果[20],密度和生物量都较低,2013年调查与本研究接近的靠近长江口南部的几个站点密度和生物量也处于较低水平,其中站位14受扰动严重,生物的数量和种类均处于最低水平,该站位位于本研究的近侧海域,推测由于围填海等近岸较为频繁的用海活动,加上陆源污染和冲淡水的汇入,大型底栖动物处于比较动荡的状态。相比围垦前该区域邻近海域调查结果[16, 17],密度、生物量也明显降低。围填海改变了原来海区的海洋水动力[10],影响了潮流、冲淤等,降低了近岸海水与外海交换能力,大型底栖动物的生存遭受前所未有的挑战。
3.3 生物多样性的变化2019年近侧海域生物多样性指数较2011年有所下降[7],略低于远侧海域。香浓威尔指数H′能反映水域环境受人为影响程度,2011年的H′=2.54±0.55>2.0,2019年近侧及远侧海域的H′分别为1.78±0.70,1.85±0.93。H′=1-3属于中度影响范围,说明2011年围堤外近侧海域已经开始受到一定影响,而2019年影响更为明显。对比1997-1998年如东-长江口附近海域底栖生物调查[16],H′>3,D=2.07-4.36,J=0.71-0.97,本研究远侧海域的H′和D也均有明显的降低。可见围填海对附近海域大型底栖动物造成明显的影响。在此长期生存的底栖动物种类越来越少,底栖动物的生物多样性指数有所降低。由于围垦、岸线变化等因素,导致近岸海域的底栖生态系统遭受影响,底栖动物的群落结构和多样性均受不同程度的影响,这与长江口南岸和天津沿岸的围填海结果类似[11, 18]。
3.4 围填海对大型底栖动物的影响围填海过程产生的悬浮物直接或间接损害底栖动物的生长存活。首先,悬浮物的矿质颗粒导致水体浑浊度增加,透明度降低,不利于天然饵料的繁殖生长。其次,很多底栖动物(如贝类等)幼体营浮游生活,大量存在的悬浮物会造成其呼吸困难和窒息现象。再次,围填海后人为扰动产生的污染物排放到底质环境中,也会影响底栖动物的生长。此外,围填海会引起海水交换能力的下降,易导致海水富营养化,大型底栖动物群落不可避免地受到伤害[10]。
本研究远侧海域的站位(D)位于RDA排序图的左侧,接近长江口的D1、D2站点与温度呈正相关,与悬浮物和营养盐呈负相关。有研究表明营养盐特别是无机氮能显著影响底栖动物的多样性[21]。说明围填海后海域原有的平稳流态受到扰动,产生滞留带,海水更易富营养化,从而影响大型底栖动物。D3、D6、D7站点离岸较远,与水深关系较为密切,该区域离围垦区较远,水深相对近侧海域较深,底栖动物的生存空间相对自由。纵观国内不同海域的底栖动物影响因子,渤海湾是水深、无机氮和溶解氧[22],胶州湾是底质和温度[23],东海大桥风电场水域是温度和盐度[24],长江口及邻近海域最主要的环境因子是水深、盐度和亚硝酸盐[25],杭州湾是温度、盐度、水深和叶绿素a[26]。国外的一些研究认为,沉积物、溶解氧等可影响底栖动物[27, 28]。可见,通常情况下影响大型底栖动物的因子主要以温度、盐度、水深为主,当然沉积物、底质、溶解氧、叶绿素等也是至关重要的影响参数,这可能要考虑区域、海况、物种的具体组成等多种因素[23, 29]。而围填海过程产生大量的悬浮物,围填海后人为扰动及污染输入等,这些要素都与底栖动物的生存息息相关,所以围填海对底栖动物的影响不言而喻。
围填海建设占用潮间带等近岸海域生物资源栖息地,致使水深变浅,底栖生境遭受永久性的破坏[10]。工程建设占用的沿海海涂和近海海域原为许多贝类、鱼类的栖息地和产卵场[11],本研究围填海工程外侧海域分布有大黄鱼产卵场、凤鲚产卵场、索饵场、海蜇产卵洄游路线等[30],具有丰富的经济贝类资源和藻类资源[15],由于围填海建设导致底栖动物栖息地逐步丧失,近岸海域底栖动物资源逐渐匮乏并向外迁移,底栖动物的优势种逐渐由抗干扰耐受种替代并且趋于小型化。围填海使近岸潮流水动力减弱,淤泥质粉砂沉降堆积,原有底质改变[10, 31],生态适应性强的物种才能在此长期生存。底质、水深、盐度等是影响大型底栖动物分布的重要环境因子[32]。如本研究近侧海域的站位(S)主要受盐度和pH影响。近侧海域的代表种白带笋螺、缢蛏、中蚓虫与盐度呈负相关,软体动物和多毛类是一定范围水深和盐度内栖息的主要类群,其中缢蛏与盐度呈负相关,因其对淡水的特殊耐受性所致[33]。加州齿吻沙蚕、纽虫对悬浮物、营养盐具有一定的耐受性,与水深呈负相关,这可能也是源于其生活习性。有研究表明水深是影响多毛类的主要环境因子[34],他们大多个体小,繁殖能力强,适应恶劣的环境的能力较强[26],因此,他们逐渐替代了个体大、生物量高的经济软体类动物,作为围填海后近侧海域的主要种类生存下来。
本研究春、夏两个季节主要类群是软体动物和环节动物,与水深、盐度和悬浮物的关系较为密切,水深和悬浮物的关系是相辅相成的,围填海后水深较浅的地方,受人为干扰大、悬浮物相对较多,底栖动物的生长和存活势必受到一定的影响。引起盐度变化的原因主要是围填海后水体交换能力的降低以及受长江冲淡水输入的影响比较频繁,该海域只有对盐度耐受较大的物种才能生存。
4 结论本研究共获得大型底栖动物40种,以软体动物和环节动物为主,优势种的季节更替较为明显,历史上的经济类软体动物逐渐向外迁移或者被小型的生物所取代,围填海后大型底栖动物呈现小型化、单一化趋势,数量和多样性指数有所下降,总体底栖生态状况受损明显。在沿海经济发展的过程中,大型底栖动物和生态环境等受到不同程度的影响,恢复是一项长期的任务,为营造健康良好的渔业生态环境、实现渔业资源的可持续利用,要从长远考虑,继续加强生物资源和岸线保护,在恢复措施和保护制度上深入研究。
| [1] |
王江竹, 宛立, 王伟, 等. 围填海工程对海洋生态环境的影响[J]. 资源节约与环境, 2018(10): 11. |
| [2] |
李铁军, 徐丹, 徐汉祥, 等. 浙江省围填海工程对海洋生态环境和渔业资源的影响分析[J]. 现代农业科技, 2017(18): 213-214, 219. DOI:10.3969/j.issn.1007-5739.2017.18.140 |
| [3] |
侯西勇, 张华, 李东, 等. 渤海围填海发展趋势、环境与生态影响及政策建议[J]. 生态学报, 2018, 38(9): 3311-3319. |
| [4] |
林磊, 刘东艳, 刘哲, 等. 围填海对海洋水动力与生态环境的影响[J]. 海洋学报, 2016, 38(8): 1-11. DOI:10.3969/j.issn.0253-4193.2016.08.001 |
| [5] |
俞存根, 张平, 郭朋军, 等. 围填海区渔业生态损害的补偿标准定量研究——以舟山近岸海域为例[J]. 生态学报, 2019, 39(4): 1416-1425. |
| [6] |
高文斌, 刘修泽, 段有洋, 等. 围填海工程对辽宁省近海渔业资源的影响及对策[J]. 大连水产学院学报, 2009, 24(S1): 163-166. |
| [7] |
佚名. 江苏启东围堤建设工程海洋现状监测报告[R]. 南通: 江苏省海洋水产研究所, 2011.
|
| [8] |
李新正, 刘录三, 李宝泉, 等. 中国海洋大型底栖生物: 研究与实践[M]. 北京: 海洋出版社, 2010: 1-378.
|
| [9] |
刘录三, 郑丙辉, 李宝泉, 等. 长江口大型底栖动物群落的演变过程及原因探讨[J]. 海洋学报: 中文版, 2012, 34(3): 134-145. |
| [10] |
李晓静, 周政权, 陈琳琳, 等. 渤海湾曹妃甸围填海工程对大型底栖动物群落的影响[J]. 海洋与湖沼, 2017, 48(3): 617-627. |
| [11] |
袁兴中, 陆健健. 围垦对长江口南岸底栖动物群落结构及多样性的影响[J]. 生态学报, 2001, 21(10): 1642-1647. DOI:10.3321/j.issn:1000-0933.2001.10.012 |
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋调查规范: GB/T 12763.6-2007[S]. 北京: 中国标准出版社, 2008.
|
| [13] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋监测规范: GB 17378.4-2007[S]. 北京: 中国标准出版社, 2008.
|
| [14] |
TER BRAAK C J F. Canonical correspondence analysis: A new eigenvector technique for multivariate direct gradient analysis[J]. Ecology, 1986, 67(5): 1167-1179. DOI:10.2307/1938672 |
| [15] |
任美锷. 江苏省海岸带和海涂资源综合调查报告[R]. 北京: 海洋出版社, 1986: 1-512.
|
| [16] |
胡颢琰, 黄备, 唐静亮, 等. 渤、黄海近岸海域底栖生物生态研究[J]. 东海海洋, 2000, 18(4): 39-46. DOI:10.3969/j.issn.1001-909X.2000.04.006 |
| [17] |
张长宽. 江苏省近海海洋环境资源基本现状[M]. 北京: 海洋出版社, 2013.
|
| [18] |
张壮壮, 王琳, 杨文波, 等. 渤海湾近海栖息地变化对大型底栖动物群落结构的影响[J]. 中国水产科学, 2015, 22(1): 106-112. |
| [19] |
张虎, 袁健美, 刘必林, 等. 江苏沿岸海域大型底栖生物群落特征[J]. 大连海洋大学学报, 2017, 32(6): 732-739. |
| [20] |
季晓, 徐韧, 刘材材, 等. 江苏启东近岸海域大型底栖动物群落健康评价[J]. 海洋渔业, 2016, 38(4): 348-363. DOI:10.3969/j.issn.1004-2490.2016.04.002 |
| [21] |
DIPPNER J W, IKAUNIECE A. Long-term zoobenth-os variability in the Gulf of Riga in relation to climate variability[J]. Journal of Marine Systems, 2001, 30(3/4): 155-164. |
| [22] |
周然, 覃雪波, 彭士涛, 等. 渤海湾大型底栖动物调查及与环境因子的相关性[J]. 生态学报, 2014, 34(1): 50-58. |
| [23] |
李宝泉, 李新正, 于海燕, 等. 胶州湾底栖软体动物与环境因子的关系[J]. 海洋与湖沼, 2005, 36(3): 193-198. DOI:10.3321/j.issn:0029-814X.2005.03.001 |
| [24] |
宋超, 侯俊利, 赵峰, 等. 春、秋季东海大桥海上风电场水域鱼类群落结构[J]. 海洋科学, 2017, 41(6): 34-40. |
| [25] |
刘勇, 线薇薇, 孙世春, 等. 长江口及其邻近海域大型底栖动物生物量、丰度和次级生产力的初步研究[J]. 中国海洋大学学报: 自然科学版, 2008, 38(5): 749-756. |
| [26] |
寿鹿, 曾江宁, 廖一波, 等. 杭州湾大型底栖动物季节分布及环境相关性分析[J]. 海洋学报: 中文版, 2012, 34(6): 151-159. |
| [27] |
MUNIZ P, PRIES A M S. Polychaete associations in a subtropical environment (Sāo sebastiāo channel, Brazil): A structural analysis[J]. Marine Ecology, 2000, 21(2): 145-160. DOI:10.1046/j.1439-0485.2000.00696.x |
| [28] |
CHAINHO P, COSTA J L, CHAVES M L, et al. Seasonal and spatial patterns of distribution of subtidal benthic invertebrate communities in the Mondego River, Portugal-a poikilohaline estuary[J]. Hydrobiologia, 2006, 555(1): 59-74. DOI:10.1007/s10750-005-1132-2 |
| [29] |
李宝泉, 李晓静, 周政权, 等. 围填海及其对底栖生物群落的生态效应[J]. 广西科学, 2016, 23(4): 293-298. |
| [30] |
周永东, 李圣法. 东海区主要经济种类三场一通道及保护区图集[M]. 北京: 海洋出版社, 2018: 1-105.
|
| [31] |
佚名. 启东市围堤建设工程海洋生态环境跟踪监测报告[R]. 南通: 江苏省海洋水产研究所, 2019.
|
| [32] |
李宝泉, 李新正, 王洪法, 等. 长江口附近海域大型底栖动物群落特征[J]. 动物学报, 2007, 53(1): 76-82. |
| [33] |
张玺, 黄修明. 中国海竹蛏科的研究[J]. 动物学报, 1964, 16(2): 193-206. |
| [34] |
MUTLU E, CINAR M E, ERGEV M B. Distribution of soft bottom polychaetes of the Levantine coast of Turkey, eastern Mediterranean Sea[J]. Journal of Marine Systems, 2010, 79(1/2): 23-35. |



