2. 广西科学院, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynethesis Chemistry, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
中国是农业种植和畜禽养殖的大国,农作物秸秆的露天焚烧及畜禽粪便的随意排放给环境带来严重的污染[1, 2]。目前,高温堆肥是农作物秸秆及畜禽粪便资源化利用的重要方式。堆肥技术以微生物为主导[3],对堆肥中结构复杂的木质纤维素原料进行解聚或分解[4, 5],转化成农业生产上所需的肥料。堆肥的高温期温度可达55℃以上,是原料中病原菌、虫卵和杂草种子灭活及驱动秸秆腐熟的主要阶段[3]。但是,过高的温度会抑制土著微生物的活性,降低堆肥中微生物的丰度和多样性,甚至导致菌株活性丧失,从而限制木质纤维素的降解速度[6, 7],而在堆肥过程中添加耐高温纤维素分解菌则可以有效解决这些问题[8]。研究表明,添加纤维素降解微生物,特别是高温降解微生物,能够加快木质纤维素降解,促进堆肥腐熟,提高堆肥效率[9-11]。目前,国内外学者已从堆肥中分离出多种高温纤维素降解菌,如链霉菌Streptomyces sp.CN9[12],烟曲霉菌Aspergillus fumigatus Z5[13],解淀粉芽孢杆菌Bacillus amyloliquefaciens XD-3[14],梭状芽孢杆菌Clostridium sp.,假丝酵母菌Candida sp.[15]等。然而,已有报道中高温纤维素分解菌耐受温度大多为50-60℃,而实际生产中好氧堆肥高温期的温度可高达70℃,这使得大部分菌株的活性降低甚至失活,从而导致该阶段的纤维素分解速度大幅下降,难以适应生产需求。为了更好地满足实际生产需求,筛选耐高温的纤维素降解菌并研究其纤维素酶活的热稳定性,对加速高温好氧堆肥的腐熟进程具有重要意义。
红树林作为热带和亚热带的独特潮间带生态系统,常年受到海水周期性浸淹、波浪、强风、强流、径流、沉积物及污水(废水)等特殊因素的影响,促使其组成成分多样化,能量和物质循环速度加快,生产力和有机质的降解活性增强,大量的植物残体和落叶的堆积,不断为微生物提供纤维素等物质[16]。胡芮等[17]在红树林土壤中获得一株产嗜热纤维素酶的枯草芽孢杆菌,该菌株在55-60℃时可维持较高酶活;曾思泉等[18]从三亚红沙河红树林区分离出一株降解纤维素的枝孢属真菌SCSIO 43503,在45-50℃时纤维素酶活性较高。可见,从红树林生境获得产纤维素酶菌株具有广泛的研究前景。广西山口红树林是广西红树林湿地特征的红树林自然保护区之一[19],属北热带季风区,生长着白骨壤、桐花树、秋茄等红树植物,有111种大型底栖动物[20],其海水污染程度低,动植物资源丰富,具有较强的研究价值。
本研究以广西山口红树林保护区内的土壤作为研究对象,通过16S rRNA基因序列的系统发育树分析,获得红树林土壤中可培养芽孢杆菌的多样性信息。同时,结合刚果红纤维素培养法、滤纸条崩解试验、纤维素酶活测定法,筛选出具有耐高温、稳定性强的纤维素酶活性菌株,为从海洋环境中寻找新的微生物资源提供理论依据和实践指导。
1 材料与方法 1.1 材料 1.1.1 红树林土壤样本2019年5月从广西山口红树林自然保护区(109°38′14″ E,21°28′53″ N)中采集潮间带低潮3处土壤样本(每处相距5 m,由近岸红树林往外采集),每处土壤取至地下0.5 m深,将样品混合后装于密封袋,4℃低温保藏备用。
1.1.2 主要试剂和仪器培养基原料、TAE缓冲液、2×EasyTaq SuperMix、扩增引物、DNA Marker、GoldView核酸染料等购于北京康为世纪生物科技有限公司,Chelex 100树脂购于美国BioRad公司。使用的仪器包括SW-CJ-2F型超净工作台、HH.B11-BS-Ⅱ型恒温培养箱、TS-100C型恒温振荡器、VB-55型高压灭菌锅、Tgradient型PCR扩增仪、伯乐电泳仪、凝胶成像仪、泰斯特SYG数显实验水浴锅、Thermo酶标仪等。
1.1.3 培养基(1) 细菌分离培养基:M7、M10、M5和P3,其配方详见表 1。
| 培养基 Culture medias |
主要成分 Main components |
其他共有成分 Other components |
| M7 | 酵母提取粉5.0 g L-天门冬酰胺1.0 g 甘油10 mL Yeast extract powder 5.0 g L-Asparagine 1.0 g Glycerol 10 mL |
复合盐母液10 mL,琼脂14.0 g,去离子水1 000 mL,pH值7.2-7.4 Compound salt ion concentrate 10 mL,agar 14.0 g,deionized-water 1 000 mL,pH 7.2-7.4 |
| M10 | 可溶性淀粉10.0 g 水解酪素0.5 g Soluble starch 10.0 g Hydrolyzed casein 0.5 g |
|
| M5 | 海藻糖5.0 g 脯氨酸1.0 g 土壤浸出液20 mL Trehalose 5.0 g Proline 1.0 g Soil extract 20 mL |
|
| P3 | 燕麦粉20.0 g Crude oat 20.0 g |
|
| 注:复合盐母液配方为KNO3 1.0 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,K2HPO4 0.5 g,NH4NO3 0.1 g,FeSO4 0.01 g,MnCl2·H2O 0.001 g,ZnSO4·7H2O 0.001 g,去离子水10 mL Note: The formula of compound salt ion concentrate is KNO3 1.0 g, NaCl 0.5 g, MgSO4·7H2O 0.5 g, K2HPO4 0.5 g, NH4NO3 0.1 g, FeSO4 0.01 g, MnCl2·H2O 0.001 g, ZnSO4·7H2O 0.001 g, deionized water 10 mL |
||
(2) 纯化培养基:链霉菌培养基2号(ISP2)的改良固体培养基[21]。
(3) 纤维素酶初/复筛培养基:刚果红纤维素培养基,参照文献[22]配制,羧甲基纤维素钠10.0 g,复合盐母液10 mL,2 g/L刚果红染液1 mL,琼脂14.0 g。
(4) 羧甲基纤维素钠(CMC-Na)发酵培养基:羧甲基纤维素钠5.0 g,复合盐母液10 mL,蒸馏水1 000 mL。
(5) 滤纸条培养基配方:胰蛋白胨1.0 g,2张1 cm×6 cm滤纸条,去离子水1 000 mL。
1.1.4 其他试剂配制(1) DNS溶液:酒石酸钾钠182 g,3, 5-二硝基水杨酸6.3 g,NaOH 21 g,苯酚5 g,蒸馏水1 000 mL;储存至棕色瓶中,室温条件下放置7 d后使用,有效期6个月。
(2) 柠檬酸-Na2HPO3缓冲液A:7.16 g Na2HPO3溶于水,加入2.1 g柠檬酸,定容至200 mL,pH值约为5.0。
1.2 方法 1.2.1 菌株分离纯化称取2.0 g样品装于20 mL无菌水中摇匀,即为原液;将原液按10-2和10-3比例进行稀释,备用。取200 μL样液分别涂布至4种分离培养基中,28℃培养3-7 d,并随时观察菌株的生长情况,挑取肉眼可见菌落进行纯化培养,记录其形态特征和菌落数,以30%(V∶V)甘油-ISP2混合液作为保护剂,将纯化好的菌株保存于冻存管并置于-70℃冰箱内。
1.2.2 16S rRNA基因测序和系统发育分析采用chelex-100树脂[23]快速提取细菌的DNA并作为PCR模板,根据Walsh等[24]的方法对其进行PCR扩增。扩增和测序引物均为细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCA-3′)和1522R (5′-AAGGAGGTGATCCAGCCGCA-3′),PCR反应条件参照李菲等[25]的方法设定。扩增产物经1%琼脂糖凝胶电泳检测合格后,委托北京擎科新业生物技术有限公司进行测序分析。序列经BioEdit Sequence Alignment Editor软件整理后,利用EzBioCloud数据库(https://www.ezbiocloud.net/)进行在线比对[26];选取同源性最高菌株的序列作为参比对象,采用MEGA 10.0软件中的Neighbor-Joining法构建系统发育树,通过重复取样1 000次所获得的自举值检测各分支的置信值,对各菌株的系统发育地位进行分析[27]。采用Excel软件计算多样性指数,计算公式如下:
Simpson指数:
λ=1-∑(Ni/N)2;
Shannon-Wiener指数:
H′=-∑Ni/N(lnNi/N);
Pielou指数:
P=∑[(Ni/N)(N-Ni)/(N-1)],
其中,N为分离到的细菌菌株数总和,Ni为第i个菌种的菌株数。
1.2.3 产纤维素酶菌的筛选运用点植法将待测芽孢杆菌接种于纤维素酶活初筛培养基上,40℃恒温培养3 d。用平板透明圈法初步判定菌株的纤维素酶活性,对选出具有纤维素酶活性的菌株进行50,60和70℃耐高温复筛,观察培养基上菌苔产生透明圈的情况;并用游标卡尺测量菌落直径(D)和透明圈直径(H),计算H/D值,直径比大表示菌株水解CMC的能力强[28]。选取酶活性显著的菌株进行下一步研究(滤纸条崩解试验)。用0.9%灭菌的生理盐水将新鲜的活性菌株制成菌悬液,调节OD600值至0.6。在98 mL滤纸条培养基中接入2 mL菌液,在37℃、180 r/min下培养7 d,以不接种菌种的滤纸条培养基作为空白组,每组3个重复。根据滤纸条的断裂崩解程度来初步判断菌株的降解性能[29]。
1.2.4 纤维素酶活力测定(1) 粗酶液制备
挑取新鲜活性菌株,加入0.9%灭菌的生理盐水制成菌悬液,用麦氏比浊管将菌悬液浓度调至约1×108 CFU/mL,取2%菌悬液接种至10 mL CMC-Na发酵培养基中,50℃、180 r/min振荡培养3 d,6 000 r/min离心10 min,上清液即为粗酶液。
(2) 葡萄糖标准曲线绘制
分别取0,0.1,0.2,0.3,0.4,0.5,0.6,0.7 mg/mL的葡萄糖溶液2 mL,加入1 mL DNS溶液,沸水浴10 min,冷却后补加21.5 mL蒸馏水。在540 nm波长下测定其吸光值,并绘制葡萄糖标准曲线。
(3) 菌株纤维素酶活力测定
通过测定滤纸酶活(FPA)、内切酶酶活(CMCase)和外切酶酶活(C1),综合表征菌株粗酶液纤维素酶活力。测定参数和反应条件如表 2所示。待反应结束,分别加入1.5 mL DNS试剂,沸水浴10 min后置于冷水中冷却;用酶标仪测定其吸光值,设定波长为540 nm。参照葡萄糖标准曲线方程[y=0.5148x-0.0171 (R2=0.997 8)],分别计算这4株菌株的滤纸酶(FPase)、纤维素内切酶(CMCase)和外切酶(C1)酶活,分析其在50-90℃时相对酶活的变化规律,以此表征与木质纤维素降解过程相关酶的热稳定性。
| 纤维素酶种类 Cellulase types |
底物 Substrate |
反应条件 Reaction conditions |
其他成分 Other components |
| 滤纸酶活 FPA | 1 cm×3 cm滤纸 1 cm×3 cm filter paper |
50℃水浴1 h 50℃ at water bath for 1 h |
|
| 内切酶酶活 CMCase | 0.5%羧甲基纤维素钠 0.5% CMC-Na |
50℃水浴0.5 h 50℃ at water bath for 0.5 h |
2 mL缓冲液A,1 mL粗酶液 2 mL of buffer A, 1 mL crude enzyme solution |
| 外切酶酶活 C1 | 0.5%微晶纤维素 0.5% microcrystalline cellulose |
50℃水浴2 h 50℃ at water bath for 2 h |
(4) 酶活力计算
按照江高飞等[28]的方法进行数据处理,在水温50℃下,1 mL粗酶液在1 min内水解底物生成1 μg葡萄糖所需的酶量为1个纤维素酶酶活力单位(U/mL)。相对酶活性(%)=(样品酶活性-对照酶活性)/对照酶活性×100%。
2 结果与分析 2.1 红树林土壤芽孢杆菌的多样性从广西山口红树林保护区的土壤中分离出可培养芽孢杆菌171株,通过形态、大小和颜色等形态学特征进行初步排重,选取77株细菌进行16S rRNA基因测序,结果获得40种芽孢杆菌,隶属于4科12属;构建其Neighbor-Joining系统发育树(图 1),其中芽孢杆菌属为优势菌属,占分离菌株的60%。
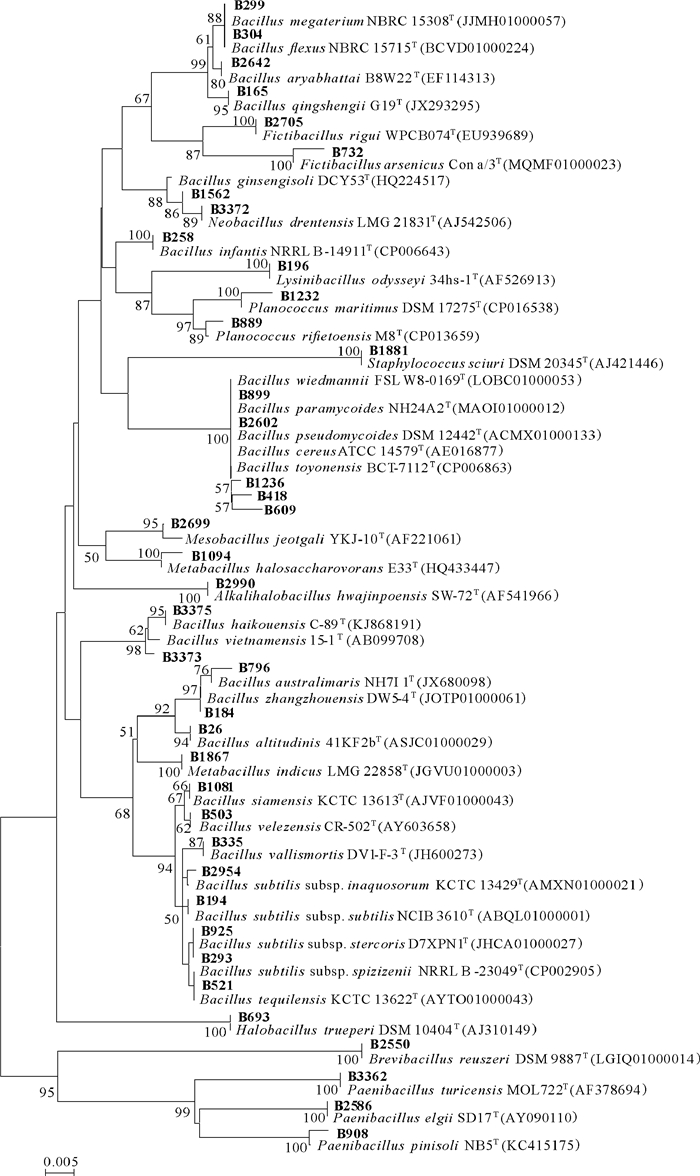
|
| 图 1 土壤中芽孢杆菌的16S rRNA基因序列Neighbor-Joining系统发育树 Fig. 1 Neighbor-Joining phylogenetic tree of 16S rRNA gene sequence of Bacillus in soil |
2.2 培养基的分离效果
采用4种分离培养基,从土壤中共分离出171株芽孢杆菌,分离效果见表 3。结果显示:以菌属数为评价标准,培养基的分离效果从优到劣排序为M7>P3>M5>M10;以菌种数为评价标准,培养基的分离效果从优到劣排序为M7=P3>M5>M10;以菌株数为评价标准,培养基的分离效果从优到劣排序为M7>P3>M5>M10。综合多样性指数分析,4种培养基分离出的芽孢杆菌多样性相近,但M7和P3培养基分离出芽孢杆菌的数量和种类均较为丰富。此外,本研究发现燕麦、甘油和海藻糖可作为分离红树林生境中细菌潜在的理想碳源,脯氨酸、天门冬氨酸和水解酪素为潜在的理想氮源。
| 培养基 Culture media |
菌株数 Number of bacteria |
菌种数 Number of strains |
菌属数 Number of genus |
Simpson指数 Simpson index (λ) |
Shannon-Wiener指数 Shannon-Wiener index (H′) |
Pielou指数 Pielou index (P) |
| M10 | 32 | 14 | 3 | 0.918 | 2.561 | 0.739 |
| M5 | 34 | 15 | 5 | 0.920 | 2.617 | 0.742 |
| M7 | 54 | 24 | 8 | 0.941 | 2.994 | 0.751 |
| P3 | 51 | 24 | 7 | 0.945 | 3.032 | 0.771 |
2.3 产纤维素酶菌株的筛选鉴定
运用点植法将40株芽孢杆菌接种至刚果红纤维素培养基上,置于4个不同温度(40,50,60和70℃)条件下培养3 d,结果获得9株能产生明显透明水解圈的菌株(图 2)。该9株菌均在40℃和50℃时生长良好,B1235在60℃时生长缓慢,其余8株细菌在60℃时生长良好,在70℃时生长缓慢。水解圈试验结果表明,不同温度下分离菌株的纤维素分解能力存在显著差异,即在刚果红纤维素培养基上水解圈与菌落直径比(H/D)不同(表 4):在40,50,60和70℃条件下,9株菌的H/D值分别为4.4-10.5,4-10.5, 3-16.5和1.5-7.2。不同活性菌株之间的H/D值存在较大的差异,菌株B26、B299、B1081、B2954和B925的H/D值在40℃和50℃时没有明显波动,在60℃时达到最高,70℃时最小,说明该5株菌在60℃时产生的纤维素酶活性最高,纤维素酶量最大;其余4株菌(B2550、B521、B1235、B194),在50℃以上均表现出H/D值变小,且同一温度下4株菌的H/D值均较小。虽然水解圈直径和菌落直径的比值可以直观表征酶浓度的高低,但不能作为菌株酶活的唯一定量指标,故需进一步测定这些菌株的产酶能力。
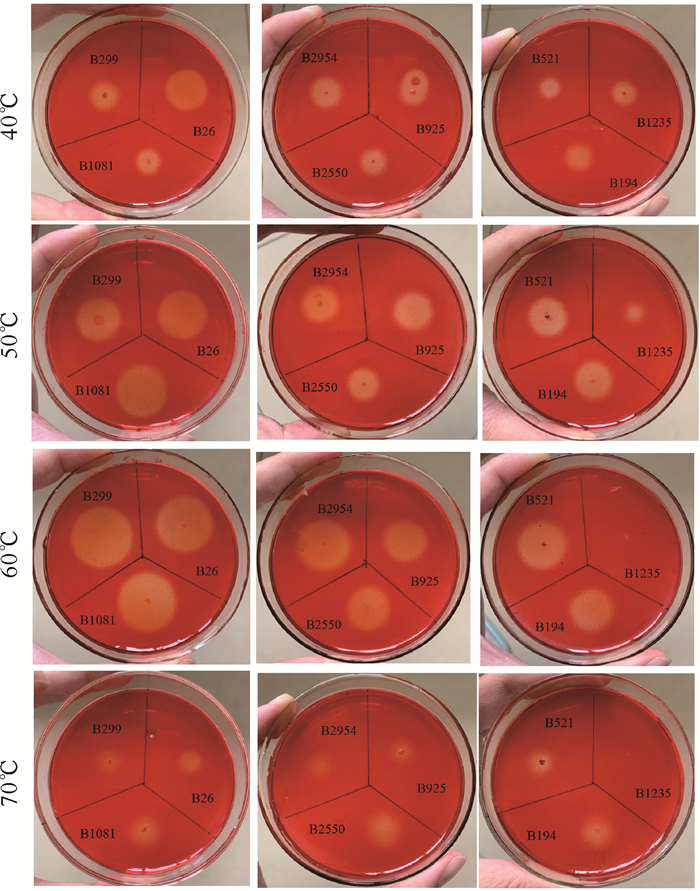
|
| 图 2 9株产纤维素酶菌株在不同温度下的平板酶活性 Fig. 2 Cellulase activity of 9 cellulase pruducing strains by plate assay at different temperature |
| 菌株编号 Strain number |
菌落直径 Colony diameter (D,mm) |
水解圈直径 Diameter of transparent ring (H,mm) |
水解圈直径/菌落直径 H/D |
|||||||||||
| 40℃ | 50℃ | 60℃ | 70℃ | 40℃ | 50℃ | 60℃ | 70℃ | 40℃ | 50℃ | 60℃ | 70℃ | |||
| B26 | 1.90±0.01 | 2.00±0.01 | 1.60±0.16 | 5.50±0.25 | 19.90±0.01 | 20.75±0.06 | 26.25±0.06 | 9.20±0.01 | 10.47 | 10.38 | 16.41 | 1.67 | ||
| B299 | 2.40±0.36 | 4.75±0.06 | 2.85±0.30 | 1.70±0.16 | 12.20±0.01 | 20.00±0.04 | 27.75±0.06 | 7.15±0.01 | 5.08 | 4.21 | 9.74 | 4.21 | ||
| B1081 | 2.05±0.06 | 3.00±0.04 | 2.15±0.02 | 2.80±0.09 | 10.75±0.06 | 23.25±0.06 | 25.90±0.01 | 9.10±0.01 | 5.24 | 7.75 | 12.05 | 3.25 | ||
| B2954 | 2.15±0.01 | 2.40±0.01 | 1.80±0.01 | 1.05±0.01 | 13.55±0.30 | 15.40±0.16 | 24.30±0.04 | 7.55±0.01 | 6.30 | 6.42 | 13.50 | 7.19 | ||
| B925 | 2.65±0.02 | 3.85±0.02 | 4.00±0.09 | 1.80±0.09 | 11.65±0.12 | 16.65±0.02 | 20.55±0.56 | 7.65±0.02 | 4.40 | 4.32 | 5.14 | 3.33 | ||
| B194 | 2.05±0.01 | 2.45±0.12 | 5.05±0.01 | 6.25±0.06 | 10.25±0.06 | 16.90±0.01 | 17.25±0.06 | 10.60±0.36 | 5.00 | 6.90 | 3.42 | 1.70 | ||
| B521 | 1.05±0.02 | 2.90±0.81 | 6.05±0.01 | 2.65±0.02 | 7.75±0.06 | 16.25±0.56 | 21.65±0.02 | 8.35±0.02 | 7.38 | 5.60 | 3.58 | 3.15 | ||
| B1235 | 1.85±0.02 | 1.05±0.01 | - | - | 10.60±0.01 | 6.25±0.06 | - | - | 5.73 | 5.95 | - | - | ||
| B2550 | 1.25±0.01 | 2.25±0.02 | 5.10±0.01 | 7.35±0.02 | 11.55±0.06 | 13.10±0.01 | 16.75±0.06 | 12.05±0.06 | 9.24 | 5.82 | 3.28 | 1.64 | ||
| 注:“-”表示无活性 Note: "-" means no activity |
||||||||||||||
将初筛得到的9株菌接种到滤纸条培养基中,50℃恒温培养7 d后,测定滤纸条的崩解程度。如图 3所示,菌株B1081、B2954、B26和B299将滤纸片崩解成块状,滤纸整体膨胀,崩解效果显著。相比之下,包括B1235在内的另外5株菌仅使滤纸边缘有一定程度的膨胀,几乎没有降解效果。
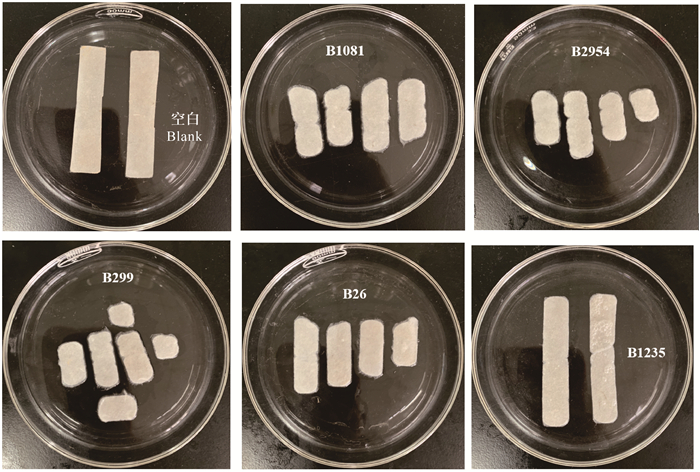
|
| 图 3 5株产纤维素酶菌株培养7 d后对滤纸的降解效果 Fig. 3 Degradation effect of 5 cellulase-producing strains on filter paper after 7 days of culture |
2.4 高效降解纤维素酶的热稳定性
由于菌株B1081、B2954、B26和B299对滤纸的崩解效果显著,因此有必要进一步研究这些菌株的酶活力。如图 4所示,4株高温纤维素降解菌的纤维素内切酶活性和滤纸酶活性热稳定性变化趋势相似,即都随着温度的升高总体呈先升高后降低的趋势,在80℃时相对活性达到最高,酶活性大小排序均为B1081>B2954>B299>B26。但4株菌的外切酶活性热稳定性表现不一致,B1081,B299和B2954随温度升高,其活性降低,即在50℃时最高;而B26随温度增加,其活性先增加后降低,在60-70℃时活性较高,但其活性在80-90℃时未检测出,可能是高温导致其失活。
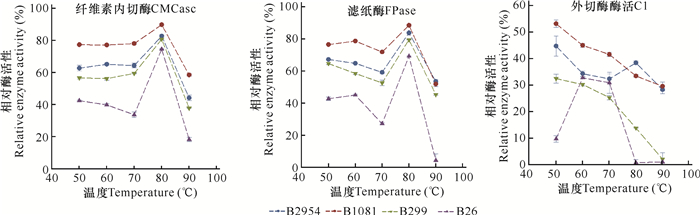
|
| 图 4 4株活性菌株的3种纤维素酶的热稳定性 Fig. 4 Thermostability of 3 cellulases from 4 active strains |
3 讨论
芽孢杆菌(Bacillus)是红树林土壤区系中常见的细菌类群[30],且大多数情况下为优势菌群,其繁殖能力强,可产耐热、耐旱、抗紫外线的芽孢,具有提升植物抗逆能力与促进植物生长的特性。目前,芽孢杆菌广泛应用于工农业、医药卫生、环保等领域,在处理工业废水、降解原油及土壤中的难溶化合物,防治植物病虫害等方面取得很好的成效[31]。陈蓉等[32]在湛江海滨公园的红树林淤泥样品中分离出两株具有高效产酶活性和部分耐药性的芽孢杆菌。赵雅慧等[22]从山口红树林土壤中分离出具有多种功能酶活性的细菌,其中芽孢杆菌为优势菌属。Shome等[33]发现印度南部的Andaman红树林沉积物中,Bacillus类群占细菌区系的50%;Ranjan等[34]也获得同样结果,即Bacillus类群为印度Bhitarkanika热带红树林环境土壤细菌中的优势菌属。在九龙江口、福建漳江口、厦门凤林湾及八门湾等红树林土壤微生物类群中Bacillus属均为各自的优势菌属[35-38]。本研究对广西山口红树林土壤可培养芽孢杆菌资源进行系统的报道,采用4种成分差异较大的培养基对广西山口红树林土壤中的芽孢杆菌进行定量分析,其中M7和P3培养基上菌落数较为丰富,M7和P3培养基中碳源较为丰富,利于更多芽孢菌群的生长。
国内外对高温纤维素降解菌的研究主要集中于芽孢杆菌属,早在1917年由荷兰学者分离到的嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus)[39],从糖厂、温泉及棕榈油厂分离到的、在60℃高温下具有稳定纤维素降解酶活性的地芽孢杆菌[40-42],从鸡粪锯末好氧堆肥样品中分离到的,具有持续耐高温且具纤维素酶活性的地芽孢杆菌[43]等。然而,单一菌种的降解能力有限,且酶活稳定性难以保持[44, 45]。嗜热脂肪地芽孢杆菌在60-70℃时,能促进好氧堆肥的腐熟进程且改善堆体理化性质,温度超过70℃时堆体理化性质会发生异常,影响堆肥进程[46]。相比之下,本研究中获得的Bacillus subtilis subsp.Inaquosorum B2954和Bacillus siamensis B1081,耐热性更强,在80℃甚至更高温度下仍然保持较高的纤维素酶活力,可更好地在堆肥或农作物环境中充分发挥其各种胞外酶的作用。
4 结论芽孢杆菌属是广西山口红树林保护区内土壤中的优势菌属,且种类丰富,纤维素酶活性显著,具有较大的挖掘潜力。其中,芽孢杆菌B1081、B2954、B26和B299具有显著的纤维素酶活力及热稳定性,而B2954和B1081具有更强的纤维素酶活性和环境相容性。
| [1] |
YANG X, LI Q, TANG Z, et al. Heavy metal concentrations and arsenic speciation in animal manure compost in China[J]. Waste Management, 2017, 64(64): 333-339. |
| [2] |
覃诚. 中国秸秆禁烧管理与美国秸秆计划焚烧管理比较研究[D]. 北京: 中国农业科学院, 2019.
|
| [3] |
徐杰, 许修宏, 门梦琪, 等. 木质纤维素降解菌剂DN-1促进堆肥腐熟度的评估[J]. 中国土壤与肥料, 2016(6): 146-151. |
| [4] |
HOSSEINI S M, AZIZ H A. Evaluation of thermochemical pretreatment and continuous thermophilic condition in rice straw composting process enhancement[J]. Bioresource Technology, 2013, 133: 240-247. DOI:10.1016/j.biortech.2013.01.098 |
| [5] |
SÁNCHEZ O J, CARDONA C. Trends in biotechnological production of fuel ethanol from different feedstocks[J]. Bioresource Technology, 2008, 99(13): 5270-5295. DOI:10.1016/j.biortech.2007.11.013 |
| [6] |
ZHAO Y, ZHAO Y, ZHANG Z C, et al. Effect of thermo-tolerant actinomycetes inoculation on cellulose degradation and the formation of humic substances during composting[J]. Waste Management, 2017, 68: 64-73. DOI:10.1016/j.wasman.2017.06.022 |
| [7] |
AWASTHI M K, LIU T, CHEN H, et al. The behavior of antibiotic resistance genes and their associations with bacterial community during poultry manure composting[J]. Bioresource Technology, 2019, 280: 70-78. DOI:10.1016/j.biortech.2019.02.030 |
| [8] |
SARKAR S, BANERJEE R, CHANDA S, et al. Effectiveness of inoculation with isolated Geobacillus strains in the thermophilic stage of vegetable waste composting[J]. Bioresource Technology, 2010, 101(8): 2892-2895. DOI:10.1016/j.biortech.2009.11.095 |
| [9] |
韩梦颖, 王雨桐, 高丽, 等. 降解秸秆微生物及秸秆腐熟剂的研究进展[J]. 南方农业学报, 2017, 48(6): 1024-1030. DOI:10.3969/j.issn.2095-1191.2017.06.14 |
| [10] |
刘月, 许修宏, 徐杰, 等. 功能菌剂对堆肥中木质纤维素降解的影响[J]. 中国土壤与肥料, 2014(4): 81-86. |
| [11] |
杨恋, 杨朝晖, 曾光明, 等. 好氧堆肥高温期的嗜热真菌和嗜热放线菌群落结构[J]. 环境科学学报, 2008, 28(12): 2514-2521. DOI:10.3321/j.issn:0253-2468.2008.12.018 |
| [12] |
吴翔, 陈强, 徐丽华, 等. 一株降解纤维素的高温放线菌的筛选及其产酶条件研究[J]. 农业环境科学学报, 2007, 26(增刊): 101-104. |
| [13] |
LIU D, ZHANG R, YANG X, et al. Thermostable cellulase production of Aspergillus fumigatus Z5 under solid-state fermentation and its application in degradation of agricultural wastes[J]. International Biodeterioration & Biodegradation, 2011, 65(5): 717-725. |
| [14] |
易旻, 杨玉婷, 李梦霖, 等. 一株耐高温纤维素降解菌的分离筛选及鉴定[J]. 吉首大学学报: 自然科学版, 2017, 38(4): 72-77. |
| [15] |
KHELIL O, CHEBA B. Thermophilic cellulolytic microorganisms from western algerian sources: Promising isolates for cellulosic biomass recycling[J]. Procedia Technology, 2014, 12: 519-528. DOI:10.1016/j.protcy.2013.12.524 |
| [16] |
HOLGUIN G, VAZQUEZ P, BASHAN Y. The role of sediment microorganisms in the productivity, conservation, and rehabilitation of mangrove ecosystems: An overview[J]. Biology and Fertility of Soils, 2001, 33(4): 265-278. DOI:10.1007/s003740000319 |
| [17] |
胡芮, 孙晓晖, 杨淼森, 等. 红树林生境产嗜热纤维素酶芽孢杆菌的筛选及其活性分析[J]. 应用海洋学学报, 2020, 39(3): 352-358. DOI:10.3969/J.ISSN.2095-4972.2020.03.006 |
| [18] |
曾思泉, 凌娟, 林丽云, 等. 1株红树林来源枝孢属真菌的分离鉴定及纤维素酶性质分析[J]. 微生物学杂志, 2018, 38(2): 37-42. DOI:10.3969/j.issn.1005-7021.2018.02.006 |
| [19] |
余辰星, 杨岗, 陆舟, 等. 迁徙季节水鸟对滨海不同类型湿地的利用——以广西山口红树林自然保护区为例[J]. 海洋与湖沼, 2014, 45(3): 513-521. |
| [20] |
韦受庆, 陈坚, 范航清. 广西山口红树林保护区大型底栖动物及其生态学的研究[J]. 广西科学院学报, 1993, 9(2): 45-57. |
| [21] |
李菲, 高程海, 余炼, 等. 秋茄内生细菌多样性及抑制甘蔗黑穗霉菌活性研究[J]. 中国抗生素杂志, 2017, 42(4): 318-327. DOI:10.3969/j.issn.1001-8689.2017.04.010 |
| [22] |
赵雅慧, 张舒琳, 吴家法, 等. 山口红树林根际土壤可培养细菌多样性及其活性筛选[J]. 海洋学报, 2018, 40(8): 138-151. DOI:10.3969/j.issn.0253-4193.2018.08.014 |
| [23] |
周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报, 2010, 26(2): 123-125. |
| [24] |
WALSH P S, METZGER D A, HIGUCHI R. Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material[J]. Biotechniques, 1991, 10(4): 506-513. |
| [25] |
李菲, 高程海, 余炼, 等. 川蔓藻内生及根际细菌多样性与抑菌活性研究[J]. 广西植物, 2018, 38(7): 924-933. |
| [26] |
KIM K H, ROH S W, CHANG H W, et al. Nocardioides basaltis sp.nov., isolated from Black Beach Sand[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 42-47. DOI:10.1099/ijs.0.65785-0 |
| [27] |
TAMURA K, PETERSON D, PETERSON N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [28] |
江高飞, 暴彦灼, 杨天杰, 等. 高温秸秆降解菌的筛选及其纤维素酶活性研究[J]. 农业环境科学学报, 2020, 39(10): 2465-2472. DOI:10.11654/jaes.2020-0958 |
| [29] |
李建树, 孙丽坤, 韩向敏, 等. 高温纤维素降解微生物的筛选、鉴定及其酶活力测定[J]. 甘肃农业大学学报, 2020, 55(3): 29-37. |
| [30] |
蒋云霞, 郑天凌, 田蕴, 等. 红树林土壤微生物的研究: 过去、现在、未来[J]. 微生物学报, 2006, 46(5): 848-851. DOI:10.3321/j.issn:0001-6209.2006.05.035 |
| [31] |
张华勇, 李振高. 土壤芽孢杆菌及其资源的持续利用[J]. 土壤, 2001(2): 92-96. |
| [32] |
陈蓉, 钟敏娟, 刘洪锷, 等. 两株海洋滩涂淤泥芽孢杆菌的筛选鉴定及药敏试验[J]. 南方农业学报, 2018, 49(12): 2551-2558. DOI:10.3969/j.issn.2095-1191.2018.12.29 |
| [33] |
SHOME R, SHOME B R, MANDAL A B, et al. Bacterial flora in mangroves of Andaman: Part Ⅰ.Isolation, identification and antibiogram studies[J]. Indian Journal of Marine Sciences, 1995, 24: 97-98. |
| [34] |
RANJAN M R, RANJAN S M, KANTI D T, et al. Diversity and seasonal fluctuation of predominant microbial communities in Bhitarkanika, a tropical mangrove ecosystem in India[J]. Revista de Biología Tropical, 2012, 60(2): 909-924. |
| [35] |
林鹏, 张瑜斌, 邓爱英, 等. 九龙江口红树林土壤微生物的类群及抗菌活性[J]. 海洋学报, 2005, 27(3): 133-141. DOI:10.3321/j.issn:0253-4193.2005.03.019 |
| [36] |
李元跃, 吴文林. 福建漳江口红树林湿地自然保护区的生物多样性及其保护[J]. 生态科学, 2004, 23(2): 134-136. |
| [37] |
王海琪, 潘文, 项炯华, 等. 厦门凤林红树林区土壤可培养微生物数量及细菌类群初探[J]. 集美大学学报: 自然科学版, 2011, 16(5): 352-358. DOI:10.3969/j.issn.1007-7405.2011.05.006 |
| [38] |
崔莹, 黄惠琴, 刘敏, 等. 八门湾红树林土壤芽胞杆菌分离与多样性分析[J]. 微生物学通报, 2014, 41(2): 229-235. |
| [39] |
DONK P J. A highly resistant thermophilic organism[J]. Journal of Bacteriology, 1920, 5(4): 373-374. DOI:10.1128/jb.5.4.373-374.1920 |
| [40] |
SUNG M H, KIM H, BAE J W, et al. Geobacillus toebii sp.nov., a novel thermophilic bacterium isolated from hay compost[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(6): 2251-2255. |
| [41] |
SARKAR S, BANERJEE R, CHANDA S, et al. Effectiveness of inoculation with isolated Geobacillus strains in the thermophilic stage of vegetable waste composting[J]. Bioresource Technology, 2010, 101(8): 2892-2895. DOI:10.1016/j.biortech.2009.11.095 |
| [42] |
RAHMAN N Z R A T, LEOW T C, SALLEH A B, et al. Geobacillus zalihae sp.nov., a thermophilic lipolytic bacterium isolated from palm oil mill effluent in Malaysia[J]. BMC Microbiology, 2007, 7(1): 77. DOI:10.1186/1471-2180-7-77 |
| [43] |
程旭艳, 霍培书, 尚晓瑛, 等. 堆肥中高温降解菌的筛选、鉴定及堆肥效果[J]. 中国农业大学学报, 2012, 17(5): 105-111. |
| [44] |
罗颖, 欧阳嘉, 许婧, 等. 耐热纤维素酶产生菌的筛选、鉴定及产酶条件优化[J]. 食品与生物技术学报, 2007(1): 84-89. DOI:10.3321/j.issn:1673-1689.2007.01.018 |
| [45] |
张楠, 杨兴明, 徐阳春, 等. 高温纤维素降解菌的筛选和酶活性测定及鉴定[J]. 南京农业大学学报, 2010, 33(3): 82-87. |
| [46] |
何秀红, 罗学刚, 贾文甫, 等. 高温快速堆肥处理屠宰废弃物效果研究[J]. 环境科学与技术, 2016, 39(1): 171-177, 182. |



