2. 江苏省海洋生物资源与环境重点实验室, 江苏连云港 222005;
3. 江苏省海洋生物产业技术协同创新中心, 江苏连云港 222005
2. Jiangsu Key Laboratory of Marine Bioresources and Environment, Lianyungang, Jiangsu, 222005, China;
3. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Lianyungang, Jiangsu, 222005, China
多糖是由十种或十种以上单糖通过糖苷键连接而成的聚合物,广泛分布于自然界中,具有十分重要的地位。微生物胞外多糖是细菌、真菌和藻类分泌到细胞壁外,且在生命活动中发挥重要作用的天然大分子[1]。与动植物多糖相比,微生物胞外多糖不受地理位置、周围环境的影响,可大规模工业化发酵,并具有成本低、易提取、无毒、安全性高等优点[2, 3]。近年来,人们对微生物胞外多糖进行广泛而深入的研究,探索胞外多糖的多种生物学功能,包括去除和吸收重金属离子[4, 5]、抗氧化[6, 7]、抗肿瘤[8, 9]、抗炎[10]、抑制黑色素形成[11]和益生元活性[12]等方面。目前,胞外多糖已在医药和食品工业中展现出巨大的应用潜力。在医药领域中,由Lactobacillus sakei Probio 65[13]产生的胞外多糖可通过抑制酪氨酸酶活性来减少黑色素的生成,进而降低黑色素瘤的发生率[14, 15];胞外多糖还可为抗肿瘤药的制备提供支持,如胶红酵母胞外多糖组分REPS2-A能有效抑制肝癌细胞的增殖,诱导肝癌细胞Hep G2凋亡[16]。在食品工业中,经黄单胞杆菌发酵生成的黄胶原是一种应用广泛的胞外多糖,它可作为增稠剂、乳化剂、悬浮剂等添加在乳制品、饮料制品、调味品中,以提高食品稳定性及品质[17]。目前,有少数学者对微杆菌属(Microbacteriu sp.)胞外多糖进行研究,例如Microbacterium TL13产生的胞外多糖能够吸附铬、铜、镍和钴等重金属离子,具有生物修复重金属污染废水和土壤的潜力[18];产自海洋Microbacterium FSW-25的胞外多糖具有比黄原胶更高的抗氧化活性,可作为一种潜在的抗氧化剂[19]。但相对而言,目前对微杆菌属发酵产胞外多糖活性的研究仍然较少。
本研究采用来源于中国连云港水湾湿地的一株微杆菌XL1发酵产胞外多糖。首先通过单因素法优化产胞外多糖的培养基成分和发酵条件;然后,探究微杆菌XL1胞外多糖的吸湿保湿性能、抗氧化活性以及抑制酪酸酶活性。本研究旨在丰富微杆菌胞外多糖活性研究,为微杆菌XL1胞外多糖在化妆品和食品行业的应用提供理论依据,并为将来开展胞外多糖的结构表征、功能机制等研究奠定基础。
1 材料与方法 1.1 材料菌株:微杆菌XL1筛选于中国连云港水湾湿地。
试剂:FeSO4·7H2O、K2PO4、MgCl2、蔗糖、琼脂粉、酵母提取物、氯仿、正丁醇、葡萄糖、果糖、麦芽糖、胰蛋白胨、尿素、硫酸铵、壳聚糖、甘油、透明质酸、碳酸钾、无水乙醇、H2O2、FeCl2、EDTA、磷酸二氢钠、磷酸氢二钠购自上海国药集团化学试剂有限公司,维生素C (Vc)、水杨酸、菲洛嗪、酪氨酸酶、左旋多巴、曲酸购自上海阿拉丁生化科技股份有限公司。
仪器:1510酶标仪(赛默飞世尔科技有限公司),SPX-150B-Z生化培养箱(上海博讯实业有限公司),M1282-0006恒温振荡器[艾本德(上海)国际贸易有限公司],JXN-26高速离心机(美国贝克曼库尔特有限公司),101A-3数显电热鼓风干燥箱(上海卓爵仪器有限公司),HH-4智能数显恒温水浴锅(巩义市予华仪器有限责任公司)。
1.2 方法 1.2.1 种子液制备将微杆菌XL1接种到固体培养基(FeSO4·7H2O 0.01 g/L、CaCl2 0.1 g/L、K2PO4 1 g/L、MgCl2 0.15 g/L、NaNO3 3 g/L、蔗糖20 g/L,琼脂粉15 g/L,pH值为7.0)中,于30℃培养箱培养2 d,从固体培养基上挑取单菌落接种于种子培养基中(FeSO4·7H2O 0.01 g/L、CaCl2 0.1 g/L、K2PO4 1 g/L、MgCl2 0.15 g/L、酵母提取物3 g/L、蔗糖20 g/L,pH值为7.0)中,250 r/min,30℃培养24 h。
1.2.2 胞外多糖的制备与提取将种子液以4%的接种量接种于发酵培养基(FeSO4·7H2O 0.01 g/L、CaCl2 0.1 g/L、K2PO4 1 g/L、MgCl2 0.15 g/L、酵母提取物3 g/L、蔗糖50 g/L,pH值为7.0)中,在250 r/min、30℃条件下发酵24 h。发酵液于8 000 r/min离心30 min去除菌体后,加入两倍体积无水乙醇,4℃搅拌过夜,再通过8 000 r/min离心15 min得到胞外多糖,放入鼓风干燥箱中60℃干燥至恒重,称其质量。
1.2.3 胞外多糖中间层蛋白的去除采用Sevag法[20]对胞外多糖初步提纯,将Sevag液(氯仿∶正丁醇,V∶V=4∶1)与3%胞外多糖水溶液以体积比1∶1混合,剧烈振荡30 min后,8 000 r/min离心15 min,去除中间层蛋白,重复3-4遍。使用BCA蛋白测定试剂盒测定蛋白含量[21],蛋白标准曲线为y=1.128 9x+0.126,R2=0.998 1。对纯化后的胞外多糖进行吸湿保湿、抗氧化和抑制酪氨酸酶活性实验。
1.2.4 微杆菌XL1胞外多糖发酵的单因素实验(1) 碳源种类
将种子液以4%的接种量接种到含有5%不同碳源(蔗糖、葡萄糖、果糖、麦芽糖)的发酵培养基中,其他成分不变,在转速为250 r/min、温度为30℃、pH值为7的条件下发酵24 h,进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
(2) 氮源种类
将种子液以4%的接种量接种到含有0.3%不同氮源(酵母提取物、胰蛋白胨、尿素、硝酸钠、硫酸铵)的发酵培养基中,其他成分不变,在转速为250 r/min、温度为30℃、pH值为7的条件下发酵24 h,进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
(3) 碳源含量
将种子液以4%的接种量接种到不同蔗糖含量(5%、10%、15%、20%、25%)的发酵培养基中,其他成分不变,在转速为250 r/min、温度为30℃、pH值为7的条件下发酵24 h,进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
(4) 氮源含量
将种子液以4%的接种量接种到不同酵母提取物含量(0.1%、0.2%、0.3%、0.4%、0.5%)的发酵培养基中,其他成分不变,在转速为250 r/min、温度为30℃、pH值为7的条件下,发酵24 h,进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
(5) 发酵温度
将种子液以4%的接种量接种到发酵培养基中,在转速为250 r/min、不同发酵温度(10,15,20,25,30℃)、pH值为7的条件下发酵24 h,进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
(6) 培养基初始pH
将种子液以4%的接种量接种到不同初始pH(6,7,8,9,10)的发酵培养基中,在转速为250 r/min、温度为20℃条件下,发酵24 h,进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
(7) 发酵时间
将种子液以4%的接种量接种到发酵培养基中,在转速为250 r/min、发酵温度为20℃、pH值为8的条件下,发酵不同时间(8,16,24,32,40 h),进行3次生物学重复,按1.2.2节的方法制备定量胞外多糖。
1.2.5 吸湿、保湿性能测定(1) 样品预处理
将1.2.3节制得的胞外多糖研成粉末,与壳聚糖、甘油和透明质酸一同放入鼓风干燥箱中60℃烘干至恒重,备用。
(2) 吸湿性试验
分别称取0.2 g胞外多糖、壳聚糖、甘油和透明质酸,每种物品各6份,其中3份样品放入有饱和碳酸钾溶液(相对湿度为43%)的密闭容器中,另外3份样品放入有饱和硫酸铵溶液(相对湿度为81%)的密闭容器中,分别称取0,1,2,4,8,16,24 h时的样品重量。根据公式计算吸湿率:
| $ 吸湿率\left( \% \right) = \frac{{{M_1} - {M_0}}}{{{M_0}}} \times 100\% , $ |
式中,M0为放入0 h样品质量(g),M1为放入不同时间后样品质量(g)。
(3) 保湿性试验
分别称取0.2 g胞外多糖、壳聚糖、甘油和透明质酸,每种物品各3份,先放置于有去离子水溶液的密闭容器中24 h,然后将样品放入有饱和碳酸钾溶液的密闭容器中,分别称取0,1,2,4,6,8 h时的样品重量。根据公式计算保湿率:
| $ 保湿率\left( \% \right) = \left( {1 - \frac{{{N_1} - {N_2}}}{{{N_1} - {N_0}}}} \right) \times 100\% , $ |
式中,N0为样品最初质量(g),N1为放置在去离子水中24 h后样品质量(g),N2为放置在饱和碳酸钾溶液中不同时间的样品质量(g)。
1.2.6 抗氧化活性测定(1) 清除DPPH自由基能力测定
取100 μL不同浓度(0,0.5,1,2,4,8,10 mg/mL)胞外多糖与100 μL 0.5 mmol/L 1, 1-二苯基-2-三硝基苯肼(DPPH)溶液(无水乙醇配制)混匀,室温避光反应30 min后,取100 μL反应液于96孔板中,在517 nm处测定吸光度值,平行测定3次[20],使用去离子水、Vc分别作为空白和阳性对照。根据公式计算DPPH清除率:
| $ 清除率\left( \% \right) = \frac{{\left( {{A_0} + {A_j}} \right) - {A_i}}}{{{A_0}}} \times 100\% , $ |
式中,A0为空白对照吸光度值,Ai为样品溶液加DPPH溶液吸光度值,Aj为样品溶液加无水乙醇吸光度值。
(2) 清除羟基自由基能力的测定
测定方法参考文献[22]。将9 mmol/L FeSO4·7H2O、9 mmol/L水杨酸(无水乙醇配制)、样品溶液、8.8 mmol/L H2O2按体积比1∶1∶1∶1的比例混合,于37℃水浴15 min,取100 μL反应液于96孔板中,在510 nm处测定吸光度值,平行测定3次,使用去离子水、Vc分别作为空白和阳性对照。样品溶液为不同浓度(0,0.5,1,2,4,8,10 mg/mL)的胞外多糖溶液。根据公式计算羟基自由基清除率:
| $ 清除率\left( \% \right) = \frac{{\left( {{B_0} + {B_j}} \right) - {B_i}}}{{{B_0}}} \times 100\% , $ |
式中,B0为空白对照吸光度值,Bi为样品吸光度值,Bj为去离子水代替H2O2溶液的吸光度值。
(3) 铁离子螯合能力测定
测定方法参考文献[23]。向1 mL不同浓度(0.1,0.2,0.4,0.6,0.8,1.0 mg/mL)的胞外多糖溶液中加入0.1 mL 2 mmol/L的FeCl2溶液和0.2 mL 5 mmol/L的菲洛嗪试剂,室温反应15 min后于562 nm处测定吸光度值,平行测定3次,使用去离子水、EDTA分别作为空白和阳性对照。根据公式计算螯合率:
| $ 螯合率\left( \% \right) = \frac{{{C_0} - {C_1}}}{{{C_0}}} \times 100\% , $ |
式中,C0为空白对照吸光度值,C1为样品吸光度值。
1.2.7 酪氨酸酶抑制活性的测定测定方法参考文献[24]。取0.5 mL左旋多巴溶液(2 mmol/L)与0.4 mL磷酸盐缓冲液(25 mmol/L,pH值为6.8)混合,加入不同浓度(0,2,4,6,8,10 mg/mL)的胞外多糖溶液,37℃孵育10 min后,加入0.05 mL酪氨酸酶液(500 U/mL),37℃孵育30 min后,于475 nm处记录吸光值,平行测定3次,使用去离子水、曲酸分别作为空白和阳性对照。根据抑制率公式计算:
| $ 抑制率\left( \% \right) = \left( {1 - \frac{{{X_1} - {X_2}}}{{{X_3} - {X_4}}}} \right) \times 100\% , $ |
式中,X1为样品吸光值,X2为样品背景吸光值,X3为空白对照吸光值,X4为空白对照的背景吸光值。
1.3 数据处理采用OriginPro 2018软件进行数据处理和作图。
2 结果与分析 2.1 多糖发酵的单因素实验结果不同发酵条件对微杆菌XL1胞外多糖产量的影响如图 1所示。从图 1a可以看出,几种碳源中蔗糖对胞外多糖产量影响最为显著,达到28 g/L,是以果糖(1.5 g/L)作为碳源的18倍,因此,蔗糖为最佳碳源。从图 1b可以看出,以酵母提取物、胰蛋白胨、尿素、硝酸钠、硫酸铵为氮源的多糖产量分别为26,21.5,22.5,22,22 g/L,选择产量最高的氮源,即酵母提取物为最佳氮源。接着分别优化了培养基中最佳碳氮源,即蔗糖和酵母提取物的最适添加量,分别为20%和0.3%(图 1c, d),蔗糖含量为20%时产量达到最高75 g/L。但此后随蔗糖含量继续增加,胞外多糖产量反而下降,这可能是由于培养基中蔗糖含量过高,导致菌体内外渗透压失衡,其生长受到抑制。后续又优化了培养基的发酵温度、初始pH以及发酵时间,微杆菌XL1在温度为15-25℃(图 1e)时,多糖产量较高,其中在20℃条件下产量达到最高值80 g/L;该菌适合在中性偏碱的环境中大量产糖,在pH值为8 (图 1f)时达到最高,为91 g/L;发酵培养基中多糖产量随发酵时间增加而增多(图 1g),在24 h达到最高值92 g/L,之后随着发酵时间增加,多糖产量变化不大。因此,经过对发酵条件单因素优化后,得到最佳培养条件如下:蔗糖为碳源、酵母提取物为氮源、20%蔗糖、0.3%酵母提取物、温度20℃、pH值为8.0、发酵时间24 h。
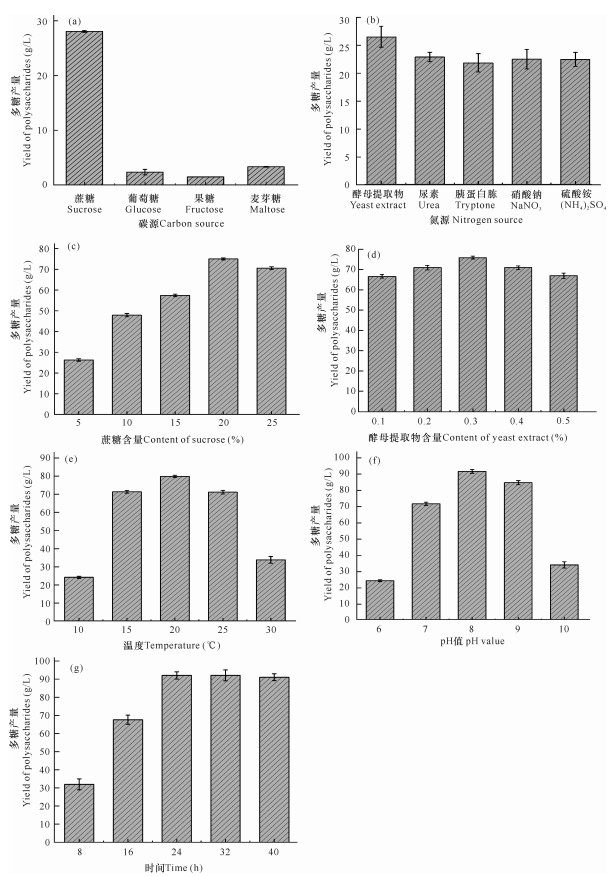
|
| 图 1 微杆菌XL1胞外多糖产量的单因素优化结果 Fig. 1 Single factor optimization results of extracellular polysaccharides yield from Microbacterium XL1 |
2.2 吸湿保湿性能测定
在一定相对湿度(43%和81%)的密闭环境中,所有样品的吸湿率都随着时间增加而增大,但是,相对湿度越大,样品在相同时间达到的吸湿率越高。在相对湿度为81%时,甘油吸湿率随处理时间增加一直上升,并在24 h时达到73.16%,远高于胞外多糖的25.38%;但此时胞外多糖的吸湿率比透明质酸、壳聚糖分别高出2.61%、10.18%(图 2a、b)。因此,虽然微杆菌XL1胞外多糖的吸湿性能比甘油差,但与透明质酸、甘油相比,仍具有良好的吸湿性能。
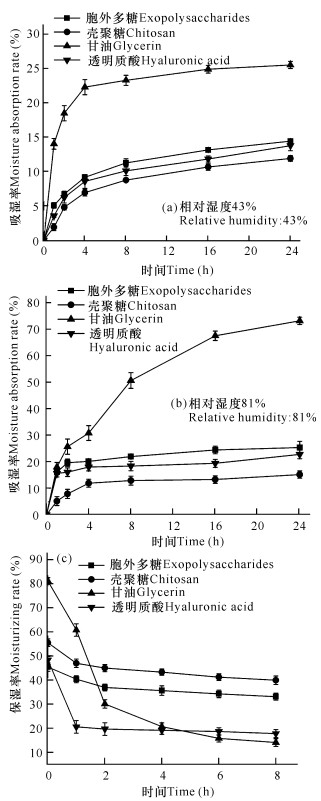
|
| 图 2 胞外多糖吸湿率(a、b)、保湿率(c)与时间变化曲线 Fig. 2 Curve of exopolysaccharide moisture absorption rate (a, b) and moisturizing rate (c) with time |
在保湿性能实验中,利用相对湿度由高到低的变化,观察样品的保湿性能。在前2 h,胞外多糖、壳聚糖和透明质酸的保湿率均有一定幅度下降,其中,甘油的保湿率大幅度下降,失水速率远超其他3种样品;在2 h之后,各样品的保湿率基本保持稳定(图 2c)。相比较而言,这4种样品的保湿性能排序为壳聚糖>胞外多糖>透明质酸>甘油。因此,微杆菌XL1胞外多糖同样具有较好的保湿性能,在化妆品行业具有广泛的应用前景。
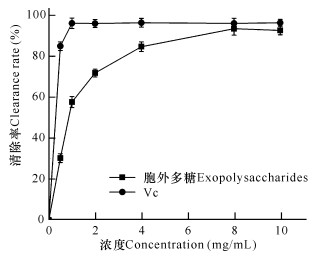
2.3 抗氧化活性 2.3.1 DPPH自由基的清除能力如图 3所示,在一定范围内,随着浓度增大,微杆菌XL1胞外多糖和Vc对DPPH自由基的清除率越高。其中,阳性对照Vc浓度为1 mg/mL时,清除率即可达到最大值96%,且在此后保持稳定。胞外多糖对DPPH自由基的清除作用在8 mg/mL时达到最大,清除率达到72%,其IC50值为1.2 mg/mL。因此,微杆菌XL1胞外多糖对DPPH自由基具有一定的清除效果。

|
| 图 3 胞外多糖的DPPH自由基清除活性 Fig. 3 DPPH radical scavenging activity of extracellular polysaccharide |
2.3.2 羟基自由基的清除能力
如图 4所示,微杆菌XL1胞外多糖和Vc随着浓度增大,对羟基自由基的清除率均呈现逐渐升高再趋于稳定的趋势。阳性对照Vc浓度为1 mg/mL时,清除率即可达到最高值97%。胞外多糖在8 mg/mL时,对羟基自由基清除率达到最高,为93%,比Vc仅低5%,其IC50值为0.8 mg/mL。因此,微杆菌XL1胞外多糖对羟基自由基具有较好的清除效果。
|
| 图 4 胞外多糖的羟基自由基清除活性 Fig. 4 Hydroxyl radical scavenging activity of extracellular polysaccharide |
2.3.3 铁离子螯合能力
通过与EDTA比较,评价微杆菌XL1胞外多糖对铁离子的螯合作用,结果发现阳性对照EDTA在0.1 mg/mL时,对铁离子的螯合率达到最大值99%;胞外多糖在浓度为0.6 mg/mL时,对铁离子的螯合率达到最大值96%,其IC50值为0.3 mg/mL比阳性对照EDTA仅低3%(图 5)。因此,微杆菌XL1胞外多糖对铁离子具有较好的螯合作用。
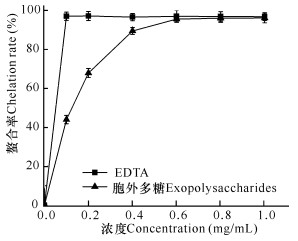
|
| 图 5 胞外多糖的铁离子螯合能力 Fig. 5 Iron chelating capacity of extracellular polysaccharide |
2.4 酪氨酸酶活性的抑制效果
酪氨酸酶是黑色素形成的主要原因,研究其酶活性抑制具有重要意义。如图 6所示,曲酸和微杆菌XL1胞外多糖对酪氨酸酶的抑制率都具有剂量依赖关系,随着浓度增加抑制速率变缓。阳性对照曲酸在10 mg/mL时,对酪氨酸酶抑制活性达到最大值80%;胞外多糖浓度为60 mg/mL时,酪氨酸酶抑制活性达到55%,胞外多糖的IC50值为14 mg/mL。虽然胞外多糖对酪氨酸酶活性的抑制性能与曲酸仍然有一定差距,但是胞外多糖作为纯天然产物,具有安全、绿色无污染等优点。因此,微杆菌XL1胞外多糖在抑制黑色素形成方面仍具有应用潜力。

|
| 图 6 曲酸(a)和胞外多糖(b)的酪氨酸酶抑制活性 Fig. 6 Tyrosinase inhibitory activity of kojic acid (a) and exopolysaccharides (b) |
3 讨论
微杆菌XL1胞外多糖发酵优化后产量达到92 g/L,是未优化前的2.3倍。比较而言,Microbacterium TL13多糖产量为36.25 g/L[18],Microbacterium FSW-25多糖产量为34.64 g/L[19],微杆菌XL1是一株高产胞外多糖的菌株。在优化发酵条件过程中,蔗糖及蔗糖添加量对胞外多糖产量的提升至关重要,以蔗糖作为碳源的产量是果糖的18倍。Han等[25]也是以蔗糖作为唯一碳源来优化微生物发酵产胞外多糖,使产量得到大幅度提升。后续的研究发现微生物在发酵过程中分泌出特定水解蔗糖合成果聚糖的蔗糖果糖酶[26]。因此,推测微杆菌XL1在发酵过程中分泌蔗糖果糖酶合成果聚糖,而且蔗糖含量越高酶活越高,故下一步可对发酵培养基中多糖合成酶及胞外多糖组分进行研究。
透明质酸吸湿保湿性能优良,被广泛应用于化妆品、医疗美容中,而胞外多糖的吸湿保湿性能与透明质酸相似,在化妆品行业应用前景广泛。微杆菌XL1胞外多糖具有较强的抗氧化活性,对羟基自由基的清除率和铁离子的螯合率分别达到93%和96%,与Vc抗氧化效果几乎一致,与Microbacterium FSW-25[19]胞外多糖相比具有更好的抗氧化效果,可作为抗氧化剂应用于食品行业中。目前国内对微生物胞外多糖的酪氨酸酶抑制活性研究较少,微杆菌XL1胞外多糖对酪氨酸酶的抑制率可达55%,虽然与EDTA的酪氨酸酶抑制效果有一定差距,但是微生物胞外多糖作为天然生物大分子,具有安全无毒、绿色环保等优点。此外,为满足实际应用的需求,通过化学修饰可以改变多糖官能团,如硫酸化、羧甲基化、乙酰基化等方法,从而获得具有更高或新的生物活性的多糖衍生物[27]。因此,后续实验有望通过对微杆菌XL1胞外多糖进行化学修饰,增强其酪氨酸酶抑制活性。
4 结论单因素法优化结果显示:微杆菌XL1发酵产胞外多糖的最佳培养基成分为FeSO4·7H2O 0.01 g/L、CaCl2 0.1 g/L、K2PO4 1 g/L、MgCl2 0.15 g/L、酵母提取物3 g/L、蔗糖200 g/L,pH值8.0;最佳培养条件为接种量4%,20℃摇床培养24 h。微杆菌XL1胞外多糖产量最高可达92 g/L,该胞外多糖具有优良的吸湿保湿性能、抗氧化活性以及抑制酪氨酸酶活性,可作为一种天然活性物质在化妆品、食品行业进一步开发利用,并有望扩大规模进行工业化生产。
| [1] |
CASILLO A, LANZETTA R, PARRILLI M, et al. Exopolysaccharides from marine and marine extremophilic bacteria: Structures, properties, ecological roles and applications[J]. Marine Drugs, 2018, 16(2): 69. DOI:10.3390/md16020069 |
| [2] |
BARCELOS M C S, VESPERMANN K A C, PELISSARI F M, et al. Current status of biotechnological production and applications of microbial exopolysaccharides[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(9): 1475-1495. DOI:10.1080/10408398.2019.1575791 |
| [3] |
ATES O. Systems biology of microbial exopolysaccharides production[J]. Frontiers in Bioengineering and Biotechnology, 2015, 3: 200. |
| [4] |
BHUNIA B, PRASAD U, OINAM G, et al. Characterization, genetic regulation and production of cyanobacterial exopolysaccharides and its applicability for heavy metal removal[J]. Carbohydrate Polymers, 2018, 179: 228-243. DOI:10.1016/j.carbpol.2017.09.091 |
| [5] |
MOHITE B V, KOLI S H, NARKHEDE C P, et al. Pr-ospective of microbial exopolysaccharide for heavy metal exclusion[J]. Applied Biochemistry and Biotechnology, 2017, 183(2): 582-600. DOI:10.1007/s12010-017-2591-4 |
| [6] |
ZHANG L, ZHAO B, LIU C J, et al. Optimization of biosynthesis conditions for the production of exopolysaccharides by Lactobacillus plantarum SP8 and the exopolysaccharides antioxidant activity test[J]. Indian Journal of Microbiology, 2020, 60(3): 334-345. DOI:10.1007/s12088-020-00865-8 |
| [7] |
CHENG X, HUANG L, LI K. Antioxidant activity changes of exopolysaccharides with different carbon sources from Lactobacillus plantarum LPC-1 and its metabolomic analysis[J]. World Journal of Microbiology and Biotechnology, 2019, 35(5): 1-13. |
| [8] |
WU J, ZHANG Y, YE L, et al. The anti-cancer effects and mechanisms of lactic acid bacteria exopolysaccharides in vitro: A review[J]. Carbohydrate Polymers, 2021, 253: 117308. DOI:10.1016/j.carbpol.2020.117308 |
| [9] |
耿晓琦, 范冰倩, 丁钦然, 等. 透明颤菌胞外多糖发酵优化及抗肿瘤活性评价[J]. 中国新药杂志, 2020, 29(19): 2229-2238. DOI:10.3969/j.issn.1003-3734.2020.19.012 |
| [10] |
常相娜, 陈雪峰, 龚频, 等. 盐胁迫环境下发菜胞外多糖抗氧化作用及镇痛抗炎活性[J]. 食品科学, 2020, 41(17): 133-138. DOI:10.7506/spkx1002-6630-20190810-113 |
| [11] |
JIN J, NGUYEN T T H, KIM C, et al. Antimelanogenesis effects of fungal exopolysaccharides prepared from submerged culture of Fomitopsis castanea mycelia[J]. Journal of Microbiology and Biotechnology, 2019, 29(8): 1204-1211. DOI:10.4014/jmb.1905.05037 |
| [12] |
石塔拉, 赵慧娟, 宓伟, 等. 发酵乳杆菌产胞外多糖的益生元样作用研究[J]. 营养学报, 2018, 40(6): 568-573. DOI:10.3969/j.issn.0512-7955.2018.06.009 |
| [13] |
VIVEK K B, RATHER I R, PARK Y H. Partially purified exopolysaccharide from Lactobacillus sakei probio 65 with antioxidant, α-glucosidase and tyrosinase inhibitory potential[J]. Journal of Food Biochemistry, 2016, 40(3): 264-274. DOI:10.1111/jfbc.12230 |
| [14] |
CHEN B J, SHI M J, CUI S, et al. Improved antioxidant and anti-tyrosinase activity of polysaccharide from Sargassum fusiforme by degradation[J]. International Journal of Biological Macromolecules, 2016, 92: 715-722. DOI:10.1016/j.ijbiomac.2016.07.082 |
| [15] |
FAWOLE O A, MAKUNGA N P, OPARA U L. Antibacterial, antioxidant and tyrosinase-inhibition activities of pomegranate fruit peel methanolic extract[J]. BMC Complementary and Alternative Medicine, 2012, 12(1): 1-11. DOI:10.1186/1472-6882-12-1 |
| [16] |
马文锦, 李梅林, 王博, 等. 胶红酵母CICC 33013胞外多糖抑制肝癌细胞活性研究[J]. 食品与机械, 2020, 36(2): 159-164. |
| [17] |
王蓓蓓, 张伟, 周晓伦. 微生物胞外多糖的提取与应用研究进展[J]. 安徽农学通报, 2021, 27(18): 21-23. DOI:10.3969/j.issn.1007-7731.2021.18.008 |
| [18] |
OUERTANI R, OUERTANI A, MAHJOUBI M, et al. New plant growth-promoting, chromium-detoxifying Microbacterium species isolated from a tannery wastewater: Performance and genomic insights[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 521. DOI:10.3389/fbioe.2020.00521 |
| [19] |
SRAN K S, BISHT B, MAYILRAJ S, et al. Structural characterization and antioxidant potential of a novel anionic exopolysaccharide produced by marine Microbacterium aurantiacum FSW-25[J]. International Journal of Biological Macromolecules, 2019, 131: 343-352. DOI:10.1016/j.ijbiomac.2019.03.016 |
| [20] |
孙柘, 邱涛, 袁如月, 等. 粒毛盘菌多糖脱蛋白方法及其条件优化[J]. 浙江大学学报, 2012, 38(4): 519-523. |
| [21] |
毕士媛. 枫香拟茎点霉菌NJUSTb1胞外多糖的结构鉴定、化学修饰及活性研究[D]. 南京: 南京理工大学, 2019.
|
| [22] |
XIONG Y W, JU X Y, LI X W, et al. Fermentation conditions optimization, purification, and antioxidant activity of exopolysaccharides obtained from the plant growth-promoting endophytic actinobacterium Glutamicibacter halophytocola KLBMP 5180[J]. International Journal of Biological Macromolecules, 2020, 153: 1176-1185. DOI:10.1016/j.ijbiomac.2019.10.247 |
| [23] |
刁欢, 张娟娟, 赵红, 等. 微生物多糖与Fe离子螯合试验研究[J]. 食品研究与开发, 2020, 41(20): 115-118, 136. DOI:10.12161/j.issn.1005-6521.2020.20.019 |
| [24] |
TANG M, HOU F, WU Y, et al. Purification, characterization and tyrosinase inhibition activity of polysaccharides from chestnut (Castanea mollissima Bl.) kernel[J]. International Journal of Biological Macromolecules, 2019, 131: 309-314. DOI:10.1016/j.ijbiomac.2019.03.065 |
| [25] |
HAN J, FENG H, WANG X, et al. Levan from Leuconostoc citreum BD1707:Production optimization and changes in molecular weight distribution during cultivation[J]. BMC Biotechnology, 2021, 21(1): 1-14. DOI:10.1186/s12896-020-00660-9 |
| [26] |
SRIKANTH R, REDDY C H, SIDDARTHA G, et al. Review on production, characterization and applications of microbial levan[J]. Carbohydrate Polymers, 2015, 120: 102-114. DOI:10.1016/j.carbpol.2014.12.003 |
| [27] |
XIE L, SHEN M, HONG Y, et al. Chemical modifications of polysaccharides and their anti-tumor activities[J]. Carbohydrate Polymers, 2020, 229: 115436. DOI:10.1016/j.carbpol.2019.115436 |



