2. 广西中医药大学壮瑶药工程技术中心, 广西南宁 530001;
3. 广西-东盟食品药品安全检验检测中心, 广西南宁 530001
2. Zhuang Yao Medicine Engineering Technology Center of Guangxi University of Traditional Chinese Medicine, Nanning, Guangxi, 530001, China;
3. Guangxi Asean Center for Food and Drug Safety Control, Nanning, Guangxi, 530001, China
三加皮是五加科植物白簕(Acanthopanax trifo-liatus (L.) Merr.)的干燥根,又名蹦乐、刺三甲、刺三加、白簕、鹅掌簕、苦刺、三叶五加等。在《本草纲目》《神农本草经》《广西植物名录》《广西中药资源名录》中均有记载,被收录在《广西壮族自治区壮药质量标准(第一卷)》,是广西特色的民间常用药用植物,其根皮可入药,其嫩叶常作为蔬菜食用。三加皮味苦,辛,凉,主要含有酚酸类、黄酮类、多糖、皂苷等成分。药理作用主要有祛风利湿、舒筋活血、清热解毒[1],抗炎镇痛、抗疲劳、抗氧化、免疫调节、抗菌等[2-6]。
三加皮的食用部分一直备受关注,近年来学者们对其食用部位研究出多种保健品,有柠檬簕菜茶、陈皮簕菜茶、燕麦簕菜茶、皇竹草和簕菜减茶、簕菜泡腾固体饮料、簕菜保健饼干、簕菜保健颗粒、簕菜保健硬糖等[7-14],但对药用根部研究甚少,有学者对其根部总黄酮进行研究[15],对根部酚酸类成分研究报道较少,未见建立根部相关的质量标准,难以对三加皮的质量进行控制,给临床用药及资源利用带来较大的困难。可见对三加皮根部进行研究,为后续建立其质量标准提供研究基础及临床用药参考是很有必要的,也为开发利用三加皮药用资源提供参考依据。
前期课题组对其质量标志物的分析发现,三加皮中所含的丰富的酚酸类成分是其主要活性成分之一,初步推断三加皮中含有新绿原酸、绿原酸、异绿原酸A、异绿原酸B和异绿原酸C等成分,此类成分都属于咖啡酰奎宁酸的酚酸类成分。据研究,该类成分有多种药理活性,如有抗炎、抗菌、抗病毒、免疫调节等作用[16]。在研究中,单一成分难以全面反映三加皮的质量,因此需选择多成分进行质量控制分析。但采用多成分对质量控制时,部分对照品稀缺及使用量大、价格昂贵,导致测定成本增加,而一测多评法可以一种价廉、稳定易得的指标成分为内参物,通过相对校正因子测定其他成分含量,同时测定多种成分并降低实验成本。目前尚未有相关研究建立新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C的一测多评方法。因此,本研究拟建立测定多种活性成分含量的一测多评法,比较一测多评法(QAMS)与外标法(ESM)测定的结果,考察QAMS的准确性与科学性,为合理评价壮药三加皮药材的质量提供科学依据,同时为进一步研究三加皮酚酸类成分、推广三加皮的药用价值提供参考。
1 材料与方法 1.1 材料Waters e2695 UV高效液相色谱系统(美国Waters公司), Agilent 1260高效液相色谱系统(美国Agilent科技有限公司), Shimadzu LC-2030 Plus高效液相色谱系统(日本岛津公司);色谱柱:phenomenex C18(4.6 mm×250 mm, 5 μL)及Inertsil ODS-3 C18(4.6 mm×250 mm,5 μL),Mettler Toledo XS105DU电子分析天平,KQ5200B型超声波清洗器(昆山市超声仪器有限公司),密理博超纯水机(广西南宁市博美生物科技有限公司)。
对照品绿原酸(批号110753-201817,纯度≥96.8%),购自中国食品药品检定研究院;新绿原酸(批号DST190124-015,纯度≥98%),异绿原酸B(批号DST190226-037,纯度≥99.04%),异绿原酸A(DST190113-036,纯度≥99.5%),异绿原酸C(DST190110-038,纯度≥99.47%),均购自成都德思特生物技术有限公司。乙腈、甲醇为色谱纯,其余为分析纯,水为超纯水。
10批三加皮药材信息见表 1,经广西中医药大学朱意麟高级鉴定师鉴定,均为五加科植物三加皮Acanthopanax trifoliatus(L.)Merr.的干燥根。
| 样品编号 Sample number |
产地 Place of origin |
| S1 | 广西桂林Guilin, Guangxi |
| S2 | 广西钦州Qinzhou, Guangxi |
| S3 | 广东揭阳Jieyang, Guangdong |
| S4 | 广西防城港Fangchenggang, Guangxi |
| S5 | 广西防城港Fangchenggang, Guangxi |
| S6 | 四川乐山Leshan, Sichuan |
| S7 | 广西金秀Jinxiu, Guangxi |
| S8 | 江西赣州Ganzhou, Jiangxi |
| S9 | 广西阳朔Yangshuo, Guangxi |
| S10 | 广东汕头Shantou, Guangdong |
1.2 方法 1.2.1 HPLC法色谱条件
色谱柱:phenomenex C18(4.6 nm×250 nm×5 μm);流动相:乙腈(C)-0.2%磷酸溶液(A),梯度洗脱(0-6 min,9.5% C;6-15 min,13% C;15-18 min, 14% C;18-20 min,15% C;20-30 min,18% C;30-45 min,30% C;45-50 min,35% C);流速:1 mL/min;检测波长:325 nm;柱温:30℃;进样量:5 μL。以上述色谱条件下三加皮样品及混合对照品的色谱图见图 1。
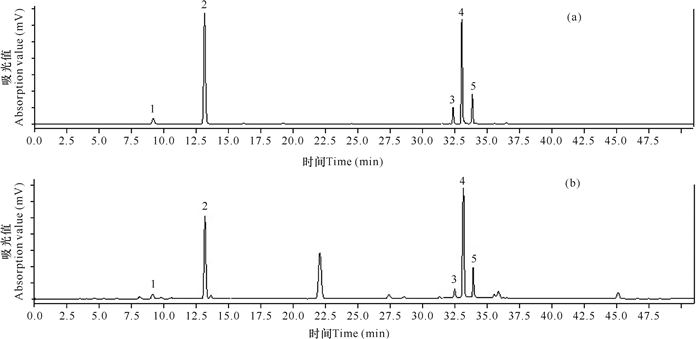
|
| 1.新绿原酸;2.绿原酸;3.异绿原酸B;4.异绿原酸A;5.异绿原酸C 1.neochlorogenic acid; 2.chlorogenic acid; 3.isochlorogenic acid B; 4.isochlorogenic acid A; 5.isochlorogenic acid C 图 1 混合对照品(a)和三加皮样品(b)的HPLC色谱图 Fig. 1 HPLC chromatograms of mixed reference (a) and Acanthopanax trifoliate sample (b) |
1.2.2 混合对照品溶液的制备
分别精密称取新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C对照品适量,加50%甲醇溶解,分别制成浓度为1.03, 1.55, 1.16, 1.01, 1.21 mg/mL的对照品溶液;另取上述溶液适量,置于同一量瓶中,加50%甲醇稀释,制成含新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C的浓度分别为0.019, 0.390, 0.200, 0.033, 0.060 mg/mL的混合对照品溶液,备用。
1.2.3 供试品溶液的制备精密称取三加皮粉末约0.5 g,置于50 mL具塞锥形瓶中,精密加入50%乙醇30 mL,称重,超声30 min,冷却,补重,加50%乙醇补足减失重量,过滤,取续滤液15 mL,挥干,用50%乙醇定容至5 mL,摇匀,离心,取上清液,即得。
2 结果与分析 2.1 HPLC定量方法的建立 2.1.1 线性关系考察分别精密吸取1.2.2节的混合对照品溶液1,3,5,8,10,15,20 μL,按1.2.1节色谱条件进样测定,记录5个成分的峰面积值,以峰面积(y)对应进样质量x(μg)进行回归分析。得各回归方程及线性范围(表 2)。
| 成分 Component |
线性回归方程 Linear regression equation |
R2 | 线性范围 Linear range (mg/mL) |
| 新绿原酸Neochlorogenic acid | y=4.122×106x1-9.689×102 | 0.999 9 | 0.019-0.380 |
| 绿原酸Chlorogenic acid | y=3.400×106x2 -1.248×105 | 0.999 7 | 0.390-7.800 |
| 异绿原酸B Isochlorogenic acid B | y=3.850×106x3+7.597×103 | 0.999 9 | 0.033-0.660 |
| 异绿原酸A Isochlorogenic acid A | y=4.269×106x4-1.008×105 | 0.999 3 | 0.200-4.000 |
| 异绿原酸C Isochlorogenic acid C | y=3.729×106x5+2.100×104 | 0.999 7 | 0.060-1.200 |
2.1.2 精密度试验
精密吸取混合对照品溶液5 μL,按1.2.1节色谱条件连续进样6次,测定峰面积,计算得到新绿原酸、绿原酸、异绿原酸B、异绿原酸A及异绿原酸C峰面积的精密度RSD值分别为0.05%、0.07%、0.39%、0.06%、0.75%,表明仪器精密度良好。
2.1.3 重复性试验取同一批三加皮供试品粉末,精密称定,按照1.2.3节的方法平行制备6份供试品溶液,分别精密吸取5 μL进样测定,分别计算新绿原酸、绿原酸、异绿原酸B、异绿原酸A及异绿原酸C 5个成分平均含量及其RSD值,结果得到新绿原酸、绿原酸、异绿原酸B、异绿原酸A及异绿原酸C 5个成分平均含量分别为1.038,16.320,1.840,17.360,5.519 mg/g,RSD值分别为1.1%、2.4%、2.1%、2.4%、2.4%,表明该方法的重复性良好。
2.1.4 稳定性试验精密吸取同一份三加皮供试品溶液5 μL,分别于制备后0,2,4,6,8,12 h进行测定,分别计算新绿原酸、绿原酸、异绿原酸B、异绿原酸A及异绿原酸C 5个成分峰面积值,计算RSD值,结果分别为0.90%、0.22%、1.20%、0.39%、1.30%,表明该供试品在12 h内稳定性良好。
2.1.5 加样回收率试验取同一批已知含量三加皮样品粉末,精密称定6份,每份约0.25 g,分别精密加入一定量的新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C对照品,按1.2.3节方法制备供试品溶液,分别测定其峰面积,计算回收率。新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C的平均回收率分别为100%、105%、98%、103%、104%;RSD值分别为2.31%、2.24%、1.90%、1.07%、1.43%,表明该方法的准确度很高。
2.2 相对校正因子的计算分别精密吸取1.2.2节的混合对照品溶液1,3,5,8,10,15,20 μL测定,以绿原酸为内参物(S),按照公式(1)计算新绿原酸(a)、异绿原酸B (b)、异绿原酸A (c)、异绿原酸C (d)的相对校正因子,结果见表 3。
| 进样体积Injection volume (μL) | fa/S | fb/S | fc/S | fd/S |
| 1 | 0.817 | 0.862 | 0.822 | 0.895 |
| 3 | 0.815 | 0.862 | 0.823 | 0.899 |
| 5 | 0.814 | 0.857 | 0.823 | 0.894 |
| 8 | 0.813 | 0.859 | 0.823 | 0.882 |
| 10 | 0.812 | 0.857 | 0.823 | 0.883 |
| 15 | 0.816 | 0.861 | 0.823 | 0.890 |
| 20 | 0.830 | 0.877 | 0.823 | 0.899 |
| 平均值 Average value |
0.817 | 0.862 | 0.823 | 0.892 |
| RSD (%) | 0.76 | 0.79 | 0.08 | 0.80 |
| $ {f_{i/{\rm{s}}}} = {f_i}/{f_{\rm{s}}} = \left( {{W_i}/{A_i}} \right)/\left( {{W_{\rm{s}}}/{A_{\rm{s}}}} \right) = \left( {{W_i} \times {A_{\rm{s}}}} \right)/\left( {{W_{\rm{s}}} \times {A_i}} \right), $ | (1) |
其中,Ai、AS分别为待测成分及内参物的峰面积,Wi、WS分别为待测成分及内参物的量。
2.3 相对校正因子(fi/ S)的耐用性考察 2.3.1 不同高效液相色谱系统及色谱柱对fi/S的影响精密吸取1.2.2节的混合对照品溶液5 μL测定,分别考察Waters e2695 UV、Agilent 1260及Shimadzu LC-2030 Plus 3种色谱仪和phenomenex C18(4.6 mm×250 mm,5 μL)及Inertsil ODS-3 C18(4.6 mm×250 mm,5 μL) 2种色谱柱对相对校正因子的影响,并计算RSD值,结果均小于3%(表 4),表明该法重现性良好。
| 仪器 Instrument |
色谱柱 Chromatographic column |
相对校正因子 Relative correction factor |
|||
| fa/S | fb/S | fc/S | fd/S | ||
| Shimadzu LC-2030 Plus | phenomenex C18 | 0.816 | 0.862 | 0.801 | 0.896 |
| Inertsil ODS-3 C18 | 0.807 | 0.851 | 0.821 | 0.899 | |
| Agilent 1260 | phenomenex C18 | 0.814 | 0.870 | 0.835 | 0.925 |
| Inertsil ODS-3 C18 | 0.813 | 0.870 | 0.830 | 0.932 | |
| Waters e2695 UV | phenomenex C18 | 0.806 | 0.864 | 0.800 | 0.919 |
| Inertsil ODS-3 C18 | 0.809 | 0.860 | 0.824 | 0.922 | |
| 平均值 Average value |
0.811 | 0.863 | 0.819 | 0.915 | |
| RSD (%) | 0.49 | 0.83 | 1.78 | 1.61 | |
2.3.2 不同色谱柱柱温对fi/S的影响
考察不同柱温(25,30,35℃)对各fi/S的影响。新绿原酸、异绿原酸B、异绿原酸A、异绿原酸C的RSD值依次为0.76%、0.79%、0.08%、0.80%(表 5),表明柱温波动对各相对效正因子fi/S无显著影响。
| 柱温Column temperature (℃) | fa/S | fb/S | fc/S | fd/S |
| 25 | 0.812 | 0.854 | 0.820 | 0.896 |
| 30 | 0.814 | 0.858 | 0.824 | 0.895 |
| 35 | 0.812 | 0.856 | 0.823 | 0.886 |
| 平均值 Average value |
0.813 | 0.856 | 0.822 | 0.892 |
| RSD (%) | 0.76 | 0.79 | 0.08 | 0.80 |
2.3.3 不同流速对fi/S的影响
考察不同流速(0.6,0.8,1.0 mL/min)对各fi/S的影响。新绿原酸、异绿原酸B、异绿原酸A、异绿原酸C的RSD值依次为0.76%、0.79%、0.08%、0.80%(表 6),表明不同流速对各相对校正因子fi/S无显著影响。
| 流速Current speed (mL/min) | fa/S | fb/S | fc/S | fd/S |
| 0.6 | 0.812 | 0.859 | 0.841 | 0.931 |
| 0.8 | 0.812 | 0.860 | 0.842 | 0.921 |
| 1.0 | 0.799 | 0.852 | 0.841 | 0.898 |
| 平均值Average value | 0.807 | 0.857 | 0.841 | 0.917 |
| RSD (%) | 0.76 | 0.79 | 0.08 | 0.80 |
2.4 待测成分色谱峰的定位
本研究考察了对不同色谱柱中各待测色谱峰与参照物峰的保留时间差(⊿ti/S)及相对保留时间(ti/S)进行定位,结果发现⊿ti/S及ti/S RSD值均小于5%,⊿ti/S波动较小(表 7,8),因此,采用⊿ti/S对待测组分色谱峰进行定位。
| 仪器 Instrument |
色谱柱 Chromatographic column |
fa/S | fb/S | fc/S | fd/S |
| Shimadzu LC-2030 Plus | phenomenex C18 | 3.965 | 19.153 | 19.816 | 20.609 |
| Inertsil ODS-3 C18 | 3.991 | 18.482 | 19.218 | 19.854 | |
| Agilent 1260 | phenomenex C18 | 4.088 | 18.977 | 19.636 | 20.406 |
| Inertsil ODS-3 C18 | 4.472 | 18.094 | 18.819 | 19.474 | |
| Waters e2695 UV | phenomenex C18 | 4.038 | 19.205 | 19.900 | 20.711 |
| Inertsil ODS-3 C18 | 4.113 | 18.523 | 19.270 | 19.918 | |
| 平均值 Average value |
4.111 | 18.739 | 19.443 | 20.162 | |
| RSD (%) | 4.51 | 2.36 | 2.13 | 2.42 |
| 仪器Instrument | 色谱柱Chromatographic column | fa/S | fb/S | fc/S | fd/S |
| Shimadzu LC-2030 Plus | phenomenex C18 | 0.702 | 2.440 | 2.489 | 2.549 |
| Inertsil ODS-3 C18 | 0.724 | 2.277 | 2.328 | 2.371 | |
| Agilent 1260 | phenomenex C18 | 0.705 | 2.370 | 2.418 | 2.473 |
| Inertsil ODS-3 C18 | 0.707 | 2.184 | 2.232 | 2.275 | |
| Waters e2695 UV | phenomenex C18 | 0.694 | 2.453 | 2.506 | 2.567 |
| Inertsil ODS-3 C18 | 0.716 | 2.278 | 2.330 | 2.375 | |
| 平均值Average value | 0.708 | 2.334 | 2.384 | 2.435 | |
| RSD (%) | 1.50 | 4.51 | 4.45 | 4.59 |
2.5 QAMS与ESM测定结果的比较
取10批产地的三加皮样品,按照1.2.3节方法制备样品溶液,按照1.2.1节的色谱条件测定,记录待测组分峰面积,分别用ESM法与QAMS法计算其含量并对结果进行比较,其相对误差RE均小于3%(表 9),用统计学计算,结果表明,P=0.000 0<0.05,2种方法所得值无显著性差异,由此说明QAMS法用于三加皮药材的多种酚酸类成分质量评价研究是可行的。
| 产地 Place of origin |
绿原酸 Chlorogenic acid |
新绿原酸 Neochlorogenic acid |
异绿原酸B Isochlorogenic acid B |
异绿原酸A Isochlorogenic acid A |
异绿原酸C Isochlorogenic acid C |
|||||||||||
| EMS | QAMS | RE (%) | EMS | QAMS | RE (%) | EMS | QAMS | RE (%) | EMS | QAMS | RE (%) | |||||
| S1 | 24.609 | 0.756 | 0.778 | 0.029 | 1.684 | 1.698 | 0.008 | 8.157 | 8.287 | 0.016 | 1.012 | 1.075 | 0.062 | |||
| S2 | 8.811 | 0.826 | 0.879 | 0.064 | 2.413 | 2.503 | 0.037 | 6.289 | 6.534 | 0.039 | 3.726 | 3.903 | 0.048 | |||
| S3 | 18.482 | 0.801 | 0.829 | 0.035 | 1.814 | 1.838 | 0.013 | 9.349 | 9.599 | 0.027 | 3.173 | 3.246 | 0.023 | |||
| S4 | 17.463 | 1.350 | 1.402 | 0.038 | 2.043 | 2.069 | 0.013 | 20.285 | 21.206 | 0.045 | 7.313 | 7.406 | 0.013 | |||
| S5 | 16.542 | 1.089 | 1.132 | 0.039 | 1.954 | 1.983 | 0.015 | 17.211 | 17.974 | 0.044 | 5.533 | 5.628 | 0.017 | |||
| S6 | 6.567 | 1.153 | 1.250 | 0.084 | 2.483 | 2.622 | 0.056 | 9.119 | 9.786 | 0.073 | 12.083 | 12.734 | 0.054 | |||
| S7 | 22.036 | 1.409 | 1.456 | 0.033 | 1.605 | 1.622 | 0.011 | 10.039 | 10.289 | 0.025 | 3.264 | 3.324 | 0.018 | |||
| S8 | 19.075 | 0.682 | 0.705 | 0.034 | 2.886 | 2.907 | 0.007 | 25.561 | 26.743 | 0.046 | 7.590 | 7.667 | 0.010 | |||
| S9 | 21.883 | 1.392 | 1.438 | 0.033 | 1.330 | 1.349 | 0.014 | 10.085 | 10.339 | 0.025 | 3.229 | 3.290 | 0.019 | |||
| S10 | 25.732 | 0.882 | 0.908 | 0.029 | 2.338 | 2.346 | 0.003 | 15.877 | 16.398 | 0.033 | 3.673 | 3.722 | 0.013 | |||
3 讨论
目前有文献报道三加皮根部总黄酮提取工艺[15],但对三加皮质量控制研究甚少,因此,本研究采用HPLC法,建立一测多评法(QAMS)对三加皮中酚酸类成分含量进行测定。
本研究考察了不同柱温、流速、色谱柱、仪器对所建立的校正因子的影响,结果表明各成分的校正因子重现性良好。QAMS旨在通过某一参照物峰实现对其他待测色谱峰的准确定位,常规方法通过保留时间差(⊿ti/S)或相对保留时间(ti/S)定位,通过保留时间差或相对保留值等参数不能准确定位时,选用定性用的对照品对待测组分色谱峰进行定位[17]。本研究应用保留时间差(⊿ti/S)或相对保留时间(ti/S)对各成分的色谱峰进行定位,发现⊿ti/S及ti/S在不同仪器和色谱柱中重现性较好,同时结合色谱峰峰型,可准确对目标峰的位置做出判断。研究测定了10批三加皮中的5个成分,结果显示QAMS与ESM的统计结果无显著性差异,说明选择绿原酸为内参物,可建立QAMS法用于三加皮药材质量控制。
如何有效建立稳定有效的对中药可控质量标准一直是热门探讨话题,中药多成分的复杂性决定了单一成分或指标测定难以评价中药的质量,由此提出多成分质量控制的模式,并可直接对药材进行质量评价。本研究通过一测多评法对多指标成分的测定反应三加皮的质量,酚酸类成分是三加皮主要活性成分之一,但新绿原酸、异绿原酸B、异绿原酸A、异绿原酸C对照品昂贵,而绿原酸对照品价廉易得,化学性质相对稳定,在10批三加皮药材中含量较高,是三加皮的主要活性成分之一,所以选择绿原酸为内参物进行QAMS分析。通过外标法测定绿原酸,用相对校正因子来计算新绿原酸、异绿原酸B、异绿原酸A、异绿原酸C 4种成分的含量,与外标法测定结果相比较,结果无显著差异,检测方法快速、简便、准确。一测多评法同步测定绿原酸、新绿原酸、异绿原酸B、异绿原酸A、异绿原酸C 5种成分的含量,符合多成分测定,不仅可全面控制三加皮的质量,解决对照品价格昂贵难获得的问题,降低检测成本,还可为三加皮质量控制提供多成分指标评价模式,对进一步利用三加皮资源及研究其保健作用和药用价值提供科学参考,为后续研究奠定基础。
此外,课题组采用高效液相色谱与Q-Exactive四极杆-静电场轨道阱高分辨质谱联用,考察不同产地的三加皮成分,借助赛默飞中药成分高分辨质谱数据库OTCML分析,但在HPLC法测定其含量时,三加皮样品中有的色谱峰跟实验室的对照品没有对应上,在有关三加皮的研究文献上也没有指认出。本课题组今后会进一步对三加皮活性成分及药理药效进行深入的研究,为三加皮的临床应用进一步提供科学依据。
| [1] |
广西壮族自治区食品药品监督管理局. 广西壮族自治区壮药质量标准: 第1卷[M]. 2008年版, 壮汉双语. 南宁: 广西科学技术出版社, 2017.
|
| [2] |
HAMID R A, KEE TH, OTHMAN F. Anti-inflammatory and anti-hyperalgesic activities of Acanthopanax trifoliatus (L)Merr.Leaves[J]. Pharmacognosy Research, 2013, 5(2): 129-133. DOI:10.4103/0974-8490.110544 |
| [3] |
杨慧文, 张旭红, 陈婉琪, 等. 白簕茎多糖对大、小鼠的抗炎镇痛及抗疲劳作用研究[J]. 中国药房, 2015, 26(31): 4364-4367. DOI:10.6039/j.issn.1001-0408.2015.31.15 |
| [4] |
李晨悦, 李冬利, 张元, 等. 不同品种簕菜的总多酚含量及抗氧化活性比较[J]. 食品与发酵工业, 2015, 41(10): 125-129. |
| [5] |
王艳, 石瑛翘, 潘育方, 等. 白簕总黄酮、多糖的体外抑菌作用研究[J]. 亚太传统医药, 2015, 11(11): 37-39. |
| [6] |
劳景辉, 潘超美, 喻勤, 等. 白簕提取物抑制痤疮丙酸杆菌及美白活性研究[J]. 中国现代中药, 2016, 18(9): 1120-1124. |
| [7] |
李劲新. 一种柠檬簕菜茶的制作方法: 201810188958.6[P]. 2018-09-28.
|
| [8] |
李雪壮. 一种陈皮簕菜茶的制作方法: 201410726686.2[P]. 2015-04-08.
|
| [9] |
冯伟森. 一种燕麦簕菜茶及其制作方法: 201510912889.5[P]. 2016-04-06.
|
| [10] |
一种含皇竹草和簕菜的减肥茶: 201610515157.7[P]. 2016-10-26.
|
| [11] |
陈泽丰, 何燕, 张焜, 等. 一种簕菜泡腾固体饮料及其制备方法: 201610002061.0[P]. 2016-05-25.
|
| [12] |
李冬利, 段庆, 张焜, 等. 一种簕菜保健饼干及其制备方法: 201710058716.0[P]. 2017-06-13.
|
| [13] |
李冬利, 张焜, 秦莹, 等. 一种簕菜保健颗粒剂及其制备方法: 201611155520.5[P]. 2017-05-24.
|
| [14] |
李冬利, 秦莹, 张焜, 等. 一种簕菜保健硬糖及其制备方法: 201611154252.5[P]. 2017-05-10.
|
| [15] |
蔡凌云, 黎云祥, 陈蕉, 等. 白簕根皮总黄酮提取工艺研究[J]. 食品科学, 2009, 30(4): 44-47. DOI:10.3321/j.issn:1002-6630.2009.04.003 |
| [16] |
朱乃亮, 彭平, 赵丽敏, 等. 植物中常见咖啡酰奎宁酸类化合物研究进展[C]//中华中医药学会中药化学分会. 中华中医药学会中药化学分会第八届学术年会论文集. 北京: 中华中医药学会中药化学分会, 2013: 10.
|
| [17] |
陆兔林, 石上梅, 蔡宝昌, 等. 基于一测多评的中药多成分定量研究进展[J]. 中草药, 2012, 43(12): 2525-2529. |



