2. 广西壮族自治区中国科学院广西植物研究所, 广西喀斯特植物保育与恢复生态学重点实验室, 广西桂林 541006
2. Guangxi Key Laboratory of Plant Conservation and Restoration Ecology in Karst Terrain, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
细菌作为微生物的重要组成部分,其在有机质分解、腐殖质形成等诸多土壤生态过程中发挥着重要作用。目前,细菌的生态特性已逐渐成为评价土壤质量的重要指标,可用于指示土壤的肥力形成及其演变过程[1]。水稻土是我国重要的耕作土壤之一,也是耕地土壤中最为高产稳产的类型,约占全国耕地面积的1/5。但是,水稻土的形成状态深受人为活动的影响[2]。例如,尽管化肥施入土壤带来了作物的增产,但是会造成土壤板结、酸化和生物性状下降等生态环境问题[3, 4]。土壤细菌对环境条件具有较高敏感性,其结构和功能的改变能够有效指示化肥施用下土壤环境或植被的变化。因此,近年来通过长期定位试验来探究施肥对土壤细菌影响的研究受到人们的广泛关注。陆海飞等[5]研究表明,与不施肥对照相比,有机/无机肥配施下土壤细菌的香农指数和丰富度指数显著增大;邢亚薇等[6]通过实时荧光定量PCR (Real-time PCR)技术发现黄土旱塬农田单施化肥处理的细菌数量较不施肥裸地增加21%,pH、全氮和有机碳含量是影响土壤微生物群落丰度的重要因子;刘佳等[7]以祁阳红壤实验站的冬小麦-夏玉米定位试验为研究对象,结果表明长期不同施肥方式改变了旱地红壤优势菌的相对丰度,长期施肥后旱地红壤细菌群落主要受土壤pH的影响。
由于独特的水分管理措施,水稻土细菌群落组成与其他耕作土壤的相比表现出诸多差异,但目前关于长期施肥下水稻土细菌群落变化的研究相对较少[8]。本研究依托1989年西南大学建立的中性紫色水稻土长期定位试验站,针对不施肥(CK)和施用化肥(CF)两种不同处理下的水稻土,通过MiSeq高通量测序,研究30年长期施肥对水稻土壤细菌的影响规律。由于氮素是植物生长和发育所必需的养分元素,氮肥是最主要的化肥施用类型[9],因此本研究特意设置为期56 d的室内氮添加试验,探究短期高强度氮添加对水稻土细菌群落的影响,以便深入了解长期施肥对水稻土细菌多样性、群落结构和组成的影响。
1 材料与方法 1.1 样品采集土壤样品采集地点位于国家紫色土长期定位试验基地(106°26′E,30°26′N),长期定位试验始于1989年。于2019采集不施肥、施用化肥两种水稻土样品(分别用CK、CF表示),其中年施肥量为尿素273.1 kg·hm-2,过磷酸钙500.3 kg·hm-2,氯化钾150.1 kg·hm-2。土壤样品装入无菌袋中运回实验室,筛出碎石等杂物后在4℃冰箱暂存,用于后续分析测定以及室内氮添加试验。
1.2 短期氮添加试验采用室内培养的方法,根据土壤含水量称取过2 mm筛的鲜土(以10.00 g干重计)置于150 mL的玻璃广口瓶。对不施肥水稻土和施肥水稻土每周分别添加氮浓度为50 mg·kg-1的CO(NH2)2。通过均匀添加无菌水调节土壤水分含量至田间持水量(WHC)的60%,并在培养过程中每隔7 d以称重法补充蒸发损失的水分以保持土样的水分含量恒定。将广口瓶置于28℃恒温培养箱中培养56 d。培养结束后取样,并与原始土壤样品一起进行高通量测序。使用CK+N和CF+N分别表示两种水稻土加氮培养56 d后的土壤样品。
1.3 土壤基本性质分析土壤pH、有机质(SOM)、全氮(TN)、全磷(TP)、全钾(TK)、硝态氮(NO3--N)、铵态氮(NH4+-N)、速效磷(AP)和速效钾(AK)按标准方法进行分析测定[10]。
1.4 土壤DNA的提取、高通量测序本试验所采用的DNA提取试剂盒为Fast DNAⓇ SPIN Kit for Soil (MP Biomedicals),并使用微量紫外分光光度计(NanoDrop ND-1000 UV-Vis)测定DNA浓度。使用引物F515 (5′-GTGCCAGCMGCCGCGG-3′)和R907(5′-CCGTCAATTCMTTTRAGTTT-3′)对细菌16S rRNA基因的V4-V5区域基因进行扩增;PCR反应程序为98℃预变性1 min,98℃变性10 s,50℃退火30 s,72℃延伸60 s,30个循环。应用Illumina MiSeq平台进行高通量测序,并委托上海美吉生物科技有限公司完成。测序原始序列上传至NCBI的SRA (Sequence Read Archive)数据库,登录号为SRP259259。
1.5 数据处理与统计分析利用Excel 2010、SPSS 13、R software (Version 3.1.1)对数据进行处理与统计分析,使用Origin 8.5软件作图,采用单因素方差分析(One-Way ANOVA)和Duncan法进行差异显著性检验(ɑ=0.05),用Spearman法进行相关分析。利用Mothur软件(version 1.31.2)分析α多样性指数(Chao1和Shannon指数)。基于Bray-Curtis距离矩阵的主坐标分析(Principal Co-ordinates Analysis, PCoA)计算不同处理下土壤细菌组成的差异性(β多样性)。使用冗余分析(Redundancy Analysis, RDA)阐明影响土壤细菌群落的关键环境因子。
2 结果与分析 2.1 不同处理下土壤化学性质由表 1可知,30年长期施用化肥使得水稻土的化学性质发生显著改变。与CK相比,CF处理使土壤pH从7.43降至6.82 (P<0.05);除pH值外,CF处理显著提高土壤其他物质的水平(P<0.05)。与原始土样(CK和CF)相比,为期56 d的氮添加(CK+N和CF+N)显著改变了土壤的NH4+-N和NO3--N水平,但对土壤其他性质影响不大。
| 处理 Treatments |
pH | SOM (g·kg-1) |
TN (g·kg-1) |
TP (g·kg-1) |
TK (g·kg-1) |
AP (mg·kg-1) |
AK (mg·kg-1) |
NH4+-N (mg·kg-1) |
NO3--N (mg·kg-1) |
| CK | 7.43±0.03a | 20.52±1.37b | 1.04±0.04b | 0.44±0.02b | 17.12±0.72b | 3.26±0.12b | 64.82±1.27b | 9.27±0.04d | 5.29±0.23d |
| CF | 6.82±0.11b | 26.14±0.71a | 1.47±0.05a | 0.82±0.07a | 22.61±1.20a | 24.99±0.51a | 85.36±1.29a | 17.32±0.52c | 8.94±0.76c |
| CK+N | 7.35±0.05a | 19.58±1.16b | 1.08±0.04b | 0.41±0.03b | 16.4±0.56b | 3.32±0.17b | 65.30±1.11b | 85.08±0.57a | 87.81±0.11b |
| CF+N | 6.74±0.08b | 24.95±0.07a | 1.49±0.13a | 0.79±0.07a | 22.34±0.18a | 25.09±0.42a | 85.32±0.92a | 60.95±0.82b | 112.01±0.47a |
| 注:不同小写字母代表处理间差异显著(P<0.05) Note: Different lowercase letters indicate significant differences between treatments (P < 0.05) | |||||||||
2.2 土壤细菌多样性
水稻土样品高通量测序共获得313 581条优质序列,以97%相似性阈值进行Operational Taxonomic Unit (OUT)聚类,在CK、CF、CK+N和CF+N处理中分别得到1 349,1 624,1 301,1 524个OUT (表 2)。Chao1指数通常用来描述群落丰富度,CF处理下的Chao1指数显著高于CK处理(P<0.05)。短期氮添加后Chao1指数与未加氮土样相比并未产生显著差异。对于Shannon指数,呈现出与Chao1指数类似的变化,CF处理相较于CK处理显著提高了水稻土壤细菌群落多样性(P<0.05)。
| 处理 Treatments |
序列数 Reads |
操作分类单元 OTUs |
Chao1指数 Chao1 indices |
香农指数 Shannon indices |
覆盖率 Coverage |
| CK | 22 061±8 787b | 1 349±110b | 1 567±69b | 6.18±0.05b | 0.986±0.006 |
| CF | 31 293±2 733a | 1 624±72a | 1 749±48a | 6.39±0.09a | 0.993±0.002 |
| CK+N | 23 085±3 351b | 1 301±77b | 1 481±56b | 6.09±0.18b | 0.989±0.002 |
| CF+N | 28 088±1 614a | 1 524±18a | 1 682±9a | 6.22±0.03a | 0.992±0.001 |
| 注:不同小写字母代表处理间差异显著(P<0.05) Note: Different lowercase letters indicate significant differences between treatments (P < 0.05) | |||||
不同处理间水稻土细菌群落组成差异的PCoA分析结果如图 1所示。在OTU水平上,PCoA1与PCoA2分别解释变量方差为43.16%和11.42%,累计解释度达54.58%,PCoA1可将CK和CK+N的细菌群落与CF、CF+N明显区分开。56 d氮添加后的土壤样品与原始土样相比分离距离较小,未明显分开,短期施氮对微生物群落结构产生的影响较小。
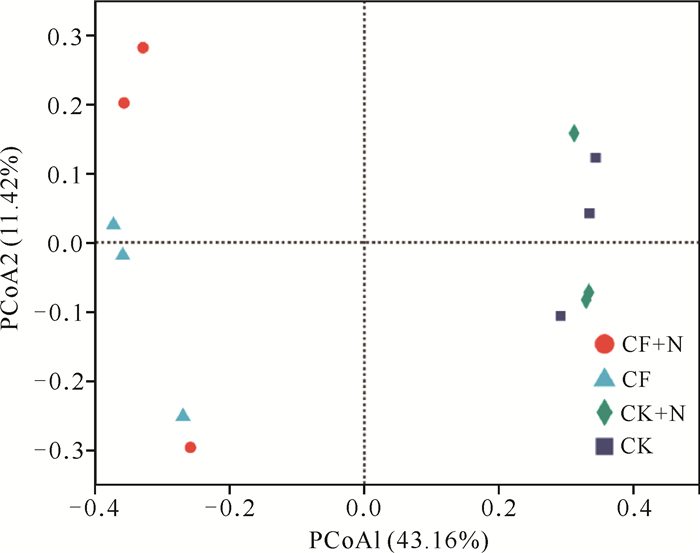
|
| 图 1 不同处理土壤细菌群落主坐标分析(PCoA) Fig. 1 Principal co-ordinate analysis (PCoA) of soil bacterial community under different treatments |
2.3 土壤细菌群落物种组成
如图 2所示,在门水平上统计各样本物种丰度,水稻土中的优势菌门(>1%)包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。在CK处理中,上述优势菌门的平均相对丰度分别为27.26%、19.04%、17.01%、14.42%、6.06%、5.69%、3.09%、1.93%和1.25%。在CF处理中,Proteobacteria、Planctomycetes和Bacteroidetes的平均相对丰度显著高于CK处理(P<0.05);而Actinobacteria、Acidobacteria、Gemmatimonadetes和Firmicutes呈现出相反的情况。在所有样品中,Proteobacteria、Acti-nobacteria、Acidobacteria和Chloroflexi的总占比均超过70%,其中Proteobacteria的相对丰度均为最高。比较CK和CK+N可知,56 d的室内氮添加明显提高了不施肥水稻土中Proteobacteria和Bacteroidetes的相对丰度(P<0.05);对比CF和CF+N,短期氮添加显著提升了施肥水稻土中Nitrospirae的相对丰度(P<0.05)。
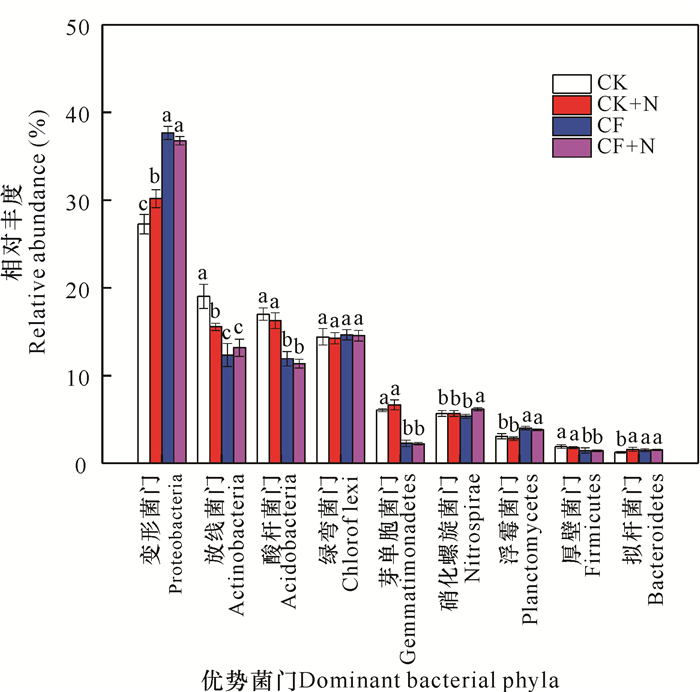
|
| 不同小写字母代表处理间差异显著(P<0.05) Different lowercase letters indicate significant differences between treatments (P < 0.05) 图 2 土壤细菌优势种群相对丰度 Fig. 2 Relative abundances of the dominant bacterial species in soil |
2.4 土壤细菌群落与环境因子的相关性
由表 3可知,Shannon指数与土壤SOM、TK显著正相关(P<0.05),而Chao1指数与除NH4+-N、NO3--N以外测定的环境因子均显著相关(P<0.05),其中和pH显著负相关(P<0.05)。在优势菌门中,Chloroflexi与土壤环境因子之间无显著相关性。NH4+-N与优势菌门间无显著相关性,NO3--N与Nitrospirae显著正相关(P < 0.05),相关性系数为0.671。各细菌门与环境因子间的关系存在差异,如土壤SOM与Proteobacteria、Nitrospirae、Planctomycetes和Bacteroidetes呈显著正相关关系,而与Actinobacteria、Acidobacteria、Gemmatimonadetes和Firmicutes则显著负相关(P < 0.05)。
| 因子 Factor |
pH | 有机质 SOM |
全氮 TN |
全磷 TP |
全钾 TK |
速效磷 AP |
速效钾 AK |
铵态氮 NH4+-N |
硝态氮 NO3--N |
| 香农指数 Shannon indices |
-0.517 | 0.713** | 0.552 | 0.469 | 0.699* | 0.350 | 0.462 | -0.084 | 0.091 |
| Chao1指数 Chao1 indices |
-0.636* | 0.874** | 0.643* | 0.809** | 0.874** | 0.615* | 0.636* | -0.322 | 0.056 |
| 操作分类单元 OTUs |
-0.650* | 0.839** | 0.678* | 0.781** | 0.867** | 0.629* | 0.615* | -0.182 | 0.133 |
| 变形菌门 Proteobacteria |
-0.741** | 0.685* | 0.727** | 0.767** | 0.685* | 0.902** | 0.769** | 0.147 | 0.357 |
| 放线菌门 Actinobacteria |
0.846** | -0.622* | -0.636* | -0.648* | -0.511 | -0.769** | -0.797** | -0.280 | -0.504 |
| 酸杆菌门 Acidobacteria |
0.727** | -0.706* | -0.804** | -0.827** | -0.797** | -0.839** | -0.657* | -0.210 | -0.552 |
| 绿弯菌门 Chloroflexi |
-0.510 | -0.350 | -0.545 | -0.158 | -0.049 | -0.349 | -0.553 | -0.196 | -0.385 |
| 芽单胞菌 Gemmatimonadetes |
0.657* | -0.692* | -0.727** | -0.844** | -0.811** | -0.874** | -0.685* | 0.119 | -0.238 |
| 硝化螺旋菌 Nitrospirae |
-0.944** | 0.643* | 0.846** | 0.701* | 0.587* | 0.804** | 0.902** | 0.272 | 0.671* |
| 浮霉菌门 Planctomycetes |
-0.685* | 0.860** | 0.734** | 0.890** | 0.839** | 0.727** | 0.608* | -0.140 | 0.217 |
| 厚壁菌门 Firmicutes |
0.916** | -0.720** | -0.804** | -0.732** | -0.608* | -0.769** | -0.951** | -0.098 | -0.587* |
| 拟杆菌门 Bacteroidetes |
-0.844** | 0.697* | 0.862** | 0.596* | 0.739** | 0.739** | 0.788** | 0.277 | 0.746** |
| 注:*表示在P < 0.05水平下相关性达到显著,**表示在P < 0.01水平下相关性达到极显著 Note:*indicates a significant correlation at the P < 0.05 level, and **indicates a extremely significant correlation at the P < 0.01 level | |||||||||
为揭示主导细菌群落变化的关键环境因子,在OTU水平上对细菌群落进行冗余分析(RDA)(图 3)。RDA1和RDA2贡献率分别为22.90%和13.97%。土壤pH、SOM、TN、TP、TK、AP、AK、NH4+-N和NO3--N共同解释了36.87%的细菌群落组成变化。箭头越长表示对水稻土细菌群落组成的解释量越大。
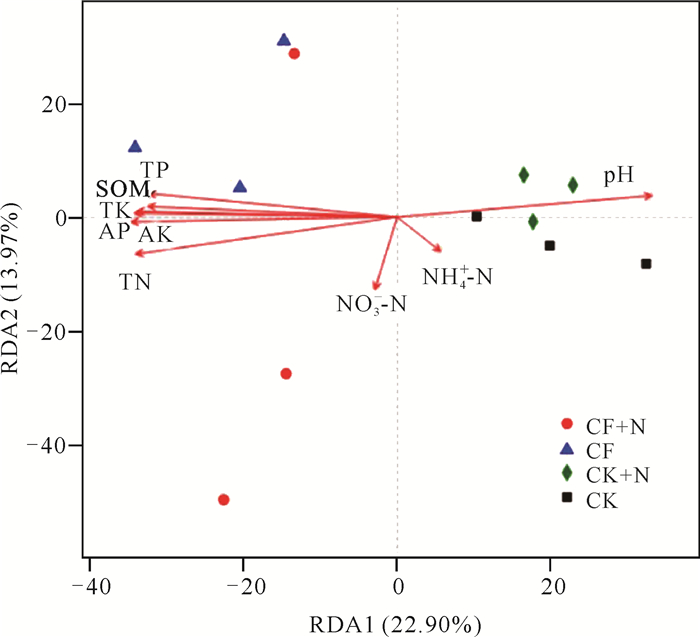
|
| 图 3 土壤细菌群落组成与环境变量的RDA分析 Fig. 3 Redundancy analysis (RDA) of soil bacterial community composition and environmental variables |
3 讨论
本研究重点关注水稻土中细菌群落对于长期化肥施用和短期氮添加的响应。作为陆地生态系统的核心组成部分,土壤微生物能够反应土壤肥力状况。研究分析表明,30年化肥的施用使得水稻土壤pH明显降低,这与先前许多长期试验所取得的结论一致[11, 12]。土壤酸化会对生态系统功能、土壤质量、食品安全和人类健康等诸多方面产生不利影响,近年来得到人们的广泛关注。高水平的氮肥施用会加速土壤酸化,通过硝化作用将铵态氮转化为硝态氮并在此过程中释放H+[13, 14]。当前,我国化肥使用量较高,为维持土壤质量与作物产量应采取相应的有效措施。在实际生产中,增施有机肥或农作物秸秆等能够有效缓解因单施化肥所引起的土壤酸化[15]。在本研究中,56 d的室内氮添加并未显著改变土壤pH,这可能与施肥时间较短有关,因为土壤酸化相对来说是一个较为漫长的过程[16]。此外,长期施肥促进了营养物质的积累,包括SOM、TN、TP、TK、AP和AK。室内氮添加明显提高土壤NH4+-N和NO3--N的浓度。施肥土壤的净硝化速率要远高于不施肥土壤[17],这可能是造成CF+N处理中NH4+-N浓度要低于CK+N处理的原因。
在本研究中,水稻土细菌群落的α多样性(Chao1指数和Shannon指数)在施肥处理下有所提高,而有研究报道称长期施肥导致土壤微生物多样性降低[18, 19],这种差异可能源于施肥时间跨度的不同。另外,土壤细菌多样性对肥料施用的响应并不一致,它们会随着施肥方式、轮作、土壤类型、土地利用方式和其他因素的变化而有所不同[20, 21]。一项调查45年稻田试验中细菌群落演变的研究表明,长期施肥并未对水稻土微生物结构产生显著影响[22]。细菌多样性由pH主导,化肥施用导致的土壤酸化使得细菌多样性降低[23]。相较于其他研究,本研究中pH值的波动较小,且营养物质水平明显提高;Chao1指数和Shannon指数在氮添加前后并未产生显著变化(表 2),表明短期氮添加对于土壤细菌α多样性影响较小。
此次试验所选用水稻土中的4类主要优势菌门为Proteobacteria、Actinobacteria、Acidobacteria和Chloroflexi,它们的总占比在各处理中均超过70%。长期施肥处理下Proteobacteria、Planctomycetes和Bacteroidetes的相对丰度显著高于不施肥处理,但Actinobacteria、Acidobacteria、Gemmatimonadetes和Firmicutes的相对丰度有所降低(图 2)。有研究指出Proteobacteria和Bacteroidetes表现出更好的适应营养丰富环境的属性,因此它们的相对丰度在高碳土壤中更高[24]。本研究中Proteobacteria和Bacteroidetes的相对丰度与土壤SOM呈显著正相关关系(表 3)。Acidobacteria更适应贫营养生境[25],所以营养水平较高的施肥土壤中该菌门的占比低于不施肥土壤。施肥土壤中的氮添加显著提高Nitrospirae的相对丰度(图 2),且Nitrospirae的相对丰度与NO3--N呈显著正相关关系(表 3)。Nitrospirae中的一部分属于亚硝酸盐氧化细菌,可将NO2--N氧化为NO3--N,所以Nitrospirae的增长或许是因为氮添加促进了土壤硝化作用。
pH是决定土壤微生物群落结构的关键生态因子[7],而土壤养分作为微生物生存发展的必要营养元素,在土壤中的有效性也成为影响或制约土壤微生物群落结构的重要因子[26]。本研究中,pH、AP、AK等环境因子对细菌群落结构与组成产生重要影响,这与大多数研究结果吻合[23, 27]。
4 结论综上所述,长期施肥处理能够影响水稻土壤pH、养分、土壤细菌多样性、群落组成和结构;短期氮添加对土壤细菌多样性特征影响较小。Proteobacteria、Actinobacteria、Acidobacteria和Chloroflexi在此次试验水稻土中的占比超过70%。土壤pH和营养状况(例如AP、AK、TP和TN等)是影响重庆地区水稻土细菌群落形成的主要驱动因子。在未来工作中,探究不同施肥处理间土壤微生物群落结构的差异及其原因,可为保持土壤微生物多样性及农业可持续发展等提供重要的理论和实践依据。
| [1] |
宋长青, 吴金水, 陆雅海, 等. 中国土壤微生物学研究10年回顾[J]. 地球科学进展, 2013, 28(10): 1087-1105. DOI:10.11867/j.issn.1001-8166.2013.10.1087 |
| [2] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924. DOI:10.3321/j.issn:0564-3929.2008.05.018 |
| [3] |
张永春, 汪吉东, 沈明星, 等. 长期不同施肥对太湖地区典型土壤酸化的影响[J]. 土壤学报, 2010, 47(3): 465-472. |
| [4] |
GUO Z C, ZHANG Z B, ZHOU H, et al. Long-term animal manure application promoted biological binding agents but not soil aggregation in a vertisol[J]. Soil and Tillage Research, 2018, 180: 232-237. DOI:10.1016/j.still.2018.03.007 |
| [5] |
陆海飞, 郑金伟, 余喜初, 等. 长期无机有机肥配施对红壤性水稻土微生物群落多样性及酶活性的影响[J]. 植物营养与肥料学报, 2015, 21(3): 632-632. |
| [6] |
邢亚薇, 李春越, 刘津, 等. 长期施肥对黄土旱塬农田土壤微生物丰度的影响[J]. 应用生态学报, 2019, 30(4): 276-283. |
| [7] |
刘佳, 陈晓芬, 刘明, 等. 长期施肥对旱地红壤细菌群落的影响[J]. 土壤学报, 2020, 57(2): 468-478. |
| [8] |
SHENG R, MENG D, WU M, et al. Effect of agricultural land use change on community composition of bacteria and ammonia oxidizers[J]. Journal of Soils and Sediments, 2013, 13(7): 1246-1256. DOI:10.1007/s11368-013-0713-3 |
| [9] |
朱兆良. 中国土壤氮素研究[J]. 土壤学报, 2008, 45(5): 778-783. DOI:10.3321/j.issn:0564-3929.2008.05.003 |
| [10] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
|
| [11] |
ZHAO S, QIU S, CAO C, et al. Responses of soil properties, microbial community and crop yields to various rates of nitrogen fertilization in a wheat-maize cropping system in north-central China[J]. Agriculture Ecosystems and Environment, 2014, 194: 29-37. DOI:10.1016/j.agee.2014.05.006 |
| [12] |
ZENG J, LIU X, SONG L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41-49. DOI:10.1016/j.soilbio.2015.09.018 |
| [13] |
GEISSELER D, SCOW K M. Long-term effects of mineral fertilizers on soil microorganisms-A review[J]. Soil Biology and Biochemistry, 2014, 75: 54-63. DOI:10.1016/j.soilbio.2014.03.023 |
| [14] |
JIANG X, HOU X, ZHOU X, et al. pH regulates key players of nitrification in paddy soils[J]. Soil Biology and Biochemistry, 2015, 81: 9-16. DOI:10.1016/j.soilbio.2014.10.025 |
| [15] |
宁川川, 王建武, 蔡昆争. 有机肥对土壤肥力和土壤环境质量的影响研究进展[J]. 生态环境学报, 2016, 25(1): 179-185. |
| [16] |
孟红旗, 刘景, 徐明岗, 等. 长期施肥下我国典型农田耕层土壤的pH演变[J]. 土壤学报, 2013, 50(6): 1109-1116. |
| [17] |
WANG Z, CAO Y, WRIGHT A L, et al. Different ammonia oxidizers are responsible for nitrification in two neutral paddy soils[J]. Soil and Tillage Research, 2019, 195: 104433. DOI:10.1016/j.still.2019.104433 |
| [18] |
ALLISON S D, HANSON C A, TRESEDER K K, et al. Nitrogen fertilization reduces diversity and alters community structure of active fungi in boreal ecosystems[J]. Soil Biology and Biochemistry, 2007, 39(8): 1878-1887. DOI:10.1016/j.soilbio.2007.02.001 |
| [19] |
DAI Z, SU W, CHEN H, et al. Long-term nitrogen fertilization decreases bacterial diversity and favors the growth of Actinobacteria and Proteobacteria in agro-ecosystems across the globe[J]. Global Change Biology, 2018, 24(8): 3452-3461. DOI:10.1111/gcb.14163 |
| [20] |
AI C, ZHANG S, ZHANG X, et al. Distinct responses of soil bacterial and fungal communities to changes in fertilization regime and crop rotation[J]. Geoderma, 2018, 319: 156-166. DOI:10.1016/j.geoderma.2018.01.010 |
| [21] |
HU X, LIU J, WEI D, et al. Soil bacterial communities under different long-term fertilization regimes in three locations across the black soil region of northeast China[J]. Pedosphere, 2018, 28(5): 751-763. DOI:10.1016/S1002-0160(18)60040-2 |
| [22] |
DAQUIADO A R, KUPPUSAMY S, KIM S Y, et al. Pyrosequencing analysis of bacterial community diversity in long-term fertilized paddy field soil[J]. Applied Soil Ecology, 2016, 108: 84-91. DOI:10.1016/j.apsoil.2016.08.006 |
| [23] |
SUN R B, ZHANG X X, GUO X S, et al. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw[J]. Soil Biology and Biochemistry, 2015, 88: 9-18. DOI:10.1016/j.soilbio.2015.05.007 |
| [24] |
FIERER N, BRADFORD M A, JACKSON R B. Towa-rd an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364. DOI:10.1890/05-1839 |
| [25] |
FIERER N, LAUBER C L, RAMIREZ K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6(5): 1007-1017. DOI:10.1038/ismej.2011.159 |
| [26] |
DING J, JIANG X, MA M, et al. Effect of 35 years inorganic fertilizer and manure amendment on structure of bacterial and archaeal communities in black soil of northeast China[J]. Applied Soil Ecology, 2016, 105: 187-195. DOI:10.1016/j.apsoil.2016.04.010 |
| [27] |
丁建莉, 姜昕, 关大伟, 等. 东北黑土微生物群落对长期施肥及作物的响应[J]. 中国农业科学, 2016, 49(22): 4408-4418. DOI:10.3864/j.issn.0578-1752.2016.22.013 |



