2. 环境污染治理与生态修复河南省协同创新中心, 河南郑州 450001
2. He'nan Collaborative Innovation Center of Environmental Pollution Control and Ecological Restoration, Zhengzhou University of Light Industry, Zhengzhou, He'nan, 450001, China
随着纳米科技的迅速发展,纳米材料被广泛应用于人类的生活和生产中,但其环境释放量也日益增多[1]。纳米材料主要通过实验室及生产工厂的废物排放、环境治理过程中的应用和纳米产品的使用等途径直接或间接地进入水体、大气和土壤中[2]。水体是纳米材料最终的富集地,纳米材料进入水体后,不仅会对水生生态系统造成影响,还可能通过食物链在水生生物体内富集并最终进入人体,对人类健康构成威胁[3]。研究表明,纳米材料会促使机体产生氧化应激反应,导致靶器官炎症,甚至透过细胞膜进入细胞和细胞核内,将其本身的生物毒性放大[4, 5]。纳米材料对环境以及人类健康的潜在风险已引起了人们的广泛关注。
纳米氧化锌作为一种新型基础材料,由于其具有较大的比表面积和独特的光电性能而被广泛应用在建筑涂料、废水处理、化妆品、塑料、陶瓷、医疗等各个领域中[6-9]。当前,纳米氧化锌的全球产量约为每年1×104 t,但随着对纳米氧化锌性能的开发,其需求量将会越来越大[10]。然而,纳米氧化锌的过度生产和不当使用导致其进入水环境中并富集,从而对细菌、藻类、鱼类及浮游动物等多种水生生物产生毒害作用[11-15]。Bhuvaneshwari等[16]发现,将斜生栅藻(Scenedesmus obliquus)暴露于纳米氧化锌中会导致斜生栅藻乳酸盐脱氢酶含量的上升、酶活性的丧失以及大量活性氧的产生,并导致细胞形态的严重变形。但是,纳米氧化锌的毒性机制目前不明确,一般认为其毒性源于材料自身所特有的光催化活性[17],也可能与其纳米颗粒的性质有关[18, 19]。
真菌是淡水生态系统中主要的分解者,其在物质循环和能量流动过程中发挥着极为重要的作用[20]。淡水生态系统中真菌的生理生态以及群落变化可作为生态系统是否健康的评价指标[21]。真菌能产生并分泌一系列胞外降解酶,以催化水体中的有机质(如凋落物)降解,为腐食性水生动物提供适口性良好的养分。其中,最重要的降解酶是参与磷循环的酸性磷酸酶、参与氮循环的亮氨酸氨基肽酶、参与碳循环的纤维二糖水解酶和参与氧化过程的过氧化物酶,这些酶的活性变化反映了真菌生理生态状态[22, 23]。此外,pH条件是影响真菌生长的重要环境参数[24],而真菌生理生态变化的最直观表现是细胞吸水和物质合成情况,即真菌鲜重和干重[25]。白地霉(Geotrichum candidum)是一种广泛存在于食物、废水和土壤中的丝孢真菌,存在于不同的溪流中[26, 27]。当毒性物质存在时,白地霉的生态生理变化在一定程度上反映出淡水生态系统的健康状况。但是,目前有关纳米氧化锌对真菌影响的生态效应研究相对较少。
本研究以从水体凋落物上分离得到的白地霉作为研究对象,评估不同浓度纳米氧化锌对其培养环境pH、菌丝鲜重、菌丝干重以及胞外降解酶(酸性磷酸酶、亮氨酸氨基肽酶、纤维二糖水解酶、过氧化物酶)活性的影响效应,并探究纳米氧化锌对白地霉生长和代谢活性的影响机制,以期为纳米材料生态安全性评估体系的建立提供有利的数据支撑。
1 材料与方法 1.1 材料 1.1.1 真菌分离和培养实验所用白地霉(Geotrichum candidum AC1)分离于钻天杨(Populus nigral L.)凋落物。2018年夏季,采集济源市天女溪沿岸钻天杨(钻天杨为河岸带的优势物种)的新鲜落叶。带回实验室,用去离子水冲洗干净,切成12 mm的圆盘,将凋落物圆盘放入0.5 mm孔径的凋落物袋中,淹没在溪流中(34°56′24.73″N,112°25′56.15″E)以进行微生物定殖。14 d后,将凋落物圆盘置于含有硫酸链霉素(16 μg/mL,Sigma-Aldrich)的100%麦芽汁固体培养基(130.1 g麦芽汁膏粉、20 g琼脂和1 L超纯水)上,30℃条件下培养2 d。采用D3390 Fungal DNA Mini Kit真菌DNA提取试剂盒(Omega Bio-Tek,Inc.),对纯化的菌株AC1进行DNA提取,使用通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)对DNA的ITS片段进行PCR扩增,PCR扩增产物送至上海美吉生物医药科技有限公司进行测序。
将分离纯化的菌株AC1接种于100%麦芽汁固体培养基上,于30℃恒温培养箱中培养2 d后,用灭菌的打孔器在培养基上打孔得到菌盘,在10%麦芽汁液体培养基中培养2 d (30℃,150 r/min),从而制得菌丝原液,保存于冰箱(4℃)待后续实验使用。
1.1.2 纳米氧化锌实验所用纳米氧化锌为粒径50 nm的粉末,购买于上海阿拉丁生物试剂公司。称取0.4 g纳米氧化锌粉末并用超纯水定容至100 mL。为使悬浮液中的纳米颗粒均匀分散,每次使用前,将悬浮液置于4℃和40 KHz条件下用数控超声波清洗器(KQ-100E,昆山市超声仪器有限公司)振荡30 min。利用场发射扫描电子显微镜(FE-SEM,JSM-7001F)观测纳米氧化锌的形貌,再使用Nano Measure 1.2标记FE-SEM图像中的粒径分布,得到悬浮液中纳米氧化锌的平均粒径为(95±28) nm。
1.2 方法取1 mL菌丝原液,加入含有40 mL 2%麦芽汁液体培养基的无菌锥形瓶中,再分别添加纳米氧化锌悬浮液使其最终浓度分别为0.1,0.5,1,5,10和20 mg/L,以不添加纳米氧化锌悬浮液的处理作为对照组,每个处理组和对照组重复3次。在30℃、150 r/min条件下培养真菌,分别于5 d(急性暴露)和10 d(慢性暴露)时取样,测定其生长及代谢活性参数,包括培养环境pH、菌丝鲜重和干重,以及包括酸性磷酸酶、亮氨酸氨基肽酶、纤维二糖水解酶和过氧化物酶在内的4种胞外降解酶的活性,具体测定方法如下。
1.2.1 培养环境pH菌丝收集后,使用pH计(E-201-C,雷磁,中国上海)测量培养环境的pH值。pH计在使用前先进行清洗和校对,以确保误差值最小;将pH复合电极插入待测溶液中,待其稳定后读取pH值。
1.2.2 菌丝鲜重和干重用预先称量过的纱布过滤真菌菌丝,用超纯水轻柔地冲洗以去除附着在菌丝上的纳米氧化锌,然后用定性滤纸吸干多余水分,称重至最精确的0.001 g,即为真菌鲜重。测定胞外降解酶活性(第1.2.3节)后,将真菌菌丝在110℃下干燥24 h至恒重,称重至最精确的0.001 g得到真菌干重。真菌鲜重(干重)表示为真菌在指定暴露时间(5 d或10 d)后的鲜重(干重)与初始鲜重(干重)比值的百分数。
1.2.3 胞外降解酶活性根据Allison实验室可见光酶标法[28]测定4种胞外降解酶活性,以评估白地霉参与磷循环(酸性磷酸酶)、碳循环(纤维二糖水解酶)、氮循环(亮氨酸氨基肽酶)和木质素降解(过氧化物酶)过程中的代谢活性。往称重后的新鲜菌丝加入3 mL pH值为5.0醋酸钠缓冲液中,并置于加冰(4℃)的数控超声波清洗器中于40 kHz条件下超声30 min。将粗酶液在4℃、7 000 r/min条件下离心5 min,取其上清液加入相应的酶底物(表 1),于28℃、66 r/min摇床中分别培养45 min(酸性磷酸酶)、2 h(亮氨酸氨基肽酶和过氧化物酶)和4 h(纤维二糖水解酶)。使用酶标仪(Multiskan FC,Thermo Fisher)分别在405 nm(酸性磷酸酶,纤维二糖水解酶和亮氨酸氨基肽酶)和450 nm(过氧化物酶)处测定上述胞外降解酶的活性。在醋酸钠缓冲液中稀释1.00 μmol/mL的对硝基苯酚溶液得到一系列标准溶液。将0.75 mL不同浓度的标准液,0.075 mL 1.0 mol/L NaOH溶液和3 mL蒸馏水混合,分别测定吸光度,通过线性回归得到标准曲线。胞外降解酶相对活性定义为第5天和第10天的酶活性与初始酶活性比值的百分数。
| 胞外降解酶 Extracellular degrading enzyme |
底物 Substrate |
| 酸性磷酸酶 Acid phosphatase |
对硝基苯磷酸二钠六水合物 4-Nitrophenyl phosphate disodium salt hexahydrate |
| 亮氨酸氨基肽酶 Leucine-aminopeptidase |
L-亮氨酸-4-硝基苯胺 L-Leucine-4-nitroanilide |
| 纤维二糖水解酶 Cellobiohydrolase |
4-硝基苯基-β-D-纤维二糖 p-Nitrophenyl-β-D-cellobioside |
| 过氧化物酶 Peroxidase |
左旋多巴 Levodopa |
1.3 数据处理
采用单因素方差(LSD法)分析法检验培养环境pH及真菌生物量在各处理间的差异,采用双因素方差分析法检验纳米氧化锌浓度和暴露时间的交互作用对胞外降解酶活性的影响。所有分析都在SPSS 18.0软件中进行,显著性水平为5%。
2 结果与分析 2.1 真菌鉴定结果菌株AC1的菌落呈平面扩散状, 生长快,乳白色,毛绒状,中心突起(图 1)。初步认定为丝孢纲,丝孢目,丛梗孢科,地霉属。
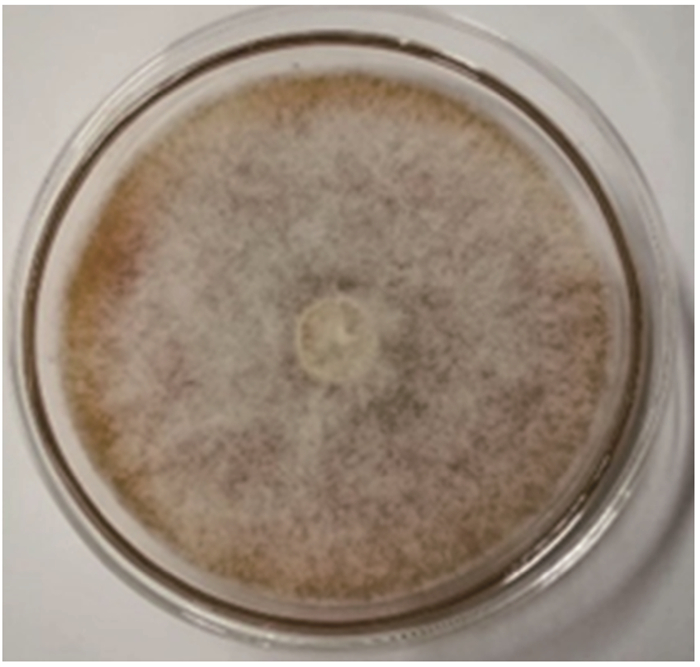
|
| 图 1 菌株AC1的菌落形态 Fig. 1 Colonial morphology of strain AC1 |
该菌的ITS序列共376 bp,将序列在NCBI数据库中进行BLAST比对分析,与白地霉(Geotrichum candidum)同源性达98.41%。通过真菌菌落形态[29, 30]和ITS分子生物学[31]共同鉴定为白地霉(Geotrichum candidum AC1,GenBank登录号:MW332541)。
2.2 培养环境pH通过单因素方差(LSD法)分析,纳米氧化锌暴露对白地霉生长培养环境的pH没有显著影响(P>0.05)。对照组中,白地霉生长的培养环境pH为2.82-2.89,添加纳米氧化锌后其培养环境pH为2.66-2.99 (图 2)。
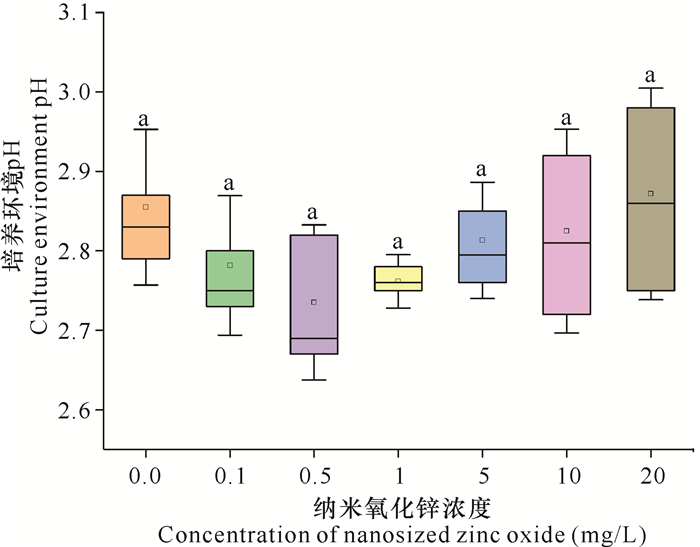
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 2 纳米氧化锌对白地霉生长培养环境pH的影响 Fig. 2 Effects of nanosized zinc oxide on culture environment pH of Geotrichum candidum |
2.3 真菌生物量 2.3.1 真菌鲜重
如图 3所示,暴露5 d时,0.1和0.5 mg/L纳米氧化锌对真菌鲜重没有显著影响(P>0.05);与对照组相比,暴露于1和5 mg/L纳米氧化锌使真菌鲜重分别降低19.11%和9.17%,而暴露于10和20 mg/L纳米氧化锌使真菌鲜重分别增加6.46%和23.14%(P<0.05)。暴露10 d时,0.5和10 mg/L纳米氧化锌处理中真菌鲜重分别降低7.39%和15.92%,而5 mg/L纳米氧化锌处理下真菌鲜重显著增加27.57%,在各处理中数值最高(P<0.05)。此外,在急性暴露下,1和5 mg/L纳米氧化锌对真菌鲜重有抑制作用,而10和20 mg/L纳米氧化锌对真菌鲜重有促进作用。但是在慢性暴露下,1和5 mg/L纳米氧化锌对真菌鲜重的影响分别为无显著影响和促进作用,而10和20 mg/L纳米氧化锌分别为抑制作用和无显著影响。
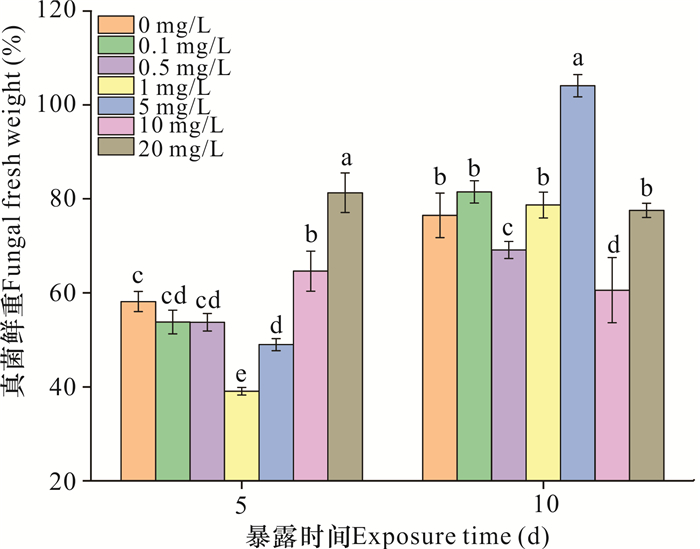
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 3 纳米氧化锌对白地霉鲜重的影响 Fig. 3 Effects of nanosized zinc oxide on Geotrichum candidum fresh weight |
2.3.2 真菌干重
如图 4所示,暴露5 d时,与对照组相比,1和10 mg/L纳米氧化锌使真菌干重分别降低41.54%和36.01%,而其他浓度处理组使真菌干重提高12.69%-29.96% (P<0.05)。暴露10 d时,除0.5和1 mg/L,其他浓度处理组均使真菌干重显著增加,提高15.01%-40.25%(P<0.05)。此外,随着暴露时间由5 d延长至10 d,1和10 mg/L纳米氧化锌对真菌干重的影响由抑制作用分别转变为无显著影响和促进作用。
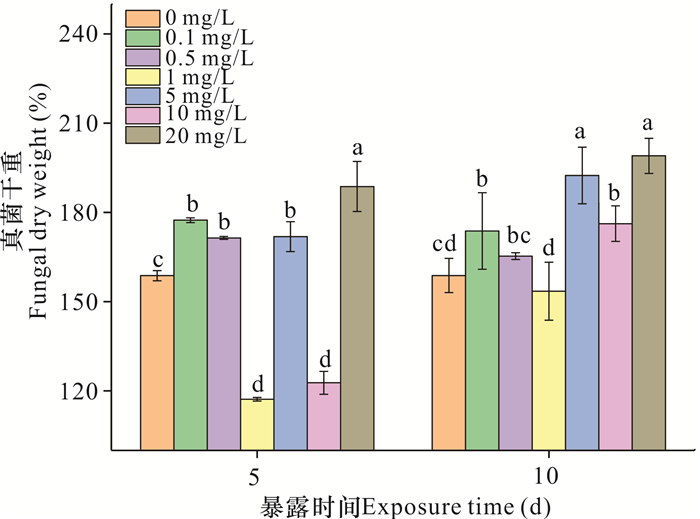
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 4 纳米氧化锌对白地霉干重的影响 Fig. 4 Effects of nanosized zinc oxide on Geotrichum candidum dry weight |
2.4 胞外降解酶活性
双因素方差分析结果表明(表 2),纳米氧化锌浓度、暴露时间以及二者的交互作用对酸性磷酸酶、亮氨酸氨基肽酶、纤维二糖水解酶和过氧化物酶活性均具有显著影响(P<0.001)。
| 胞外降解酶 Extracellular degrading enzyme |
浓度 Concentrations |
时间 Time |
浓度×时间 Concentrations×Time |
|||||
| F | P | F | P | F | P | |||
| 酸性磷酸酶 Acid phosphatase |
26.804 | <0.001 | 255.052 | <0.001 | 23.627 | <0.001 | ||
| 亮氨酸氨基肽酶 Leucine-aminopeptidase |
63.194 | <0.001 | 180.232 | <0.001 | 17.619 | <0.001 | ||
| 过氧化物酶 Peroxidase |
84.211 | <0.001 | 51.092 | <0.001 | 121.432 | <0.001 | ||
| 纤维二糖水解酶 Cellobiohydrolase |
196.805 | <0.001 | 101.858 | <0.001 | 176.883 | <0.001 | ||
| 注:P<0.001表示显著相关 Note: P < 0.001 indicates significant correlation | ||||||||
2.4.1 酸性磷酸酶
如图 5所示,暴露5 d时,0.1 mg/L纳米氧化锌使酸性磷酸酶相对活性比对照组提高257.80% (P<0.05);酸性磷酸酶相对活性随着纳米氧化锌浓度的增加而降低,其中1-20 mg/L纳米氧化锌使该酶相对活性显著降低158.96%-218.85% (P<0.05)。暴露10 d时,0.1-5 mg/L纳米氧化锌处理下,酸性磷酸酶相对活性相较于对照组显著增加57.41%-270.26%,但随着纳米氧化锌浓度(1-20 mg/L)的增加,该酶相对活性呈下降趋势。纳米氧化锌浓度为1和5 mg/L,在急性暴露时表现为抑制作用,而慢性暴露时转变为促进作用(P<0.05)。
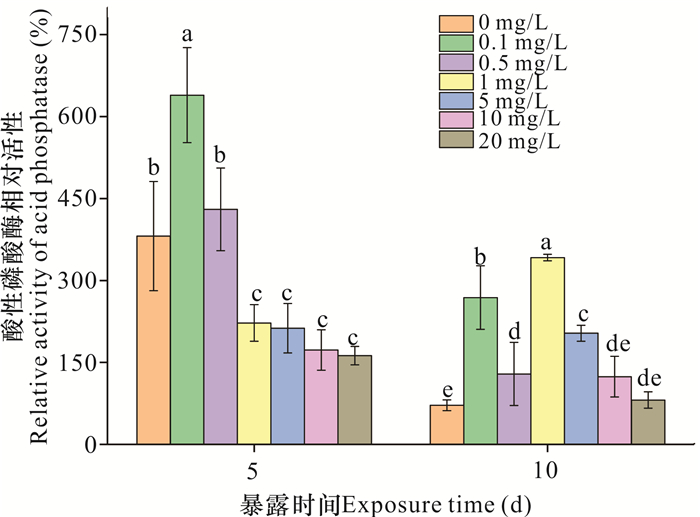
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 5 纳米氧化锌对酸性磷酸酶相对活性的影响 Fig. 5 Effects of nanosized zinc oxide on the relative activity of acid phosphatase |
2.4.2 亮氨酸氨基肽酶
如图 6所示,暴露5 d时,0.1 mg/L纳米氧化锌使亮氨酸氨基肽酶相对活性显著增加69.06% (P<0.05);当纳米氧化锌浓度为20 mg/L时,该酶相对活性受到显著抑制,相较于对照组降低45.75% (P<0.05)。暴露10 d时,1-10 mg/L纳米氧化锌导致亮氨酸氨基肽酶相对活性相较于对照组显著增加15.64%-35.61%(P<0.05),而其他处理组对该酶相对活性并无显著影响。此外,随着暴露时间由5 d延长至10 d,20 mg/L纳米氧化锌对该酶相对活性的抑制作用转变为无明显影响。
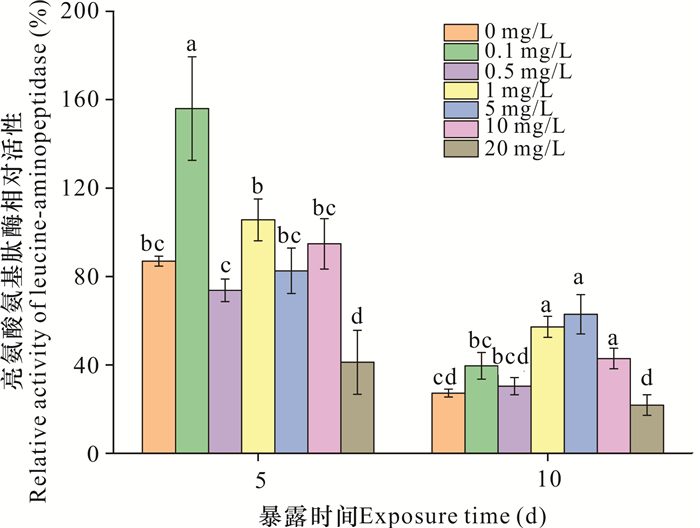
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 6 纳米氧化锌对亮氨酸氨基肽酶相对活性的影响 Fig. 6 Effects of nanosized zinc oxide on the relative activity of leucine-aminopeptidase |
2.4.3 纤维二糖水解酶
如图 7所示,暴露5 d时,除0.1 mg/L处理组外,其他处理组使纤维二糖水解酶的相对活性显著低于对照组(降低34.35%-55.57%,P<0.05),且各处理之间没有显著性差异(P>0.05)。暴露10 d时,各浓度纳米氧化锌对该酶相对活性没有显著影响(P>0.05)。因此,当暴露时间延长时,真菌的纤维二糖水解酶对于纳米氧化锌有所适应。
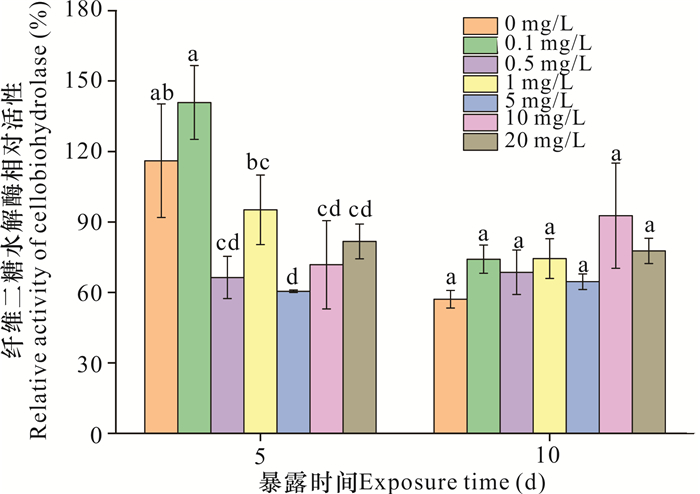
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 7 纳米氧化锌对纤维二糖水解酶相对活性的影响 Fig. 7 Effects of nanosized zinc oxide on the relative activity of cellobiohydrolase |
2.4.4 过氧化物酶
如图 8所示,暴露5 d时,0.1 mg/L纳米氧化锌处理下的过氧化物酶相对活性显著高于对照组69.92%,而高浓度(5-20 mg/L)纳米氧化锌显著抑制了该酶相对活性,且低于对照组25.26%-62.39% (P<0.05)。暴露10 d时,除0.5和1 mg/L纳米氧化锌对该酶相对活性没有显著影响(P>0.05)外,其他处理组均对该酶相对活性有显著促进作用(37.87%-139.52%,P<0.05)。此外,当暴露时间由慢性(5 d)变为急性(10 d)时,高浓度(5-20 mg/L)纳米氧化锌对该酶相对活性的抑制作用转变为促进作用。
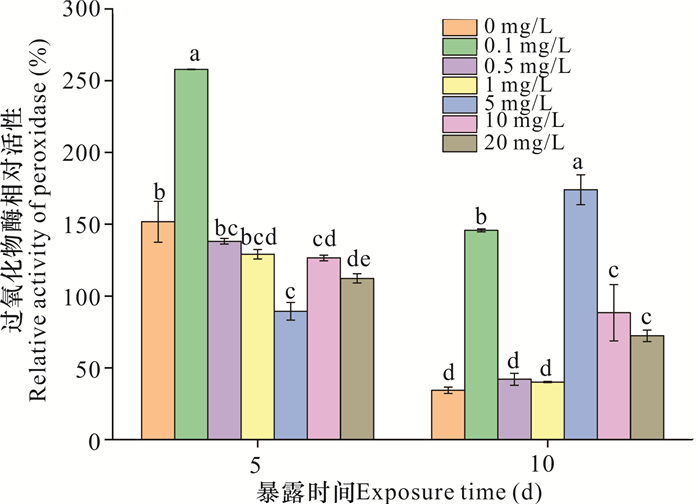
|
| 不同字母表示不同处理之间存在显著差异(P<0.05) Different letters represent significant difference under different treatment (P < 0.05) 图 8 纳米氧化锌对过氧化物酶相对活性的影响 Fig. 8 Effects of nanosized zinc oxide on the relative activity of peroxidase |
3 讨论
纳米氧化锌的泄漏会对淡水生态系统产生严重的破坏,针对纳米氧化锌造成的水体污染研究,已引起科研者的广泛关注[32, 33]。尽管许多研究已经证明纳米氧化锌对水生生物及淡水生态系统功能的影响[7, 32, 34],但仍缺乏纳米氧化锌对单一真菌生长和代谢活性的影响研究。
pH是影响微生物生长的重要生态因子[35]。通常,微生物都有其最适宜生长的pH值[36]。外界环境的pH一方面通过影响细胞膜蛋白以及胞外水解酶的活性,从而对细胞本身营养物的正常吸收与转运产生影响;另一方面通过影响细胞对营养物的解离与吸收过程或细胞膜的表面电荷性质及膜的通透性,进而对物质的吸收能力产生影响[37]。本研究中纳米氧化锌的暴露不会对真菌生长的培养环境pH值产生影响,这表明纳米氧化锌不是通过影响培养环境pH值来影响白地霉的生长和代谢活性。
真菌鲜重用来表征其吸水情况,而干重用来衡量其物质合成情况[22]。Yang等[38]通过对真菌鲜重和干重的评估,表明氧化石墨烯促进了白腐真菌的生长。本研究中,不同浓度纳米氧化锌对真菌鲜重和干重产生的影响具有差异性,表明真菌的吸水量和物质合成对不同浓度下纳米氧化锌的响应不同。急性暴露下,纳米氧化锌对真菌吸水量表现为低浓度抑制而高浓度促进的整体影响,而慢性暴露下的影响不明显。对于真菌物质合成,无论急性和慢性暴露,0.1,5和20 mg/L纳米氧化锌表现为显著的促进作用。不同的响应可能是纳米氧化锌对真菌生长的生态毒性和真菌对环境压力适应性的综合作用结果。
胞外降解酶活性用来衡量真菌的代谢活性和降解功能[39]。急性暴露下,纳米氧化锌对4种胞外降解酶活性的影响表现为低浓度促进而高浓度抑制。这种以低剂量刺激和高剂量抑制为特征的剂量反应关系被称为毒物兴奋效应[40]。这种毒物兴奋效应可能是白地霉胞外降解酶系统应对环境胁迫的适应性反应[41]。在Du等[42]研究中发现, 纳米氧化锌在极低浓度(30 ng/L)下对于参与凋落叶分解的水生真菌的生物量具有刺激效应。综合以上研究,推测白地霉的代谢活性对低浓度纳米氧化锌具有一定的适应性。然而这种适应性在高浓度情况下,特别是20 mg/L纳米氧化锌处理下是不存在的,反而表现为与碳、氮、磷循环有关的代谢活性和降解功能被显著抑制。在时间维度上,随着暴露时间的延长,高浓度纳米氧化锌暴露对胞外降解酶活性的抑制作用逐渐削弱,甚至转变为促进作用。例如,5-20 mg/L纳米氧化锌的急性暴露显著抑制了酸性磷酸酶、亮氨酸氨基肽酶和过氧化物酶的相对活性,但随着暴露时间的延长,纳米氧化锌对上述白地霉释放的几种酶的相对活性表现为无显著影响或者促进作用。因此推测,纳米氧化锌慢性暴露可能会促使白地霉的胞外降解酶系统产生一定的适应性,从而使其代谢活性避免受到显著影响。
4 结论分析表明,纳米氧化锌暴露及其浓度变化对真菌培养环境的pH值无显著影响,因此纳米氧化锌不是通过影响培养环境pH而影响真菌的生长和代谢活性。急性暴露下,真菌的吸水量和代谢活性对于纳米氧化锌的响应具有浓度差异性;而慢性暴露下,纳米氧化锌显著促进了真菌的生长和代谢活性,表明随暴露时间延长,真菌对纳米氧化锌产生了一定的适应性。本研究的成果有助于进一步了解纳米氧化锌的生态毒性,同时为揭示水生生态系统中真菌对毒性物质污染物胁迫时的响应机制奠定了基础。
| [1] |
WIESNER M R, LOWRY G V, CASMAN E, et al. Meditations on the ubiquity and mutability of nano-sized materials in the environment[J]. ACS Nano, 2011, 5(11): 8466-8470. DOI:10.1021/nn204118p |
| [2] |
赵晓丽, 王珺瑜, 方蕾, 等. 人工合成纳米材料在水环境中的聚沉行为研究进展[J]. 矿物岩石地球化学通报, 2019, 38(3): 522-533, 439. |
| [3] |
PENG C, ZHANG W, GAO H, et al. Behavior and otential impacts of metal-based engineered nanoparticles in aquatic environments[J]. Nanomaterials, 2017, 7(1): 21. DOI:10.3390/nano7010021 |
| [4] |
WANG J, ZHANG X, CHEN Y, et al. Toxicity assess- ment of manufactured nanomaterials using the unicellular green alga Chlamydomonas reinhardtii[J]. Chemosphere, 2008, 73(7): 1121-1128. DOI:10.1016/j.chemosphere.2008.07.040 |
| [5] |
ASHARANI P V, MUN G L K, HANDE M P, et al. Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J]. ACS Nano, 2009, 3(2): 279-290. DOI:10.1021/nn800596w |
| [6] |
DEMIR E, AKCA H, KAYA B, et al. Zinc oxide nanoparticles: Genotoxicity, interactions with UV-light and cell-transforming potential[J]. Journal of Hazardous Materials, 2014, 264: 420-429. DOI:10.1016/j.jhazmat.2013.11.043 |
| [7] |
HAN Y, KIM D, HWANG G, et al. Aggregation and dissolution of ZnO nanoparticles synthesized by different methods: Influence of ionic strength and humic acid[J]. Colloids and Surfaces a Physicochemical and Engineering Aspects, 2014, 451: 7-15. |
| [8] |
KOLODZIEJCZAK-RADZIMSKA A, JESIONOWSKI T. Zinc oxide-from synthesis to application: A review[J]. Materials, 2014, 7(4): 2833-2881. DOI:10.3390/ma7042833 |
| [9] |
NEZHADHEYDARI H, TAVABE K R, MIRVAGHE- FI A, et al. Effects of different concentrations of Fe3O4@ZnO and Fe3O4@CNT magnetic nanoparticles separately and in combination on aquaculture wastewater treatment[J]. Environmental Technology & Innovation, 2019, 15: 100414. |
| [10] |
BAYSAL A, SAYGIN H, USTABASI G S. Interaction of PM 2.5 airborne particulates with ZnO and TiO2 nanoparticles and their effect on bacteria[J]. Environmental Monitoring & Assessment, 2018, 190(1): 34. |
| [11] |
葛钼. 纳米氧化锌对大肠杆菌的致毒机理及生物膜对其毒性的影响[D]. 南京: 南京大学, 2013.
|
| [12] |
DOBRETSOV S, SATHE P, BORA T, et al. Toxicity of different zinc oxide nanomaterials at 3 trophic levels: Implications for development of low-toxicity antifouling agents[J]. Environmental Toxicology and Chemistry, 2020, 39(7): 1343-1354. DOI:10.1002/etc.4720 |
| [13] |
DE CAMPOS R P, CHAGAS T Q, ALVAREZ T G D, et al. Analysis of ZnO nanoparticle-induced changes in Oreochromis niloticus behavior as toxicity endpoint[J]. Science of the Total Environment, 2019, 682: 561-571. DOI:10.1016/j.scitotenv.2019.05.183 |
| [14] |
RENZI M, BLASKOVIC A. Ecotoxicity of nano-metal oxides: A case study on Daphnia magna[J]. Ecotoxicology, 2019, 28(8): 878-889. DOI:10.1007/s10646-019-02085-3 |
| [15] |
WONG S W Y, ZHOU G J, KWOK K W H, et al. In vivo toxicities of nine engineered nano metal oxides to the marine diatom Skeletonema costatum and rotifer Brachionus koreanus[J]. Marine Pollution Bulletin, 2020, 153: 110973. DOI:10.1016/j.marpolbul.2020.110973 |
| [16] |
BHUVANESHWARI M, ISWARYA V, ARCHANAA S, et al. Cytotoxicity of ZnO NPs towards fresh water algae Scenedesmus obliquus at low exposure concentrations in UV-C, visible and dark conditions[J]. Aquatic Toxicology, 2015, 162: 29-38. DOI:10.1016/j.aquatox.2015.03.004 |
| [17] |
MA H, KABENGI N J, BERTSCH P M, et al. Comparative phototoxicity of nanoparticulate and bulk ZnO to a free-living nematode Caenorhabditis elegans: The importance of illumination mode and primary particle size[J]. Environmental Pollution, 2011, 159(6): 1473-1480. DOI:10.1016/j.envpol.2011.03.013 |
| [18] |
HEINLAAN M, IVASK A, BLINOVA I, et al. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus[J]. Chemosphere, 2008, 71(7): 1308-1316. DOI:10.1016/j.chemosphere.2007.11.047 |
| [19] |
CUPI D, HARTMANN N B, BAUN A. The influence of natural organic matter and aging on suspension stability in guideline toxicity testing of silver, zinc oxide, and titanium dioxide nanoparticles with Daphnia magna[J]. Environmental Toxicology & Chemistry, 2015, 34(3): 497-506. |
| [20] |
HIEBER M G, GESSNER M O. Contribution of stream detrivores, fungi, and bacteria to leaf breakdown based on biomass estimates[J]. Ecology, 2002, 83(4): 1026-1038. DOI:10.1890/0012-9658(2002)083[1026:COSDFA]2.0.CO;2 |
| [21] |
KRAUSS G J, SOLE M, KRAUSS G, et al. Fungi in freshwaters: Ecology, physiology and biochemical potential[J]. FEMS Microbiology Reviews, 2011, 35(4): 620-651. DOI:10.1111/j.1574-6976.2011.00266.x |
| [22] |
DONG C C, WANG W, LIU H Y, et al. Temperate grassland shifted from nitrogen to phosphorus limitation induced by degradation and nitrogen deposition: Evidence from soil extracellular enzyme stoichiometry[J]. Ecological Indicators, 2019, 101: 453-464. DOI:10.1016/j.ecolind.2019.01.046 |
| [23] |
LUO X Z, HOU E Q, ZHANG L L, et al. Effects of forest conversion on carbon-degrading enzyme activities in subtropical China[J]. Science of the Total Environment, 2019, 696: 133968. DOI:10.1016/j.scitotenv.2019.133968 |
| [24] |
CHAMIER A C. Effect of pH on microbial degradation of leaf litter in seven streams of the English Lake District[J]. Oecologia, 1987, 71(4): 491-500. DOI:10.1007/BF00379287 |
| [25] |
XIE J, MING Z, LI H, et al. Toxicity of graphene oxide to white rot fungus Phanerochaete chrysosporium[J]. Chemosphere, 2016, 151: 324-331. DOI:10.1016/j.chemosphere.2016.02.097 |
| [26] |
SLAVIKOVA E, VADKERTIOVA R. Seasonal occurrence of yeasts and yeast-like organisms in the river Danube[J]. Antonie van Leeuwenhoek, 1997, 72(2): 77-80. DOI:10.1023/A:1000287005253 |
| [27] |
VADKERTIOVA R, SLAVIKOVA E. Killer activity of yeasts isolated from the water environment[J]. Canadian Journal of Microbiology, 1995, 41(9): 759-766. DOI:10.1139/m95-105 |
| [28] |
The Allison Lab. Colorimetric enzyme assays[EB/ OL]. [2021-05-10]. http://web.stanford.edu/group/Vitousek/methods.html.
|
| [29] |
胡建华, 周森, 郝文军, 等. 清香型白酒生产中白地霉的分离鉴定[J]. 酿酒科技, 2013(8): 47-49. |
| [30] |
贾丽艳, 田宇敏, 荆旭, 等. 果香风味导向白地霉M5的分离鉴定及生物学特性研究[J]. 中国食品学报, 2020, 20(3): 210-220. |
| [31] |
GARAS L S, UZABAKIRIHO J D, CHIMWAMURO- MBE P M. Isolation and identification of fungal species associated with gall formation on Acacia mellifera in the Western Windhoek[J]. Journal of Pure and Applied Microbiology, 2012, 6(2): 713-716. |
| [32] |
BLINOVA I, IVASK A, HEINLAAN M, et al. Ecotoxicity of nanoparticles of CuO and ZnO in natural water[J]. Environmental Pollution, 2010, 158(1): 41-47. DOI:10.1016/j.envpol.2009.08.017 |
| [33] |
HANDY R D, SHAW B J. Toxic effects of nanoparticles and nanomaterials: Implications for public health, risk assessment and the public perception of nanotechnology[J]. Health Risk & Society, 2007, 9(2): 125-144. |
| [34] |
DU J J, ZHANG Y Y, CUI M H, et al. Evidence for negative effects of ZnO nanoparticles on leaf litter decomposition in freshwater ecosystems[J]. Environmental Science-Nano, 2017, 4(12): 2377-2387. DOI:10.1039/C7EN00784A |
| [35] |
高小朋, 何猛超, 许可, 等. 工业微生物发酵过程中pH调控研究进展[J]. 中国生物工程杂志, 2020, 40(6): 93-99. |
| [36] |
PATIL S A, HARNISCH F, KOCH C, et al. Electroactive mixed culture derived biofilms in microbial bioelectrochemical systems: The role of pH on biofilm formation, performance and composition[J]. Bioresource Technology, 2011, 102(20): 9683-9690. DOI:10.1016/j.biortech.2011.07.087 |
| [37] |
周群英, 王士芬. 环境工程微生物学[M]. 4版. 北京: 高等教育出版社, 1988.
|
| [38] |
YANG H, FENG S, MA Q, et al. Influence of reduced graphene oxide on the growth, structure and decomposition activity of white-rot fungus Phanerochaete chrysosporium[J]. Rsc Advances, 2018, 8(9): 5026-5033. DOI:10.1039/C7RA12364G |
| [39] |
GOMES P P, MEDEIROS A O, GONCALVES JUNIOR J F. The replacement of native plants by exotic species may affect the colonization and reproduction of aquatic hyphomycetes[J]. Limnologica, 2016, 59: 124-130. DOI:10.1016/j.limno.2016.05.005 |
| [40] |
IAVICOLI I, LESO V, FONTANA L, et al. Nanoparticle exposure and hormetic dose-responses: An update[J]. International Journal of Molecular Sciences, 2018, 19(3): 805. DOI:10.3390/ijms19030805 |
| [41] |
IAVICOLI I, CALABRESE E J, NASCARELLA M A. Exposure to nanoparticles and hormesis[J]. Dose-Response, 2010, 8(4): 501-517. |
| [42] |
DU J J, ZHANG Y Y, YIN Y T, et al. Do environmental concentrations of zinc oxide nanoparticle pose ecotoxicological risk to aquatic fungi associated with leaf litter decomposition?[J]. Water Research, 2020, 178: 115840. DOI:10.1016/j.watres.2020.115840 |



