随着纳米科技的飞速发展和纳米产品的普及,纳米材料将不可避免地向环境排放,对生态环境构成巨大的潜在威胁[1, 2]。由于纳米材料在水体中的迁移能力更强、影响范围更广、影响因素更复杂,因而对其环境行为的研究主要集中在水环境[3, 4]。其中,纳米银(AgNPs)因其抗菌特性和对人体的低毒性而被广泛应用于医疗、消费品和水处理等多个领域[3-5]。因此,AgNPs已成为目前世界上产量最大和应用最广的纳米材料。截止目前,AgNPs的全球产量每年可达600 t,并有持续上升的趋势[5]。
AgNPs产品的广泛使用增加了其向水环境释放和人体暴露的机会。AgNPs本身及其释放的银离子(Ag+)均会对环境产生纳米毒性,加之Ag+毒性强烈,因而将会对水环境造成更加复杂的毒理效应[1-3]。同时,由于水环境成分复杂,AgNPs进入水环境后,受各种环境因素(如pH、有机质和离子类型等)的影响,其在价态、种类和形态等方面均会发生较大的变化,导致其生态毒理效应进一步复杂化[6-9]。因此,系统阐述AgNPs在水环境中的来源、转化和毒理效应,将对准确评估和管理AgNPs引起的环境生态风险起着至关重要的作用。
目前,对AgNPs研究进展的综述主要集中在AgNPs制备、应用、转化或生物毒理效应等方面,缺乏对其在水环境中的综合分析。基于此,本文重点综述水环境中AgNPs的来源与现实环境浓度、可能的迁移转化规律和水生态毒理效应机制,提出当前研究中存在的不足,并指出今后需要进一步调查的领域,以期为含AgNPs材料的风险评估提供理论依据。
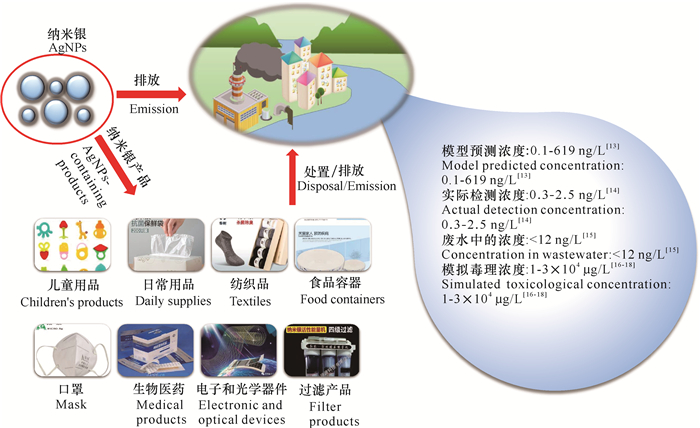
1 水环境中AgNPs来源和浓度水生态环境中AgNPs的来源可分为两部分,一部分为含AgNPs产品的排放产生,另一部分由自然环境中的Ag+转化形成,其中含AgNPs产品的排放是水环境中AgNPs的主要来源(图 1)。据统计,有超过438种产品包含有AgNPs[10],这些产品主要来自纺织品、药品和服装等生物杀灭产品[11],以及油漆、木质外墙、纳米洗衣机和塑料[12]。AgNPs主要通过AgNPs产品的生产、含AgNPs产品使用和处置过程等进入水环境[13]。通常,现实水环境中AgNPs的浓度往往明显低于实验室测试浓度(图 1)。地表水中AgNPs的预测浓度为0.1-619 ng/L[13],而实际检测到的地表水中AgNPs浓度为0.3-2.5 ng/L[14],废水中AgNPs浓度小于12 ng/L[15]。实验室所模拟AgNPs毒理浓度基本上为1 μg/L到30 mg/L[16-18],对纳克每升水平的毒理效应知之甚少。同时,由于毒理学浓度是了解AgNPs归宿和毒性的重要参数之一,其能影响银纳米粒子的稳定性和归宿(如溶解、聚集和硫化等),且AgNPs可以在现实环境中长期存在[19],因此开展低浓度(< 1 000 ng/L)和长期暴露(数月至数年)下AgNPs毒理效应的研究,对准确评估AgNPs生态毒理效应具有重要意义。
|
| 图 1 水环境中纳米银的来源和浓度 Fig. 1 Source and concentration of AgNPs in aquatic environment |
2 水环境中影响AgNPs的因素和AgNPs的转化机理
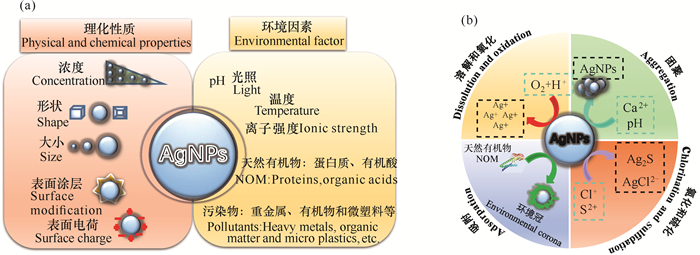
一旦进入水环境,AgNPs的归宿及其对生态系统的毒性将会受到多种因素的影响(图 2a),包括环境(pH、有机质、离子强度、光照、溶解氧和温度)、生物(生物降解和改性)因素以及AgNPs物理化学性质(浓度、大小、表面电荷、表面涂层和形状等)[6-9]。
|
| 图 2 影响纳米银毒性的各种因素(a)及纳米银在水环境中转化(b) Fig. 2 Various factors affecting silver nanoparticles (a) and its transformation in aquatic environments (b) |
由于易受环境因素的影响,AgNPs会根据其所在环境或生物介质的不同,改变其溶解和聚集状态,进而改变其生态毒性。在水环境中,AgNPs往往会发生如下几类转化行为:氧化溶解、团聚、氧化还原(硫化和氯化)、吸附(图 2b)等。其中,氧化溶解是AgNPs转化的主要途径,O2和H+参与其中[9]。已有研究表明,水环境中pH、有机质、离子强度、光照、溶解氧和温度等因素均可影响AgNPs的溶解行为[7, 13, 20-23],进而对AgNPs生态毒性产生不同影响[20]。鉴于AgNPs的不稳定性,实际生产应用中往往会根据不同需求对AgNPs进行包被修饰,如聚乙烯吡咯烷酮(PVP)、聚乙烯醇(PVA)和柠檬酸钠等,这些修饰主要通过静电作用力和空间位阻调控AgNPs的稳定性及颗粒溶解速率[20, 24]。即使包被修饰提高了AgNPs的稳定性,但AgNPs表面的包埋剂常会因吸附解离或降解脱落,进而可能被环境中广泛存在的腐殖质(HA)、黄腐酸(FA)、胞外聚合物(EPS)和蛋白质等天然有机质取代或者二次包埋[20]。例如,PVP、柠檬酸盐包埋剂在太阳光和紫外光照射下易发生光解[25, 26],因此水环境中大量天然有机质(NOM)更易吸附在AgNPs表面形成二次包埋[27],进而可能会对AgNPs生态毒性产生不同的影响。AgNPs团聚(包括均质团聚和异质团聚)往往受很多因素的影响,如AgNPs粒径、形貌、类型及水体pH值等[28]。例如,相对于大粒径AgNPs,小粒径AgNPs因其比表面积大,往往会更易团聚[28],而pH可通过降低AgNPs表面的ζ电势而导致纳米颗粒团聚[29]。团聚会改变由AgNPs释放的Ag+浓度[20, 30]及其与细胞表面接触的有效位点,进而导致AgNPs生物毒性的减弱或增强。硫和氯作为水环境中存在的两种主要元素,极易与溶液中Ag+发生硫化和氯化反应,分别生成难溶性硫化银或氯化银,进而限制可溶性银的浓度,降低其在环境中的毒性和生物利用度[30-32]。AgNPs的硫化反应在好氧和厌氧条件下均可发生,其发生方式高度依赖于水体中S2-的浓度[33];而AgNPs氯化过程的发生主要依赖于Ag/Cl比,进而形成各种Ag化合物,包括固体AgCl和几种可溶性AgClx(x-1)-化合物[32, 34]。
除直接排放到环境中的AgNPs外,自然环境中的Ag+也可通过自然或生物转化形成AgNPs。研究表明,自然光照射条件下,水体中Ag+可被天然有机质、活性氧[35]以及SO2[2]还原成AgNPs。此外,环境生物体(包括微生物、植物、病毒或DNA模板)也能够将Ag+还原成AgNPs[21, 36-38],如利用枫香内生真菌Phomopsis liquidambaris可合成平均粒径为18.7 nm AgNPs;Gardea-Torresdey等[39]研究发现,紫花苜蓿(Medicago sativa)的根可以吸收Ag+,然后通过特殊渠道运输至不同的部位合成AgNPs。
水环境是一个复杂而多变的环境,其中不仅存在大量天然有机物(如腐植酸、半胱氨酸和蛋白质等),还有可能存在各种化学污染物(有机污染物、重金属和微塑料等)。由于其高比表面积和强吸附特性,AgNPs一旦进入水环境,将不可避免吸附这些物质并产生相互作用,形成“环境冠”,进而改变AgNPs的理化特征和生态毒理效应[7, 40-42]。例如,Yang等[43]发现腐植酸和半胱氨酸通过不同的机制减少PVP-AgNP的沉积;天然有机物(NOM)的存在降低AgNPs的聚集率[42];一些抗生素(如四环素和庆大霉素)能够改变AgNPs的表面电性,促进AgNPs与菌体结合,并会加速Ag+的释放[44, 45]。
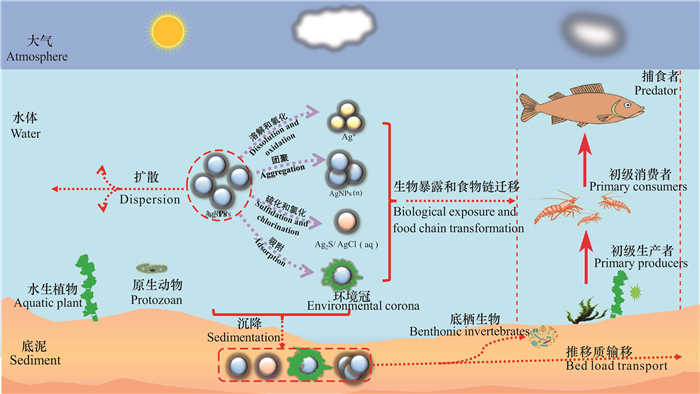
3 AgNPs在水环境中的迁移和生态毒理效应由于AgNPs体积小,在从原产品向环境的运输和转化过程中可能会产生多种毒性风险。一旦进入水环境,AgNPs将会与不同环境因素或生物因素相互作用,并通过直接(水体暴露)或间接作用(食物链传递)对水生生物产生一系列复杂的生态毒理效应(图 3)。由于AgNPs颗粒自身性质(如形态、粒径和表面涂层类型等)以及含AgNPs产品材料类型的不同(如塑料用品、纺织产品和医疗用品等),其进入水环境必然会产生不同形式的迁移和转化,进而改变AgNPs的毒性,最终导致水环境中AgNPs毒理效应和毒理机制的变化。AgNPs本身和其释放的Ag+对水生动物[46-50]、植物[51, 52]和微生物[20, 53, 54]均可产生纳米毒性。另外,AgNPs与生物体之间可能发生相互作用,这可能会导致其通过食物链产生潜在毒性,进而通过被取食对人体产生毒害作用。研究表明,长期摄入银会造成银中毒,对人体皮肤、神经均有一定的损伤[55, 56]。
|
| 图 3 纳米银在水环境中的迁移和生态毒理效应 Fig. 3 Transport and ecotoxicological effect of AgNPs in aquatic environment |
3.1 AgNPs对微生物及水生态学系统功能的影响
微生物作为水环境中物质和能量循环的主要参与者,对维持健康的水生态系统结构与功能具有重要意义。AgNPs的优良抑菌性无疑是一把双刃剑。一方面,由于优良的抗菌性,AgNPs被广泛应用于日常生活中:作为一种广谱性的抗菌剂,AgNPs能有效抑制革兰氏阴性菌和阳性菌的生长(虽然对其抗菌效能还存在争议[57]);另外,除抑菌作用外,AgNPs还能刺激一些特殊菌的增殖,如硫酸盐还原菌Desulfovibrio vulgaris[58]。另一方面,AgNPs优良的杀菌作用是一个严重的问题,因为即使浓度很低,也有可能引起水生生态系统中微生物的扰动,从而对更高形式的生命产生连锁效应。Huang等[59]发现,在人工湿地系统中,即使低浓度AgNPs (50,200 μg/L)的持续暴露,也会影响微生物群落结构和关键功能菌。在活性污泥处理系统中,1 mg/L AgNPs对反应器硝化抑制率达到41.4%,同时会显著降低硝化细菌的丰度[60]。然而,Zhang等[61]发现0.1 mg/L AgNPs长期处理对膜生物反应器的效能和细胞活性没有显著影响,而且硝化细菌的群落结构较为稳定。可见,不同浓度AgNPs在不同生态系统中对微生物群落结构的影响并不一致。
近年来,研究结果发现AgNPs对微生物群落和生态功能水平的毒理效应不仅受环境因素的影响,而且还受到环境因素对AgNPs释放Ag+浓度的影响。Pradhan等[62]研究AgNPs对欧洲桤木(Alnus glutinosa)叶凋落物降解过程及其相关微生物群落结构和功能的影响,结果发现AgNPs与AgNO3中的Ag+对凋落物降解速率、水生真菌生物量和产孢率的影响无显著差异,但与对照相比呈现出显著的抑制效应。随后,Batista等[63]研究发现温度的升高促进了凋落物的微生物分解,提高了凋落物降解酶的活性,而低温则增加了真菌的生物量和多样性。最近,笔者课题组[18]首次解析了夜间人造光污染和AgNPs复合作用对河流生态系统中凋落物降解及其相关的微生物(真菌和细菌)群落结构、功能的生态毒理机制,认为人造光污染不仅可以改变溪流中AgNPs和凋落物的特性,而且还可以减轻AgNPs对凋落物降解的负面影响。这种减轻作用主要归因于夜间人造光作用下AgNPs释放的Ag+浓度和叶凋落物中木质素含量的下降、微生物量的增加及主要水解酶(β-葡萄糖苷酶)活性的增强。该研究不仅强调了评估AgNPs生态毒理效应时应考虑环境因素的重要性,而且为纳米材料的生态安全评估提供科学依据和新视野。
有关AgNPs对微生物的毒理机制研究表明,Ag+的释放、活性氧(ROS)的产生、对细胞完整的破坏性与膜通透性改变及其与功能蛋白质互作是AgNPs损伤微生物的主要因素[20, 56]。但也有研究发现,Ag2SNPs暴露5 d后对淡水生物膜的生物活性和群落组成有明显影响,认为是其纳米毒性而非离子毒性所致[64]。
3.2 AgNPs对水生植物毒理效应AgNPs对水生植物毒理效应及机制研究主要集中在藻类[65-67]、浮萍[67-69]和水稻等[52, 70],且主要集中在对单一物种在短期内的毒理效应方面,并聚焦于AgNPs对植物生长速率、光合作用和生理水平上的氧化胁迫等方面。例如,Oukarroum等[71]发现AgNPs通过产生活性氧(ROS)降低Chlorella vulgaris和Dunaliella tertiolecta的生长速率、光合作用和细胞活力;Miao等[72]和He等[73]发现,AgNPs对Thalassiosira weissflogii、Chattonella marina的生长和生存的影响主要由AgNPs释放的Ag+所造成。同时,AgNPs对浮游植物的毒理效应随AgNPs来源、类型和试验对象(如月牙藻、小球藻和衣藻)的不同而不同[56]。对一些大型水生植物的研究表明,AgNPs暴露可诱导产生过量的ROS,从而引起多不饱和脂肪酸过氧化(称为脂质过氧化)、细胞膜通透性损伤、细胞结构改变或蛋白质、DNA直接损伤,进而导致植物细胞死亡和生长抑制[74, 75]。例如,Yuan等[74]发现,AgNPs暴露后,沉水植物埃格草(Egeria densa)的膜损伤指数MDA明显高于出苗的灯心草(Juncus effusus L.),说明AgNPs对沉水植物的胁迫作用更大。Jiang等[66]研究发现,在水环境中,AgNPs主要沉积在表层底泥中,并且在水生植物大量积累银元素,因此AgNPs可能会通过食物链在不同营养级上传递。
3.3 AgNPs对水生动物毒理效应对AgNPs水生动物毒理效应的研究主要集中在水生无脊椎动物(如线虫、大型溞和贝类等)和鱼类中。作为水生食物链的主要参与者,无脊椎动物在物质循环、能量转化以及污染物迁移积累方面均扮演着重要角色。研究发现,AgNPs会对无脊椎动物产生很强的毒性作用,并且AgNPs及其释放的Ag+对生物的毒理效应与水体pH、离子成分及强度、溶液中大分子物质(如共存污染物和硫元素等)等因素联系密切[3, 4]。一旦进入这些无脊椎动物体内,AgNPs可随血液循环进入不同组织中,且主要分布在腮、肝胰和肠道上[51]。Yan等[75]发现,AgNPs还可以通过大型蚤(Daphnia magna)母体内转移到下一代,且显著抑制F0代和F1代的繁殖能力。
另外,AgNPs对脊椎动物鱼类的毒理作用研究显示,AgNPs对鱼类(研究的主要模型为耐寒的淡水鱼斑马鱼和咸水鱼日本青鳉)的毒性作用主要表现为影响鱼类的胚胎发育(导致如眼、尾和心脏的畸形等),破坏鳃的组织结构,产生呼吸和神经毒性等[3, 46, 48]。AgNPs对鱼类会表现出比Ag+更强的生物毒性效应[76],AgNPs对斑马鱼的毒性呈现粒径效应[48]。此外,由于Ag+可以替代Na+/K+ ATPase中的Na+,而AgNPs表面涂层材料会影响Ag+的释放量,因此其会影响日本青鳉体内的生理平衡[77]。AgNPs对日本青鳉具有一定的亚慢性毒性[78],在日本青鳉体内的组织分布为肝>鳃>肠>脑,毒性主要作用于肝脏、鳃和肠道,其中肝脏损伤最为显著,即肝脏是AgNPs毒性作用的靶器官[46]。另外发现,0.1 mg/L AgNPs溶液会降低鱼类对低氧环境的耐受力,表明氧化损伤可能是AgNPs对鱼类产生毒性的一个重要机制[48]。可见,AgNPs可通过水体直接暴露和食物链转移产生毒理效应,甚至还会通过母体转移对下一代产生毒理效应。
3.4 AgNPs在水生食物链的迁移和转化截至目前,对AgNPs在食物链迁移转化规律的研究主要集中在少数几个模式生物之间。例如,对不同包被(巯基、没食子酸和酪氨酸等)AgNPs沿藻类(Chlamydomonas reinhardtii)→大型溞(Daphnia magna)和沿小球藻(Chlorella vulgaris)→大型溞食物链传递效应的研究结果表明,AgNPs中的Ag+可沿食物链传递,且Ag+主要通过食物摄取传递[47, 79]。Jiang等[66]报道AgNPs从水柱和沉积物向动植物的营养转移,Chae等[80]报道了纳米银线(AgNWs)从藻类向水蚤和斑马鱼的营养转移。在河口环境中,由含有AgNPs的消费品中释放的Ag+被各种生物群(生物膜、无脊椎动物、植物)吸收,通过吸附、迁移和生物积累等过程产生不同的生态毒理效应[81]。可见,在水环境中,AgNPs可沿捕食食物链向上传递,但由于捕食者与被捕食者的消化生理差异,日益增加的物种复杂性可能改变AgNPs暴露生物敏感性,并可能改变AgNPs诱导的毒性[10]。
4 展望AgNPs优良的抗菌特性虽然给人类生产生活带来了诸多便利,但其日益增强的环境释放也给生态环境带来潜在生态风险。由于水环境的复杂性,AgNPs一旦进入其中,其理化特征、环境行为及毒理效应将会受到多种因素的影响。迄今为止,虽然已有大量研究报道水环境中AgNPs的来源、迁移转化和生态毒理效应等,但这些研究存在以下5点问题:(1)报道主要是对总Ag(包括Ag+、AgNPs和AgNPs-Ag+复合物)的评估,而不是环境毒理研究中常用的生物体摄取的各种不同类型的AgNPs[82];(2)对AgNPs生物毒性测定缺乏标准方法以及有效研究技术手段[40, 83];(3)AgNPs对单一物种毒理效应和机制的研究主要集中在物种本身的生理变化方面,而较少从分子水平探讨其致毒机制[65];(4)报道多数只涉及单一环境因素对AgNPs在水生态迁移转化和生态毒理效应的研究, 而对不同环境因素互作条件下的毒理效应机制知之甚少;(5)对AgNPs在食物链中的研究主要集中于二级食物链或模式生物上面,不能完全反映真实复杂的生物系统[83]。因此,未来对AgNPs在水环境中的迁移转化、生物积累及生态毒理机制等研究可从以下5方面入手:
(1) 在实际暴露场景和剂量条件下,对环境实际浓度AgNPs在不同实验尺度(微观和中观)和时间(长期和短期)中的水生态迁移转化和生态毒理效应进行研究;
(2) 开发新的AgNPs在复杂环境介质中的表征和量化方法,并提供标准的或可参考的环境管理体系以及安全性实验方案,建立一个全面、规范的评价体系,这对环境中AgNPs的毒性进行有效评价至关重要;
(3) 对AgNPs生态毒理效应进行多组学(包括高通量筛选、预测毒理学和基因组学/表观遗传学/代谢组学等)研究,并从分子水平进行探讨AgNPs致毒机制,以将AgNPs研究从描述性科学转向基于机制的毒理学;
(4) 开展多因素(包括非生物和生物因素)条件下AgNPs在水环境迁移转化和生态毒理效应研究,深入探究AgNPs-污染物之间的相互作用,以及环境条件如何使这种相互作用复杂化,最终将这些研究应用于实际生态环境,以评估其在自然环境条件下的总体毒性;
(5) 建立完整的实验条件,加强AgNPs在三级食物链尤其是在水环境中常见的食物链中迁移转化规律的研究,进而深入探究原位而非实验室模拟条件下AgNPs在食物链中的传递规律及其机制。
在上述研究的基础上,开发由化学、物理、生物学、数学、统计学和信息学等跨学科科学领域组成的AgNPs毒性数据库,建立AgNPs生物风险评估体系及环境标准,使其在排放前预处理,从而从根源上降低生态风险。
| [1] |
SHARMA V K, FILIP J, ZBORIL R, et al. Natural inorganic nanoparticles-formation, fate, and toxicity in the environment[J]. Chemical Society Reviews, 2015, 44(23): 8410-8423. DOI:10.1039/C5CS00236B |
| [2] |
HAO Z N, LI F S, LIU R, et al. Reduction of ionic silver by sulfur dioxide as a source of silver nanoparticles in the environment[J]. Environmental Science & Technology, 2021, 55(8): 5569-5578. |
| [3] |
SHARMA V K, SISKOVA K M, ZBORIL R, et al. Organic-coated silver nanoparticles in biological and environmental conditions: Fate, stability and toxicity[J]. Advances in Colloid and Interface Science, 2014, 204: 15-34. DOI:10.1016/j.cis.2013.12.002 |
| [4] |
ZHANG C Q, HU Z Q, DENG B L. Silver nanoparticles in aquatic environments: Physiochemical behavior and antimicrobial mechanisms[J]. Water Research, 2016, 88: 403-427. DOI:10.1016/j.watres.2015.10.025 |
| [5] |
TEMIZEL-SEKERYAN S, HICKS A L. Global environmental impacts of silver nanoparticle production methods supported by life cycle assessment[J]. Resources, Conservation and Recycling, 2020, 156: 104676. DOI:10.1016/j.resconrec.2019.104676 |
| [6] |
LEAD J R, BATLEY G E, ALVAREZ P J J, et al. Nanomaterials in the environment: Behavior, fate, bioavailability, and effects-An updated review[J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1825-1851. DOI:10.1897/08-090.1 |
| [7] |
杨悦锁, 王晨, 袁雪梅, 等. 天然水环境中纳米银的来源、分析与转化[J]. 应用生态学报, 2017, 28(6): 2073-2082. |
| [8] |
MCGILLICUDDY E, MURRAY I, KAVANAGH S, et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology[J]. Science of the Total Environment, 2017, 575: 231-246. DOI:10.1016/j.scitotenv.2016.10.041 |
| [9] |
ZHANG W C, XIAO B D, FANG T. Chemical transformation of silver nanoparticles in aquatic environments: Mechanism, morphology and toxicity[J]. Chemosphere, 2018, 191: 324-334. DOI:10.1016/j.chemosphere.2017.10.016 |
| [10] |
KALANTZI I, MYLONA K, TONCELLI C, et al. Ecotoxicity of silver nanoparticles on plankton organisms: A review[J]. Journal of Nanoparticle Research, 2019, 21(3): 65. DOI:10.1007/s11051-019-4504-7 |
| [11] |
KVNNIGER T, GERECKE A C, ULRICH A, et al. Release and environmental impact of silver nanoparticles and conventional organic biocides from coated wooden façades[J]. Environmental Pollution, 2014, 184: 464-471. DOI:10.1016/j.envpol.2013.09.030 |
| [12] |
KRZYZEWSKA I, KYZIOŁ-KOMOSIHSKA J, ROSIK-DULEWSKA C, et al. Inorganic nanomaterials in the aquatic environment: Behavior, toxicity, and interaction with environmental elements[J]. Archives of Environmental Protection, 2016, 42(1): 87-101. DOI:10.1515/aep-2016-0011 |
| [13] |
ZHANG W C, KE S, SUN C Y, et al. Fate and toxicity of silver nanoparticles in freshwater from laboratory to realistic environments: A review[J]. Environmental Science and Pollution Research, 2019, 26(8): 7390-7404. DOI:10.1007/s11356-019-04150-0 |
| [14] |
PETERS R J B, VAN BEMMEL G, MILANI N B L, et al. Detection of nanoparticles in Dutch surface waters[J]. Science of the Total Environment, 2018, 621: 210-218. DOI:10.1016/j.scitotenv.2017.11.238 |
| [15] |
LI L X Y, HARTMANN G, DOBLINGER M, et al. Quantification of nanoscale silver particles removal and release from municipal wastewater treatment plants in Germany[J]. Environmental Science & Technology, 2013, 47(13): 7317-7323. |
| [16] |
GAISER B K, BISWAS A, ROSENKRANZ P, et al. Effects of silver and cerium dioxide micro- and nano-sized particles on Daphnia magna[J]. Journal of Environmental Monitoring, 2011, 13(5): 1227-1235. DOI:10.1039/c1em10060b |
| [17] |
HU Y, CHEN X J, YANG K, et al. Distinct toxicity of silver nanoparticles and silver nitrate to Daphnia magna in M4 medium and surface water[J]. Science of the Total Environment, 2018, 618: 838-846. DOI:10.1016/j.scitotenv.2017.08.222 |
| [18] |
PU G Z, ZENG D J, MO L, et al. Does artificial light at night change the impact of silver nanoparticles on microbial decomposers and leaf litter decomposition in streams?[J]. Environmental Science: Nano, 2019, 6(6): 1728-1739. DOI:10.1039/C9EN00081J |
| [19] |
ELLIS L-J A, BAALOUSHA M, VALSAMI-JONES E, et al. Seasonal variability of natural water chemistry affects the fate and behaviour of silver nanoparticles[J]. Chemosphere, 2018, 191: 616-625. DOI:10.1016/j.chemosphere.2017.10.006 |
| [20] |
卢雪蓉, 冯晓丽, 刘朝莹, 等. 纳米银的迁移转化对环境微生物毒性的影响[J]. 生态毒理学报, 2018, 13(5): 49-57. |
| [21] |
DE SOUZA T A J, ROSA SOUZA L R, FRANCHI L P. Silver nanoparticles: An integrated view of green synthesis methods, transformation in the environment, and toxicity[J]. Ecotoxicology and Environmental Safety, 2019, 171: 691-700. DOI:10.1016/j.ecoenv.2018.12.095 |
| [22] |
LIU J Y, HURT R H. Ion release kinetics and particle persistence in aqueous nano-silver colloids[J]. Environmental Science & Technology, 2010, 44(6): 2169-2175. |
| [23] |
LIU J Y, SONSHINE D A, SHERVANI S, et al. Controlled release of biologically active silver from nanosilver surfaces[J]. ACS Nano, 2010, 4(11): 6903-6913. DOI:10.1021/nn102272n |
| [24] |
BADAWY A M E, SILVA R G, MORRIS B, et al. Surface charge-dependent toxicity of silver nanoparticles[J]. Environmental Science & Technology, 2011, 45(1): 283-287. |
| [25] |
YU S J, YIN Y G, CHAO J B, et al. Highly dynamic PVP-coated silver nanoparticles in aquatic environments: Chemical and morphology change induced by oxidation of Ag0 and reduction of Ag+[J]. Environmental Science & Technology, 2014, 48(1): 403-411. |
| [26] |
LI Y, NIU J F, SHANG E X, et al. Photochemical trans- formation and photoinduced toxicity reduction of silver nanoparticles in the presence of perfluorocarboxylic acids under UV irradiation[J]. Environmental Science & Technology, 2014, 48(9): 4946-4953. |
| [27] |
GUNSOLUS I L, MOUSAVI M P S, HUSSEIN K, et al. Effects of humic and fulvic acids on silver nanoparticle stability, dissolution, and toxicity[J]. Environmental Science & Technology, 2015, 49(13): 8078-8086. |
| [28] |
ZHANG Y Q, XIA J C, LIU Y L, et al. Impacts of morphology, natural organic matter, cations, and ionic strength on sulfidation of silver nanowires[J]. Environmental Science & Technology, 2016, 50(24): 13283-13290. |
| [29] |
BADAWY A M E, LUXTON T P, SILVA R G, et al. Impact of environmental conditions (pH, ionic strength, and electrolyte type) on the surface charge and aggregation of silver nanoparticles suspensions[J]. Environmental Science & Technology, 2010, 44(4): 1260-1266. |
| [30] |
SINGH A, HOU W C, LIN T F. Combined impact of silver nanoparticles and chlorine on the cell integrity and toxin release of Microcystis aeruginosa[J]. Chemosphere, 2021, 272(3): 129825. DOI:10.1016/j.chemosphere.2021.129825 |
| [31] |
LEVARD C, HOTZE E M, COLMAN B P, et al. Sulfidation of silver nanoparticles: Natural antidote to their toxicity[J]. Environmental Science & Technology, 2013, 47(23): 13440-13448. |
| [32] |
LI Y, ZHAO J, SHANG E X, et al. Effects of chloride ions on dissolution, ROS generation, and toxicity of silver nanoparticles under UV irradiation[J]. Environmental Science & Technology, 2018, 52(8): 4842-4849. |
| [33] |
LIU J Y, PENNELL K G, HURT R H. Kinetics and mechanisms of nanosilver oxysulfidation[J]. Environmental Science & Technology, 2011, 45(17): 7345-7353. |
| [34] |
LI L Y X, XU Z L, WIMMER A, et al. New insights into the stability of silver sulfide nanoparticles in surface water: Dissolution through hypochlorite oxidation[J]. Environmental Science & Technology, 2017, 51(14): 7920-7927. |
| [35] |
YIN Y, LIU J, JIANG G. Sunlight-induced reduction of ionic Ag and auto metallic nanoparticles by dissolved organic matter[J]. ACS Nano, 2012, 6(9): 7910-7919. DOI:10.1021/nn302293r |
| [36] |
乔自鹏, 王奇志, 杨道茂, 等. 真菌介导纳米银生物合成的研究进展[J]. 生物技术通报, 2021, 37(3): 185-197. |
| [37] |
RÓNAVÁRI A, IGAZ N, ADAMECZ D I, et al. Green silver and gold nanoparticles: Biological synthesis approaches and potentials for biomedical applications[J]. Molecules, 2021, 26(4): 844. DOI:10.3390/molecules26040844 |
| [38] |
SEETHARAMAN P K, CHANDRASEKARAN R, GNANASEKA S, et al. Antimicrobial and larvicidal activity of eco-friendly silver nanoparticles synthesized from endophytic fungi Phomopsis liquidambaris[J]. Biocatalysis and Agricultural Biotechnology, 2018, 16: 22-30. DOI:10.1016/j.bcab.2018.07.006 |
| [39] |
GARDEA-TORRESDEY J L, GOMEZ E, PERALTA-VIDEA J R, et al. Alfalfa sprouts: A natural source for the synthesis of silver nanoparticles[J]. Langmuir, 2003, 19(4): 1357-1361. DOI:10.1021/la020835i |
| [40] |
侯瑞锋, 尹双, 代燕辉, 等. 人工合成纳米颗粒在水生食物链中的分布、传递及其影响因素[J]. 科学通报, 2018, 63(9): 790-800. |
| [41] |
XU L N, XU M, WANG R X, et al. The crucial role of environmental coronas in determining the biological effects of engineered nanomaterials[J]. Small, 2020, 16(36): e2003691. DOI:10.1002/smll.202003691 |
| [42] |
AHAMED A, LIANG L L, LEE M Y, et al. Too small to matter? Physicochemical transformation and toxicity of engineered nTiO2, nSiO2, nZnO, carbon nanotubes, and nAg[J]. Journal of Hazardous Materials, 2021, 404: 124107. DOI:10.1016/j.jhazmat.2020.124107 |
| [43] |
YANG X Y, LIN S H, WIESNER M R. Influence of natural organic matter on transport and retention of polymer coated silver nanoparticles in porous media[J]. Journal of Hazardous Materials, 2014, 264: 161-168. DOI:10.1016/j.jhazmat.2013.11.025 |
| [44] |
WANG Y W, TANG H, WU D, et al. Enhanced bactericidal toxicity of silver nanoparticles by the antibiotic gentamicin[J]. Environmental Science-Nano, 2016, 3(4): 788-798. DOI:10.1039/C6EN00031B |
| [45] |
DENG H, MCSHAN D, ZHANG Y, et al. Mechanistic study of the synergistic antibacterial activity of combined silver nanoparticles and common antibiotics[J]. Environmental Science & Technology, 2016, 50(16): 8840-8848. |
| [46] |
吴源. 纳米银的生物效应及毒性作用机制[D]. 合肥: 中国科学技术大学, 2010.
|
| [47] |
MCTEER J, DEAN A P, WHITE K N, et al. Bioaccumulation of silver nanoparticles into Daphnia magna from a freshwater algal diet and the impact of phosphate availability[J]. Nanotoxicology, 2014, 8(3): 305-316. DOI:10.3109/17435390.2013.778346 |
| [48] |
辛琦, 章强, 程金平. 纳米银对鱼类的毒性效应研究进展[J]. 生态毒理学报, 2014, 9(6): 1014-1026. |
| [49] |
GAMBARDELLA C, COSTA E, PIAZZA V, et al. Effect of silver nanoparticles on marine organisms belonging to different trophic levels[J]. Marine Environmental Research, 2015, 111: 41-49. DOI:10.1016/j.marenvres.2015.06.001 |
| [50] |
KHAN F R, PAUL K B, DYBOWSKA A D, et al. Accumulation dynamics and acute toxicity of silver nanoparticles to Daphnia magna and Lumbriculus variegatus: Implications for metal modeling approaches[J]. Environmental Science & Technology, 2015, 49(7): 4389-4397. |
| [51] |
MIRALLES P, CHURCH T L, HARRIS A T. Toxicity, uptake, and translocation of engineered nanomaterials in vascular plants[J]. Environmental Science & Technology, 2012, 46(17): 9224-9239. |
| [52] |
YAN A, CHEN Z. Impacts of silver nanoparticles on plants: A focus on the phytotoxicity and underlying mechanism[J]. International Journal of Molecular Sciences, 2019, 20(5): 1003. DOI:10.3390/ijms20051003 |
| [53] |
SURESH A K, PELLETIER D A, DOKTYCZ M J. Relating nanomaterial properties and microbial toxicity[J]. Nanoscale, 2013, 5(2): 463-474. DOI:10.1039/C2NR32447D |
| [54] |
IVASK A, KURVET I, KASEMETS K, et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro[J]. PLoS ONE, 2014, 9(7): e102108. DOI:10.1371/journal.pone.0102108 |
| [55] |
衣俊, 黄俊, 程金平. 纳米银在水环境中的环境行为和毒性效应研究进展[J]. 生态毒理学报, 2015, 10(1): 101-109. |
| [56] |
秦捷, 隋铭皓, 袁博杰, 等. 纳米银在水环境中的行为及毒性效应[J]. 四川环境, 2017, 36(6): 155-160. DOI:10.3969/j.issn.1001-3644.2017.06.026 |
| [57] |
SONDI I, SALOPEK-SONDI B. Silver nanoparticles as antimicrobial agent: A case study on E.coli as a model for Gram-negative bacteria[J]. Journal of Colloid and Interface Science, 2004, 275(1): 177-182. DOI:10.1016/j.jcis.2004.02.012 |
| [58] |
CHEN Z Y, LU J, GAO S H, et al. Silver nanoparticles stimulate the proliferation of sulfate reducing bacterium Desulfovibrio vulgaris[J]. Water Research, 2018, 129: 163-171. DOI:10.1016/j.watres.2017.11.021 |
| [59] |
HUANG J, XIAO J, CHEN M, et al. Fate of silver nanoparticles in constructed wetlands and its influence on performance and microbiome in the ecosystems after a 450-day exposure[J]. Bioresource Technology, 2019, 281: 107-117. DOI:10.1016/j.biortech.2019.02.013 |
| [60] |
LIANG Z H, DAS A, HU Z Q. Bacterial response to a shock load of nanosilver in an activated sludge treatment system[J]. Water Research, 2010, 44(18): 5432-5438. DOI:10.1016/j.watres.2010.06.060 |
| [61] |
ZHANG C Q, LIANG Z H, HU Z Q. Bacterial re- sponse to a continuous long-term exposure of silver nanoparticles at sub-ppm silver concentrations in a membrane bioreactor activated sludge system[J]. Water Research, 2014, 50: 350-358. DOI:10.1016/j.watres.2013.10.047 |
| [62] |
PRADHAN A, SEENA S, PASCOAL C, et al. Can metal nanoparticles be a threat to microbial decomposers of plant litter in streams?[J]. Microbial Ecology, 2011, 62(1): 58-68. DOI:10.1007/s00248-011-9861-4 |
| [63] |
BATISTA D, PASCOAL C, CÁSSIO F. Temperature modulates AgNP impacts on microbial decomposer activity[J]. Science of the Total Environment, 2017, 601/602: 1324-1332. DOI:10.1016/j.scitotenv.2017.05.229 |
| [64] |
LIU S Q, WANG C, HOU J, et al. Effects of silver sulfide nanoparticles on the microbial community structure and biological activity of freshwater biofilms[J]. Environmental Science-Nano, 2018, 5(12): 2899-2908. DOI:10.1039/C8EN00480C |
| [65] |
李曼璐, 姜玥璐. 人工纳米颗粒在水体中的行为及其对浮游植物的影响[J]. 环境科学, 2015, 36(1): 365-372. |
| [66] |
JIANG H S, YIN L Y, REN N N, et al. The effect of chronic silver nanoparticles on aquatic system in microcosms[J]. Environmental Pollution, 2017, 223: 395-402. DOI:10.1016/j.envpol.2017.01.036 |
| [67] |
JIANG H S, YIN L Y, REN N N, et al. Silver nanoparticles induced reactive oxygen species via photosynthetic energy transport imbalance in an aquatic plant[J]. Nanotoxicology, 2017, 11(2): 157-167. DOI:10.1080/17435390.2017.1278802 |
| [68] |
PEREIRA S P P, JESUS F, AGUIAR S, et al. Phytotoxicity of silver nanoparticles to Lemna minor: Surface coating and exposure period-related effects[J]. Science of the Total Environment, 2018, 618: 1389-1399. DOI:10.1016/j.scitotenv.2017.09.275 |
| [69] |
ZOU X Y, LI P H, HUANG Q, et al. The different response mechanisms of Wolffia globosa: Light-induced silver nanoparticle toxicity[J]. Aquatic Toxicology, 2016, 176: 97-105. DOI:10.1016/j.aquatox.2016.04.019 |
| [70] |
NAIR P M G, CHUNG I M. Physiological and molecular level effects of silver nanoparticles exposure in rice (Oryza sativa L.) seedlings[J]. Chemosphere, 2014, 112: 105-113. DOI:10.1016/j.chemosphere.2014.03.056 |
| [71] |
OUKARROUM A, BRAS S, PERREAULT F, et al. Inhibitory effects of silver nanoparticles in two green algae, Chlorella vulgaris and Dunaliella tertiolecta[J]. Ecotoxicology and Environmental Safety, 2012, 78: 80-85. DOI:10.1016/j.ecoenv.2011.11.012 |
| [72] |
MIAO A J, SCHWEHR K A, XU C, et al. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances[J]. Environmental Pollution, 2009, 157(11): 3034-3041. DOI:10.1016/j.envpol.2009.05.047 |
| [73] |
HE D, DORANTES-ARANDA J J, WAITE T D. Silver nanoparticle-algae interactions: Oxidative dissolution, reactive oxygen species generation and synergistic toxic effects[J]. Environmental Science & Technology, 2012, 46(16): 8731-8738. |
| [74] |
YUAN L, RICHARDSON C J, HO M, et al. Stress responses of aquatic plants to silver nanoparticles[J]. Environmental Science & Technology, 2018, 52(5): 2558-2565. |
| [75] |
YAN N, TSIM S M J, HE X W, et al. Direct visualization and quantification of maternal transfer of silver nanoparticles in zooplankton[J]. Environmental Science & Technology, 2020, 54(17): 10763-10771. |
| [76] |
SHAW B J, HANDY R D. Physiological effects of nanoparticles on fish: A comparison of nanometals versus metal ions[J]. Environment International, 2011, 37(6): 1083-1097. DOI:10.1016/j.envint.2011.03.009 |
| [77] |
KWOK K W H, DONG W, MARINAKOS S M, et al. Silver nanoparticle toxicity is related to coating materials and disruption of sodium concentration regulation[J]. Nanotoxicology, 2016, 10(9): 1306-1317. DOI:10.1080/17435390.2016.1206150 |
| [78] |
周艳君, 施阳, 吴源. 纳米银对青鳉的亚慢性毒性研究[J]. 安徽医科大学学报, 2017, 52(5): 719-723. |
| [79] |
LEKAMGE S, MIRANDA A F, BALL A S, et al. The toxicity of coated silver nanoparticles to Daphnia carinata and trophic transfer from alga Raphidocelis subcapitata[J]. PLoS ONE, 2019, 14(4): e0214398. DOI:10.1371/journal.pone.0214398 |
| [80] |
CHAE Y, AN Y J. Toxicity and transfer of polyvinylp- yrrolidone-coated silver nanowires in an aquatic food chain consisting of algae, water fleas, and zebrafish[J]. Aquatic Toxicology, 2016, 173: 94-104. DOI:10.1016/j.aquatox.2016.01.011 |
| [81] |
CLEVELAND D, LONG S E, PENNINGTON P L, et al. Pilot estuarine mesocosm study on the environmental fate of silver nanomaterials leached from consumer products[J]. Science of the Total Environment, 2012, 421/422: 267-272. DOI:10.1016/j.scitotenv.2012.01.025 |
| [82] |
DROBNE D, NOVAK S, TALABER I, et al. The biological fate of silver nanoparticles from a methodological perspective[J]. Materials (Basel), 2018, 11(6): 957. DOI:10.3390/ma11060957 |
| [83] |
RASTOGI A, ZIVCAK M, SYTAR O, et al. Impact of metal and metal oxide nanoparticles on plant: A critical review[J]. Frontiers in Chemistry, 2017, 5: 78. DOI:10.3389/fchem.2017.00078 |



