2. 自然资源部第三海洋研究所海洋生物遗传资源重点实验, 福建厦门 361005
2. Key Laboratory of Marine Biogenetic Resources, Third Institute of Oceanography, Ministry of Natural Resources, Xiamen, Fujian, 361005, China
海洋放线菌是海洋微生物的重要组成部分,也是产生多种天然化合物的重要来源。链霉菌是海洋放线菌中研究最多的一个菌属,截至2016年从海洋链霉菌中分离得到的次级代谢产物有547个[1],包括生物碱类、甾体类、萜类、聚酮类等化合物,其中生物碱类化合物是主要的结构类型。迄今为止,大多数链霉属放线菌是从海洋沉积物中分离得到的,而从珊瑚中分离到的链霉属放线菌次级代谢产物研究鲜有报道。本研究通过对珊瑚来源的链霉属放线菌次级代谢产物进行研究,丰富珊瑚来源的链霉属放线菌次级代谢产物的结构类型,为进一步研究和开发珊瑚来源链霉属放线菌的化学成分提供参考。
1 材料与方法 1.1 材料 1.1.1 仪器和试剂旋转蒸发仪(N-1100,上海诶朗科技有限公司),核磁共振仪(Bruker Avance Ⅱ 400 MHz),高分辨质谱仪(Waters Xevo G2 Q-TOF),紫外可见分光光度计(UV-800,上海元析仪器有限公司),中压制备体系(C-605,BUCHI),反向色谱柱(ODS,YMC),柱层层析硅胶和薄层层析硅胶板(山东省烟台江友硅胶开发有限公司产品),Sephadex LH-20凝胶(GE Healthcare Bio-Sciences AB),分析纯试剂(广州市化学试剂厂)。
1.1.2 菌种放线菌分离自海南琼东海域蜂巢珊瑚样品,经16S rRNA序列分析鉴定为Streptomyces albidoflavus M13.1[2]。菌种保存于厦门海洋微生物菌种保藏管理中心。
1.2 菌种活化及发酵培养将保存于-80℃甘油管的菌株接种到已灭菌的马铃薯葡萄糖琼脂(PDA)培养基[3]上,于28℃恒温箱中培养3—5 d;挑取单菌落接种到2216E液体培养基中,于28℃,180 r·min-1条件下培养7 d,作为发酵的种子液;取20 mL发酵种子液接种至装有380 mL液体培养基[4](含有淀粉20 g、葡萄糖10 g、酵母提取粉5 g、细菌学蛋白胨5 g、海盐30 g)的1 L锥形瓶中,共接种100瓶,于28℃、180 r·min-1条件下培养7 d,共得到40 L发酵液。
1.3 提取与分离将发酵液离心得到上清液,用等体积的乙酸乙酯萃取上清液,萃取3次后合并萃取液,减压浓缩得到乙酸乙酯粗提物21 g。将得到的粗提物用硅胶拌样后置于柱层析硅胶中,用洗脱剂石油醚和二氯甲烷-甲醇(体积比50:1→1:1)依次进行洗脱,在薄层硅胶板上点样、展开、显色后,将其划为10个馏分(Fr1-Fr10)。
Fr3 (69.8 mg)经过ODS反相硅胶中压色谱柱甲醇-水(体积比50:50→100:0)、Sephadex LH-20凝胶洗脱得到化合物1(25.8 mg)、2(46.8 mg)。Fr5(186.5 mg)经过ODS反相硅胶中压色谱柱甲醇-水(体积比60:40→100:0)、Sephadex LH-20凝胶及薄层色谱板制备得到化合物3(1.5 mg)。Fr7(1.04 g)经过ODS反相硅胶中压色谱柱甲醇-水(体积比15:85→100:0)、Sephadex LH-20凝胶甲醇-水洗脱得到化合物4(4.1 mg)和5(5.1 mg)。Fr8(419.2 mg)经过ODS反相硅胶中压色谱柱甲醇-水(体积比50:50→100:0)、Sephadex LH-20凝胶洗脱得到化合物6(66.2 mg)、7(3.5 mg)、8(57.8 mg)。Fr9(317.6 mg)经过ODS反相硅胶中压色谱柱甲醇-水(体积比15:85→100:0)、Sephadex LH-20凝胶洗脱得到化合物9(2.4 mg)、10(4.7 mg)。最后一段Fr10(611.0 mg)经过ODS反相硅胶中压色谱柱甲醇-水(体积比25:75→100:0)、Sephadex LH-20凝胶及乙腈-水(体积比10:90→95:5)的HPLC液相色谱柱纯化得到化合物11(13.6 mg)、12(2.0 mg)、13(2.6 mg)。
2 结果与分析 2.1 化合物结构鉴定化合物1:白色粉末,高分辨质谱HR-ESI-MS m/z: 247.133 9 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH 7.71 (1H, dd, J=5.7, 1.1 Hz, H-3), 6.11(1H, dd, J=5.7, 1.9 Hz, H-2), 5.13(1H, m, H-4), 2.57(1H, m, H-10), 2.14 (3H, s, H-12), 1.80(1H, m, H-5a), 1.60—1.69(2H, m, H-9a, H-5b), 1.34—1.46(7H, m), 1.06(3H, d, J=7.0 Hz, H-13); 13C-NMR(CD3OD, 100 MHz), δC 216.5(C-11), 176.4(C-1), 160.2(C-3), 122.1(C-2), 86.1(C-4), 48.6(C-10), 34.5(C-5), 34.3(C-9), 30.9(C-7), 28.7(C-12), 28.5(C-8), 26.4(C-6), 17.1(C-13)。上述数据与文献[5]报道的数据基本一致,故鉴定化合物为5-(6-methyl-7-oxooctyl)furan-2(5H)-one。
化合物2:白色粉末,高分辨质谱HR-ESI-MS m/z: 319.081 6 [2M+Na]+。1H-NMR (CD3OD, 400 MHz), δH 7.60—7.38 (5H, m), 7.67 (1H, d, J=16.0 Hz, H-8), 6.47 (1H, d, J=16.0 Hz, H-7);13C-NMR (CD3OD, 100 MHz), δC 170.9 (COOH), 146.9 (C-1), 136.3 (C-4), 131.9 (C-8), 130.5 (C-3, C-5), 129.7 (C-2, C-6), 119.4 (C-7)。上述数据与文献[6]报道的数据基本一致,故鉴定化合物为肉桂酸。
化合物3:黄色粉末,高分辨质谱HR-ESI-MS m/z:211.1143 [M+H]+。1H-NMR (CD3OD, 400 MHz), δH 4.25 (1H, t, J=6.92 Hz, H-9), 4.12 (1H, m, H-6), 3.51—3.48 (2H, m, H-3), 2.32—2.26 (2H, m, H-5), 2.06—1.83 (4H, m), 1.48—1.53 (1H, m), 0.95 (3H, d, J=2.68 Hz, H-12), 0.94 (3H, d, J=2.44 Hz, H-13);13C-NMR (CD3OD, 100 MHz), δC173.3(C-1), 169.4(C-7), 60.8(C-6), 55.1(C-9), 46.9 (C-3), 39.9 (C-10), 29.6 (C-5), 26.2 (C-11), 24.1 (C-4), 23.8 (C-12), 22.7 (C-13)。上述数据与文献[7]报道的数据基本一致,故鉴定化合物为环(亮-脯)二肽。
化合物4:白色粉末,高分辨质谱HR-ESI-MS m/z:265.144 6 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH7.71(1H, d, J=5.7Hz, H-4), 6.11(1H, dd, J=5.7, 1.5 Hz, H-3), 5.14(1H, m, H-5), 3.56(1H, d, J=6.4 Hz, H-7′), 1.82—1.64(2H, m, H-1′), 1.49—1.36(8H, m, H-2′, 3′, 4′, 5′), 1.11(3H, d, J=6.4 Hz, H-8′), 1.07(3H, s, 6′-Me); 13C-NMR(CD3OD, 100 MHz), δC 176.4(C-2), 160.2(C-4), 122.0(C-3), 86.1(C-5), 76.2(C-6′), 74.6(C-7′), 39.5(C-5′), 34.5 (C-1′), 31.6(C-4′), 26.5(C-2′), 24.7(C-3′), 22.1(C6′-Me), 18.1 (C-8′)。上述数据与文献[8]报道的数据基本一致,故鉴定化合物为5-(6, 7-dihydroxy-6-methyloctyl)furan-2(5H)-one。
化合物5:白色粉末,1H-NMR(CD3OD, 400 MHz), δH 4.20(2H, m, H-3, 6), 3.51(2H, m, H-9), 2.50—2.00(4H, m, H-7, H-8), 1.37(3H, d, J=6.92 Hz, H-10);13C-NMR(CD3OD, 100 MHz), δC173.1(C-2), 169.6(C-5), 61.0(C-6), 52.6(C-3), 46.9(C-9), 29.7(C-7), 24.1(C-8), 16.2(C-10)。上述数据与文献[9]报道的数据基本一致,故鉴定化合物为环(丙-脯)二肽。
化合物6:白色粉末,1H-NMR (CD3OD, 400 MHz), δH 7.58(1H, d, J=15.92 Hz, H-7), 7.43(2H, d, J=8.4 Hz, H-2, 6), 6.81(2H, d, J=8.35 Hz, H-3, 5), 6.26(1H, d, J=15.88 Hz, H-8);13C-NMR(CD3OD, 100 MHz), δC171.2(C-9), 161.1(C-4), 146.5(C-7), 131.1(C-2, 6), 127.2(C-1), 115.8(C-3, 5), 115.8(C-8)。上述数据与文献[10]报道的数据基本一致,故鉴定化合物为香豆酸。
化合物7:白色粉末,高分辨质谱HR-ESI-MS m/z: 207.110 7 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH 4.0(1H, d, J=0.72 Hz, H-3), 3.93(1H, dd, J=8.4, 4.72 Hz, H-6), 1.75(2H, m, H-7), 1.63(1H, m, H-8), 1.44(3H, d, J=7.08 Hz, H-11), 0.96(6H, t, J=6.84 Hz, H-9, 10); 13C-NMR(CD3OD, 100 MHz), δC172.0(C-2), 171.5(C-5), 55.1(C-6), 52.4(C-3), 45.6(C-7), 25.8(C-8), 24.0(C-10), 22.6(C-9), 21.4(C-11)。上述数据与文献[11]报道的数据基本一致,故鉴定化合物为环(丙-亮)二肽。
化合物8:白色粉末,高分辨质谱HR-ESI-MS m/z:202.084 8 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH7.04(2H, d, J=8.4 Hz, H-2′, 6′), 6.73(2H, d, J=8.44 Hz, H-3′, 5′), 3.34(2H, t, J=7.24 Hz, H-1), 2.69(2H, t, J=7.6 Hz, H-2), 1.91(3H, s, H-Me); 13C-NMR(CD3OD, 100 MHz), δC173.7(C=O), 157.3(C-4′), 131.7(C-1′), 131.2(C-2′, 6′), 116.7 (C-3′, 5′), 42.9(C-1), 36.1(C-2), 23.0(Me)。上述数据与文献[12]报道的数据基本一致,故鉴定化合物为N-乙酰基酪胺。
化合物9:白色粉末,高分辨质谱HR-ESI-MS m/z: 283.107 1 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH 7.30—7.20(5H, m, H-Ar), 4.48(1H, t, J=4.96 Hz, H-4), 4.35(1H, dd, J=11.6, 4.1 Hz, H-6), 4.27(1H, t, J=4.72 Hz, H-9), 3.70(2H, dd, J=13.0, 5.08 Hz, H-3), 3.27—3.13(2H, m, H-5), 2.05(2H, dd, J=13.5, 5.92 Hz, H-10); 13C-NMR(CD3OD, 100 MHz), δC 171.8(C-1), 167.6(C-7), 137.9(C-1′), 131.5(C-2′, 6′), 130.0(C-3′, 5′), 128.6(C-4′), 69.0(C-4), 58.8(C-6), 58.1(C-9), 55.7 (C-3), 39.4(C-5), 38.5(C-10)。上述数据与文献[13]报道的数据基本一致,故鉴定化合物为环(4-羟基-脯-苯丙)二肽。
化合物10:白色粉末,1H-NMR(CD3OD, 400 MHz), δH 4.00(1H, q, J=7 Hz, H-2), 3.91(2H, brs, H-2′), 1.43(3H, d, J=7.04 Hz, H-3); 13C-NMR(CD3OD, 100 MHz), δC 172.1(C-1), 169.3(C-1′), 52.2(C-2), 45.9(C-2′), 19.9(C-3)。上述数据与文献[14]报道的数据基本一致,故鉴定化合物为环(甘-丙)二肽。
化合物11:白色粉末,1H-NMR(CD3OD, 400 MHz), δH 4.22(1H, m, H-2), 4.09(1H, d, J=16.8 Hz, H-2′), 3.73(1H, d, J=16.8 Hz, H-2′), 3.55—3.50(2H, m, H-5), 2.30—1.85(4H, m, H-3, 4);13C-NMR (CD3OD, 100 MHz), δC 172.5(C-1), 166.9(C-1′), 60.3(C-2), 47.5(C-2′), 46.8(C-5), 29.9(C-3), 23.8(C-4)。上述数据与文献[15]报道的数据基本一致,故鉴定化合物为环(甘-脯)二肽。
化合物12:白色晶体,高分辨质谱HR-ESI-MS m/z:267.1 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH 8.00(1H, d, J=8.08 Hz, H-6), 5.88(1H, d, J=4.56 Hz, H-1′), 5.69 (1H, d, J=8.08 Hz, H-5), 4.15(2H, m, H-2′, 3′), 3.99(1H, m, H-4′), 3.38(2H, dd, J=12.28, 2.72 Hz, H-5′); 13C-NMR(CD3OD, 100 MHz), δC 166.8(C-4), 153.0(C-2), 143.2(C-6), 103.2(C-5), 91.2(C-1′), 86.8(C-4′), 76.2(C-3′), 71.8(C-2′), 62.8(C-5′)。上述数据与文献[16]报道的数据基本一致,故鉴定化合物为尿嘧啶核苷。
化合物13:白色粉末,高分辨质谱HR-ESI-MS m/z:281.075 3 [M+Na]+。1H-NMR(CD3OD, 400 MHz), δH 8.08(1H, d, J=8.12 Hz, H-6), 5.94(1H, d, J=3.6 Hz, H-1′), 5.68(1H, d, J=8.08 Hz, H-5), 4.23(1H, t, J=5.6 Hz, H-3′), 3.96(1H, m, H-4′), 3.84(2H, m, H-5′), 3.75 (1H, dd, J=12.36, 2.92 Hz, H-2′), 3.51(3H, s, -OCH3); 13C-NMR (CD3OD, 100 MHz), δC166.7(C-4), 152.7(C-2), 143(C-6), 103.0(C-5), 89.3(C-1′), 86.6(C-4′), 85.5(C-2′), 70.3(C-3′), 62.1(C-5′), 59.3(C2′-OMe)。上述数据与文献[17]与文献报道的数据基本一致,故鉴定化合物为2′-O-甲氧基尿嘧啶核苷。
化合物1—13的化学结构如图 1所示。
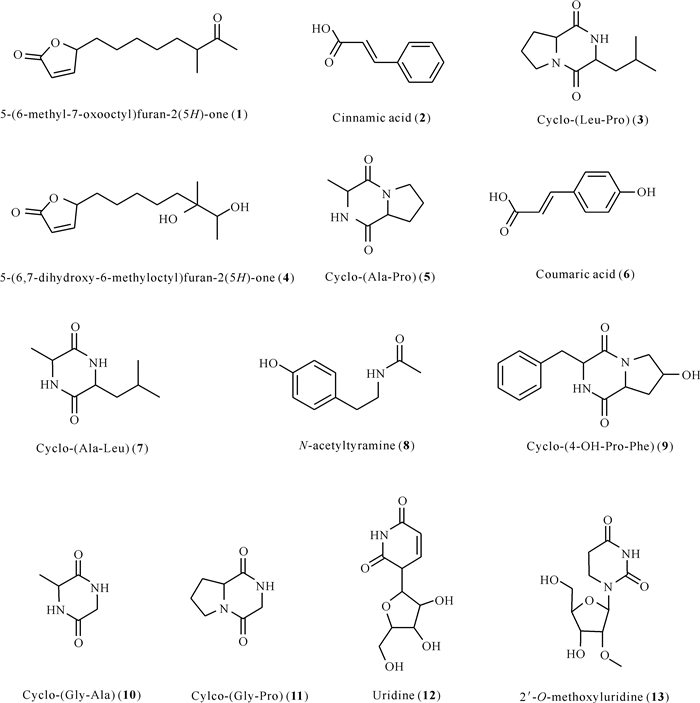
|
| 图 1 化合物1—13结构 Fig. 1 Structures of compound 1—13 |
2.2 化合物活性测定结果
采用CCK-8法,测定13个化合物对人宫颈癌细胞(HELA)、食管癌细胞(ECA-109)、肝癌细胞(BEL-7402)、膀胱癌细胞(BIU-87)、胰腺癌细(PANC-1)的抗细胞增殖活性。结果显示,13个化合物均无明显的抗肿瘤细胞增殖活性。
3 结论从放线菌S.albidoflavus M13.1次级代谢产物中,分离获得13个化合物。经鉴定,其中有6个二肽类化合物,分别为环(亮-脯)二肽(3)、环(丙-脯)二肽(5)、环(丙-亮)二肽(7)、环(4-羟基-脯-苯丙)二肽(9)、环(甘-丙)二肽(10)、环(甘-脯)二肽(11);有2个呋喃类化合物,分别为5-(6-methyl-7-oxooctyl)furan-2(5H)-one(1)、5-(6, 7-dihydroxy-6-methyloctyl)furan-2(5H) -one(4);有2个核苷类化合物,分别为尿嘧啶核苷(12)、2′-O-甲氧基尿嘧啶核苷(13);此外还有1个肉桂酸(2)、1个香豆酸(6)、1个N-乙酰基酪胺(8)。以上13个化合物均为首次从珊瑚来源的S.albidoflavus M13.1样品中分离得到。对13个化合物进行了体外抗肿瘤细胞增殖活性检测,均未发现明显的活性化学成分。
| [1] |
王聪, 梅显贵, 朱伟明. 海洋链霉菌来源的天然产物[J]. 海洋科学集刊, 2016(51): 86-124. |
| [2] |
周渊, 谢富全, 牛文涛, 等. 琼东海域珊瑚共附生放线菌的多样性[J]. 应用海洋学学报, 2018, 37(2): 218-228. DOI:10.3969/J.ISSN.2095-4972.2018.02.009 |
| [3] |
张莉, 倪孟祥. 海洋放线菌AM8发酵条件的优化及抑菌活性物质的初步研究[J]. 化学与生物工程, 2017, 34(6): 51-55. |
| [4] |
王小琴, 龚斌, 朱薇玲, 等. 放线菌327#的发酵培养基筛选及培养条件优化[J]. 中国酿造, 2010(10): 47-50. |
| [5] |
刘志国, 唐梦月, 孟庆红, 等. 1株链霉菌Streptomyces sp.A1693的次级代谢产物研究[J]. 中国中药杂志, 2018, 43(16): 3301-3306. |
| [6] |
刘年珍, 赵碧清, 钱群刚, 等. 玄参化学成分的研究[J]. 中成药, 2019, 41(3): 576-579. |
| [7] |
WANG C Y, HAN L, KANG K, et al. Secondary metabolites from green algae Ulva pertusa[J]. Chemistry of Natural Compounds, 2010, 46(5): 828-830. DOI:10.1007/s10600-010-9760-9 |
| [8] |
ZHAO P J, LI G H, SHEN Y M. New chemical constituents from the endophyte Streptomyces species LR4612 cultivated on Maytenus hookeri[J]. Chemistry & Biodiversity, 2006, 3(3): 337-342. |
| [9] |
王举涛, 张培良, 王刚, 等. 凤丹内生真菌Fusarium oxysporum次生代谢产物的研究[J]. 中草药, 2018, 49(22): 5247-5253. DOI:10.7501/j.issn.0253-2670.2018.22.005 |
| [10] |
GOETZ G, FKYERAT A, MÉTAIS N, et al. Resistance factors to grey mould in grape berries:Identification of some phenolics inhibitors of Botrytis cinerea stilbene oxidase[J]. Phytochemistry (Oxford), 1999, 52(5): 759-767. DOI:10.1016/S0031-9422(99)00351-9 |
| [11] |
艾峰, 许强芝, 杨妤, 等. 东海微生物中6种环二肽类天然活性物质的分离和鉴定[J]. 第二军医大学学报, 2006, 27(1): 22-24. |
| [12] |
SUN J F, WU Y, YANG B, et al. Chemical constituents of marine sponge Halichondria sp.from South China Sea[J]. Chemistry of Natural Compounds, 2015, 51(5): 975-977. |
| [13] |
康敏, 王泽宇, 郭大乐, 等. 疣孢漆斑菌发酵液正丁醇部位化学成分研究[J]. 中药材, 2016, 39(3): 548-551. |
| [14] |
高昊, 陈国栋, 唐金山, 等. 海洋细菌Bacillus sp.次生代谢产物的分离与鉴定[J]. 沈阳药科大学学报, 2010, 27(1): 69-75. |
| [15] |
WEI J, ZHANG X Y, DENG S, et al. α-Glucosidase inhibitors and phytotoxins from Streptomyces xanthophaeus[J]. Natural Product Research, 2017, 31(17): 2062-2066. |
| [16] |
KANG U, RYU S M, LEE D, et al. Chemical constituents of the leaves of Brassica oleracea var.acephala[J]. Chemistry of Natural Compounds, 2018, 54(1): 1023-1026. |
| [17] |
李丹丹, 丁丽琴, 杨灵, 等. 海蒿子含氮有机化学成分研究[J]. 中草药, 2017, 48(9): 1735-1739. |



