2. 广西中医药大学, 广西中医药科学实验中心/广西中医基础研究重点实验室, 广西南宁 530200;
3. 汕头大学理学院生物系, 广东汕头 515063
2. Guangxi Key Laboratory of Chinese Medicine Foundation Research, Guangxi Scientific Experimental Center of Traditional Chinese Medicine, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China;
3. Department of Biology, College of Science, Shantou University, Shantou, Guangdong, 515063, China
曲酸(Kojic acid)又名麴酸、曲菌酸,具有抗氧化、抗菌、杀虫、抗肿瘤等广泛的生物活性,曲酸及其衍生物现已开发成为护肤霜、洗液、肥皂和牙科护理产品,广泛应用于化妆品、食品和制药工业等领域[1-3]。医学方面,有研究表明曲酸有望成为治疗人角膜内皮细胞衰老相关疾病的药物[4],以及治疗和预防马尔尼菲蓝状菌感染的重要辅助药物[5, 6];另外,体内外实验研究表明曲酸具有很强的抗弓形虫活性[7]。在农业领域,曲酸可作为防治飞蝗的有机磷类杀虫剂的增效剂[8]。在食品方面,曲酸可保鲜蔬菜,提高食品的保藏品质[9]。虽然一些研究发现曲酸具有一定的致癌作用[10],但是在有效剂量浓度下曲酸的使用是安全的[1, 3]。随着研究的深入,曲酸的应用范围将会继续扩大。
生产曲酸的菌种多见于曲霉属和青霉属真菌,如Aspergillus oryzae、A.flavus、A.tamarii、Penicillium citrinum、P.griseofulvum、P.purpurogenum和P.rubrum等[11]。这些真菌的曲酸产量与其发酵工艺密切相关,发酵工艺的优化是提高曲酸产量的研究热点。目前,曲酸发酵工艺的优化主要包括碳源、氮源、矿物质元素、促进剂等培养基成分优化和发酵条件优化[12, 13]。在曲酸生产中,葡萄糖、蔗糖和淀粉通常用作碳源,蛋白胨和酵母膏则是常用的氮源。另外,部分农工副产品也可用作曲酸发酵的培养基成分,如豆渣、黄浆水、木薯淀粉、白薯粉淀粉酶水解液、柑橘皮渣、豆饼粉、鲣油等[14-16]。魏少鹏等[17]研究发现在蔗糖与葡萄糖组合作为碳源时,曲酸产量明显高于单一碳源,蛋白胨与酵母提取物等有机氮比无机氮更有利于曲酸产量的提高。而低浓度的甲醇、乙醇、氯丙醇等作为添加剂也能够提高曲酸产量[18]。
本研究从海洋沉积物中发现一株曲霉Aspergillus sp.GXIMD02003,其能够在大米培养基中产曲酸。为进一步提高该真菌的曲酸产量,本研究对海盐含量和发酵时间对曲酸产量的影响进行实验。曲酸生产在工业化生产和工艺研究中多采用液体培养基发酵,但其所需设备和原料成本较高,因此本研究使用大米固体培养基,旨在规避曲酸生产中添加原料复杂、成本高、生产过程烦琐的问题,简化生产过程,从而获得成本低廉的曲酸原料。
1 材料与方法 1.1 试剂与培养基曲酸对照品,广州分析测试中心科力技术开发公司生产;麦芽提取粉,广东环凯微生物科技有限公司生产;海盐,广东省盐业集团多品种盐股份有限公司生产;大米,贵州鸿穗农业开发有限公司生产;甲醇、乙醇、乙酸乙酯、丙酮分析级试剂,均购买于成都市科隆化学品有限公司;甲酸(分析纯)和磷酸(分析纯),天津市科密欧化学试剂有限公司生产;磷酸二氢钾(分析纯),广东光华科技股份有限公司生产;甲醇(色谱纯),上海星可高纯溶剂有限公司生产。
种子培养基:称取海盐3 g、麦芽提取粉1.5 g于500 mL锥形瓶中,加入100 mL水和适量玻璃珠,摇匀,在121℃下高压灭菌20 min,冷却后备用。
大米固体培养基:称取75 g大米放入500 mL锥形瓶中,加入75 mL一定浓度的海盐水,摇匀,在121℃下高压灭菌20 min,冷却后备用。
1.2 仪器LC-2030C 3D Plus型高效液相色谱仪(日本岛津),N-1300V-WB型小型旋转蒸发仪(上海爱朗仪器有限公司),ZWYR-2102型恒温培养振荡器(上海智诚分析仪器制造有限公司),HR1500-IIB2型生物安全柜(青岛海尔生物医疗股份有限公司),MLS-3781L-PC型高压灭菌锅(SANYO Techno Solutions Tottori Co, Ltd.),SB-5200D型超声波清洗器(宁波新芝生物科技股份有限公司)。
1.3 菌种菌株分离于广西涠洲岛的海泥,经过ITS rDNA基因序列分析,鉴定该菌株为真菌Aspergillus sp.,保藏于广西中医药大学海洋药物研究院,编号为GXIMD02003。
1.4 方法 1.4.1 种子液制备在生物安全柜中将平板培养基的菌种接种于种子培养基中,在25℃、180 r/min下培养72 h作为种子液。
1.4.2 曲酸发酵条件考察(1) 最佳盐度
配制盐度分别为0、1%、2%、3%、5%、7%的海盐水溶液,按1.1节方法制备大米固体培养基,分别接入种子液5 mL,25℃静置发酵30 d,每个浓度取3份样品测定曲酸含量,取平均值。
(2) 最佳发酵时间
使用最佳盐度制备的大米固体培养基,接入种子液5 mL进行发酵培养,分别在第15,20,25,30,35,40天取两份样品,检测曲酸含量,计算平均值。
1.4.3 发酵条件验证在最佳盐度和发酵时间条件下发酵,高效液相色谱法(HPLC)检测曲酸含量,计算曲酸产量,从而验证研究结果的可重现性。
1.4.4 曲酸的提取与检测(1) 曲酸标准溶液配制
称取曲酸对照品5 mg,精密称量,超纯水溶解后,转移至10 mL容量瓶中,定容至刻度线。配置成0.54 mg/mL曲酸标准储备溶液。在使用时,用超纯水稀释至所需浓度,分别以质量浓度为8.44,16.88,33.75,67.5,135 mg/L的曲酸标准溶液进样,记录色谱图。以色谱峰面积(Y)对样品溶液的质量浓度(X,mg/L)绘制标准曲线,所得回归方程为Y=24389.37X+2678.94,相关系数R=0.999 99 (R2=1),结果说明在8.44-135 mg/L内线性关系良好。
(2) 曲酸的提取
曲酸的提取方法基于文献[19, 20]并作适当调整。由于曲酸易溶于水,因此通常采用水作为曲酸的提取溶剂。为确定最佳的提取参数,本研究考察液料比和超声提取次数对曲酸提取的影响。其提取方法简述如下:将发酵后的大米培养基搅碎,称取适量样品,加入一定比例的蒸馏水超声提取,过滤,合并过滤液; 回收溶剂后得到样品,加入超纯水溶解,定容于10 mL容量瓶中备用。
(3) 曲酸的高效液相色谱法检测
曲酸检测参照文献[19, 20]已报道的方法。色谱柱:Inertsil ODS-SP (5 μm,150 mm×4.6 mm);流动相:2‰磷酸水溶液(A)/甲醇(B)(95:5)等度洗脱;流速:1.2 mL/min;柱温:30℃;检测波长:269 nm;进样体积:10 μL。
2 结果与分析 2.1 曲酸提取条件的确定随着提取溶剂体积的增加,大米培养基中曲酸的提取量均有不同程度提高。方差分析显示,当液料比达到15:1后,继续增大液料比,曲酸提取率没有显著提高,即液料比15:1和20:1的提取结果无显著性差异,因此选择液料比为15:1(图 1a)。另外,随着超声提取次数的增加,曲酸提取量有所增加,超声提取1次、2次、3次所得的曲酸含量皆存在显著性差异,超声提取4次与超声提取3次无显著性差异(图 1b)。因此,3次为最佳提取次数。根据优化的结果,确定液料比15:1,提取3次为曲酸的最佳提取方案。
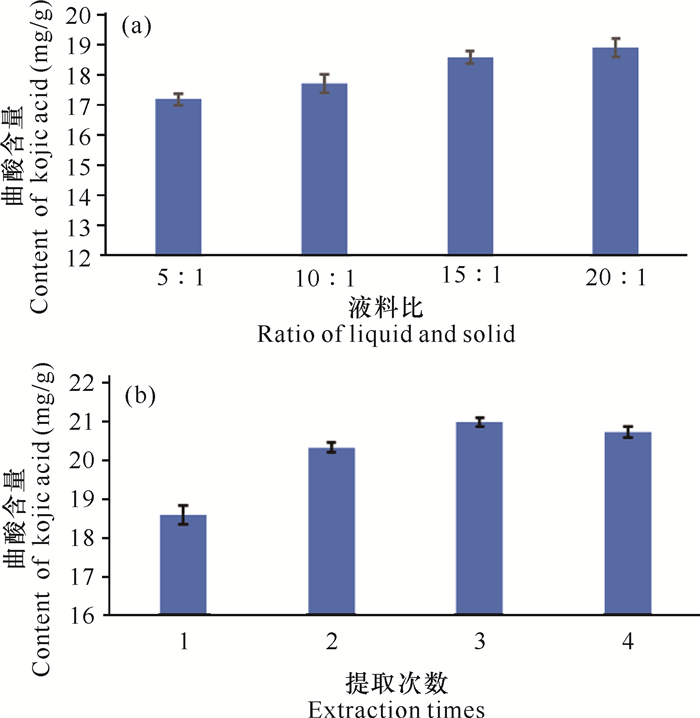
|
| 图 1 提取条件的考察 Fig. 1 Investigation of extraction condition |
2.2 盐度对曲酸产量的影响
在0、1%、2%、3%、5%、7%盐度下,每克大米产生的曲酸量分别是11.9,23.6,24.3,21.7,19.9,19.8 mg (图 2)。结果表明,随盐度的增加,曲酸产量增高,在2%海盐的培养基中曲酸产量最高;当海盐含量大于2%后,曲酸产量呈稍微下降趋势。但总体而言,含有海盐的大米培养基所产生的曲酸量高于不含海盐的大米培养基。此外,海盐含量影响Aspergillus sp.代谢产物的复杂性,如图 3所示,不含海盐和1%海盐培养基发酵产物的化学成分复杂,非曲酸成分占比较高;而当盐度达到2%时,代谢产物成分简单,主要为曲酸。
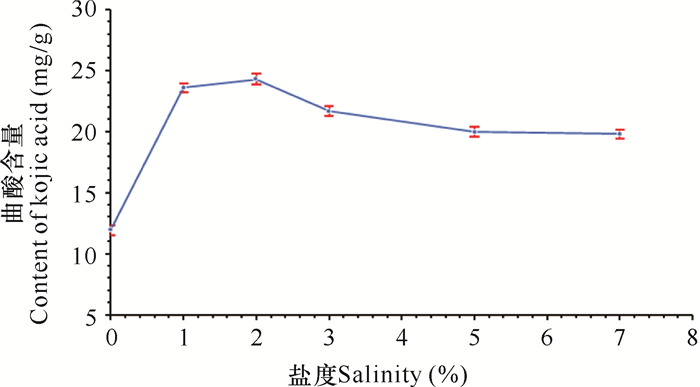
|
| 图 2 不同盐度条件下的曲酸产量 Fig. 2 The yield of kojic acid under different salinity conditions |
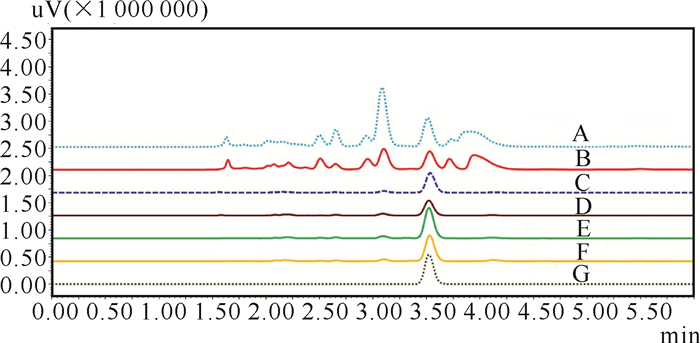
|
| A-F:浓度依次为0、1%、2%、3%、5%、7%的海盐培养基, G:曲酸对照品 A-F:Sea salt medium with concentrations of 0, 1%, 2%, 3%, 5% and 7%;G:Kojic acid reference substance 图 3 不同盐度条件下的发酵产物HPLC图 Fig. 3 HPLC chromatogram of fermentation products under different salinity conditions |
2.3 发酵时间对曲酸产量的影响
在15, 20, 25, 30, 35, 40 d时的曲酸产量分别为10.1, 13.8, 17.0, 25.8, 26.5, 26.2 mg/g (图 4)。随发酵时间增加,曲酸的产量越来越高,但30 d后曲酸的产量增幅不大。因此,曲酸的最佳发酵时间为30 d。
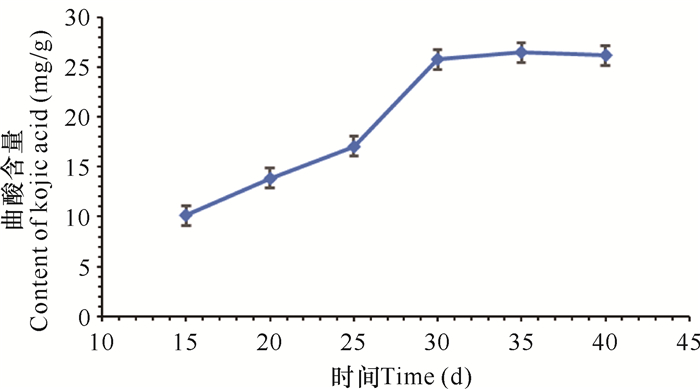
|
| 图 4 不同发酵时间的曲酸产量 Fig. 4 The yield of kojic acid in different fermentation time |
2.4 最佳发酵条件下的曲酸产量
为进一步验证最佳条件下的曲酸产量,采用2%海盐的大米培养基发酵30 d,HPLC检测曲酸含量,测得最佳发酵条件下1 000 g大米培养基发酵产生的曲酸含量为24.2 mg/g (图 5)。
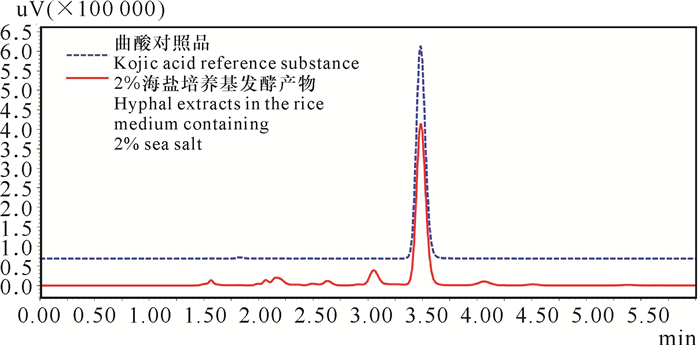
|
| 图 5 最佳发酵条件下的发酵产物HPLC图 Fig. 5 HPLC chromatogram of fermentation extracts under optimal fermentation conditions |
3 讨论
海盐的主要成分是氯化钠,氯化钠对维持细胞的正常形态有重要的作用。当盐度提高到一定浓度后,可能使菌体处于渗透压相对较高的状态而影响真菌的生长或刺激真菌自身代谢的酶活性,从而影响代谢产物的变化。与空白组相比,含海盐大米培养基的曲酸产量均有明显的增加。另外,海盐的含量影响Aspergillus sp.代谢产物的复杂性(图 3),Ola等[21]使用不含盐的大米培养基培养Aspergillus sp.,其代谢产物中主要含曲酸,与本研究结果不一致,其原因可能是文献的菌种Aspergillus sp.是从植物中分离出,其生长条件不需要盐来维持菌体渗透压便可产生曲酸。
真菌的发酵过程可分为真菌生长阶段与代谢产物积累阶段。在发酵的前期阶段,大米培养基养分充足,真菌处于生长繁殖时期,代谢产物积累相对较少,曲酸含量相对较低。随着真菌大量繁殖,其代谢产物不断积累,曲酸含量明显增加,Aspergillus sp.GXIMD02003的曲酸产量在发酵30 d达到最高,为1 000 g大米培养基发酵产生24.2 g曲酸。李天笑等[22]发明专利比较米曲霉(A.oryzae ATCC42129)、杂色曲霉菌(A.versicolor ATCC28286)以及黄曲霉(A.flavus)、烟曲霉(A.fumigatus)、伦氏曲霉(A.lentulus)在不含盐的大米固体培养基发酵的曲酸产量,A.versicolor ATCC28286的产量最高,为1 000 g大米培养基发酵产6.2 g曲酸[22]。本研究采用含盐大米固体培养基发酵Aspergillus sp.GXIMD02003,所得曲酸产量高于其报道的杂色曲霉菌(A.versicolor ATCC28286)和黄曲霉(A.flavus)的曲酸产量,分别为3.9倍和22.9倍。
4 结论曲酸在生活中被广泛应用,市场需求不断增加,如何提高曲酸产量备受学者们关注,而优化真菌发酵工艺是提高曲酸产量的一种重要方法。本研究发现海洋来源真菌Aspergillus sp.GXIMD02003能够产生曲酸,其在含2%海盐的大米培养基发酵30 d时曲酸产量相对最高。该研究结果说明海洋来源真菌Aspergillus sp.GXIMD02003可以作为曲酸的生产菌株,海盐影响该菌株的曲酸代谢。此外,本研究所提供发酵工艺所需仪器设备简单、生产成本低、操作简单,利于工业化生产。
| [1] |
BURDOCK G A, SONI M G, CARABIN I G. Evaluation of health aspects of kojic acid in food[J]. Regulatory Toxicology and Pharmacology, 2001, 33(1): 80-101. DOI:10.1006/rtph.2000.1442 |
| [2] |
KIM J H, CAMPBELL B C, CHAN K L, et al. Synergism of antifungal activity between mitochondrial respiration inhibitors and kojic acid[J]. Molecules, 2013, 18(2): 1564-1581. DOI:10.3390/molecules18021564 |
| [3] |
SAEEDI M, ESLAMIFAR M, KHEZRI K. Kojic acid applications in cosmetic and pharmaceutical preparations[J]. Biomedicine and Pharmacotherapy, 2019, 110: 582-593. DOI:10.1016/j.biopha.2018.12.006 |
| [4] |
WEI X, LUO D, YAN Y, et al. Kojic acid inhibits senescence of human corneal endothelial cells via NF-κB and p21 signaling pathways[J]. Experimental Eye Research, 2019, 180: 174-183. DOI:10.1016/j.exer.2018.12.020 |
| [5] |
何晓玥, 刘栋华, 周燕华. 曲酸对巨噬细胞吞噬马尔尼菲蓝状菌的影响[J]. 中国人兽共患病学报, 2018, 34(7): 599-602, 612. DOI:10.3969/j.issn.1002-2694.2018.00.109 |
| [6] |
LIU D, WEI L, GUO T, et al. Detection of DOPA-Melanin in the dimorphic fungal pathogen Penicillium marneffei and its effect on macrophage phagocytosis in vitro[J]. PloS One, 2014, 9(3): e92610. DOI:10.1371/journal.pone.0092610 |
| [7] |
MONTAZERI M, EMAMI S, ASGARIAN-OMRAN H, et al. In vitro and in vivo evaluation of kojic acid against Toxoplasma gondii in experimental models of acute toxoplasmosis[J]. Experimental Parasitology, 2019, 200: 7-12. DOI:10.1016/j.exppara.2019.03.009 |
| [8] |
李一波, 曹广春, 贾苗, 等. 曲酸对飞蝗酚氧化酶以及其他生化酶活性的影响[J]. 环境昆虫学报, 2017, 39(3): 640-649. |
| [9] |
李庆鹏, 崔文慧, 郭芹, 等. 曲酸处理对鲜切西兰花品质及生理变化的影响[J]. 核农学报, 2014, 28(9): 1664-1668. |
| [10] |
BURNETT C L, BERGFELD W F, BELSITO D V, et al. Final report of the safety assessment of kojic acid as used in cosmetics[J]. International Journal of Toxicology, 2010, 29(6_suppl): 244s-273s. DOI:10.1177/1091581810385956 |
| [11] |
CHIB S, DOGRA A, NANDI U, et al. Consistent production of kojic acid from Aspergillus sojae SSC-3 isolated from rice husk[J]. Molecular Biology Reports, 2019, 46(6): 5995-6002. DOI:10.1007/s11033-019-05035-8 |
| [12] |
SANO M. Aspergillus oryzae nrtA affects kojic acid production[J]. Bioscience, Biotechnology, and Biochemistry, 2016, 80(9): 1776-1780. DOI:10.1080/09168451.2016.1176517 |
| [13] |
BENTLEY R. From miso, saké and shoyu to cosmetics:A century of science for kojic acid[J]. Natural Products Reports, 2006, 23(6): 1046-1062. |
| [14] |
EL-KADY I A, ZOHRI A N A, HAMED S R. Kojic acid production from agro-industrial by-products using fungi[J]. Biotechnology Research International, 2014, 2014: 642385. |
| [15] |
YAN S, TANG H, WANG S, et al. Improvement of kojic acid production in Aspergillus oryzae B008 mutant strain and its uses in fermentation of concentrated corn stalk hydrolysate[J]. Bioprocess and Biosystems Engineering, 2014, 37(6): 1095-1103. DOI:10.1007/s00449-013-1081-5 |
| [16] |
刘容, 孙卫东, 李军委. 米曲霉发酵蔗糖生产曲酸的培养基优化[J]. 轻工科技, 2016, 22(10): 5-7, 18. |
| [17] |
魏少鹏, 徐楠, 姬志勤. Aspergillus flavus F52菌株鉴定及不同碳源对曲酸产量的影响[J]. 微生物学报, 2014, 54(10): 1155-1160. |
| [18] |
曾柏全, 解西玉, 周小芹. 乙醇对米曲霉发酵产曲酸的影响[J]. 中国食品学报, 2010, 10(6): 127-131. DOI:10.3969/j.issn.1009-7848.2010.06.021 |
| [19] |
田富饶, 王旭强, 孙文闪, 等. 高效液相色谱法测定化妆品中曲酸[J]. 理化检验:化学分册, 2012, 48(8): 983-984. |
| [20] |
顾慧莹, 张颖, 赵丽莉. 高效液相色谱法测定面粉中的曲酸[J]. 农业机械, 2013, 56(9): 65-66. |
| [21] |
OLA A R B, METBOKI G, LAY C S, et al. Single production of kojic acid by Aspergillus flavus and the revision of flufuran[J]. Molecules, 2019, 24(22): 4200. DOI:10.3390/molecules24224200 |
| [22] |
李天笑, 贾学伟, 王颖, 等.杂色曲霉菌株在发酵生产曲酸中应用: CN 110218750 A[P].2019-09-10.
|



