抗生素耐药性是全球范围内普遍存在的公共卫生问题,临床上β-内酰胺类、大环内酯类和氨基糖苷类等抗生素的耐药性问题日益严重,随着多重耐药“超级细菌”的出现,抗生素耐药性问题受到广泛关注[1-3]。耐甲氧西林金黄色葡菌球菌(MRSA)自1961年在英国首次被发现以来,以惊人的速度在世界范围内蔓延。目前,MRSA是引起医院感染的重要病原菌之一,对临床多种抗生素产生严重的耐药性,其感染人数已超过艾滋病、结核病和病毒性肝炎患病人数, 是患者延长住院时间和增加医疗费用的重要原因[4-6]。中国是抗生素生产和使用大国,由抗生素滥用导致因耐药菌感染而引起的临床死亡病例日益增多,挖掘新型抗生素迫在眉睫[7]。海洋占地球表面积的71%,具有广袤的地理空间及特殊的生态环境,孕育着丰富的特色海洋生物资源。作为海洋生物的重要组成部分,海洋微生物长期栖息在高压、高盐、高pH值等特殊生态环境,具有独特的生理代谢机制[8],是新颖复杂活性天然产物的重要来源[9],为新型抗生素的发现提供化学实体[10]。
海洋真菌是海洋微生物的重要组成部分,其来源广泛,可以从海洋动植物(含红树林)、海水及海洋沉积物等载体中分离得到,是近年来海洋天然产物研究的热点[11]。海洋真菌次级代谢产物具有化学多样性,包括生物碱、多肽、聚酮、萜类、甾体等[12],是抗肿瘤、抗感染等活性分子的重要来源[13, 14]。
广西北部湾地处热带与亚热带地区,其中涠洲岛珊瑚礁区孕育着丰富独特的海洋生物资源。这些丰富多样的海洋生物共附生微生物与宿主在长期进化过程中产生化学防御物质,而这些化学防御物质往往具有新颖复杂的化学结构及广谱显著的生物活性。虽然广西涠洲岛珊瑚礁区海洋微生物资源丰富,但是关于其海洋微生物活性天然产物的研究起步较晚[15]。基于此,本研究从广西涠洲岛珊瑚礁区采集珊瑚、海绵和海藻等北部湾特色海洋生物样品,利用稀释分离法从其新鲜组织中初步分离纯化菌株,采用现代谱学分析技术及抗MRSA活性进一步筛选,从而得到代谢产物丰富且具潜在抗菌活性的菌株,为发现海洋真菌来源新型抗生素奠定基础。
1 材料与方法 1.1 材料 1.1.1 仪器与试剂EYELAN-1001型旋转蒸发仪(上海爱郎仪器有限公司),SHZ-CB型循环水真空泵(巩义市予华仪器有限公司),KQ-250DB型超声仪(巩义市予华仪器有限公司),立式自动电热压力蒸汽灭菌锅(合肥华泰医疗器械有限公司),薄层硅胶板(烟台江友硅胶开发有限公司),Agilent 1260型高效液相色谱仪(安捷伦公司),Applied Biosystems PCR仪(赛默飞世尔科技公司),麦芽提取粉(广东环凯微生物科技有限公司)。海盐(广州海利水产有限公司),提取分析所用试剂乙酸乙酯、甲醇等均为化学纯(广州化学试剂厂),液相色谱用乙腈和甲醇均为色谱纯(美国Merck公司)。
1.1.2 培养基真菌分离MB培养基:麦芽提取粉15 g,琼脂粉15 g,海盐10 g,氯霉素0.2 g,蒸馏水1 L,调节pH值为7.4-7.8,于121℃下高压蒸汽灭菌30 min,待温度降至60℃左右,于超净工作台倒平板,冷却后待用。
MB液体培养基:麦芽提取粉1.5 g,海盐2 g,蒸馏水100 mL,调节pH值为7.4-7.8,用橡胶塞封口,于121℃下高压蒸汽灭菌30 min,冷却后待用。
大米培养基:大米50 g,海盐1.5 g,蒸馏水75 mL,于121℃下高压蒸汽灭菌30 min,冷却后待用。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,琼脂粉18 g,海盐10 g,蒸馏水1 L,调节pH值为7.4-7.8,于121℃下高压蒸汽灭菌30 min,待温度降至60℃左右,于超净工作台倒平板,冷却后待用。
1.2 方法 1.2.1 海洋真菌的分离鉴定采集广西涠洲岛珊瑚礁区的叶状蔷薇珊瑚(Montipora foliosa)、伴绵藻(Ceratodictyon spongiosum)和巢沙菜(Hypnea pannosa)等海洋生物样品(图 1)。将上述海洋生物新鲜组织用清水洗净并剪断成长度为2—3 mm的碎片,用无菌水漂洗3次后,分别置于盛有无菌海水的125 mL三角瓶中,在摇床上振荡10 min (120 r/min),即成备用菌悬液,然后用无菌水依次稀释,取合适梯度浓度的菌悬液涂布于MB平板上,每个稀释度重复3次,置于26-28℃恒温箱中培养3 d,待菌落长出后,挑取形态、色泽、大小不同的单菌落在MB平板上重新培养纯化。

|
| 图 1 涠洲岛珊瑚礁区采集的珊瑚、海绵和海藻样品 Fig. 1 The coral, sponge, and algae samples collected from the Weizhou Island coral reef |
采用分子生物学鉴定技术[16],根据内转录间隔区(ITS)序列和系统发育树分析对部分菌株进行鉴定。用无菌牙签挑取少量真菌菌丝体,置于1.5 mL离心管中,微波法提取真菌基因组DNA[17]。采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCG-G-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增分离菌株的rDNA ITS区。PCR反应体系(25 μL)如下:模板DNA 1 μL,引物(20 μmol/L)各0.5 μL,Premix Taq引物酶12.5 μL,ddH2O补足至25 μL。PCR扩增程序如下:94℃ 3 min;94℃ 50 s,52℃ 1 min,72℃ 50 s,35个循环;72℃ 10 min。扩增产物用1%琼脂糖凝胶电泳检测,基因测序委托上海美吉生物医药科技有限公司完成。测序结果在GenBank数据库中进行BLAST分析,检索相似性序列,初步鉴定菌株的种属。
1.2.2 海洋真菌的小量发酵及提取浓缩对分离得到的单一菌株采用大米培养基进行小量发酵。同时,利用500 mL锥形瓶准备MB液体培养基,灭菌后,将菌株接种至该培养基中,然后于28℃、180 r/min条件下培养2 d,即为种子液。在超净工作台中将种子液接种至已灭菌的大米固体培养基中(4%接种量),于室温静止发酵30 d。观察菌株生长状态,发酵结束后向大米培养基发酵产物中加入等体积乙酸乙酯,捣碎,超声提取20 min。减压过滤后,利用旋转蒸发仪浓缩滤液,滤渣继续用乙酸乙酯反复提取,至滤液颜色变浅,然后浓缩合并滤液获得菌株粗提物。
1.2.3 菌体提取物的色谱分析将菌株粗提物用甲醇溶解配成1 mg/mL的溶液,以毛细玻璃管吸取5-10 μL,点于硅胶G254薄层板上,挥干甲醇,分别采用二氯甲烷-甲醇(V/V,20:1)和石油醚-乙酸乙酯(V/V,8:1)作为展开剂进行展开,置于紫外光灯(254 nm)下以及碘缸中显色观察。使用0.22 μm滤膜过滤1 mg/mL菌株粗提物溶液,然后采用HPLC-DAD指纹图谱分析。色谱条件为色谱柱:YMC-Pack ODS-A, 250×4.6 mm LD., S-5 μm, 12 nm;流动相:乙腈(95%-100%)/纯水,梯度洗脱60 min;检测波长:200-500 nm;柱温:35℃;流速:1 mL/min;进样量:20 μL;采用二极管阵列检测器(DAD)检测。
1.2.4 菌株提取物的MRSA抑制活性测试采用滤纸片琼脂扩散法筛选抑菌活性化合物[18],将待测菌株粗提物配成浓度为0.10 mg/mL的甲醇溶液,阳性对照氨苄西林配成0.64 mg/mL的甲醇溶液,甲醇溶液作为阴性对照。分别用移液枪吸取10 μL待测样品溶液于直径为6 mm的无菌滤纸片上,待甲醇挥干后,将载样滤纸片贴于已涂布100 μL×106 CFU/mL MRSA菌悬液的LB培养基上,25℃条件下倒置培养24 h,每隔12 h观察是否产生抑菌圈。以ds≥1/2 dp(ds:粗提物样品的抑菌圈直径,dp:阳性药的抑菌圈直径)的粗提物样品对应的菌株为具有抗菌活性的菌株。
2 结果与分析 2.1 菌株鉴定结果采用稀释分离法从涠洲岛珊瑚礁区海洋生物中共分离得到40株真菌,其中从叶状蔷薇珊瑚中分离出10株(MF01—MF10),从巢沙菜中分离出22株(HP01—HP22),从伴绵藻中分离出8株(CS01-CS08)。通过分子生物学技术对代谢产物丰富、活性较好的部分潜力菌株进行物种鉴定(表 1),发现这些菌株主要为曲霉属Aspergillus(占鉴定菌株中38.1%)和木霉属Trichoderma(占鉴定菌株中23.8%)。
| 菌株 Strains |
物种鉴定 Species identification |
ITS序列相似度 ITS sequence similarity (%) |
| MF02 | Aspergillus terreus | 99.84 |
| MF04, MF05 | Chaetomium globosum | 100.00 |
| MF06 | Aspergillus sp. | 100.00 |
| MF08, HP18, HP20 | A.flavus | 100.00 |
| HP01 | Trichoderma asperellum | 100.00 |
| HP03, CS05 | T.longibrachiatum | 100.00 |
| HP08 | Fusarium equiseti | 100.00 |
| HP09 | A.aculeatus | 100.00 |
| HP12 | A.ochraceopetaliformis | 100.00 |
| HP13 | F.solani | 100.00 |
| HP14 | Talaromyces verruculosus | 99.83 |
| HP16 | Paraconiothyrium sp. | 99.83 |
| HP17 | A.unguis | 100.00 |
| CS01, CS08 | Trichoderma sp. | 99.84 |
| CS06 | Myrothecium inundatum | 99.83 |
| CS07 | P.cyclothyrioides | 100.00 |
2.2 色谱分析结果
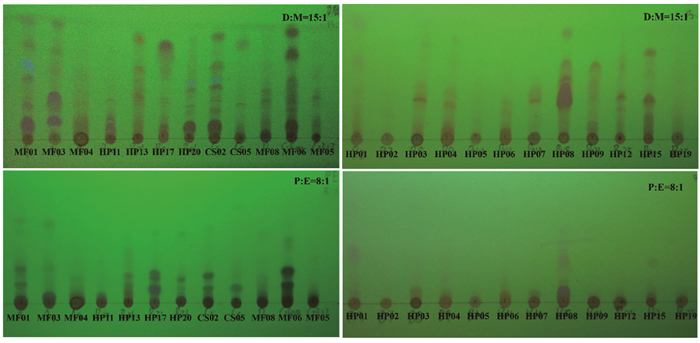
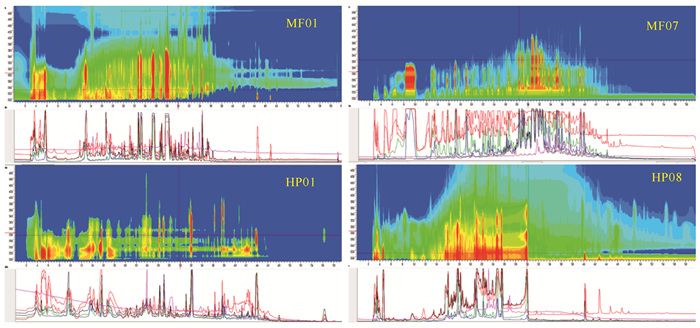
薄层色谱(TLC)分析发现,菌株MF01、MF03、MF06、HP08、HP13、HP17、CS02的大米培养基发酵产物显色斑点较多,说明其代谢产物丰富(图 2)。高效液相色谱(HPLC-DAD)分析结果表明不同菌株提取物的谱学特征具有显著差异,其中菌株MF01、MF03、MF07、HP01、HP04、HP08、HP16、HP17、HP22、CS02的大米培养基发酵产物中代谢产物较为丰富(图 3)。以上TLC和HPLC-DAD分析结果基本一致。
|
| D:二氯甲烷Dichloromethane;M:甲醇Methanol;P:石油醚Petroleum ether;E:乙酸乙酯Ethyl acetate 图 2 部分菌株提取物的TLC谱图(254 nm紫外观察) Fig. 2 TLC spectra of some strains extracts (254 nm UV observation) |
|
| 图 3 菌株MF01、MF07、HP01和HP08大米培养基发酵产物的HPLC-DAD指纹图谱 Fig. 3 HPLC-DAD finger prints of the fermented products of strains MF01, MF07, HP01, and HP08 based on solid rice fermentation |
2.3 抗菌活性筛选结果
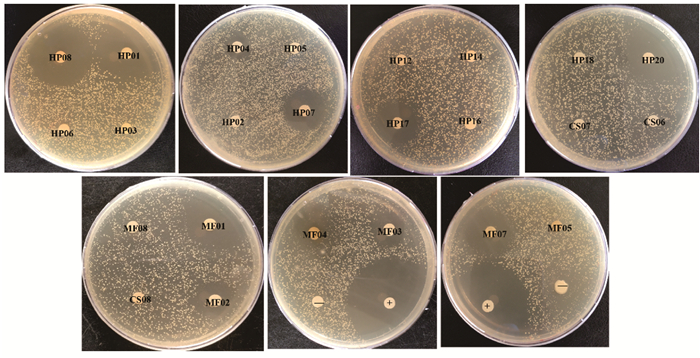
基于滤纸片琼脂扩散法对40株真菌的大米培养基发酵产物进行抗MRSA活性初步筛选,结果显示菌株MF01、MF07、HP01、HP07、HP08、HP17和HP20的大米培养基发酵产物具有一定的抗MRSA活性(表 2和图 4)。
| 菌株 Strains |
抑菌圈直径 Diameter of bacteriostatic circle (mm) |
| 空白对照Blank control | — |
| 阳性对照Positive control | 40 |
| A.terreus MF01 | 20 |
| C.globosum MF04 | 18 |
| A.flavus MF07 | 20 |
| T.asperellum HP01 | 20 |
| T.longibrachiatum HP07 | 20 |
| F.equiseti HP08 | 24 |
| A.unguis HP17 | 22 |
| A.flavus HP20 | 20 |
| Others | — |
| 注:表中“—”表示没有抗菌活性 Note:"—" means no antimicrobial activity | |
|
| 图 4 菌株大米培养基发酵产物的MRSA抑制活性 Fig. 4 MRSA inhibitory activity of the fermented products of the strains based on solid rice fermentation |
3 结论
本研究采用稀释分离法从广西涠洲岛珊瑚礁区叶状蔷薇珊瑚、伴绵藻和巢沙菜的新鲜组织中,分离纯化获得40株真菌,其中巢沙菜的共附生真菌最为丰富。基于分子生物学鉴定方法对菌株进行物种鉴定,发现这些真菌以曲霉属和木霉属为主。综合运用薄层层析色谱和HPLC-DAD分析菌株大米培养基发酵产物中的化学多样性,并结合基于滤纸片琼脂扩散法的MRSA抑制活性初步筛选研究发现, 菌株A.terreus MF01、A.flavus MF07、T.asperellum HP01、F.equiseti HP08和A.unguis HP17不仅具有丰富多样的次生代谢产物,还具有显著的MRSA抑制活性,后续将开展活性代谢产物的发掘研究,为发现新型抗MRSA活性分子奠定理论基础。
| [1] |
刘胤岐, 孙强, 阴佳, 等. 中国抗生素耐药性治理的政策演变及启示[J]. 中国卫生政策研究, 2019, 12(5): 44-48. |
| [2] |
汤雨晴, 叶倩, 郑维义. 抗生素类药物的研究现状和进展[J]. 国外医药:抗生素分册, 2019, 40(4): 295-301. |
| [3] |
王艺晖, 杨慧君, 李晓娜, 等. 青霉素结合蛋白与产β-内酰胺酶细菌耐药性的研究进展[J]. 畜牧与兽医, 2016, 48(11): 105-107. |
| [4] |
宋颢, 秦勇. 抗耐甲氧西林金葡菌(MRSA)天然产物研究进展[J]. 药学学报, 2016, 51(5): 698-709. |
| [5] |
王文灏, 曹银芳, 李慧君. 住院患者金黄色葡萄球菌感染分布及耐药性分析[J]. 中国医药导刊, 2015, 17(12): 1280-1281. |
| [6] |
王继仿, 潘爱平, 顾月芹, 等. 耐甲氧西林金葡菌感染患者42例分布特征及临床分析[J]. 临床合理用药杂志, 2017, 10(20): 92-93. |
| [7] |
JINKS T, LEE N, SHARLAND M, et al. A time for action:Antimicrobial resistance needs global response[J]. Bull World Health Organ, 2016, 94(8): 558-558A. DOI:10.2471/BLT.16.181743 |
| [8] |
张偲, 张长生, 田新朋, 等. 中国海洋微生物多样性研究[J]. 中国科学院院刊, 2010, 25(6): 651-658. DOI:10.3969/j.issn.1000-3045.2010.06.011 |
| [9] |
CARROLL A R, COPP B R, DAVIS R A, et al. Marine natural products[J]. Natural Product Reports, 2020, 37(2): 175-223. |
| [10] |
WIESE J, IMHOFF J F. Marine bacteria and fungi as promising source for new antibiotics[J]. Drug Deve-lopment Research, 2019, 80(1): 24-27. DOI:10.1002/ddr.21482 |
| [11] |
CARROLL A R, COPP B R, DAVIS R A, et al. Marine natural products[J]. Natural Product Reports, 2019, 36(1): 122-173. |
| [12] |
朱伟明, 王俊锋. 海洋真菌生物活性物质研究之管见[J]. 菌物学报, 2011, 30(2): 218-228. |
| [13] |
DESHMUKH S K, PRAKASH V, RANJAN N. Marine fungi:A source of potential anticancer compounds[J]. Frontiers in Microbiology, 2018, 8: 2536. DOI:10.3389/fmicb.2017.02536 |
| [14] |
DESHMUKH S K, GUPTA M K, PRAKASH V, et al. Mangrove-associated fungi:A novel source of potential anticancer compounds[J]. Journal of Fungi, 2018, 4(3): 101. |
| [15] |
于清武. 北部湾(广西海域)海洋微生物多样性研究现状与对策[J]. 南方农业学报, 2014, 45(12): 2293-2296. |
| [16] |
张玲, 张庆波, 陈玉婵, 等. 18株南海海洋真菌的初步鉴定及其发酵产物的细胞毒活性和抗菌活性筛选[J]. 热带海洋学报, 2013, 32(3): 47-51. |
| [17] |
潘力, 崔翠, 王斌. 一种用于PCR扩增的丝状真菌DNA快速提取方法[J]. 微生物学通报, 2010, 37(3): 450-453. |
| [18] |
陈春梅, 罗小卫, 李坤龙, 等. 一株海绵共附生真菌Fusarium equiseti SCSIO 41019的次级代谢产物及其抑菌活性研究[J]. 中国抗生素杂志, 2019, 44(9): 1035-1040. |



