2. 广西大学, 广西南海珊瑚礁研究重点实验室, 广西大学珊瑚礁研究中心, 广西南宁 530004;
3. 广西大学工程实践与训练中心, 广西南宁 530004
2. Coral Reef Research Center of China, Guangxi Laboratory on the Study of Coral Reefs in the South China Sea, Nanning, Guangxi, 530004, China;
3. Engineering Practice and Training Center, Guangxi University, Nanning, Guangxi, 530004, China
群体感应(Quorum Sensing, QS)是细菌根据自身细胞密度变化进行自我协调的一种群体行为[1]。QS调控机制与病原微生物的毒力和致病性密切相关。受QS调控的细菌,通过产生不同的信号分子如AHL、AI-2、CAI-1等,控制其不同的性状表达,如抗生素的合成、毒素的产生、生物膜成熟及生物发光等[2-5]。
近年来,珊瑚白化现象日益严重。导致珊瑚白化的主诱因有很多种,其中由各类致病菌引起的珊瑚疾病已成为世界三大珊瑚礁区白化的重要因素[6]。频繁发生的珊瑚疾病造成主要造礁物种突发性大范围死亡,严重减少礁区的生物多样性,对珊瑚礁生态系统产生不可控的甚至是难以逆转的生态破坏[7]。Weir-Brush等[8]发现溶藻弧菌(Vibrio alginolyticus)浓度与海水表温相关性良好,是引发珊瑚死亡,尤其是引起变形角珊瑚疾病的主要病原体。溶珊瑚弧菌(V.coralliilyticus)作为较新发现的珊瑚疾病病原体,也是近年来多种珊瑚的隐形杀手[9]。Bhedi等[10]研究表明,高温胁迫下黑带病菌大量繁殖并合成AHL,加速侵染健康珊瑚,导致珊瑚大范围白化。有研究发现,机会条件下部分珊瑚共附生细菌如溶藻弧菌、嗜水气单胞菌(Aeromonas hydrophila)、创伤弧菌(V.vuLnificus)等,利用QS信号因子改变珊瑚共附生微生物种群组成,打破珊瑚内稳定的结构,导致宿主珊瑚白化[11]。Papenfort等[2]发现致病弧菌霍乱弧菌(V.cholerae)和哈维氏弧菌(V.harveyi)受QS系统调控,通过分泌信号因子AI-2、CAI-1与膜受体结合,激活体内群体感应基因的表达。Certner等[12]对健康鹿角珊瑚(A.cervicornis)添加外源AHL信号分子,发现也会促使其白化。这些研究证据表明,珊瑚细菌性白化与寄生珊瑚的病原细菌群体感应密切相关,意味着致病菌的群体淬灭完全有可能降低甚至解除珊瑚患病的威胁。
群体淬灭(Quorum Quenching,QQ)指通过抑制致病菌的QS效应,阻断胞间“信息交流”,达到抵御致病菌感染的目的[13]。群体淬灭产生菌可通过降解病原菌信号因子,阻断细菌的信号交流,从而在不产生耐药性的情况下有效抑制毒力基因的表达,是新型环境友好型的病菌防治策略[14]。目前已发现多例群体淬灭现象,Dong等[4]在苏云金芽孢杆菌中克隆获得的AiiA基因编码的AHL内酯酶,能高效抑制具有QS效应的植物致病菌软腐欧文氏菌(Erwinia carotovora);Koch等[15]在布鲁氏菌(Brucella melitensis)中发现,酰基转移酶AibP在体外条件下能够降解自身产生的内生信号分子,并在巨噬细胞的侵染期间减少内生信号分子的积累;Chan等[16]从马来西亚雨林的生姜根围中分离出3株具有抑制群体感应效果的菌,其中两株通过自身产生的内酯水解酶产生广谱的AHL降解活性从而抑制群体感应,另一株则通过酰基转移酶改变AHL的结构实现群体感应的抑制。可见,干扰病原细菌间的QS效应有可能成为解决珊瑚白化的新方法。群体淬灭现象同样可以在珊瑚中实现,Meyer等[17]从珊瑚蓝细菌中分离得到一种抑制剂,该化合物能够结合珊瑚致病菌V.harveyi群体感应受体蛋白,产生群体淬灭,还能够使珊瑚共附生弧菌荧光淬灭。因此,挖掘具有群体淬灭活性的菌株,开展其对珊瑚共附生微生物中群体感应和群体淬灭介导的相互作用机制的研究,可为深入解析珊瑚共附生微生物抗病分子机制提供物质基础,也能为今后深入研究珊瑚礁生态系统的生物修复提供理论依据。
微生物界中常见的病原菌几乎都可以形成生物被膜,病原菌生物被膜的形成是造成宿主慢性感染的主要原因。溶珊瑚弧菌和溶藻弧菌为常见的珊瑚病原菌,广泛分布于海洋环境中,Cervino等[18]发现溶藻弧菌与其他弧菌协同作用可使健康的圆菊珊瑚(Montastrea spp.)感病,其中溶藻弧菌也常常被认为是鱼类、甲壳类和人类疾病的病原[19];而Kimes等[20]揭露溶珊瑚弧菌的毒力因子表达受温度调控,可在水生动物组织的表面形成生物被膜。可形成生物被膜的细菌对抗生素和宿主免疫防御机制的抗性较普通病原菌强[21],相比物理、化学方法,通过抑制病原菌的QS调控形成生物被膜的生物治疗方法解决珊瑚感病问题,具有环境友好、安全性高及可持续强等优势[22]。
三亚珊瑚岸礁是我国岸礁最为发育的地点之一,鹿回头岸段一直是我国开展珊瑚礁研究和保护管理的代表地区[23],该地区珊瑚及其共附生微生物物种丰富度高,是热带海洋中最突出的代表性生态系统之一[24]。虽然近年来鹿回头地区珊瑚面临着多重威胁,珊瑚覆盖率从以前的80%—90%下降到如今的21.83%,但已有相关研究表明,这种情况主要是人类活动影响和全球气候变化所导致的[25],而该地区极少有关于珊瑚疾病的研究及报道[7],由此推测,该地区可能存在群体淬灭活性菌。
紫色杆菌(Chromobacterium violaceum)是一类具QS效应的革兰氏阴性细菌,当自身细胞密度达到一定临界浓度时,会向环境释放信号分子C6-HSL与特定转录调节蛋白结合,调控紫色素相关基因的表达[26],产生紫色素用以指示QS作用的产生。目前作为一种简便、直观的QS抑制因子筛选模型[27],被广泛应用于各类细菌的QS研究中。本项目选取三亚鹿回头7类珊瑚样品为研究对象,以紫色杆菌为指示菌,筛选出具有较高群体淬灭活性的珊瑚共附生菌株,运用16S rDNA测序分析并结合GenBank数据库进行种属鉴定,研究其对海洋致病菌溶珊瑚弧菌和溶藻弧菌的生长、运动性和生物被膜生成的影响,为防治病原细菌群体感应引起的珊瑚白化提供新材料。
1 材料与方法 1.1 材料 1.1.1 样品从三亚市鹿回头半岛三亚湾(109°28′E, 18°13′N)采集覆盖度高的、具有代表性的珊瑚样品,包括鹿角珊瑚(Acropora austera)、鹿角杯型珊瑚(Pocillopora damicornis)、扁脑珊瑚(Platygyra sp.)、片状蔷薇(Turgescens sp.)、滨珊瑚(Porites sp.)、盾形陀螺(Scleractinla sp.)及角蜂巢(Favites sp.)等7类珊瑚。每类珊瑚采集3个样品,每个样品剪碎后装入10 mL海水,振荡仪振荡后,保存于4℃备用。
1.1.2 主要试剂胰蛋白胨粉末(LP0042)、酵母粉末、技术琼脂粉末(Agar Powder)购自广东环凯微生物科技有限公司;葡萄糖粉购自国药集团化学试剂有限公司;氯化钠、柠檬酸铁购自天津市大茂化学试剂厂;宿主弧菌溶珊瑚弧菌、溶藻弧菌购自国家海洋局第三研究所海洋微生物保藏中心;紫色杆菌CV12614购自美国微生物保藏中心;2×Taq Mastermix购自生工生物工程(上海)股份有限公司;Glycine、TRIS、SDS购自北京索莱宝科技有限公司;胶回收试剂盒、DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.1.3 培养基配制Marine Agar (MA)培养基(g/L):胰蛋白胨5.0,酵母提取粉1.0,葡萄糖0.5,柠檬酸铁0.1,海水定容,pH值为7.2—7.5。
MA固体培养基:在MA培养基的基础上,加入10.0 g/L琼脂,海水定容。
珊瑚内环境原位模拟培养基[28]:0.22 μm有机过滤膜过滤珊瑚组织匀浆,去除细菌,制备无细胞珊瑚组织液(CFCF)。以CFCF:MA固体培养基=1:10体积比例配制模拟珊瑚内环境的营养固体培养基。
2.0%琼脂固体培养基:琼脂20.0 g/L,海水定容。
Luria-Bertani (LB)培养基(g/L):胰蛋白胨5.0,酵母提取粉1.0,氯化钠10.0,双蒸水定容,pH值为7.4。
LB固体培养基:在LB培养基的基础上,加入10.0 g/L琼脂。
群体淬灭活性筛选培养基:融化的40℃ LB固体培养基200 mL,加入紫色杆菌CV12614发酵液200 μL混匀。
1.2 珊瑚共附生微生物的分离培养 1.2.1 菌体收集参考文献[28]的方法:称取1 g含骨骼、黏液及珊瑚组织的珊瑚样品碎块,同一种珊瑚样品称取3份,分别用无菌海水浸泡在15 mL收集管中,1 920 r/min转速下漩涡振动15 min,获得浓稠的珊瑚组织匀浆,放置在4℃冰箱内短时间保存。
1.2.2 原位模拟培养蔗糖密度梯度离心是将珊瑚组织匀浆中不同类属的微生物分层的有效方法,大大提高珊瑚共附生微生物的存活率,获得更多种类的可培微生物。参考文献[29]的蔗糖密度梯度离心方法:在1.5 mL EP管中依次加入0.3 mL 40%、30%、20%、10%梯度浓度的蔗糖溶液;移液枪取0.4 mL各珊瑚组织匀浆0.5 μm过滤膜过滤液,移入EP管溶液上层,低速离心;以0.4 mL为1个级分,用移液枪定量移取不同级分离心液至EP管,用无菌海水稀释至3个浓度(10-1、10-2、10-3);取200 μL稀释10-3倍后的不同级分菌液,在珊瑚内环境原位模拟固体培养基上涂布,常温培养24 h。
1.3 群体淬灭活性产生菌的筛选 1.3.1 单菌落分离纯化从1.2.2节培养的平板中挑出不同单菌落,在MA固体培养基平板上划线,纯化培养出单一菌落,再接种到10 mL MA液体培养基内,160 r/min 25℃条件下扩大培养。
1.3.2 群体淬灭活性菌株的筛选紫色杆菌CV12614具备显著的群体感应现象[27],共附生菌株会抑制紫色菌素的分泌,产生透明圈,具备该现象的菌株即为群体淬灭活性菌株。实验中考虑到紫色杆菌CV12614在液体培养基中难以把控存活周期及紫色菌素分泌量,故利用固体培养基对群体淬灭活性菌株进行筛选。
操作步骤:将群体淬灭活性筛选培养基划分16格打孔,取200 μL 1.3.1节分离培养的菌株发酵液置于孔内培养初筛,以产生透明抑菌圈为阳性菌株[26]。牛津杯均匀排布在2.0%琼脂固体培养基平板上,倒入群体淬灭活性筛选培养基,制成四孔双层群体淬灭活性验证平板。待平板凝固后,每个孔加入200 μL阳性菌株发酵液,30℃培养48 h,观察结果。
1.4 16S rDNA序列分析使用16S rDNA通用引物27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-TACGGGY-TACCTTGTATACGACTT-3′)对群体淬灭活性菌株的基因片段进行PCR扩增[28]。反应条件:95℃预变性5 min;94℃变性1 min,57℃退火1 min,72℃延伸1.5 min,共30个循环。琼脂糖凝胶电泳验证条带后, 将PCR产物送深圳华大基因股份有限公司进行基因测序,测定序列通过GenBank数据库进行比对鉴定。
1.5 菌株发酵和活性物质提取取群体淬灭活性菌株各100 μL置于10 mL MA培养基中,恒温过夜振荡培养至培养液的OD600为1,即得纯化培养后的菌株发酵液。发酵液于8 000 r/min离心5 min取上清液,用0.22 μm有机滤膜过滤,除菌保存,获得无菌阳性菌株的发酵液上清,即为含有群体淬灭活性物质的溶液。
1.6 群体淬灭活性物质对珊瑚病原菌V545和Z-14生长的影响以比浊法测定海洋病原菌生长曲线[30, 31]。微生物生长曲线是描述微生物生长状况的基本指标[32]。比浊法测定生长量的原理是以细菌悬浮液的生物量与悬浮液的混浊程度成正比为基础,利用紫外可见分光光度计测定OD600,间接推断样品中微生物总量[33]。
操作步骤:将病原菌V545和Z-14接种到MA液体培养基中,恒温过夜振荡培养至OD600为1,即为病原菌液。取2 mL无菌阳性菌株发酵液上清与10 mL MA液体培养基混合,接种1%病原菌液。以12 mL MA接种1%病原菌液为空白对照。25℃,160 r/min振荡培养,每隔一定时间测定OD600并记录。至菌株生长进入衰弱期时停止培养,以培养时间为横坐标,OD600值为纵坐标绘制生长曲线。
1.7 群体淬灭活性物质对珊瑚病原菌V545和Z-14运动性的影响弧菌具有极性鞭毛,可在液体环境中游动,并可在半固态表面上显示出运动性[34],本实验采用半固体培养基法分析病原菌运动性[35]。
操作步骤:将珊瑚病原菌V545和Z-14分别接种至MA培养基中,恒温过夜振荡培养至OD600为1。以MA液体培养基:菌液=100:1的比例稀释珊瑚病原菌发酵液,将稀释后的珊瑚病原菌发酵液与无菌阳性菌株发酵液上清按1:1的比例混合,取0.5 μL接种于LB固体培养基平板;将稀释后的珊瑚病原菌发酵液与MA液体培养基1:1混合,取0.5 μL作为空白对照,每株菌种平行点样3个;室温静置过夜培养,记录菌团直径(mm)。
1.8 群体淬灭活性物质对珊瑚病原菌V545和Z-14生物被膜生成的影响采用96孔微量板法[36]并参考文献[36-38]的实验方法进行一定改动。采用1.7节培养的珊瑚病原菌V545和Z-14,然后用MA/2液体培养基(浓度为MA液体培养基的一半)将病原菌发酵液稀释至OD600为0.05。取100 μL稀释后的病原菌发酵液和100 μL无菌阳性菌株发酵液上清混合,加入96孔聚苯乙烯微培养板,每孔200 μL。另外取100 μL稀释后的病原菌发酵液与100 μL MA培养基混合,作为空白对照,每孔200 μL。每组设置3个平行实验。
将微孔板室温放置24 h后,孔壁上附着一层厚度均匀的薄膜(生物被膜),小心除去培养液,以一级水浸洗微孔板,风干后用1%结晶紫染色20 min。待染色完全后,以一级水浸微孔洗板并风干,再加入200 μL无水乙醇充分溶解,用酶标仪测定OD570,取3个复孔均值。
2 结果与分析 2.1 珊瑚共附生菌株的分离与群体淬灭活性本研究通过蔗糖密度梯度离心法和原位模拟培养法,共从7类不同珊瑚的样品中分离出256株共附生菌种(未鉴定物种)。如图 1为蔗糖密度梯度离心法稀释样品后,在原位模拟环境下培养出的角珊瑚共附生菌菌落。

|
| 图 1 原位模拟培养平板 Fig. 1 In-situ simulation culture plate |
紫色杆菌CV12614具备显著的群体感应现象[2],本研究通过判断其紫色菌素的分泌,筛选出群体淬灭活性菌株。由图 2可见,鹿角珊瑚中分离培养出的共附生菌株周围产生透明圈,且仍可见密集无色的紫色杆菌菌落,说明该菌为具群体淬灭活性的阳性菌株。同样原理,从256株共附生菌种中初步筛选出20株具备潜在群体淬灭活性的菌株。
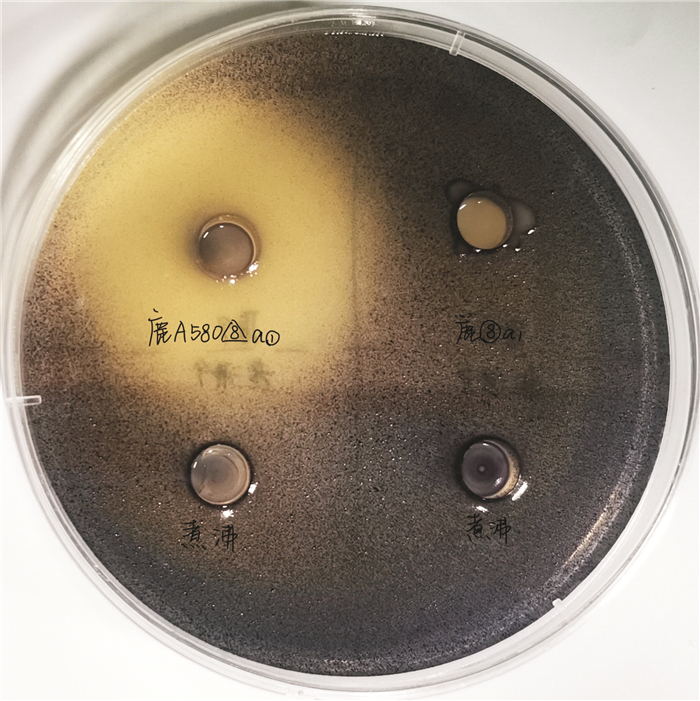
|
| 图 2 群体淬灭活性筛选平板 Fig. 2 Screening plate of quorum quenching activity |
2.2 16S rDNA序列检测结果
对筛选得到的20株群体淬灭活性菌株进行16S rDNA测序鉴定及BLAST同源性比对,编号依次为GXU-HJ-1—20。测序结果显示(表 1):GXU-HJ-1、GXU-HJ-2、GXU-HJ-3、GXU-HJ-4、GXU-HJ-7以及GXU-HJ-13—20等13个菌株属于Vibrio属;GXU-HJ-5、GXU-HJ-6、GXU-HJ-8、GXU-HJ-10、GXU-HJ-11等5个菌株属于Ralstonia属;GXU-HJ-9属于Bacillus属,GXU-HJ-12属于Sphingomonas属。
| 编号 No. |
相似菌株 Similar strains |
同源相似性 Homology similarity (%) |
| GXU-HJ-1 | Vibrio alginolyticus strain ATCC 17749 | 97.65 |
| GXU-HJ-2 | V.parahaemolyticus | 98.22 |
| GXU-HJ-3 | V.alginolyticus strain 5-19 | 98.78 |
| GXU-HJ-4 | V.alginolyticus strain ATCC 17749 |
98.08 |
| GXU-HJ-5 | Ralstonia pickettii strain CN11 | 98.26 |
| GXU-HJ-6 | R.pickettii | 98.16 |
| GXU-HJ-7 | V.alginolyticus strain 5-1 | 98.21 |
| GXU-HJ-8 | R.pickettii | 98.24 |
| GXU-HJ-9 | Bacillus sp.strain PS3 | 98.92 |
| GXU-HJ-10 | Ralstonia sp.strain SRS-181-F-2019 | 95.87 |
| GXU-HJ-11 | Ralstonia sp.strain SRS-181-F-2019 | 95.87 |
| GXU-HJ-12 | Sphingomonas echinoides strain DSM 1805 |
84.16 |
| GXU-HJ-13 | V.alginolyticus strain 6-8 | 98.36 |
| GXU-HJ-14 | V.alginolyticus strain NBRC 15630 |
98.27 |
| GXU-HJ-15 | V.harveyi strain 5-52 | 98.55 |
| GXU-HJ-16 | V.alginolyticus strain NBRC 15630 |
98.42 |
| GXU-HJ-17 | V.harveyi strain 5-52 | 97.12 |
| GXU-HJ-18 | V.alginolyticus strain ATCC 17749 |
97.06 |
| GXU-HJ-19 | Vibrio sp.strain 201707CJKOP-Y165 | 97.89 |
| GXU-HJ-20 | V.alginolyticus strain NBRC 15630 |
98.77 |
2.3 群体淬灭活性物质对病原菌V545和Z-14生长的影响
菌株GXU-HJ-5、GXU-HJ-8、GXU-HJ-10、GXU-HJ-12、GXU-HJ-18因浓度过低,无法获得有效的生长曲线,进而无法研究其对致病菌的运动情况及对生物被膜生长的影响,故不列入后续研究项目。通过生长曲线来判断菌株是否有抑制作用,并对有抑制作用的菌株平稳期OD600与空白对照平稳期OD600进行统计分析,使用方差检验(P值),检验抑制作用是否具有显著差异。结果显示(图 3,4):GXU-HJ-1、GXU-HJ-3、GXU-HJ-7、GXU-HJ-15对溶珊瑚弧菌V545有抑制作用;其中,GXU-HJ-15抑制作用较轻微,平稳期较空白对照浓度降低了0.53×107 cfu/mL;GXU-HJ-1、GXU-HJ-3、GXU-HJ-7抑制作用较明显,平稳期较空白对照浓度分别降低了0.87×107,0.82×107,2.00×107 cfu/mL (P < 0.05)。GXU-HJ-4、GXU-HJ-7、GXU-HJ-9、GXU-HJ-19对溶藻弧菌Z-14有抑制作用。其中GXU-HJ-19抑制作用较轻微,平稳期较空白对照浓度降低了0.73×107 cfu/mL,GXU-HJ-4、GXU-HJ-7、GXU-HJ-9抑制作用较明显,平稳期较空白对照浓度分别降低了1.63×107,1.83×107,1.39×107 cfu/mL (P < 0.05)。

|
| 图 3 群体淬灭活性菌株发酵液对V545生长的影响(P < 0.05) Fig. 3 Effect of quorum quenching active strain fermentation broth on the growth of V545 (P < 0.05) |
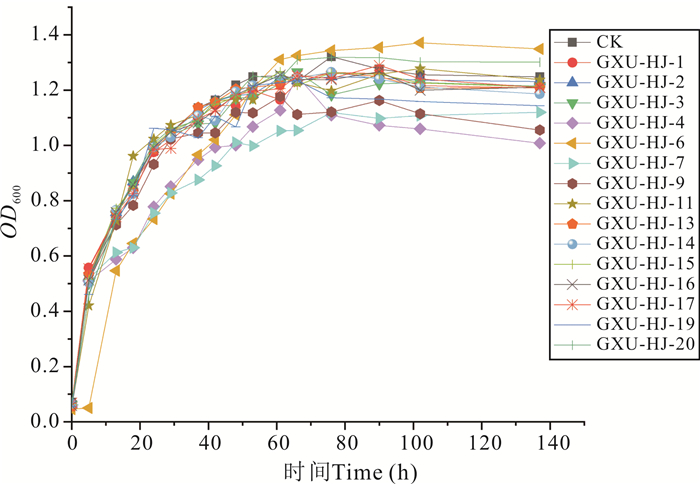
|
| 图 4 群体淬灭活性菌株发酵液对Z-14生长的影响(P < 0.05) Fig. 4 Effect of quorum quenching active strain fermentation broth on the growth of Z-14 (P < 0.05) |
2.4 病原菌V545和Z-14的运动情况
图 5显示,GXU-HJ-6对溶珊瑚弧菌V545运动性有轻微抑制作用,其运动范围直径较空白对照缩减0.2 mm。图 6显示,GXU-HJ-1、GXU-HJ-6、GXU-HJ-7、GXU-HJ-14、GXU-HJ-15、GXU-HJ-16、GXU-HJ-19、GXU-HJ-20对溶藻弧菌Z-14有抑制作用;其中GXU-HJ-1、GXU-HJ-6、GXU-HJ-14、GXU-HJ-19抑制作用较轻微,运动范围直径较空白对照分别缩减0.3,0.3,0.2,0.3 mm;GXU-HJ-7、GXU-HJ-15、GXU-HJ-16、GXU-HJ-20抑制作用较明显,运动范围直径较空白对照分别缩减3.0,0.7,0.5,0.5 mm。

|
| 图 5 群体淬灭活性菌株发酵液对V545运动性的影响 Fig. 5 Effect of quorum quenching active strain fermentation broth on the mobility of V545 |
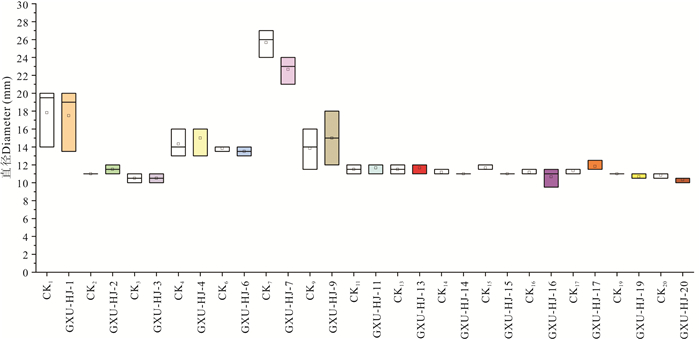
|
| 图 6 群体淬灭活性菌株发酵液对Z-14运动性的影响 Fig. 6 Effect of quorum quenching active strain fermentation broth on the mobility of Z-14 |
2.5 病原菌V545和Z-14生物被膜生长情况
如图 7所示,9株菌株对病原菌V545生物被膜形成具有抑制作用,在溶珊瑚弧菌V545生物被膜形成阶段,相同培养条件下,加入GXU-HJ-2、GXU-HJ-3、GXU-HJ-6、GXU-HJ-7、GXU-HJ-11、GXU-HJ-16、GXU-HJ-17、GXU-HJ-19、GXU-HJ-20的提取物后,其形成的生物膜吸光值均低于空白组,抑制率分别为(67.09±7.61)%、(84.18±3.27)%、(73.47±7.98)%、(30.26±1.82)%、(82.95±2.36)%、(72.68±4.70)%、(56.28±6.99)%、(20.29±11.97)%、(81.87±4.85)%(图 7a)。14株菌株对溶藻弧菌Z-14生物被膜形成具有抑制作用,在相同培养条件下,GXU-HJ-1、GXU-HJ-2、GXU-HJ-3、GXU-HJ-4、GXU-HJ-6、GXU-HJ-7、GXU-HJ-9、GXU-HJ-11、GXU-HJ-13、GXU-HJ-14、GXU-HJ-15、GXU-HJ-16、GXU-HJ-17、GXU-HJ-19对病原菌Z-14生物被膜生长的抑制率分别为(93.76±7.13)%、(93.30±5.00)%、(94.31±3.94)%、(95.93±8.62)%、(79.30±3.38)%、(94.51±2.64)%、(91.66±2.55)%、(51.20±1.52)%、(91.19±2.02)%、(93.77±1.76)%、(88.71±4.04)%、(89.62±6.05)%、(95.82±5.25)%、(14.83±0.53)%(图 7b),有11个菌株抑制率超过85%。GXU-HJ-2、GXU-HJ-3、GXU-HJ-6、GXU-HJ-11、GXU-HJ-16、GXU-HJ-17等6个菌株对两种病原菌的生物被膜形成均具有较强的抑制作用。
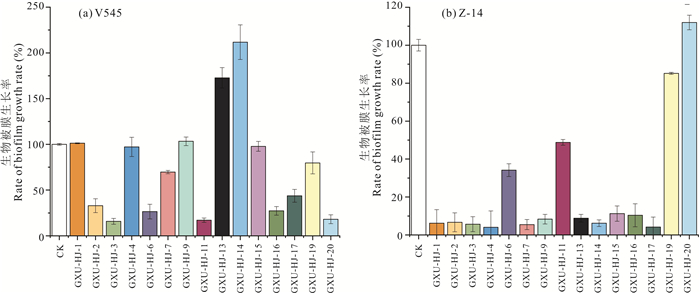
|
| 图 7 群体淬灭活性菌株发酵液对病原菌生物被膜生长的影响 Fig. 7 Effect of quorum quenching active strain fermentation broth on the biofilm growth of pathogenic bacteria |
3 讨论
本研究在珊瑚共附生微生物中成功筛选出具有群体淬灭活性,且能抑制珊瑚病原菌V545和Z-14生长、运动及生物膜形成的菌株,说明三亚鹿回头半岛三亚湾的珊瑚中具备大量未开发的群体淬灭活性菌种资源。受限于培养条件,本研究中部分菌种难以扩大培养,优化培养基后或有机会发掘更多群体淬灭活性菌株资源,进而在一定程度上改善珊瑚疾病防治现状。
经16S rDNA测序鉴定,本研究筛选出的群体淬灭活性菌株以弧菌为主,目前关于群体淬灭活性弧菌的研究较少,如田晓荣等[39]采用平板交互划线和高通量筛选的方法,从青岛近海沉积物生物被膜中分离得到83株共54种具有群体感应和群体淬灭活性的细菌,其中优势属为弧菌属和鲁杰氏菌属;于敏等[40]发现,纤维弧菌科海洋细菌中的AHL酰基转移酶与阿古菌素的AHL酰基转移酶具有同源性。由此推测,海洋中可能有更多具有群体淬灭活性的弧菌,仍需科研人员进一步深入挖掘。
群体淬灭活性微生物的应用现今正被一步步开发。抗生素的发现与滥用导致病原菌抗性广泛出现,而群体淬灭能减弱病原菌的致病毒性且不会产生相关抗药性,是近年来替代抗生素的最有希望策略[41]。如Nhan等[42]应用一种N-酰基高丝氨酸内酯降解菌富集培养物(ECs)取代抗生素来控制疾病,从而实现更可持续的水产养殖生产。以微生物繁殖代谢为主要原因的高蛋白食品腐败以及果蔬产品病害对食品流通及销售造成了巨大的障碍,阻碍相关产业的进一步发展,以群体淬灭活性菌作为微生物群体感应抑制剂成为食品工业中新的研究热点[43]。Vinoj等[44]发现地衣芽孢杆菌(B.licheniformis)DAHB1产生的AHL内酯酶AiiA能够抑制弧菌生物被膜的产生,同时显著降低虾的感染率和死亡率。本实验筛选出的多株群体淬灭活性菌株可为珊瑚疾病的防治提供一定的原材料,推动群体淬灭活性菌在珊瑚疾病防治中的研究,并给予生物被膜污染治理提供较新的研究路径和理论支持。
在后续研究中,应对以上20株活性菌株进行大量发酵,分离活性物质,探究其抑制紫色杆菌QS效应的有效成分及抑制机制;优化菌株的培养基配方及外界培养环境,将具备较高群体淬灭活性的菌株进行大批量发酵;提取纯化其活性物质,分析其化合物结构,并于珊瑚实验缸中进行初步抑制珊瑚白化的实验验证。相关成果可为国内珊瑚礁生态修复工作提供支持,为研发新药物抑制群体感应型细菌感染提供有力依据。
4 结论本研究选用蔗糖密度梯度离心法稀释珊瑚提取物,模拟珊瑚原生内环境配制原位模拟培养基,在三亚鹿回头半岛三亚湾珊瑚礁的7类珊瑚中分离出256株珊瑚共生菌。根据紫色杆菌严格受QS调控产紫色菌素的特性,利用紫色杆菌CV12614作模式菌,对珊瑚共生菌进行多次筛选培养,得到20株具群体淬灭活性的菌株。经16S rDNA测序鉴定,群体淬灭活性菌株大部分为弧菌属。结合比浊法以及半固体培养基法,分析群体淬灭活性菌株对两种珊瑚病原菌溶珊瑚弧菌V545和溶藻弧菌Z-14生长、运动的影响,结果显示,5株菌株对溶珊瑚弧菌V545的生长、运动有抑制作用,10株菌株对溶藻弧菌Z-14的生长、运动有抑制作用。扩展研究表明,9株菌株对溶珊瑚弧菌V545生物被膜形成具有抑制作用,14株菌株对溶藻弧菌Z-14生物被膜形成具有抑制作用。上述结果证实珊瑚共附生的群体淬灭活性菌对弧菌的生长、运动及生物被膜形成具有抑制作用。
| [1] |
FREEMAN J A, LILLEY B N, BASSLER B L. A genetic analysis of the functions of LuxN:A two-component hybrid sensor kinase that regulates quorum sensing in Vibrio harveyi[J]. Molecular Microbiology, 2000, 35(1): 139-149. |
| [2] |
PAPENFORT K, BASSLER B L. Quorum sensing signal-response systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588. DOI:10.1038/nrmicro.2016.89 |
| [3] |
KALIA V C, PUROHIT H J. Quenching the quorum sensing system:Potential antibacterial drug targets[J]. Critical Reviews in Microbiology, 2011, 37(2): 121-140. |
| [4] |
DONG Y H, XU J L, LI X Z, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(7): 3526-3531. DOI:10.1073/pnas.97.7.3526 |
| [5] |
SWIFT S, DOWNIE A J, WHITEHEAD N A, et al. Quorum sensing as a population-density-dependent determinant of bacterial physiology[J]. Advances in Microbial Physiology, 2001, 45: 199-270. DOI:10.1016/S0065-2911(01)45005-3 |
| [6] |
ROSENBERG E, BEN-HAIM Y. Microbial diseases of corals and global warming[J]. Environmental Microbiology, 2002, 4(6): 318-326. DOI:10.1046/j.1462-2920.2002.00302.x |
| [7] |
黄玲英, 余克服. 珊瑚疾病的主要类型、生态危害及其与环境的关系[J]. 生态学报, 2010, 30(5): 1328-1340. |
| [8] |
WEIR-BRUSH J R, GARRISON V H, SMITH G W, et al. The relationship between gorgonian coral (Cnidaria:Gorgonacea) diseases and African dust storms[J]. Aerobiologia, 2004, 20(2): 119-126. DOI:10.1023/B:AERO.0000032949.14023.3a |
| [9] |
SUSSMAN M, WILLIS B L, VICTOR S, et al. Coral pathogens identified for white syndrome (WS) epizootics in the Indo-Pacific[J]. PLoS ONE, 2008, 3(6): e2393. DOI:10.1371/journal.pone.0002393 |
| [10] |
BHEDI C D, PREVATTE C W, LOOKADOO M S, et al. Elevated temperature enhances short-to medium-chain acyl homoserine lactone production by black band disease-associated vibrios[J]. FEMS Microbiology Ecology, 2017, 93(3): fix005. DOI:10.1093/femsec/fix005 |
| [11] |
ZHOU J, LIN Z J, CAI Z H, et al. Opportunistic bacteria use quorum sensing to disturb coral symbiotic communities and mediate the occurrence of coral bleaching[J]. Environmental Microbiology, 2020, 22(5): 1944-1962. DOI:10.1111/1462-2920.15009 |
| [12] |
CERTNER R H, VOLLMER S V. Evidence for autoinduction and quorum sensing in white band disease-causing microbes on Acropora cervicornis[J]. Scientific Reports, 2015, 5(1): 11134. DOI:10.1038/srep11134 |
| [13] |
刘佳, 郭继强, 李宪臻. 群体感应与群体感应淬灭及其在抗微生物感染中的潜在应用[J]. 生物技术通讯, 2010, 21(3): 428-432. DOI:10.3969/j.issn.1009-0002.2010.03.030 |
| [14] |
王志航, 冯雪, 李树仁, 等. 细菌群体感应通讯系统淬灭及应用[J]. 药物生物技术, 2018, 25(5): 443-447. |
| [15] |
KOCH G, NADAL-JIMENEZ P, REIS C R, et al. Reducing virulence of the human pathogen Burkholderia by altering the substrate specificity of the quorum-quenching acylase PvdQ[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(4): 1568-1573. DOI:10.1073/pnas.1311263111 |
| [16] |
CHAN K G, ATKINSON S, MATHEE K, et al. Characterization of N-acyl-homoserine lactone degrading bacteria associated with the Zingiber officinale (ginger) rhizosphere:Co-existence of quorum quenching and quorum sensing in Acinetobacter and Burkholderia[J]. BMC Microbiology, 2011, 11(1): 51. DOI:10.1186/1471-2180-11-51 |
| [17] |
MEYER J L, GUNASEKERA S P, SCOTT R M, et al. Microbiome shifts and the inhibition of quorum sensing by Black Band Disease cyanobacteria[J]. The ISME Journal, 2016, 10(5): 1204-1216. DOI:10.1038/ismej.2015.184 |
| [18] |
CERVINO J M, HAYES R L, POLSON S W, et al. Relationship of Vibrio species infection and elevated temperatures to yellow blotch/band disease in Caribbean corals[J]. Applied and Environmental Microbiology, 2004, 70(11): 6855-6864. DOI:10.1128/AEM.70.11.6855-6864.2004 |
| [19] |
杨思悦, 龙昊, 章翔, 等. 珊瑚病原微生物鉴定及其分子诊断技术进展[J]. 微生物学通报, 2020, 47(2): 623-633. |
| [20] |
KIMES N E, GRIM C J, JOHNSON W R, et al. Temperature regulation of virulence factors in the pathogen Vibrio coralliilyticus[J]. The ISME Journal, 2012, 6(4): 835-846. DOI:10.1038/ismej.2011.154 |
| [21] |
鲁文茹, 刘广锋, 郭志勋, 等. 金银花、连翘对溶珊瑚弧菌及其生物膜活性的影响[J]. 广东药学院学报, 2014, 30(3): 297-300, 308. DOI:10.3969/j.issn.1006-8783.2014.03.009 |
| [22] |
赵畅, 王文昭, 徐期勇. 群体感应淬灭菌的分离及其膜污染控制性能[J]. 环境科学, 2016, 37(12): 4720-4726. |
| [23] |
李扬.三亚鹿回头珊瑚礁区珊瑚共生虫黄藻亚系群群落结构及其生态意义[D].南宁: 广西大学, 2018.
|
| [24] |
孙有方, 雷新明, 练健生, 等. 三亚珊瑚礁保护区珊瑚礁生态系统现状及其健康状况评价[J]. 生物多样性, 2018, 26(3): 258-265. |
| [25] |
HUGHES T P, HUANG H, YOUNG M A, et al. The wicked problem of China's disappearing coral reefs[J]. Conservation Biology, 27(2): 261-269. DOI:10.1111/j.1523-1739.2012.01957.x |
| [26] |
王为善, 邹姗姗, 尹守亮, 等. 具有群体感应抑制活性海洋放线菌的分离和鉴定[J]. 微生物学通报, 2009, 36(9): 1372-1377. |
| [27] |
MARTINELLI D, GROSSMANN G, SEQUIN U, et al. Effects of natural and chemically synthesized furanones on quorum sensing in Chromobacterium violaceum[J]. BMC Microbiol, 2004, 4(1): 25. DOI:10.1186/1471-2180-4-25 |
| [28] |
SU H F, XIAO Z L, YU K F, et al. Diversity of cultivable protease-producing bacteria and their extracellular proteases associated to scleractinian corals[J]. PeerJ, 2020, 8(pt1): e9055. DOI:10.7717/peerj.9055 |
| [29] |
高顺平, 吴国华, 颜新敏, 等. 蔗糖密度梯度离心技术纯化山羊痘病毒的研究[J]. 黑龙江畜牧兽医, 2018(11): 52-54, 253. |
| [30] |
李丽, 杨泽贤, 王素霞, 等. 产氨短杆菌生长曲线的测定[J]. 饲料研究, 2015(1): 71-73. |
| [31] |
WANG T N, GUAN Q T, PAIN A, et al. Discovering, characterizing, and applying acyl homoserine lactone-quenching enzymes to mitigate microbe-associated problems under saline conditions[J]. Frontiers in Microbiology, 2019, 10: 823. DOI:10.3389/fmicb.2019.00823 |
| [32] |
李红, 赵姗姗. 农产品食品质量可追溯性研究进展[J]. 物流技术, 2017, 36(9): 16-20, 179. DOI:10.3969/j.issn.1005-152X.2017.09.004 |
| [33] |
陈玉琪. 微生物生长曲线中生长量测定方法的比较[J]. 轻工科技, 2020, 36(4): 7-8, 12. |
| [34] |
袁媛, 彭仁. 环二鸟苷酸对细菌运动调控的研究进展[J]. 江西师范大学学报:自然科学版, 2020, 44(2): 182-189. |
| [35] |
伍甜. 水稻白叶枯病菌fkbM基因对其运动性的影响[J]. 安徽农业科学, 2017, 45(5): 144-146, 150. |
| [36] |
喻华英, 李启峰. 大肠杆菌生物膜的筛选及生长曲线测定[J]. 中国农学通报, 2014, 30(5): 23-27. |
| [37] |
李雪, 周学章. 表皮葡萄球菌生物膜形成能力及生长曲线测定[J]. 临床医药文献电子杂志, 2019, 6(74): 11. |
| [38] |
魏丹丹, 李喜红, 王莲慧, 等. 血液分离高黏液表型肺炎克雷伯菌的毒力基因检测及生物膜形成测定[J]. 中国感染与化疗杂志, 2016, 16(5): 622-626. |
| [39] |
田晓荣, 于敏, 李蓓, 等. 青岛近海沉积物生物被膜中密度感应及密度感应淬灭细菌多样性[J]. 微生物学通报, 2019, 46(6): 1272-1281. |
| [40] |
于敏, 刘娜, 赵友彬, 等. 海洋细菌密度感应淬灭酶及在水产养殖中的应用[J]. 中国海洋大学学报:自然科学版, 2018, 48(S1): 34-43. |
| [41] |
范兴辉.AHLs淬灭菌的筛选鉴定及其生物防治效果研究[D].广州: 华南农业大学, 2018.
|
| [42] |
NHAN D T, CAM D T, WILLE M, et al. Quorum quenching bacteria protect Macrobrachium rosenbergii larvae from Vibrio harveyi infection[J]. Journal of Applied Microbiology, 2010, 109(3): 1007-1016. |
| [43] |
励建荣, 李婷婷, 王当丰. 微生物群体感应系统及其在现代食品工业中应用的研究进展[J]. 食品科学技术学报, 2020, 38(1): 1-11. |
| [44] |
VINOJ G, VASEEHARAN B, THOMAS S, et al. Quorum-quenching activity of the AHL-lactonase from Bacillus licheniformis DAHB1 inhibits Vibrio biofilm formation in vitro and reduces shrimp intestinal colonisation and mortality[J]. Marine Biotechnology, 2014, 16(6): 707-715. |



