灵菌红素类色素是一类由微生物次级代谢所产生的,具有3个吡咯环母核结构的天然红色素的总称[1],根据其侧链烷基的长短及环化位置不同可分为多种结构类似物,包括灵菌红素、庚基灵菌红素、十一烷基灵菌红素、环烷基灵菌红素、间环丙菌素、链玉红菌素B等[2]。灵菌红素是三吡咯类微生物色素的典型代表,研究人员已分离到很多产灵菌红素类物质的微生物,其中沙雷氏菌[3]、假单胞菌[4]、河氏菌[5]、弧菌[6]等是主产灵菌红素的菌属。庚基灵菌红素是灵菌红素的结构类似物,其区别仅在于吡咯C环的3-位烷基侧链被庚基取代。目前,仅有为数不多的菌株如Pseudovibrio denitrificans[7]、P.magnesiorubra[8]和Vibrio gazogenes[9]被报道可产庚基灵菌红素,且产量极低,如主产灵菌红素的细菌P.magnesiorubra,其产生的庚基灵菌红素的比例仅占总代谢物的1%[7]。现代药理研究发现,灵菌红素及其类似物具有广泛的生物活性,在医药、化妆品、环境治理、纺织染料等领域具有广阔的应用前景和市场价值[1, 2, 10-13]。
目前针对产灵菌红素菌种诱变改良的方法较多,包括利用紫外或微波技术处理的物理诱变法[4, 14]、用EMS处理的化学诱变法[5]和复合诱变法[15]等。张德伟等[16]采用常压室温等离子体(Atmospheric and Room Temperature Plasma,ARTP)诱变筛选灵菌红素生产菌突变株,使灵菌红素产量比诱变前提高1.23倍。与其他诱变育种手段相比,利用ARTP进行微生物诱变育种可造成DNA多样性损伤,且具有操作简便、成本低、无有毒有害物质参与诱变过程、突变率高等优点,并易获得遗传稳定性良好的突变株[17]。目前尚未有关于使用ARTP诱变筛选庚基灵菌红素高产菌株的方法报道。前期研究发现一株非致病性的海洋细菌Notoacmeibacter sp.BGMRC2072(简称C9),其主要代谢产物为庚基灵菌红素,对高温、紫外线照射具有较强的抗性[18]。为了使海洋细菌C9能更高效、大量合成庚基灵菌红素,本研究以C9为出发菌株,利用ARTP进行诱变,并结合遗传稳定性测试,筛选稳定高产庚基灵菌红素的菌株,为庚基灵菌红素的生产发酵、现代药理研究提供理论依据和技术借鉴。
1 材料与方法 1.1 材料 1.1.1 试剂酵母粉、麦芽提取粉、葡萄糖和琼脂(广州环凯微生物科技有限公司),海盐(广东盐业集团有限公司),甲醇、丙酮和盐酸(国药集团化学试剂有限公司)。
1.1.2 菌种海洋细菌C9来源于广西防城港怪石滩的海绵,经16S RNA测序鉴定为Notoacmeibacter属的一个种,本实验室选育保藏,编号为BGMRC2072。
1.1.3 培养基改良ISP2液体培养基(1 L):酵母粉0.2%,麦芽提取粉0.2%,葡萄糖0.2%,海盐3%,加水溶解后121℃高压灭菌20 min。固体培养基在此基础上添加1.3%琼脂。
1.1.4 主要仪器高压灭菌锅(日本PHCbi,型号:MLS-371L-PC),万分之一电子分析天平(广州梅特勒,型号:ML204T),DHG-9246A电热鼓风干燥箱和SHP-250生化培养箱(上海精宏实验设备有限公司),可见分光光度计(上海精科电子有限公司,型号:721G),常温等离子诱变育种仪(无锡源清天木有限公司,型号:APTR-lls),台式高速离心机(立日本日),超净工作台(苏州安泰空气技术有限公司,型号:SW-CJ-2F),纯水机(四川优普超纯科技有限公司,型号:UPH-ll-JDZB),手动移液枪(艾本德国际贸易有限公司,型号:Eppendorf-100/1000型),恒温振荡器(苏州精骐有限公司,型号:IS-RDS3)。
1.2 方法 1.2.1 菌体干重及比生长速率测定结合Tu等[19]和Cao等[20]的方法,利用分光光度法测定600 nm处的光密度值(OD600)及菌体干重(CDW)来衡量菌体的生长情况。收集待测菌液加入离心管中,10 000 r/min快速离心5 min收集菌体,弃上清,菌体用蒸馏水清洗3遍,100℃干燥至恒重。
| $ \text { 菌体的比生长速率 } \mu=\left(\ln W_{t}-\ln W_{0}\right) / T \text { ,} $ |
其中,W0和Wt分别代表进入对数生长期的菌体OD600初始值和最终值,T代表培养时间(h)。
1.2.2 ARTP诱变处理方法(1) ARTP诱变致死曲线
将菌种从-80℃超低温冰箱中取出,转接至改良ISP2固体培养基平板上,28℃培养2—3 d后,挑取单菌落转接至改良ISP2液体培养基中,于28℃、180 r/min培养30—40 h至对数生长期。收集菌液,10 000 r/min快速离心5 min,弃上清,用5%甘油生理盐水重悬,分光光度计测量菌悬液OD600为0.6—0.8。取10 μL菌悬液至ARTP诱变金属载片上进行诱变,以99.99%氦气作为工作气体(流量10 mL/min),在电源功率115 W的条件下分别诱变处理0,10,20,30,40,50,60,70,80,90,105 s。诱变结束后用5%甘油生理盐水稀释,分别取10-4、10-5和10-6 3个浓度的菌液100 μL涂布于改良ISP2固体培养基平板上,置于28℃培养2—3 d后记录每皿菌落数,计算诱变致死率,绘制致死率曲线。
| $ \begin{array}{l} \text { 致死 率 }(\%)=\frac{\text { 对照菌落数 }-\text { 诱变菌落数 }}{\text { 对照菌落数 }} \times \\ 100 \%。\end{array} $ |
(2) 诱变时间确定
结合张德伟等[16]和Cao等[20]的方法,综合考虑不同生长阶段的正负突变率及比生长速率,确定最佳诱变时间。若突变菌株的考察指标值(菌落形态、颜色、OD600、比生长速率等)高于原始菌株视为正突变,反之则视为负突变。
| $ \text { 正突变率 }(\%)=\frac{\text { 正突变菌株数 }}{\text { 对照菌株数 }} \times 100 \% \text { 。} $ |
在最佳处理时间下诱变后,根据平板上菌落的生长状况挑取生长大而丰满、色泽鲜艳、菌落直径较大的单菌落,接种于装有50 mL改良ISP2液体培养基的250 mL三角瓶中,28℃、180 r/min培养34 h。利用分光光度法测定菌体的OD600并观察菌体颜色、形态进行初筛,再通过测定初筛突变菌株的庚基灵菌红素含量进行复筛,最后将复筛得到的突变菌株接种发酵,以菌体生物量为指标筛选优势突变菌株。
1.2.4 庚基灵菌红素的提取与检测取1 mL培养至34 h的菌体发酵液,加入9 mL酸性甲醇(pH=3),震荡破壁,10 000 r/min快速离心5 min,至菌体基本无色,取上清液稀释至合适浓度后,用分光光度计检测536 nm处的吸光值。庚基灵菌红素含量的计算公式为
| $ \begin{aligned} &\text { 庚基灵菌红素含量 }(\mu \mathrm{g} / \mathrm{mL})=(19.076 \times\\ &\left.O D_{536}+0.800\right) \times D \times V, \end{aligned} $ |
其中,D为色素浸提液的稀释倍数,V为发酵液的体积(mL)。
1.2.5 突变菌株的稳定性将复筛得的突变菌株接种于改良ISP2固体培养基上,连续培养10代,再分别转接到改良ISP2液体培养基中发酵培养,并测定10代菌种的庚基灵菌红素产量,考察突变菌株的遗传稳定性。
2 结果与分析 2.1 ARTP诱变致死曲线如图 1所示,致死率随着诱变时间的增加而增大,当处理时间延长到40 s后,ARTP诱变导致的菌株致死率上升缓慢;当处理时间延长到50 s后,菌株的致死率达90%以上且趋于平缓;诱变时间大于60 s后致死率小幅度回落。现代育种研究表明,致死率达到90%以上时,菌株正突变概率大大增加[21]。但由于在只知致死率大小的情况下,无法判断50,60,70 s中哪个处理时间点造成正突变的概率最大,因此还需结合这3个时间段的正负突变率来综合考虑最终选择的诱变处理时间。
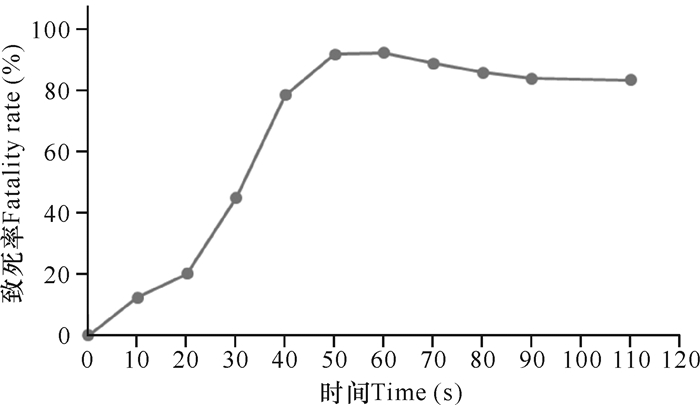
|
| 图 1 ARTP诱变致死率曲线 Fig. 1 Fatality rate curve of ARTP mutagenesis |
2.2 最佳突变时间
选择菌体生长初始期、对数生长期及稳定期3个阶段综合考察菌体突变情况,结果如图 2所示,当处理50 s时,对数生长期的正突变率最高,但初始期的正突变率较低;当处理70 s时,初始期的正突变率最高,但对数生长期的正突变率最低;只有处理时间为60 s时,初始期、稳定期、对数生长期的正负突变率都较均衡。经综合考虑,最终选择60 s作为突变处理时间。

|
| 图 2 不同处理时间的正负突变率 Fig. 2 Positive and negative mutation rates at different treatment time |
2.3 突变菌株筛选
A、B两组出发菌株经ARTP平行诱变处理60 s后,根据菌落生长情况挑取生长大而丰满,色泽鲜艳的菌落,接种发酵后测定菌液OD600,并观察菌体颜色深浅,初筛得到35株OD600高于出发菌株且发酵颜色较深的突变株,测定其庚基灵菌红素含量进行复筛,结果如图 3所示。根据文献[20],选择与出发菌株相比产量增加20%以上的菌株作为正突变筛选范围,可以看出庚基灵菌红素产量超过20%的菌株有A6、A7、A10、A11、A13、B4、B5、B6、B10、B13共10株。

|
| 图 3 突变菌株的庚基灵菌红素产量 Fig. 3 Heptylprodigiosin production of mutant strain |
将上述筛选的10株突变菌株接种发酵,以生物量为指标筛选优势突变菌株,如图 4a所示,大多数突变菌株在稳定期OD600与比生长速率无较大差别,而A11和B10这两株突变菌株在稳定期OD600和比生长速率明显低于其他平行突变菌株,生长稳定性欠佳。结合突变菌株菌体生物量(图 4b),除了突变菌株A10的菌体生物量显著性高于出发菌株及其他突变菌株外,其余的菌株菌体生物量无较大差别,其中B5、B13这2株突变菌株略高于出发菌株。综合菌落形态、庚基灵菌红素产量和菌体生物量等因素,最终选择B5、B13这2株突变菌株进行下一轮的遗传稳定性复筛。
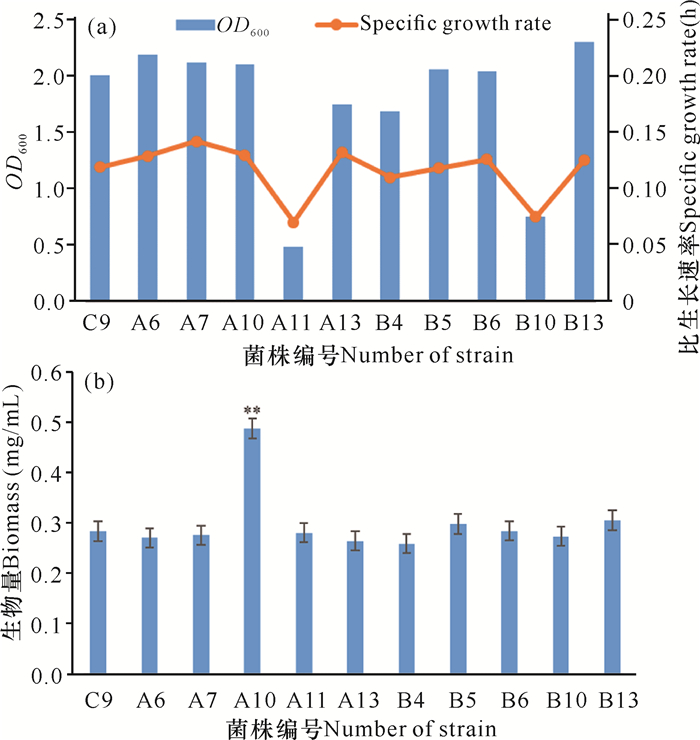
|
| **表示突变菌株A10菌体生物量显著高于其他水平突变株 **indicats that the biomass of mutant A10 is significantly higher than that of other mutant strains 图 4 突变菌株的稳定期OD600、比生长速率(a)和生物量(b) Fig. 4 Specific growth rate (a) and biomass (b) of mutant strain |
2.4 突变菌株的稳定性
突变菌株B5在传代3代后菌株的庚基灵菌红素产量开始下降(图 5a),推测突变菌株B5的遗传不稳定;而突变菌株B13的庚基灵菌红素产量相对稳定在748.91—756.27 μg/mL,没有随着传代数的增加而下降(图 5b),所以最终确定突变菌株B13为最佳突变菌株。
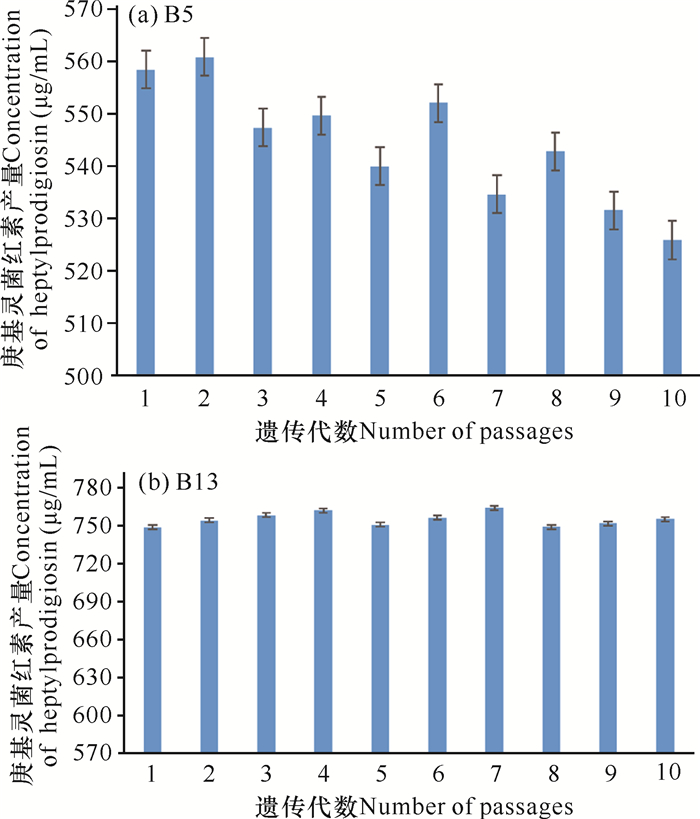
|
| 图 5 B5和B13的遗传稳定性 Fig. 5 Genetic stability of B5 and B13 |
3 讨论
海洋细菌Notoacmeibacter sp.BGMRC2072代谢过程中主要累积庚基灵菌红素,尽管生物合成途径未明确,但课题组前期研究发现庚基灵菌红素在对数生长期前期产量极低,培养16—32 h菌体进入稳定期后开始大量合成,并于接种后40 h达到最大值,约为(384.27±13.25) mg/L,且这类灵菌红素对高温、紫外线照射具有较强的抗性[18],因此提高海洋细菌Notoacmeibacter sp.BGMRC2072的庚基灵菌红素生产能力具有重要的研究意义。利用ARTP诱变技术得到的突变菌株存在正突变和负突变,为了快速高效地筛选到有利的菌株,结合菌株生长形态和生物量(OD600)进行快速初筛。金玮玥等[22]通过测定OD600并观察菌株颜色深浅进行初筛,最终结合实验筛选到一株高产类胡萝卜素的菌株。Cao等[20]综合考虑菌体密度、比生长速率、菌体干重、脂肪酸产率等最终获得一株总脂肪酸含量明显提高的突变株,该方法显著提高ARTP诱变突变株的筛选效率。本研究通过观察单菌落的形态及颜色,结合细菌生物量OD600进行初筛,得到35株突变株,再通过测定初筛菌株的庚基灵菌红素的产量,获得10株庚基灵菌红素产量高于出发菌株产量20%的突变株,最后以生物量为指标筛选优势突变菌。结果表明突变菌株的菌体生物量和庚基灵菌红素产量均高于出发菌株,进一步证明通过菌体生物量、单菌落个体大小及菌体颜色深浅能够提示菌株发生了正突变。
为了更好地发酵生产庚基灵菌红素,下一步还需对突变菌株开展培养条件优化、发酵罐发酵培养等,并对突变菌株进行全基因测序分析,明确庚基灵菌红素的生物合成分子调控机理,为实现庚基灵菌红素的产业化生产奠定基础。
4 结论本实验以海洋细菌Notoacmeibacter sp.BGMRC2072为出发菌株,利用常压室温等离子体(ARTP)进行诱变,得到一株高产庚基灵菌红素的突变菌株B13,其庚基灵菌红素产量为748.91 μg/mL,而出发菌株为384.27 μg/mL,突变菌株B13比原始菌株的庚基灵菌红素产量增加了94.9%,且突变菌株B13具有良好的遗传稳定性。
| [1] |
STANKOVIC N, SENEROVIC L, ILIC-TOMIC T, et al. Properties and applications of undecylprodigiosin and other bacterial prodigiosins[J]. Applied Microbiology and Biotechnology, 2014, 98(9): 3841-3858. DOI:10.1007/s00253-014-5590-1 |
| [2] |
NISHA N, KUMAR K, KUMAR V. Prodigiosin alkaloids:Recent advancements in total synthesis and their biological potential[J]. RSC Advances, 2015, 5(15): 10899-10920. DOI:10.1039/C4RA10296G |
| [3] |
WILLIAMSON N R, FINERAN P C, LEEPER F J, et al. The biosynthesis and regulation of bacterial prodiginines[J]. Nature Reviews Microbiology, 2006, 4(12): 887-899. DOI:10.1038/nrmicro1531 |
| [4] |
LIU X X, WANG Y J, SUN S Q.Condensing enzyme used in biosynthesis of prodigiosin: CN102653732A[P]. 2012-09-04.http://d.wanfangdata.com.cn/patent/CN201110051722.6.
|
| [5] |
KIM D, LEE J S, PARK Y K, et al. Biosynthesis of antibiotic prodiginines in the marine bacterium Hahella chejuensis KCTC 2396[J]. Journal of Applied Microbiology, 2007, 102(4): 937-944. |
| [6] |
HARRIS A K, WILLIAMSON N R, SLATER H, et al. The Serratia gene cluster encoding biosynthesis of the red antibiotic, prodigiosin, shows species- and strain-dependent genome context variation[J]. Microbiology, 2004, 150(Pt11): 3547-3560. |
| [7] |
LAZARO J E H, NITCHEU J, PREDICALA R Z, et al. Heptyl prodigiosin, a bacterial metabolite, is antimalarial in vivo and non-mutagenic in vitro[J]. Journal of Natural Toxins, 2002, 11(4): 367-377. |
| [8] |
SERTAN-DE G A A, PREDICALA R Z, BERNARDO E B, et al. Pseudovibrio denitrificans strain Z143-1, a heptylprodigiosin-producing bacterium isolated from a Philippine tunicate[J]. FEMS Microbiology Letters, 2007, 277(2): 188-196. DOI:10.1111/j.1574-6968.2007.00950.x |
| [9] |
ALIHOSSEINI F, LANGO J, JU K S, et al. Mutation of bacterium Vibrio gazogenes for selective preparation of colorants[J]. Biotechnology Progress, 2010, 26(2): 352-360. |
| [10] |
SURYAWANSHI R K, PATIL C D, BORASE H P, et al. Towards an understanding of bacterial metabolites prodigiosin and violacein and their potential for use in commercial sunscreens[J]. International Journal of Cosmetic Science, 2015, 37(1): 98-107. DOI:10.1111/ics.12175 |
| [11] |
YANG F, WEI H Y, LI X Q, et al. Isolation and characterization of an algicidal bacterium indigenous to lake Taihu with a red pigment able to lyse Microcystis aeruginosa[J]. Biomedical and Environmental Sciences, 2013, 26(2): 148-154. |
| [12] |
CHAUHAN K, DALSANIYA P, PATHAK H. Optimization of prodigiosin-type biochrome production and effect of mordants on textile dyeing to improve dye fastness[J]. Fibers and Polymers, 2015, 16(4): 802-808. DOI:10.1007/s12221-015-0802-6 |
| [13] |
GACEM M A, OULD-EL-HADJ-KHELIL A, BOUDJEMAA B, et al. Antimicrobial and antioxidant effects of a forest actinobacterium V002 as new producer of spectinabilin, undecylprodigiosin and metacycloprodigiosin[J]. Current Microbiology, 2020, 77(10): 2575-2583. DOI:10.1007/s00284-020-02007-1 |
| [14] |
TAO J L, WANG X D, SHEN Y L, et al. Strategy for the improvement of prodigiosin production by a Serratia marcescens mutant through fed-batch ermentation[J]. World Journal of Microbiol Biotechnology, 2005, 21(6/7): 969-972. DOI:10.1007/s11274-004-7257-z |
| [15] |
陶金莉, 沈亚领, 魏东芝, 等. 产灵菌红素沙雷氏菌的诱变育种[J]. 微生物学通报, 2004, 31(2): 45-48. |
| [16] |
张德伟, 薛正莲, 王洲, 等. 一株产灵菌红素菌的筛选及其等离子体诱变[J]. 安徽工程大学学报, 2016, 31(1): 10-15. |
| [17] |
XIANG J, YANG Y, DABBOUR M, et al. Metabolomic and genomic profiles of Streptomyces albulus with a higher ε-polylysine production through ARTP mutagenesis[J]. Biochemical Engineering Journal, 2020, 162: 107720. DOI:10.1016/j.bej.2020.107720 |
| [18] |
李小群.海洋细菌Notoacmeibacter sp.BGMRC2072鉴定及其次级代谢产物研究[D].南宁: 广西大学, 2018.
|
| [19] |
TU R J, JIN W B, WANG M, et al. Improving of lipid productivity of the biodiesel promising green microalga Chlorella pyrenoidosa, via low-energy ion implantation[J]. Journal of Applied Phycology, 2016, 28(4): 2159-2166. DOI:10.1007/s10811-015-0783-2 |
| [20] |
CAO S, ZHOU X, JIN W B, et al. Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma (ARTP)[J]. Bioresource Technology, 2017, 244(Pt2): 1400-1406. |
| [21] |
WANG L Y, HUANG Z L, LI G, et al. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma[J]. Journal of Applied Microbiology, 2010, 108(3): 851-858. |
| [22] |
金玮玥, 宋明凯, 矫文豪, 等. 常压室温等离子体诱变选育类胡萝卜素高产菌株及其性质研究[J]. 生物技术通报, 2015, 31(12): 249-255. |



