2. 中国科学院大学, 北京 100049;
3. 广西中医药大学, 广西南宁 530200
2. University of Chinese Academy of Science, Beijing, 100049, China;
3. Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China
炎症是免疫系统对外部挑战或组织损伤的一种普遍、复杂和有益的生理反应,可以恢复组织结构和功能。炎症反应的发生有助于伤口治愈,但当炎症过激或不可控时,异常而长时间的炎症反应将引发多种疾病。由免疫细胞活性氧物质引起的基因突变,以及炎症反应中涉及的炎症介质,可能会引发许多疾病,例如癌症、多发性硬化、动脉粥样硬化、关节炎、心脏疾病、胰岛素抵抗等[1]。因此,研究抑制炎症介质的过度产生是治疗这些疾病的有力策略。目前临床常用的抗炎药主要有甾体类抗炎药、非甾体抗炎药和生物制剂,但这些药物都有一定的副作用,所以在临床使用上受到限制。
海洋生物为了更好地适应极端的生存环境,形成独特的遗传系统和生物合成途径,并产生大量结构新颖、生物活性丰富的次级代谢物[2],为药物开发开辟了新的前景,越来越多的候选药物进入临床试验或已批准上市[3]。其中,多肽因具有独特结构、活性高、分子量小、靶向性强、毒性低、易于跨膜吸收等特点被广泛研究,并且许多化合物已被证实具有抗真菌、抗病毒和抗增殖等作用[4]。但迄今为止从海洋栖息地中发现抗炎肽的例子还很少,海洋来源的具有特殊细胞靶标的新型生物活性肽的发现,可能有助于寻找有前途的先导药物或候选药物[5, 6]。本文综述了自20世纪90年代以来,具有治疗炎症相关疾病潜力的海洋来源活性肽的研究进展,为开发新的抗炎药物提供参考。
1 炎症信号途径及抗炎活性研究模型海洋来源环肽类抗炎化合物多数作用于NF-κB信号途径,该途径是经典的炎症信号途径[7]。位于细胞质中的NF-κB由两个亚基(p50和p65)组成,它们是抑制蛋白IκB-α的非活性异二聚体。在刺激条件下,IκB-α的磷酸化和蛋白水解使NF-κB易位进入核内,然后通过与DNA结构中的κB位点结合来调节靶基因的转录[8]。NF-κB的反式激活会增加下游炎症介质的表达,例如IL-1β、IL-6和TNF-α等促炎细胞因子[9],重要的促炎酶(例如诱导型一氧化氮合酶iNOS和环氧化酶COX-2)及其派生产物NO和PGE2[10]。炎症介质的过度产生引起细胞损伤,例如发红、疼痛、发烧和肿胀[11]。因此,抑制炎症介质的过度产生是治疗炎症性疾病的重要目标,可以作为评估药物发挥抗炎作用的指标。除NF-κB活化外,还有一种涉及细胞外信号调节激酶(ERK)、p38和cJun NH2末端激酶(JNK)的MAPK信号途径,也可以激活炎症,并调节各种炎症相关基因的转录,调节炎症因子的基因表达[12]。
研究人员常用的体外抗炎活性研究模型有两种:(1)建立脂多糖(Lipopolysaccharides, LPS)、佛波酯(Phorbol 12-myristate 13-acetate, PMA)或其他药物刺激的体外免疫单核细胞和巨噬细胞(BMDM细胞、RAW264.7细胞等)等体外模型[13]。通过这些模型评价药物对一氧化氮释放的影响,以及ELISA、Western blotting分析相关炎症因子(IL-1、IL-6、TNF-α、PGE2等)和蛋白(iNOS和COX-2等)表达水平,是判断天然产物是否具有潜在抗炎活性的有效手段[14]。(2)通过LPS刺激中性粒细胞,检测中性粒细胞弹性蛋白酶(Enutorphil Elastase, NE)的表达,NE抑制剂抑制NE活性,调节炎性细胞因子和趋化因子的释放,抑制炎细胞激活、跨膜迁移及组织毒性物质释放[15],发挥多层次的抗炎效应。在体内实验也主要有两种研究模型:(1)在大鼠足跖内注射卡拉胶能使大鼠出现局部毛细血管扩张、血管通透性增高、组织液渗出、足水肿等一系列类似于人体急性炎症的反应[16]。(2)二甲苯或PMA诱导小鼠耳肿胀,然后通过检测炎症部位改善情况评估抗炎效果[17]。
2 海洋来源抗炎活性肽分子海洋环境复杂多变,生物种类丰富,蕴含着大量结构新颖的活性化合物,肽类为其中一类重要的活性天然产物,是未来药物开发的方向之一。目前为止,已发现的具有抗炎作用的海洋来源活性肽主要有4类。
2.1 环肽类及其抗炎机制Gulavita等[18]从澳大利亚西南部采集到的海绵Theonella sp.中分离得到环八肽perthamide B (1),化合物1显示轻微的抑制细胞因子IL-1β表达,半抑制浓度(50% Inhibitory Concentraton, IC50)为27.6 μmol/L。Festa等[19]从所罗门群岛的海绵Theonella sp.中发现perthamides C—K (2—10),其中perthamides C (2)和D (3)具有显著的抗炎活性;在卡拉胶诱导的小鼠足水肿模型中,化合物2,3,8,7和10均能显著降低卡拉胶诱导的足水肿,且无论在早期阶段(0—6 h)还是在晚期阶段(24—96 h),其作用程度呈剂量相关,当化合物2腹腔注射(ip)用药剂量为300 μg/kg时能降低60%小鼠足水肿。佛波酯(PMA)能诱导死后人肾(PHK)细胞引起的末端分化和炎症反应,是研究银屑病常用的体外模型之一[20]。perthamide C (2)和perthamide E (4)能抑制组织型纤溶酶原激活剂(Tissue Plasminogen Activator, TPA)诱导PHK细胞炎症因子上调,化合物4能抑制IL-8表达,而化合物2能同时抑制TNF-α和IL-8的表达起抑制炎症作用,提供新的抗银屑病研究方向[21]。当perthamide G (6)中的脯氨酸替代化合物2的γ-甲基脯氨酸,抗炎作用消失;具有ADAA残基的perthamide J (9)具有强抗炎作用。研究表明同时拥有γ-甲基脯氨酸、AHMHA和ADAA结构片段, 是perthamides化合物分子产生抗炎作用的药效条件[4]。
以上化合物的化学结构见图 1。

|
| 图 1 化合物perthamides (1—10)的结构 Fig. 1 Structures of compounds perthamides (1—10) |
Cyclomarins A (11)、B (12)和C (13)是从海洋放线菌Streptomyces sp.提取得到的环七肽(图 2);cyclomarin A由3种常见氨基酸和4种特殊的氨基酸组成,在体内与体外实验都表现出显著的抗炎作用;在PMA诱导小鼠耳肿胀模型中,cyclomarin A在50 μg/耳的剂量下耳肿抑制率达92%;腹腔注射给药剂量30 mg/kg时,耳肿抑制率达45%[22],表明该化合物是一种潜在的抗炎候选药物。

|
| 图 2 化合物cyclomarins (11—13)的结构 Fig. 2 Structures of compounds cyclomarins (11—13) |
Solomonamides A (14)和B (15)是来自海绵Theonella swinhoei的环肽新骨架(图 3),化合物14能够降低卡拉胶诱导的足水肿,以100 μg/kg(ip)的剂量能使抑制率达60%,呈剂量相关[23]。

|
| 图 3 化合物Solomonamides (14,15)、stylissatin A (16)和(17),violaceomide A (18)的结构 Fig. 3 Structures of compounds solomonamides (14, 15), stylissatin A (16) and (17), violaceomide A (18) |
来自海绵Stylissa massa的新天然产物stylissatin A(16)[24]及其全合D-allo-Ile4叔丁基衍生物(17)[25](图 3),在LPS诱导的RAW264.7细胞炎症模型中,能显著抑制一氧化氮的生成,IC50分别为87和12 μmol/L。
IL-10作为免疫抑制因子,通过抑制多种效应分子来抑制机体的抗肿瘤免疫,通过诱导产生IL-2和IFN-C来抑制IL-12及TNF-α的表达,同时作为促炎细胞因子参与TNF-α的负反馈调节。Liu等[26]从海绵共附生真菌Aspergillus violaceofuscus中发现环四肽violaceomide A (18)(图 3),在LPS诱导的THP-1源巨噬细胞中,当用药浓度在10 μmol/L时,化合物18显著抑制促炎细胞因子IL-10的表达,抑制率为84.3%。
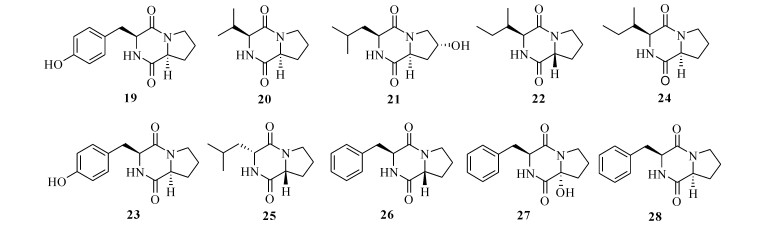
Nalli等[27]从海洋链霉属Streptomyces sp.中分离获得10个吡嗪-1, 4-二酮取代环二肽类化合物(19—28)(图 4),其中化合物21,22,23,25和26对脂多糖诱导的巨噬细胞中的两种促炎细胞因子TNF-α和IL-6均具有良好的抑制作用,在10 μmol/L用药剂量下,抑制率为23.7%—62.1%;体外和体内实验都证实化合物25是TNF-α的特异性抑制剂,可有效抑制LPS诱导的外周血单个核细胞(PBMCs)中TNF-α的产生。
|
| 图 4 吡嗪-1, 4-二酮取代环二肽类化合物(19—28)的结构 Fig. 4 Structures of compounds pyrazine-1, 4-dione substituted cyclic dipeptides (19—28) |
2.2 缩肽类及其抗炎机制
缩肽化合物是一类包含酯键的多肽,是羟基酸和氨基酸由酯键和酰胺键连接构成的一类寡聚物,具有抗菌、抗病毒、抗血栓、抗虫以及抗肿瘤等多种生物活性[28]。
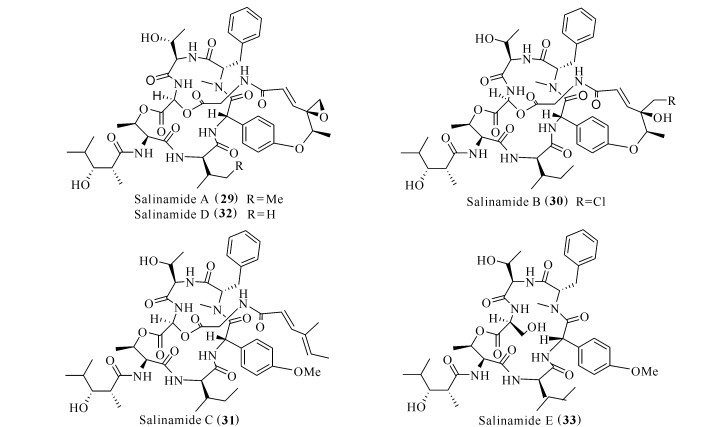
TPA诱导小鼠耳肿是一种模拟非特异炎症的动物模型,TPA诱导小鼠耳组织角质形成细胞产生TNF-α、IL-1β和IL-6等促炎细胞因子[29]。从水母表面共附生放线菌Streptomyces sp.中提取得到的salinamides A—E (29—33)(图 5),其中salinamides A (29)和B (30)具有较好的抗炎作用,在TPA诱导的小鼠耳肿模型下,以50 μg/耳的给药剂量,抑制率分别达84%和83%[30]。
|
| 图 5 化合物Salinamides (29—33)的结构 Fig. 5 Structures of compounds salinamides (29—33) |
Halipeptins A—C (34—36)[31]是从海绵Haliclona sp.提取获得的17元环缩酯肽(图 6),化合物34具有较好的抗炎特性,在体内的抗炎作用比商业抗炎药物如萘普生和吲哚美辛更强。在小鼠皮下气囊(Subcutaneous Air Pouch,SAP)慢性炎症模型中,通过足下注射卡拉胶诱发炎症反应,经药物处理后发现,在300 μg/kg给药剂量下,能减轻60%足水肿[32]。

|
| 图 6 化合物halipeptins (34—36)的结构 Fig. 6 Structures of compounds halipeptins (34—36) |
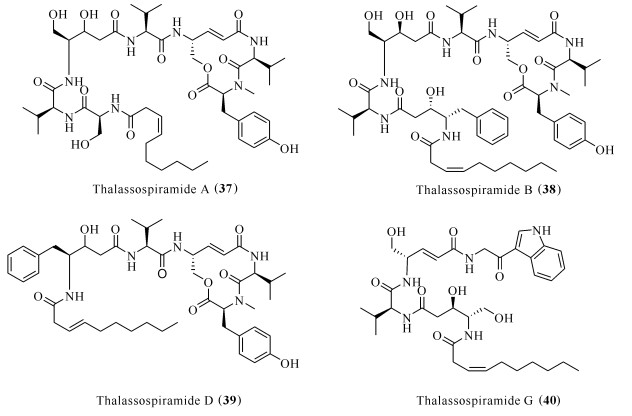
Thalassospiramides A (37)、B (38)、D (39)和G (40)[33]分离自海洋细菌Thalassospira sp.(图 7),化合物38对Th2细胞免疫应答中上调的IL-5产生抑制作用,IC50为5 μmol/L[34]。进一步研究发现,thalassospiramides A (37)和D (39)能抑制LPS诱导的RAW264.7巨噬细胞中一氧化氮的释放,IC50分别为16.4和4.8 μmol/L[35]。
|
| 图 7 化合物thalassospiramids (37—40)的结构 Fig. 7 Structures of compounds thalassospiramids (37—40) |
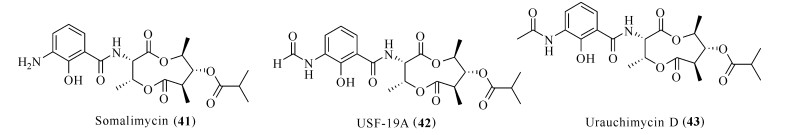
从深海链霉菌Somaliensis SCSIOZH66中提取分离的抗霉素型缩肽somalimycin (41)、USF-19A(42)和urauchimycin D (43)(图 8),能够抑制卵白蛋白诱导哮喘小鼠脾细胞中IL-5的释放。化合物42的IC50达0.57 μmol/L,化合物41和43的IC50均大于10 μmol/L,但细胞毒半数致死量LD50仅为34.6—192.9 μmol/L,具有良好的抗炎潜力[36]。
|
| 图 8 化合物Somalimycin (41)、USF-19A (42)和urauchimycin D (43)的结构 Fig. 8 Structures of compounds somalimycin (41), USF-19A (42) and urauchimycin D (43) |
2.3 脂肽类及其抗炎机制
脂肽类是一类结构复杂、生物活性显著的化合物,具有抗细菌、抗真菌、抗肿瘤、抗炎[35]等生物活性。脂肽类化合物的应用前景较为广泛,具有较大的开发价值。
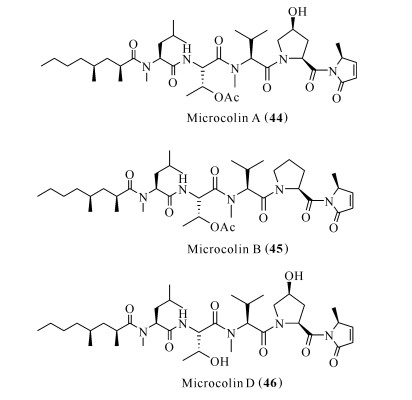
Microcolin A (44)、microcolin B (45)和microcolin D (46)是从蓝藻Lyngbya majuscula中分离得到的(图 9)[37]。淋巴细胞功能相关抗原LFA-1是白细胞整合素家族的一员,参与T细胞与抗原呈递细胞的结合。胞内黏附分子ICAM-1是胞内黏附分子的一种类型,在细胞与细胞互相作用时,抑制白细胞浸润。LFA-1/ICAM-1相互作用在炎症疾病的发病机制中发挥重要作用[38]。化合物45和46抑制LFA-I/ICAM-I介导的细胞黏附,IC50分别为0.15和0.9 μmol/L,有望被开发为LFA-I/ICAM-I抑制剂[39, 40]。化合物44能够阻止IL-2的产生与IL-2受体的表达,并且对刀豆凝集素A (Concanavalin A)活化小鼠脾细胞淋巴细胞的增殖有抑制作用[41]。
|
| 图 9 化合物Microcolins (44—46)的结构 Fig. 9 Structures of compounds microcolins (44—46) |
Malyngamides类化合物分子中的脂肪酸链与具有环己烯酮或环氧环己酮结构的胺均通过酰胺键连接,是一类骨架新颖、结构复杂的脂肪酰胺化合物,具有良好的生物活性[42]。Malyngamide S (47)能抑制分别由趋化肽(fMLP)和PMA诱导的人中性粒细胞中超氧阴离子的生成,抑制率分别为73%和83%[43]。Malyngamide C (48)、malyngamide J (49)和malyngamide L (50)分离自蓝藻Lyngbya majuscula,能抑制LFA-I/ICAM-I介导的细胞黏附,伴随着较小的细胞毒性[39]。Malyngamide 2 (51)分离自未知蓝藻,能够抑制LPS诱导的RAW264.7巨噬细胞一氧化氮的释放,IC50为8.0 μmol/L。
以上化合物的化学结构见图 10。

|
| 图 10 化合物Malyngamides (47—51)的结构 Fig. 10 Structures of compounds malyngamides (47—51) |
2.4 蛋白质类及其抗炎机制
藻蓝蛋白(Phycocyanin, PC)是一种光合色素,广泛存在于蓝藻和红藻细胞内,其分子量在40 kU左右,由α和β两个亚基组成,肽链上共价结合1个开链的四吡咯环辅基。藻蓝蛋白在小鼠模型中被证明可以抑制各种类型的水肿和活性自由基的释放,类似于其他非甾体抗炎药,如吲哚美辛和布洛芬[43]。在花生四烯酸(AA)诱导的小鼠耳炎模型中,藻蓝蛋白可以抑制前列腺素E2的产生、抑制磷脂酶A2的活性和组胺的释放[44-46]。进一步的研究发现藻蓝蛋白能抑制COX-2蛋白的表达和促炎细胞因子TNF-α的释放[47]。
凝集素(Lectin)是一种糖蛋白,分离自各种植物、无脊椎动物和高等动物。最近的研究发现,海洋生物中也存在凝集素,并且具有一定的抗炎作用。在酵母聚糖诱导的颞下颌关节骨关节炎动物模型中,预先用分离自绿藻Caulerpa cupressoides的海藻凝集素保护,随后用酵母聚糖诱导炎症,结果发现其可降低小鼠关节痛并抑制促炎细胞因子IL-1β和TNF-α的生成,并抑制白细胞浸润以及降低髓过氧化物酶(MPO)的活性。在卡拉胶诱导小鼠足水肿模型中,该凝集素能显著降低肿胀率和中性粒细胞的渗透,也可以抑制促炎细胞因子IL-1β、TNF-α、IL-6和COX-2表达。除此之外,海藻凝集素对葡聚糖和组胺诱导的足水肿也有抑制作用,但对5-羟色胺和缓激肽诱导的足水肿没有效果,表明该凝集素的抗炎作用可能与抑制促炎细胞因子IL-1β、TNF-α、IL-6、COX-2和组胺受体的表达有关[48]。
抗菌肽因其在宿主免疫机能中的重要地位,又被称为宿主防御肽(Host Defense Peptides),参与机体先天性免疫反应。天然抗菌肽通常由30多个氨基酸残基组成,是碱性小分子多肽,这些肽通常具有一定的抗炎、调控免疫活性。Epinecidin-1是从海洋石斑鱼Epinephelus coioides中分离出来的抗菌肽,能促进LPS激活的RAW264.7巨噬细胞中IL-10的分泌,但却对TNF-α的分泌没有明显作用,表明该抗菌肽能通过促进促炎细胞因子的分泌来发挥抗炎作用[49]。Chrysophsin-1是从海洋真鲷Chrysophrys major中提取的抗菌肽,可以抑制LPS激活的RAW264.7巨噬细胞中TNF-α的释放[50]。
3 展望海洋生物来源的活性肽根据其化学结构的不同表现出不同的药理作用,这些不同类型的肽对在生物医学研究上阐明疾病机理和药物作用机理具有重要意义。例如,环肽在过去的几年里引起越来越多的关注,许多研究主要集中在它们在体内和体外炎症模型中潜在的抗炎作用。对环肽的重视主要是因为其分子量小,可以保持良好的细胞通透性,同时又保证它们与药物作用时有足够大的接触面积,可以扩大药物界面,增强亲和力和选择性。因此,环肽可通过其环状结构克服蛋白的熵(吉布斯自由能)障碍,增强与靶蛋白表面的结合。环肽的刚性是另一个关键因素,其可以通过显著降低熵,更好地使目标分子与受体结合。由于这些原因,与线性结构相比,环肽通常表现出更好的生物活性。此外,由于缺乏羧基和氨基末端,环肽的环状结构提高了它们对外肽酶水解的抵抗力。本文综述的具有抗炎活性的海洋来源活性肽,由于环肽类物质含量低,且易降解,使得其临床开发较难,但是随着研究的不断深入,以及酶工程技术和生物合成技术的成熟运用,开发海洋活性肽作为药物先导化合物的研究有望在不久的将来得以实现。
| [1] |
HUNTER P. The inflammation theory of disease.The growing realization that chronic inflammation is crucial in many diseases opens new avenues for treatment[J]. Embo Reports, 2012, 13(11): 968-970. DOI:10.1038/embor.2012.142 |
| [2] |
SKROPETA D, WEI L. Recent advances in deep-sea natural products[J]. Natural Product Reports, 2014, 31(8): 999-1025. DOI:10.1039/C3NP70118B |
| [3] |
RANGEL M, FALKENBERG M. An overview of the marine natural products in clinical trials and on the market[J]. Journal of Coastal Life Medicine, 2015, 3(6): 421-428. |
| [4] |
FESTA C, DE MARINO S, D'AURIA M V, et al. Anti-inflammatory cyclopeptides from the marine sponge Theonella swinhoei[J]. Tetrahedron, 2012, 68(13): 2851-2857. DOI:10.1016/j.tet.2012.01.097 |
| [5] |
ANDAVAN G S B, LEMMENS-GRUBER R. Cyclodepsipeptides from marine sponges:Natural agents for drug research[J]. Marine Drugs, 2010, 8(3): 810-834. DOI:10.3390/md8030810 |
| [6] |
BUCCI M, ROVIEZZO F, POSADAS I, et al. Endothelial nitric oxide synthase activation is critical for vascular leakage during acute inflammation in vivo[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(3): 904-908. DOI:10.1073/pnas.0408906102 |
| [7] |
GILMORE T D. The Rel/NF-кB signal transduction pathway:Introduction[J]. Oncogene, 1999, 18(49): 6842-6844. DOI:10.1038/sj.onc.1203237 |
| [8] |
DRAY A. Inflammatory mediators of pain[J]. British Journal of Anaesthesia, 1995, 75(2): 125-131. DOI:10.1093/bja/75.2.125 |
| [9] |
ZHANG J M, AN J. Cytokines, inflammation and pain[J]. International Anesthesiology Clinics, 2007, 45(2): 27-37. DOI:10.1097/AIA.0b013e318034194e |
| [10] |
AHMAD R, RASHEED Z, AHSAN H. Biochemical and cellular toxicology of peroxynitrite:Implications in cell death and autoimmune phenomenon[J]. Immunopharmacology & Immunotoxicology, 2009, 31(3): 388-396. |
| [11] |
MEDZHITOV R. Origin and physiological roles of inflammation[J]. Nature, 2008, 454(7203): 428-435. DOI:10.1038/nature07201 |
| [12] |
MIAKOTINA O L, SNYDER J M. TNF-alpha inhibits SP-A gene expression in lung epithelial cells via p38 MAPK[J]. American Journal of Physiology-Lung Cellular and Molecular Physiolog, 2002, 283(2): 418-427. DOI:10.1152/ajplung.00470.2001 |
| [13] |
WANG L, TU Y C, LIAN T W, et al. Distinctive antioxidant and antiinflammatory effects of flavonols[J]. Journal of Agricultural & Food Chemistry, 2006, 54(26): 9798-9804. |
| [14] |
刘燕芳, 刘丹, 刘兰, 等. 应用于天然产物抗炎活性研究的主要细胞模型[J]. 天然产物研究与开发, 2020, 32(5): 874-881. |
| [15] |
张瑞霞, 龙尧. 中性粒细胞弹性蛋白酶抑制剂在疾病中的作用[J]. 医学综述, 2008, 14(6): 919-921. DOI:10.3969/j.issn.1006-2084.2008.06.047 |
| [16] |
HUANG Z, WANG C, WEI L, et al. Resveratrol inhibits EMMPRIN expression via P38 and ERK1/2 pathways in PMA-induced THP-1 cells[J]. Biochemical & Biophysical Research Communications, 2008, 374(3): 517-521. |
| [17] |
周娟, 张梦军, 郭嘉伟, 等. 小鼠耳肿胀模型及药理应用[J]. 国际检验医学杂志, 2012, 33(17): 2102-2104. |
| [18] |
GULAVITA N K, POMPONI S A, WRIGHT A E, et al. Isolation and structure elucidation of perthamide B, a novel peptide from the sponge Theonella sp.[J]. Tetrahedron Letters, 1994, 35(37): 6815-6818. DOI:10.1016/0040-4039(94)85012-7 |
| [19] |
FESTA C, DE MARINO S, SEPE V, et al. Perthamides C and D, two new potent anti-inflammatory cyclopeptides from a Solomon Lithistid sponge Theonella swinhoei[J]. Tetrahedron, 2009, 65(50): 10424-10429. DOI:10.1016/j.tet.2009.10.026 |
| [20] |
WESTERGAARD M, HENNINGSEN J, JOHANSEN C, et al. Expression and localization of peroxisome proliferator-activated receptors and nuclear factor B in normal and lesional psoriatic skin[J]. Journal of Investigative Dermatology, 2003, 121(5): 1104-1117. |
| [21] |
FESTA C, DE MARINO S, SEPE V, et al. Perthamides C-F, potent human antipsoriatic cyclopeptides[J]. Tetrahedron, 2011, 67(40): 7780-7786. DOI:10.1016/j.tet.2011.07.077 |
| [22] |
RENNER M K, SHEN Y C, CHENG X C, et al. Cyclomarins A-C, new antiinflammatory cyclic peptides produced by a marine bacterium (Streptomyces sp.)[J]. Journal of the American Chemical Society, 1999, 121(49): 11273-11276. DOI:10.1021/ja992482o |
| [23] |
FESTA C, DE MARINO S, SEPE V, et al. Solomon-amides A and B, new anti-inflammatory peptides from Theonella swinhoei[J]. Organic Letters, 2011, 13(6): 1532-1535. DOI:10.1021/ol200221n |
| [24] |
KITA M, GISE B, KAWAMURA A, et al. Stylissatin A, a cyclic peptide that inhibits nitric oxide production from the marine sponge Stylissa massa[J]. Tetrahedron Letters, 2013, 54(50): 6826-6828. DOI:10.1016/j.tetlet.2013.10.003 |
| [25] |
ZHANG M, SUNABA T, SUN Y, et al. Anti-inflammatory marine cyclic peptide stylissatin A and its derivatives inhibit differentiation of murine preadipocytes[J]. Chemical Communications, 2019, 55(38): 5471-5474. DOI:10.1039/C9CC02517K |
| [26] |
LIU J, GU B, YANG L, et al. New anti-inflammatory cyclopeptides from a sponge-derived fungus Aspergillus violaceofuscus[J]. Frontiers in Chemistry, 2018, 6: 226-233. DOI:10.3389/fchem.2018.00226 |
| [27] |
NALLI Y, GUPTA S, KHAJURIA V, et al. TNF-alpha and IL-6 inhibitory effects of cyclic dipeptides isolated from marine bacteria Streptomyces sp.[J]. Medicinal Chemistry Research, 2017, 26(1): 93-100. |
| [28] |
KIM C-K, WANG D, BOKESCH H R, et al. Swinhopeptolides A and B:Cyclic depsipeptides from the sponge Theonella swinhoei that inhibit Ras/Raf interaction[J]. Journal of Natural Products, 2020, 83(4): 1288-1294. |
| [29] |
STANLEY P L, STEINER S, HAVENS M, et al. Mou-se skin inflammation induced by multiple topical applications of 12-O-tetradecanoylphorbol-13-acetate[J]. Skin Pharmacology and Physiology, 1991, 4(4): 262-271. DOI:10.1159/000210960 |
| [30] |
TRISCHMAN J A, TAPIOLAS D M, JENSEN P R, et al. Salinamide-a and salinamide-b-antiinflammatory depsipeptides from a marine streptomycete[J]. Journal of the American Chemical Society, 1994, 116(2): 757-758. |
| [31] |
DELLA MONICA C, RANDAZZO A, BIFULCO G, et al. Structural revision of halipeptins:Synthesis of the thiazoline unit and isolation of halipeptin C[J]. Tetrahedron Letters, 2002, 43(33): 5707-5710. DOI:10.1016/S0040-4039(02)01209-1 |
| [32] |
RANDAZZO A, BIFULCO G, GIANNINI C, et al. Halipeptins A and B:Two novel potent anti-inflammatory cyclic depsipeptides from the vanuatu marine sponge Haliclona species[J]. Journal of the American Chemical Society, 2001, 123(44): 10870-10876. DOI:10.1021/ja010015c |
| [33] |
UM S, PYEE Y, KIM E-H, et al. Thalassospiramide G, a new gamma-amino-acid-bearing peptide from the marine bacterium Thalassospira sp.[J]. Marine Drugs, 2013, 11(3): 611-622. |
| [34] |
OH D-C, STRANGMAN W K, KAUFFMAN C A, et al. Thalassospiramides A and B, immunosuppressive peptides from the marine bacterium Thalassospira sp.[J]. Organic Letters, 2007, 9(8): 1525-1528. DOI:10.1021/ol070294u |
| [35] |
MAYER A M S, GUERRERO A J, RODRÍGUEZ A D, et al. Marine pharmacology in 2014-2015:Marine compounds with antibacterial, antidiabetic, antifungal, anti-inflammatory, antiprotozoal, antituberculosis, antiviral, and anthelmintic activities; affecting the immune and nervous systems, and other miscellaneous mechanisms of action[J]. Marine Drugs, 2020, 18(1): 5. |
| [36] |
LI H Y, HUANG H M, HOU L K, et al. Discovery of antimycin-type depsipeptides from a wbl gene mutant strain of deepsea-derived streptomyces somaliensis SCSIO ZH66 and their effects on pro-inflammatory cytokine production[J]. Frontiers in Microbiology, 2017, 8: 678-685. |
| [37] |
SIVAPATHASEKARAN C, MUKHERJEE S, SA-MANTA R, et al. High-performance liquid chromatography purification of biosurfactant isoforms produced by a marine bacterium[J]. Analytical & Bioanalytical Chemistry, 2009, 395(3): 845-854. |
| [38] |
KATAKAI T, HABIRO K, KINASHI T. Dendritic cells regulate high-speed interstitial T cell migration in the lymph node via LFA-1/ICAM-1[J]. Journal of Immunology, 2013, 191(3): 1188-1199. DOI:10.4049/jimmunol.1300739 |
| [39] |
TAKAMATSU S, NAGLE D G, GERWICK W H. Secondary metabolites from marine cyanobacteria and algae inhibit LFA-1/ICAM-1 mediated cell adhesion[J]. Planta Medica, 2004, 70(2): 127-131. |
| [40] |
KOEHN F E, LONGLEY R E, REED J K. Microcolins A and B, new immunosuppressive peptides from the blue-green alga Lyngbya majuscula[J]. Journal of Natural Products, 1992, 55(5): 613-619. |
| [41] |
ZHANG L H, LONGLEY R E, KOEHN F E. Antiproliferative and immunosuppressive properties of microcolin A, a marine-derived lipopeptide[J]. Life Sciences, 1997, 60(10): 751-762. |
| [42] |
MIN W, MILLIGAN K E, GERWICK W H. Three new malyngamides from the marine cyanobacterium Lyngbya majuscula[J]. Tetrahedron, 1997, 53(47): 15983-15990. |
| [43] |
ROMAY C, ARMESTO J, REMIREZ D, et al. Antioxidant and anti-inflammatory properties of C-phycocyanin from blue-green algae[J]. Inflammation Research, 1998, 47(1): 36-41. |
| [44] |
APPLETON D R, SEWELL M A, BERRIDGE M V, et al. A new biologically active malyngamide from a New Zealand collection of the sea hare Bursatella leachii[J]. Journal of Natural Products, 2002, 65(4): 630-631. |
| [45] |
ROMAY C, LEDON N, GONZALEZ R. Effects of phycocyanin extract on prostaglandin E-2 levels in mouse ear inflammation test[J]. Arzneimittelforschung Drug Research, 2000, 50(12): 1106-1109. |
| [46] |
GONZALEZ R, RODRIGUEZ S, ROMAY C, et al. Anti-inflammatory activity of phycocyanin extract in acetic acid-induced colitis in rats[J]. Pharmacological Research, 1999, 39(1): 55-59. |
| [47] |
DENG R, CHOW T-J. Hypolipidemic, antioxidant, and antiinflammatory activities of microalgae Spirulina[J]. Cardiovascular Therapeutics, 2010, 28(4): e33-e45. |
| [48] |
赵博闻, 刘雨晴, 吴海歌, 等. 海洋天然产物及其抗炎活性的研究进展[J]. 天然产物研究与开发, 2017, 29(7): 1248-1255. |
| [49] |
LEE S C, PAN C Y, CHEN J Y. The antimicrobial peptide, epinecidin-1, mediates secretion of cytokines in the immune response to bacterial infection in mice[J]. Peptides, 2012, 36(1): 100-108. |
| [50] |
HSU J C, LIN L C, TZEN J T C, et al. Characteristics of the antitumor activities in tumor cells and modulation of the inflammatory response in RAW264.7 cells of a novel antimicrobial peptide, chrysophsin-1, from the red sea bream (Chrysophrys major)[J]. Peptides, 2011, 32(5): 900-910. |



