2. 广西大学, 广西南宁 530004
2. Guangxi University, Nanning, Guangxi, 530004, China
蒽贝素(Embelin)又称酸藤子酚,为苯醌类化合物2, 5-二羟基-3-十一烃-2, 5-环己二烯-1, 4二酮(2, 5-dihydroxy-3-undecyl-2, 5-cyclohexadiene-1, 4-dione)[1],是酸藤子属植物的主要有效成分之一。从酸藤子Embelia laeta果实中分离得到蒽贝素并纯化制成中药化学对照品[1-2],目前对蒽贝素活性研究表明其具有驱虫[3]、抗氧化自由基[4]、降血糖[5]、保护胰岛细胞[6]、治疗心脏病[7]和精神障碍[8]等作用,还能抑制癌细胞增殖和诱导其凋亡[9-10]。但是蒽贝素在体内血药浓度及其药动学未见研究报道。超高效液相色谱串联质谱(UPLC-MS/MS)技术具有灵敏度高、检出限低、样品用量少的优点,广泛用于化学成分[11]、药物代谢[12]、杂质鉴定[13]等药物分析中。本研究建立测定大鼠血浆中蒽贝素浓度的超高效液相色谱串联质谱法,并研究蒽贝素血药浓度及药动学规律,为其临床药学基础研究提供科学实验依据。
1 材料与方法 1.1 仪器Agilent 1290超高效液相色谱仪(美国,Agilent公司),Agilent 6460 Triple Quad质谱检测器(美国,Agilent公司),Synthesis A10TM超纯水系统(美国,Millipore公司),ME235S电子天平(德国,Sartorius公司),KQ2200DV型数控超声波清洗器(昆山市超声仪器有限公司),5810R真空浓缩仪(德国,Eppendorf公司)。
1.2 药品与试剂蒽贝素对照品(纯度≥98%)由本课题组制备[1-2](EBS-20140728)。内标物大黄素(纯度≥98%)购自四川省维克奇生物科技有限公司(wkq-00148)。色谱甲醇、乙腈购自美国Fisher公司。分析纯乙醇、氨水、乙酸乙酯购自广东光华科技股份有限公司。色谱纯甲酸购自美国Merck KGaA公司。实验用水为超纯水。
1.3 动物Sprague-Dawley (SD)大鼠12只(随机分组,不分雌雄),体质量为(280±20) g,购自广西医科大学实验动物中心,动物生产许可证号为SCXK(广西)2009-0002。
1.4 测定条件色谱条件:Agilent Zorbax Eclipse Plus C18色谱柱(2.1 mm×50 mm, 1.8 μm);流动相:0.1%氨水(A)-甲醇(B);梯度洗脱:0.0—4.0 min,10%→100% B;4.0—8.0 min,100% B;流速:0.3 mL/min;进样量:1 μL;柱温25℃。
质谱条件:电喷雾离子源(ESI),负离子模式检测,多反应监测(MRM)。
毛细管正(ESI+)、负(ESI-)离子电压分别为4 000 V和3 000 V。干燥气和鞘气均为N2,温度分别为300℃和360℃,流速分别为10 L/min和12 L/min。雾化气为N2,压力为2.8×105 Pa。蒽贝素和内标物大黄素的质谱分析参数:蒽贝素母离子293.1,二级碎片子离子96.6,源内碎裂电压190 V,碰撞能量25 eV;大黄素母离子269.0,二级碎片子离子225.1,源内碎裂电压135 V,碰撞能量32 eV。
1.5 溶液的配制 1.5.1 蒽贝素标准溶液精密称取蒽贝素对照品10 mg,置于10 mL量瓶中,用甲醇溶解并定容,制成质量浓度为1.0 mg/mL的对照品贮备液。取上述对照品贮备液适量,用甲醇进一步稀释,制成质量浓度分别为制备10,50,150,300,500,750,1 000,1 200 ng/mL的蒽贝素系列标准溶液,置于4℃下密封保存,备用。
1.5.2 内标溶液精密称取大黄素对照品10 mg,置于10 mL量瓶中,用甲醇溶解并定容,制成质量浓度为1.0 mg/mL的内标贮备液,置于4℃下保存,使用前用甲醇稀释至所需浓度。
1.5.3 蒽贝素药液精密称取羧甲基纤维素钠(CMC-Na) 0.50 g,加超纯水100 mL,加热搅拌使其溶解,超声振荡3 h,静置过夜制成0.5% CMC-Na水溶液。精密称取蒽贝素4.2 mg,加入5 mL 0.5% CMC-Na水溶液中,摇匀形成均匀悬浊液。
1.6 血浆样品处理取血浆样品100 μL,加入500 μg/mL大黄素20 μL、丙酮200 μL和乙酸乙酯200 μL,将混合物涡旋混合1 min,在4℃、转速1.2×104 r/min条件下离心20 min,取上清液通过浓缩仪蒸发溶剂至干燥,残渣加入甲醇100 μL复溶,超声振荡10 min后再次离心20 min,取上清液用0.22 μm滤膜滤过,取滤液1 μL,进样分析。
1.7 方法学考察 1.7.1 专属性取空白血浆、加入蒽贝素和内标物的空白血浆及大鼠灌胃给药蒽贝素1.5 h后的血浆,按1.6节的方法处理后,再按1.4节的色谱条件进样分析。
1.7.2 线性关系和检出限取空白血浆200 μL,依次加入蒽贝素系列标准溶液,制备10,50,150,300,500,750,1 000,1 200 ng/mL蒽贝素血浆样品。按1.6节的方法处理后,再按1.4节的色谱条件进样分析。以待测物质量浓度(x,ng/mL)为横坐标,待测物与内标的峰面积比值(y)为纵坐标进行线性回归,使用加权因子(w=1/x2)最小二乘法计算标准曲线方程。
1.7.3 精密度和准确度按1.7.2节的方法分别配制低、中、高质量浓度(150,500,1 000 ng/L,下同)的质控样品各6份,按1.6节的方法处理后,再按1.4节的色谱条件进样分析,考察日内精密度;连续测定3 d,考察日间精密度。同时,将理论质量浓度与实测质量浓度(x±s)进行比较,考察准确度。
1.7.4 回收率和基质效应按1.7.2节的方法分别配制低、中、高质量浓度的质控样品各6份,按1.6节的方法处理后,再按1.4节的色谱条件进样分析,记录蒽贝素与内标的峰面积比值(R1);精密量取空白血浆适量,共6份,按1.6节的方法处理后,加入相应质量浓度的蒽贝素标准溶液,使最终质量浓度与上述质控样品对应,以氮气流吹干,残渣用甲醇100 μL复溶,涡旋1 min后,1.2×104 r/min离心20 min,取上清液滤过后,进样分析,记录蒽贝素与内标物的峰面积比值(R2)。提取回收率=(R1/R2)×100%。
1.7.5 稳定性按1.7.2节的方法配制低、中、高质量浓度的质控样品各6份,分别于4℃储存24 h,-20℃储存20 d和冻融循环3次后,按1.6节的方法处理,再按1.4节的色谱条件进样分析,考察上述样品的稳定性。
1.8 药动学实验SD大鼠12只,禁食不禁水,12 h后,灌胃1.5.1节的蒽贝素药液15.0 mg/kg。分别于给药前及给药后0.083,0.25,0.50,0.75,1,2,3,4,6,8,10,12,24,36,48,72 h,从大鼠的眼底静脉采集血浆500 μL,保存至肝素钠管中,立即离心分离出上层血浆,按照1.6节的方法处理后,再按1.4节的色谱条件进样分析。采血过程(3 d)中对大鼠采取维持措施。采用内标法,按随行标准曲线计算大鼠血浆中蒽贝素的血药浓度,并采用3P97软件绘制平均药-时曲线,并对上述平均药-时曲线数据进行分析,拟合房室模型,同时计算相关药动学参数;采用SPSS 20.0软件对数据进行统计分析,数据以x±s表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果与分析 2.1 方法学考察结果蒽贝素与内标物的保留时间分别为3.6 min和2.9 min,能够完全分离,峰形好,血浆中内源性物质不干扰蒽贝素和内标物的测定(图 1)。蒽贝素血药浓度的线性范围为10—1 200 ng/mL,定量下限为10 ng/mL(信噪比为10:1),以信噪比3:1测得最低检测限为3 ng/mL。蒽贝素标准曲线回归方程为y=3.5816×10-4 x+0.4869(r=0.999 0)。精密度和准确度试验结果见表 1, 提取回收率和基质效应试验结果见表 2, 稳定性试验结果见表 3。

|
| A.空白血浆; B.空白血浆+蒽贝素+大黄素; C.大鼠灌胃给药后1.5 h的血浆样品;Ⅰ.蒽贝素, Ⅱ.大黄素 A.Blank rat plasma; B.Blank rat plasma spiked with embelin and IS; C.Rat plasma sample after gastric infusion of embelin for 1.5 h; Ⅰ.Embelin, Ⅱ.Emodin 图 1 大鼠血浆中蒽贝素和内标物MRM色谱图 Fig. 1 MRM chromatograms of embelin and IS blank in rat plasma |
| 浓度 Concentration (ng/mL) |
精密度RE (%) | 准确度RSD (%) | |||
| 日内考察 Intra-day investi-gation |
日间考察 Inter-day investi-gation | 日内考察 Intra-day investi-gation |
日间考察 Inter-day investi-gation |
||
| 150 | -8.8 | 14.0 | 5.0 | 6.2 | |
| 500 | -1.3 | 4.9 | 7.4 | 8.7 | |
| 1 000 | 5.5 | 4.2 | 1.4 | 5.1 |
|
| 浓度 Concentration (ng/mL) |
提取回收率 Extraction recovery (%) | 基质效应 Matrix effect (%) |
|||
| 平均值 Mean |
RSD | 平均值 Mean |
RSD | ||
| 150 | 91.0 | 12.8 | 96.6 | 13.5 | |
| 500 | 96.0 | 2.3 | 101.9 | 2.4 | |
| 1 000 | 89.2 | 7.0 | 94.6 | 7.4 |
|
| 考察条件 Investigation condition |
理论质量浓度 Theoretical mass concentration (ng/mL) |
实测质量浓度 (x±s) Measured mass concentration (ng/mL) |
RSD (%) |
| 4℃放置24 h Place at 4℃ for 24 h |
150 | 131.9±1.4 | 1.2 |
| 500 | 514.4±6.9 | 1.9 | |
| 1 000 | 1 061.2±7.9 | 0.8 | |
| -20℃储存20 d Storage at -20℃ for 20 d |
150 | 137.6±7.5 | 5.9 |
| 500 | 441.4±10.4 | 2.9 | |
| 1 000 | 1 066.2±4.9 | 0.7 | |
| 反复冻融3次 Repeated freezethaw for 3 times |
150 | 144.2±1.9 | 0.9 |
| 500 | 436.9±19.9 | 3.5 | |
| 1 000 | 1 043.6 ±13.3 | 1.4 |
2.2 药动学研究
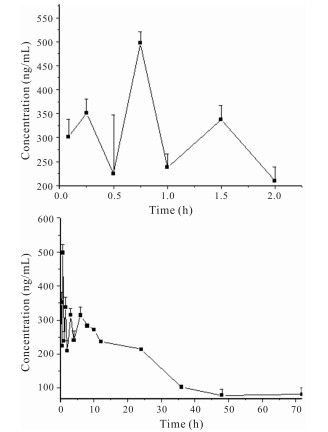
由图 2可知,大鼠灌胃给药蒽贝素后的药-时曲线符合二室模型。通过计算得到蒽贝素在大鼠体内的主要药动学参数,分别是分布半衰期(t1/2α)为(12.60±1.19) h、消除半衰期(t1/2β)为(15.95±0.73) h、表关分布容积(V)为(0.001±0.00) L/g、清除率(CL)为(0.001±0.00)、AUC0–∞为(3 717.48±269.82) ng·h/mL、AUC0–t为(3 596.31±271.93) ng·h/mL、药物从中央室消除的一级速率常数(K10)为(0.05±0.00) h、药物从中央室向周边室运转的一级速率常数(K12)为(0.01±0.00) h、药物从周边室向中央室转运的一级速率常数(K21)为(0.05±0.01) h。蒽贝素灌胃给药后在体内吸收较快,血药浓度在0.15 h达到最大值,蒽贝素的t1/2β值较大,说明其在体内消除速度缓慢。蒽贝素的药时曲线不规则,存在3个峰,可能是肝肠吸收、胃肠吸收、双部位吸收等原因导致的。
|
| 图 2 蒽贝素在大鼠体内的平均药-时曲线 Fig. 2 Average plasma-time curve of embelin in rats |
2.3 测定方法优化 2.3.1 内标物的选择
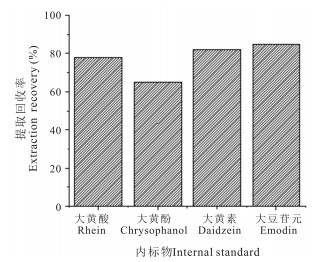
分别以大黄酸、大黄酚、大黄素和大豆苷元作为内标物进行试验,结果发现大黄素与蒽贝素结构相似,保留时间相近,无内源性干扰(图 3)。因此采用大黄素作为内标物。
|
| 图 3 血浆中不同内标物的提取回收率 Fig. 3 Extraction recovery of different internal standard in plasma |
2.3.2 色谱条件的优化
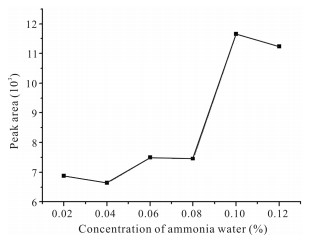
分别以甲醇-水和乙腈-水作为流动相进行分离效果试验,结果甲醇-水体系作流动相时蒽贝素与内标物的分离效果较好。为提高蒽贝素离子化强度,对不同体积分数的氨水溶液0.02%、0.04%、0.06%、0.08%、0.10%、0.12%进行试验,结果采用0.10%氨水-甲醇作流动相时,蒽贝素灵敏度最高(图 4)。因此采用0.10%氨水-甲醇为流动相。
|
| 图 4 流动相中氨水浓度对蒽贝素峰面积的影响 Fig. 4 Effect of the concentration of ammonia water in flow phase on peak areas of embelin |
2.3.3 质谱条件的优化
在正负离子监测模式下进行定量分析,分别对蒽贝素和内标物进行二次碎裂,根据离子扫描得到的二级质谱特征离子图确定碎裂的碰撞能量,最后在负离子监测模式下优化源内碎裂电压和碰撞池加速电压。因为蒽贝素结构中含有酚羟基,而该类化合物在氨水等挥发性碱性溶剂中容易形成负离子,所以适合在电喷雾离子源(ESI)质谱中采用负离子模式进行检测。
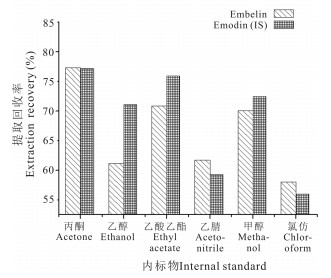
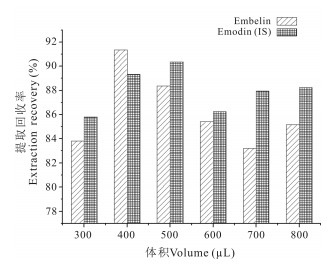
2.3.4 血浆样品处理条件的优化分别对不同蛋白沉淀剂(乙腈、乙醇和甲醇)和液液萃取剂(氯仿、丙酮和乙酸乙酯)的提取效率进行试验。结果采用丙酮和乙酸乙酯处理样品的提取效率较高(图 5)。对不同比例的丙酮和乙酸乙酯(1:0,1:1,2:1,3:1,4:1,0:1,V:V)的提取效率进行试验,结果体积比为1:1的丙酮和乙酸乙酯作萃取剂效果最好(图 6)。此外,还对不同体积的丙酮-乙酸乙酯(300,400,500,600,700,800 μL)对提取效率的影响进行试验。结果表明,采用400 μL丙酮-乙酸乙酯对血浆进行萃取的提取效率最高(图 7)。因此采用200 μL丙酮和200 μL乙酸乙酯作萃取剂。
|
| 图 5 不同沉淀试剂对血浆中分析物的提取回收率 Fig. 5 Extraction recovery of analytes in plasma by different precipitation reagents |

|
| 图 6 不同比例丙酮-乙酸乙酯对血浆中分析物的提取回收率 Fig. 6 Extraction recovery of analytes in plasma by different ratios of acetone-ethyl acetate |
|
| 图 7 不同体积丙酮-乙酸乙酯对血浆中分析物的提取回收率 Fig. 7 Extraction recovery of analytes in plasma by different volume of acetone-ethyl acetate |
3 结论
本文建立了一种以大黄素为内标物,测定大鼠血浆中蒽贝素的超高效液相色谱串联质谱(UPLC-MS/MS)分析方法,该方法简单、快速、准确、选择性强。并对大鼠口服蒽贝素给药血药浓度和药动学进行试验。研究表明,大鼠灌胃给药蒽贝素后的药-时曲线符合二室模型,蒽贝素口服灌胃给药后在体内吸收较快,血药浓度在0.15 h达到最大,t1/2β值较大,说明蒽贝素在体内消除速度缓慢。该研究结果为蒽贝素在生物体内的有效性及安全性评价提供了实验依据,为今后测定蒽贝素的生物功效及临床药学研究奠定基础。
| [1] |
刘布鸣, 韦宝伟, 黄艳, 等. 蒽贝素候选化学对照品制备及分析研究[J]. 中药新药与临床药理, 2018, 29(6): 794-798. |
| [2] |
刘布鸣, 邱宏聪. 中药化学对照品研究与开发[J]. 广西科学, 2019, 26(5): 461-465. |
| [3] |
GUPTA O P, ANAND K K, GHATAK B J, et al. Invitro anthelmintic activity of disalts of embelin[J]. Indian Journal of Experimental Biology, 1976, 14(3): 356-357. |
| [4] |
THIPPESWAMY B S, MAHENDRAN S, BIRADAR M I, et al. Protective effect of embelin against acetic acid induced ulcerative colitis in rats[J]. European Journal of Pharmacology, 2011, 654(1): 100-105. |
| [5] |
MAHENDRAN S, BADAMI S, MAITHILI V W. Evaluation of antidiabetic effect of embelin from Embelia ribes in alloxan induced diabetes in rats[J]. Biomedicine and Preventive Nutrition, 2010, 1(1): 25-31. |
| [6] |
DURG S, VEERAPUR V P, NEELIMA S, et al. Antidiabetic activity of Embelia ribes, embelin and its derivatives:A systematic review and meta-analysis[J]. Biomedicine and Pharmacotherapy, 2017, 86: 195-204. DOI:10.1016/j.biopha.2016.12.001 |
| [7] |
KOCAK C, KOCAK F E, AKCILAR R, et al. Molecular and biochemical evidence on the protective effects of embelin and carnosic acid in isoproterenol-induced acute myocardial injury in rats[J]. Life Sciences, 2016, 147: 15-23. DOI:10.1016/j.lfs.2016.01.038 |
| [8] |
郜一飞.植物提取物Embelin对小鼠肥胖的影响及机制研究[D].天津: 天津医科大学, 2016.
|
| [9] |
顾建华, 赵欣, 郭仁德, 等. 蒽贝素体外抑制人胰腺癌细胞Mia PaCa-2细胞增殖和诱导凋亡的作用及其机制研究[J]. 现代药物与临床, 2014, 29(8): 843-847. |
| [10] |
胡荣, 朱珂, 张潇月, 等. Embelin逆转白血病耐药细胞株K562/D对柔红霉素的耐药性[J]. 中国医科大学学报, 2010, 39(4): 272-275. |
| [11] |
喻军, 莫建光, 陈秋虹, 等. 金花茶叶多酚类成分HPLC指纹图谱研究[J]. 广西科学, 2019, 26(2): 238-244. |
| [12] |
CHEN X Q, ZHU P C, LIU B M, et al. Simultaneous determination of fourteen compounds of Hedyotis diffusa Willd extract in rats by UHPLC-MS/MS method:Application to pharmacokinetics and tissue distribution studys[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 157: 490-512. |
| [13] |
李丹凤, 朱健萍, 卢日刚. 药物杂质结构鉴定的研究进展[J]. 广西科学院学报, 2019, 35(4): 281-287. |



