2. 桂林华艺生物科技有限公司, 广西桂林 541805
2. Guilin Huayi Biotechnology Co., Ltd., Guilin, Guangxi, 541805, China
黄芪为豆科植物膜荚黄芪(Astragalus membranaceus)或蒙古黄芪(A. membranaceus var. mongholicus)的干燥根,黄芪多糖为黄芪的主要活性成分,临床常用作免疫增强剂,抗细菌、抗病毒药物[1-2]。随着集约化养殖业的发展,畜禽应激性增加,免疫力持续下降,发病率逐年攀升。自2006年猪高热病爆发以来,黄芪多糖成为“明星药物”,在市场上供不应求,造成目前市场上黄芪多糖产品繁多、价格各异、质量参差不齐,存在掺假和以次充好等现象。
黄芪多糖常用的鉴别方法有物理方法(颜色、手感、味道和溶解情况)和化学方法[3-4](醇沉淀法、高热法和高效薄层色谱仪鉴别法),这些方法只能大致鉴别,不能确定产品的品质。目前常用于测定黄芪多糖含量的方法为紫外分光光度法[5-6]。该方法以葡萄糖为对照品,采用苯酚-硫酸显色法测定总多糖含量,因此不能辨别是否含有葡萄糖、麦芽糊精。多糖由各种单糖组成,来自同一植物资源的多糖其单糖组成及构成比例在一定范围内波动,通过对单糖的检测可对药材及产品进行鉴别。目前已有学者采用柱前衍生化高效液相色谱法和乙酰化气相色谱法等[7-11],对不同来源黄芪多糖的单糖成分进行分析。然而这些方法都需要衍生化处理才可以分析,前处理烦琐,还可能引入杂质,干扰测定结果。
示差折光检测器是一种高度稳定、灵敏的通用型检测器。现行测定单糖的国家标准GB/T 22221—2008和GB/T 22222—2008采用的就是高效液相色谱示差折光法[12]。采用该方法检测黄芪多糖的研究报道较少,且未见不同厂家黄芪多糖的质量评价。为评价不同来源黄芪多糖产品的优劣,给消费者提供科学评价方法与依据,本研究应用高效液相色谱示差折光法测定黄芪多糖的组成与构成,同时应用紫外分光光度法、物理鉴别对多个黄芪多糖产品进行比较研究。
1 材料与方法 1.1 材料和试剂从不同来源获取9批黄芪多糖产品(A—I),所有产品均为粉末状。其中,产品A、B、E来自桂林华艺生物科技有限公司,产品C、D为桂林华艺生物科技有限公司从别的厂家收集得到,产品F-I为从淘宝网上采购(产品H产地为河北石家庄,产品F、G和I均产自河南省)。葡萄糖和阿拉伯糖标准品为本实验室自制,纯度99.9%;其他试剂均为国产分析纯。实验用水全部采用超纯水。
1.2 仪器设备T6型紫外可见分光光度计(北京普析通用仪器有限责任公司);日本岛津高效液相色谱仪LC-20AT,包括RID-10A示差检测器、控制器CBM-20A、在线脱气器DGU-20A5、泵LC-20AT和手动进样器7255;柱温箱(Millipore公司);Transgenomic Ca2+分析柱(300 mm×6.5 mm);50 L YXQ-LS-SII立式灭菌锅(上海博讯实业有限公司医疗设备厂);电子天平(梅特勒AT-200);台式离心机(珠海黑马医学仪器有限公司);B3500S-MT超声清洗器(上海必能信超声有限公司);DDS-11A雷磁电导率仪(上海仪电科学仪器股份有限公司);HH-S数显恒温水浴锅(郑州长城科工贸有限公司);超纯水仪(Millipore公司)。
1.3 方法 1.3.1 紫外分光光度法(UV)[5-6] 1.3.1.1 对照溶液的制备准确称取在105℃干燥至恒重的无水葡萄糖500 mg,置于100 mL量瓶中,加水溶解并稀释至刻度,摇匀,精密量取10 mL葡萄糖溶液置于100 mL量瓶中,加水至刻度,即得。
1.3.1.2 供试品溶液制备准确称取黄芪多糖粉末1.000 g置于250 mL量瓶中,加20 mL水溶解,再加入30%硫酸锌溶液5 mL,水浴加热5 min后,在振摇下加入亚铁氰化钾试液5 mL,冷却后加水至刻度,摇匀,滤过,弃初滤液,取续滤液5 mL置于200 mL量瓶中,加水至刻度,摇匀,即得。
1.3.1.3 含量测定准确量取对照品溶液与供试品溶液各2 mL,分别置于10 mL量瓶中,各加入2%苯酚溶液0.5 mL,硫酸5 mL,摇匀,水浴加热30 min,冷却,加水稀释至刻度,摇匀,采用紫外分光光度法在490 nm处分别测定吸收值,以葡萄糖浓度为x轴,吸光值为y轴,绘制标准回归曲线,并根据标准回归曲线进行回归分析,计算样品含量。
1.3.1.4 精密度、回收率和稳定性试验精密度:取同一浓度葡萄糖标准品1 d内重复测定6次,计算葡萄糖日内RSD。
回收率:将不同浓度的葡萄糖标准品加入6份样品中,测定平均回收率,计算RSD。
稳定性:取3种不同浓度的无水葡萄糖溶液,分别水浴加热0,5,10,20,30 min,在490 nm处分别测定吸收值。
1.3.2 黄芪多糖的物理鉴别法分别称取9批黄芪多糖供试品1.0 g,置于100 mL玻璃三角瓶中,观察它们的颜色和粒度,看是否有白色颗粒;放置30 min后,摇晃三角瓶观察是否有挂壁现象;加入25 mL 18 g/L稀硫酸溶液溶解,观察溶解情况,摇晃三角瓶,观察是否有泡沫产生。水解后摇匀,取1.5 mL水解液10 000 r/min离心5 min,观察沉淀量。
1.3.3 高效液相色谱(HPLC)法 1.3.3.1 黄芪多糖的水解参照文献[13]的方法并适当改进,精密称取黄芪多糖产品粉末1.0 g置于100 mL三角瓶中,加入25 mL 18 g/L H2SO4溶液,于超声清洗器中均匀分散,盖上橡胶塞,置于立式灭菌锅内121℃水解90 min。放冷,水解结束后补足蒸发的水分。过滤除去溶液中的不溶物,取0.5 mL水解液,先加入4 mL水稀释,再加1.5 mL左右0.1 mol/L NaOH溶液调pH为中性,最后定容至10 mL;加入混合树脂1.2 g (m阴离子树脂 :m阳离子树脂=2:1)和少量活性炭,放摇床上,脱盐后电导仪检测电导降至5 μs/cm以下时,用0.45 μm微孔滤膜过滤。
1.3.3.2 HPLC测定条件岛津高效液相色谱仪器、LC solution色谱工作站、色谱柱Transgenomic Ca2+、RID-10A示差检测器,流动相为超纯水,流速0.5 mL/min,柱温85℃,进样量20 μL。
1.3.3.3 标准曲线的绘制取6个不同浓度的葡萄糖和阿拉伯糖混合标准品溶液,按照HPLC条件进行测定,以加入标准溶液浓度为横坐标x,以相应单糖峰面积为纵坐标y,绘制标准曲线。根据信噪比确定检出限(RSN=3)和定量限(RSN=10)。
1.3.3.4 精密度、回收率和稳定性试验精密度:取同一浓度葡萄糖和阿拉伯糖标准品1 d内重复测定6次,分别计算其日内RSD。
回收率:分别取葡萄糖、阿拉伯糖加水配制成不同浓度的标准品,再分别加入6份黄芪多糖样品中,测定平均回收率,计算RSD。
稳定性:取同一批黄芪多糖样品,分别水解0,1,2,4,8,24 h后,测定葡萄糖和阿拉伯糖的浓度,计算RSD。
1.3.3.5 样品测定分别适量取7家企业生产的9批黄芪多糖产品,按1.3.3.1节的方法水解后处理制成供试品溶液,按照HPLC条件进行含量测定,与单糖标准品进行比对,分析样品水解产物,并根据标准曲线计算黄芪多糖样品水解后葡萄糖和阿拉伯糖的浓度。
2 结果与分析 2.1 黄芪多糖产品总多糖含量 2.1.1 标准曲线、精密度、回收率和稳定性试验研究结果显示,葡萄糖标准回归曲线为y= 0.2122x-0.00612,R2=0.998 0,浓度区间为0.05—1.50 g/L,表明线性关系较好。葡萄糖日内RSD为0.72% (n=6),说明该方法的精密度良好;平均回收率为99.20%,RSD为0.55%,表明该方法的回收率符合要求;显色反应时间在30 min内时,溶液吸收度无明显变化,稳定性较好。
2.1.2 样品含量测定对9批产品中黄芪总多糖进行含量测定,结果如表 1所示,9批黄芪多糖产品的总多糖含量差别均比较大,有5批产品总多糖含量达到0.600 0 g/g以上,其中产品C、H的总多糖含量超过0.900 0 g/g,而另外4个产品总多糖含量较低,为0.100 0—0.300 0 g/g。
| 批号 Number |
黄芪总多糖含量 Total polysaccharides content (g/g) |
| A | 0.623 4 |
| B | 0.637 2 |
| C | 0.900 8 |
| D | 0.291 2 |
| E | 0.731 6 |
| F | 0.149 9 |
| G | 0.143 0 |
| H | 0.963 3 |
| I | 0.185 5 |
2.2 黄芪多糖的性状
图 1中(a)为9批黄芪多糖产品粉末外观,(b)为9批产品溶解在稀硫酸中的产泡情况,(c)为9批产品水解离心后的情况。由图 1及表 2可以看出,9批黄芪多糖产品颜色差别比较大,颜色较浅的有产品A、B、E,产品F和G的颜色最深,为红褐色。各产品摇晃后,大部分有挂壁现象,只有产品D和I没有。从溶解情况来看,产品C溶解速度最快,溶解最好,溶液透亮,离心后没有沉淀;产品D最难溶,有大量的不溶物,离心后沉淀量也最多。从产泡情况来看各产品也有很大的差别,有的产品摇晃后无泡,如产品C和H;有的有少量泡沫,如产品D—G、I;产泡沫量最大的是产品A和B。

|
| 图 1 9批黄芪多糖产品的外观、溶解后产泡及水解液情况 Fig. 1 Appearance, foam production after dissolution and hydrolysis of nine batches of Astragalus polysaccharides |
| 批号 Number |
质量 Weight (g) |
粉末颜色 Color of powder |
摇晃后挂 壁情况 Wall handing situation after shaking |
溶解情况 Dissolution |
溶液颜色 Color of solution |
泡沫情况 Situation of foam |
| A | 1.002 9 | 淡黄色 Faint yellow |
有 Yes |
不太好溶,少量沉淀 Not easy to dissolve, small amount of precipitate |
淡黄褐色 Pale yellow brown |
大量泡沫 Large amount of foam |
| B | 1.007 5 | 淡黄色 Faint yellow |
有 Yes |
不太好溶,少量沉淀 Not easy to dissolve, small amount of precipitate |
淡黄褐色 Pale yellow brown |
大量泡沫 Large amount of foam |
| C | 1.009 6 | 棕黄色 Tan |
有 Yes |
易溶,无沉淀 Easy to dissolve, no precipitate |
黄褐色 Yellow brown |
无泡沫 No foam |
| D | 1.016 1 | 黄绿色 Greenish yellow |
无 No |
难溶,有大量沉淀 Difficult to dissolve, large amount of precipitate |
淡黄褐色 Pale yellow brown |
少量泡沫 Small amount of foam |
| E | 1.009 5 | 类白色 Off-white |
有 Yes |
不太好溶,有沉淀 Not easy to dissolve, precipitate |
淡黄色 Pale yellow |
少量泡沫 Small amount of foam |
| F | 1.008 7 | 红褐色 Reddish- brown |
有 Yes |
不太好溶,有沉淀 Not easy to dissolve, precipitate |
深褐色 Dark brown |
少量泡沫 Small amount of foam |
| G | 1.012 2 | 红褐色 Reddish- brown |
有 Yes |
不太好溶,有沉淀 Not easy to dissolve, precipitate |
深褐色 Dark brown |
少量泡沫 Small amount of foam |
| H | 1.000 0 | 棕黄色 Tan |
有 Yes |
不太好溶,少量沉淀 Not easy to dissolve, small amount of precipitate |
黄色 Yellow |
无泡沫 No foam |
| I | 1.030 4 | 褐色 Brown |
无 No |
不太好溶,少量沉淀 Not easy to dissolve, small amount of precipitate |
黄褐色 Yellow brown |
少量泡沫 Small amount of foam |
2.3 黄芪多糖单糖组成 2.3.1 标准曲线、线性范围和检出限测定结果
葡萄糖标准曲线为y = 273649x+377.87,R2=1,浓度区间为0—2.0 g/L;葡萄糖的检出限为0.003 1 g/g,定量限为0.009 3 g/g。阿拉伯糖标准曲线为y=303410x-15.929,R2=1,浓度区间为0.0—0.5 g/L,检出限为0.002 1 g/g,定量限为0.006 3 g/g。
2.3.2 精密度、回收率、稳定性试验葡萄糖和阿拉伯糖日内RSD分别为0.67%(n=6)、0.93%(n=6),表明仪器精密度良好;葡萄糖和阿拉伯糖的平均回收率分别为99.28%、99.10%,RSD均小于1.00%,表明该方法的回收率符合要求;葡萄糖和阿拉伯糖峰面积RSD分别为1.86%、1.95%,说明样品溶液在24 h稳定。
2.3.3 9批黄芪多糖样品中葡萄糖和阿拉伯糖的含量通过与单糖标准品进行比对,可确定黄芪多糖水解后主要含有葡萄糖和阿拉伯糖(图 2)。从表 3可以看出,黄芪多糖水解后各单糖含量有很大差别。产品A、B、E水解后的葡萄糖含量为0.36—0.40 g/g,产品C和H葡萄糖含量大于0.60 g/g;其他产品的葡萄糖含量很低,小于0.1 g/g。这个结果与紫外分光光度检测结果相吻合:总多糖含量高的,则水解后葡萄糖单糖含量也相应地高。同时,样品中葡萄糖和阿拉伯糖含量比例有很大的差别。产品A、B、E的峰面积比分别为5.70:1,5.28:1,5.71:1;在产品C和H中,水解后的葡萄糖与阿拉伯糖的峰高相差较大,葡萄糖含量很高,而阿拉伯糖含量相对较少,两者的峰面积比在15:1左右;在产品D、F、G和I中,检测到葡萄糖和阿拉伯糖的峰都很小,所含葡萄糖的量很少,两者的峰面积比为(3.34—1.75):1。
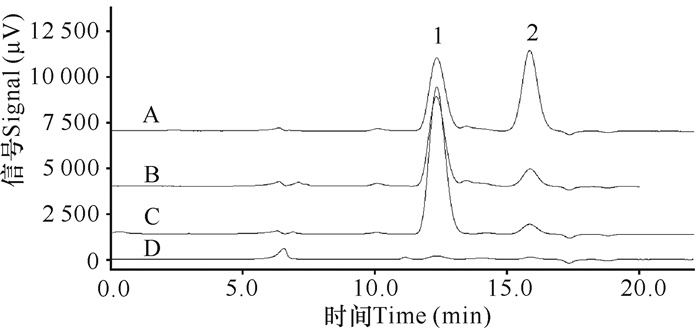
|
| 1:葡萄糖Glucose2:阿拉伯糖Arabinose 图 2 单糖对照品(A)、黄芪多糖产品A (B)、黄芪多糖产品H (C)和黄芪多糖产品I (D)的HPLC色谱图 Fig. 2 HPLC chromatograms of monosaccharide reference substances (A), Astragalus polysaccharides product A (B), H (C) and I (D) |
| 批号 Number |
葡萄糖含量 Content of glucose (g/g) |
阿拉伯糖含量 Content of arabinose (g/g) |
葡萄糖:阿拉 伯糖峰面积比 Peak area ratio of glucose to arabinose |
| A | 0.423 0 | 0.067 0 | 5.70 |
| B | 0.364 2 | 0.062 3 | 5.28 |
| C | 0.607 9 | 0.035 9 | 15.27 |
| D | 0.096 5 | 0.026 2 | 3.34 |
| E | 0.409 8 | 0.064 8 | 5.71 |
| F | 0.025 3 | 0.011 5 | 2.04 |
| G | 0.019 8 | 0.006 4 | 2.89 |
| H | 0.622 8 | 0.035 6 | 15.76 |
| I | 0.012 4 | 0.006 7 | 1.75 |
3 讨论 3.1 黄芪多糖产品外观性状的比较
李桂菊[3]和杜继红等[4]认为:黄芪多糖外观一般为浅黄色和浅棕色,纯度较高的呈淡黄白色;具有吸湿性和挂壁现象,可溶解于水中,但溶解速度较慢,溶解后会产生泡沫。而质量差的黄芪多糖颜色较深,溶解性不好,有很多沉淀,产泡较少。此外,黄芪多糖产品如果加入葡萄糖复合物、麦芽糖糊精复合物等会出现溶解速度加快的现象[3]。本实验通过对黄芪多糖产品外观性状的比较发现,产品A、B为淡黄色,产品E为类白色,具有吸湿性和挂壁现象,溶解后产生气泡,沉淀较少。产品C为黄褐色,最容易溶解且无气泡产生。产品D、F、G和I则呈颜色较深、难溶解、沉淀多、气泡少的特点。仅从外观判断,产品A、B、E这3个批次质量较好,其余批次质量较差。此方法简便,但无法判断产品的纯度。
3.2 紫外分光光度法分析黄芪多糖产品李桂菊[3]认为,黄芪多糖以葡萄糖计,口服液级应不低于65%,针用级应不低于70%。而杜继红等[4]认为,就目前最佳技术条件而言,动物保健品行业中唯一取得黄芪多糖新药证书的产品——黄芪多糖粉中多糖含量不超过70%,市场上出现的含量80%—98%的黄芪多糖产品基本是在黄芪多糖里面加葡萄糖的假冒伪劣产品。本研究通过紫外分光光度法检测总多糖含量,发现产品A、B、C、E和H的总多糖含量大于60%,其中产品C和H的总多糖含量大于90%,其余产品的总多糖含量为14%—29%。紫外分光光度法是以葡萄糖为对照品进行含量测定,可以判断质量较差的产品(如产品D、F、G和I总多糖含量低于30%),但是无法对掺假(加入葡萄糖和麦芽糖)的产品进行鉴别。因此,仅仅从外观性状和紫外分光光度法测总多糖含量鉴别黄芪产品的质量显然不够全面。
3.3 HPLC示差法测定黄芪多糖产品黄芪多糖是从黄芪中提取出来的,由于黄芪品种、产地不同,黄芪多糖的单糖组成和比例都有差别。陈虎虎等[11]用柱前衍生化-高效液相色谱法测定蒙古黄芪多糖中单糖的组成,发现其水解后主要有阿拉伯糖、半乳糖醛酸和葡萄糖,含量比分别为1:0.94:5.56。王赵等[14]对注射用黄芪多糖单糖组分进行分析,发现其单糖主要由阿拉伯糖、半乳糖和葡萄糖组成,峰面积比为1:0.429:8.430。HPLC示差法不需要衍生化,水解处理后就可以分析单糖的组成。本研究通过测定发现黄芪多糖的单糖主要组成是阿拉伯糖和葡萄糖,其中产品A、B和E中,阿拉伯糖和葡萄糖的峰面积比接近1:5,这些产品的单糖组成与文献结果[11, 14]相近。姚丹等[7]用气相色谱分析黄芪多糖单糖组分,测定阿拉伯糖-果糖-葡萄糖-甘露糖的摩尔构成比例为1.00:10.30:24.60:0.46,本研究产品C和H的测定结果接近这个比值。而产品D、F、G和I的阿拉伯糖和葡萄糖峰面积比为1:(1.75—3.34),与文献[7, 11, 14]报道的结果相差较远。
4 结论本研究采用紫外分光光度法测定各批次黄芪多糖总多糖含量,用物理方法观察黄芪外观性状,用高效液相色谱示差折光法分析黄芪多糖的单糖组成及含量,同时对黄芪多糖产品进行鉴定,能客观准确地反映出产品的质量。通过对9批黄芪多糖产品的检测后认为:黄芪多糖产品中,颜色较浅、溶解速度慢、可产大量的泡沫、总多糖含量为0.60—0.75 g/g、单糖的主要成分是葡萄糖和阿拉伯糖、峰面积比为(4—7):1的产品,是质量比较优的产品,如产品A、B和E。总多糖含量很高(大于0.90 g/g)、溶解速度很快、产泡不多、葡萄糖与阿拉伯糖的峰面积比偏大(15:1)的产品,则掺入了葡萄糖复合物等其他东西,产品质量不太好,如C和H产品。对于那些颜色深、起泡少、总多糖和单糖含量都很低的产品,其质量很差,如产品D、F、G和I。本方法简便、快速,且更全面地评价了各黄芪多糖产品的质量,可为鉴别黄芪多糖产品品质提供参考。
| [1] |
单俊杰, 王顺春, 刘涤, 等. 黄芪多糖的化学和药理研究进展[J]. 上海中医药大学学报, 2000, 14(3): 61-64. |
| [2] |
刘瑞生. 黄芪多糖对猪免疫功能影响的研究进展[J]. 养猪, 2018(5): 20-24. |
| [3] |
李桂菊. 黄芪多糖的几种鉴别方法[J]. 兽药, 2011(5): 238. |
| [4] |
杜继红, 贾召锋, 侯晓礁, 等. 黄芪多糖的组成及真伪鉴别[J]. 当代畜牧, 2013(3): 42-43. |
| [5] |
武志勇, 朱萍. 黄芪提取物中黄芪多糖的检测和掺假鉴别方法[J]. 中国牧业通讯, 2009(22): 38-39. |
| [6] |
杨淑萍. 紫外分光光度法检测黄芪多糖含量[J]. 现代畜牧科技, 2019(8): 7-9. |
| [7] |
姚丹, 王宏军. 黄芪多糖单糖组分的气相色谱分析[J]. 安徽农业科学, 2012, 40(9): 5128-5129. |
| [8] |
陈艳蕊, 毛欣月, 金文闻, 等. 黄芪多糖结构及其单糖组成的气相色谱-质谱研究[J]. 现代生物医学进展, 2011, 11(23): 4632-4635. |
| [9] |
颜军, 易勇, 邬晓勇, 等. 黄芪多糖的相对分子量测定及单糖组成分析[J]. 食品科技, 2012, 37(12): 278-283. |
| [10] |
丘成桢, 王志香, 陈淑芳, 等. 米糠多糖与黄芪多糖单糖组分鉴定及对机体免疫功能的影响[J]. 中国家禽, 2015, 37(10): 57-60. |
| [11] |
陈虎虎, 孙静, 杨金颖, 等. 柱前衍生化-高效液相色谱法测定蒙古黄芪多糖中单糖的组成[J]. 现代药物与临床, 2012, 27(5): 468-470. |
| [12] |
热孜万古力·赛买提, 陈士恩, 高丹丹, 等. 单糖高效液相色谱法检测技术研究进展[J]. 食品与机械, 2018, 34(2): 185-190. |
| [13] |
周玉恒, 覃香香, 蔡爱华, 等. 过氧化物漂白对蔗渣木聚糖提取的影响[J]. 食品与发酵工业, 2012, 38(5): 232-235. |
| [14] |
王赵, 赵剑锋, 王莹, 等. 注射用黄芪多糖单糖鉴别及游离单糖检查方法研究[J]. 中国药业, 2018, 27(11): 21-24. |



