2. 广西壮族自治区中国科学院广西植物研究所, 广西植物功能物质研究与利用重点实验室, 广西桂林 541006
2. Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
紫珠属Callicarpa是马鞭草科Verbenanceae的一个大属,该属约有190种,主要分布于热带和亚热带亚洲以及大洋洲,少数分布于美洲,极少数种延伸分布到亚洲和北美洲的温带地区。我国约有46种,是重要的紫珠资源原产地,该属中有些种类可供药用,有些可供栽培观赏[1]。尖尾枫Callicarpa longissima为紫珠属灌木或小乔木,又名粘手风、穿骨枫(广西)、雪突、牛舌广(福建),生长于海拔1 200 m以下的荒野、山坡、谷地丛林中,产于广东、福建、江西、广西、四川、台湾,越南也有分布。尖尾枫全株可供药用,有止血镇痛、散瘀消肿、祛风湿的功效[1]。其味辛微苦,性温,入肺、肝二经,常用于治疗风湿骨痛、关节痛、跌打损伤、风寒咳嗽、腹痛、风湿性腰腿痛、瘫痪、小儿麻痹后遗症、产后风、骨折、毒蛇咬伤等[2]。尖尾枫作为一种特色民族药,在广西壮族、瑶族等少数民族中具有悠久的使用历史,如广西特色瑶药“虎牛钻风”中“七十二风”的粘手风就是尖尾枫[3]。近年来,尖尾枫的药用价值受到越来越多的关注,其化学成分及药理活性的研究也取得了一定的进展。王红刚等[4]、陈伟波[5]、杜勤等[6]研究了尖尾枫的药材性状,尖尾枫叶常皱缩卷曲,纸质、易碎,新鲜时稍粘手,Liu等[7]建立可以快速鉴定和分析尖尾枫的直接喷雾质谱法。本文对尖尾枫的化学成分、药理活性及质量标准研究进展进行综述,为其进一步的研究提供参考。
1 化学成分据国内外报道,从尖尾枫中分离鉴定出来的化学成分主要有萜类、苯丙素类、木脂素类、黄酮类、甾醇类以及挥发油等[8-15]。
1.1 萜类 1.1.1 二萜类Liu等[8]从尖尾枫的乙酸乙酯部位中分离得到6个二萜类化合物,分别为callilongisin A (1)、callilongisin B (2)、callilongisin C (3)、callilongisin D (4)、3-oxoanticopalic acid (5)、(E)-6β-hydroxylabda-8(17), 13-dien-15-oic acid (6)。高微等[10]通过溶剂萃取及柱色谱法从尖尾枫氯仿部位分离得到1个二萜类化合物,即seco-hinokiol(7)。袁经权等[11-12]从尖尾枫中分离得到3个二萜类化合物,分别为andrographlide (8)、neoandrographolide (9)、longissimoside E (10),其中化合物9、10为二萜苷。以上各化合物的化学结构式如图 1所示。
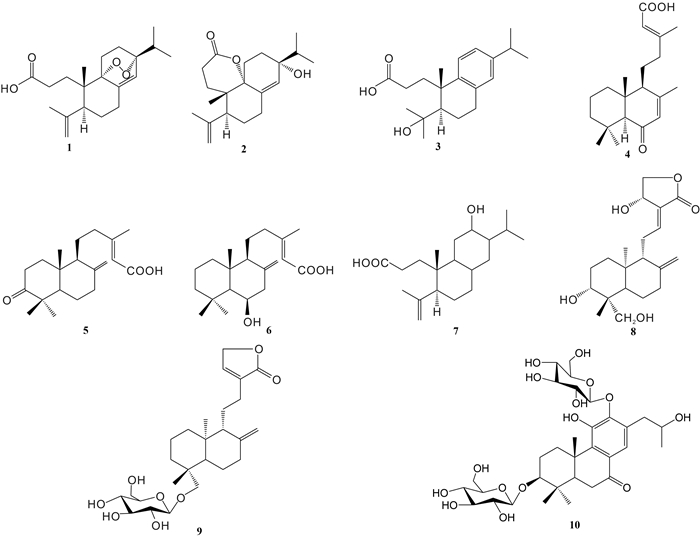
|
| 图 1 从尖尾枫中分离的二萜类化合物 Fig. 1 Diterpenes isolated from Callicarpa longissima |
1.1.2 三萜类
Liu等[8]从尖尾枫的乙酸乙酯部位中分离得到1个三萜类化合物,即乌苏酸(ursolic acid,11)。高微等[10]通过溶剂萃取及柱色谱法从尖尾枫氯仿部位分离得到6个三萜类化合物,分别为乌苏酸(ursolic acid,11)、齐墩果酸(oleanolic acid,12)、乌发醇(uvaol,13)、高根二醇(erythrodiol,14)、野鸦椿酸(euscaphic acid,15)、山楂酸(maslinic acid,16)。袁经权[11]从尖尾枫中分离得到5个三萜类化合物,分别为乌苏酸(ursolic acid,11)、齐墩果酸(oleanolic acid,12)、野鸦椿酸(euscaphic acid,15)、山楂酸(maslinic acid,16)、2α, 3α-dihydroxy-urs-12-en-28-oic acid (17)。以上各化合物的化学结构式如图 2所示。
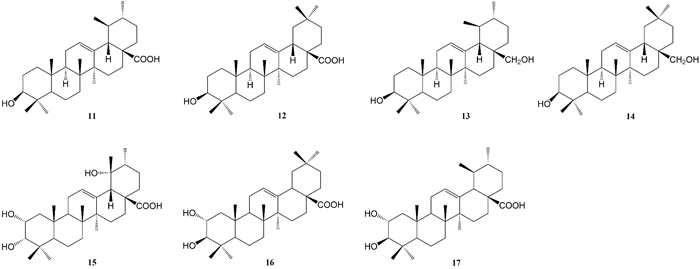
|
| 图 2 从尖尾枫中分离的三萜类化合物 Fig. 2 Triterpenes isolated from Callicarpa longissima |
1.2 苯丙素类
袁经权等[11-12]从尖尾枫中分离得到15个苯丙素类化合物,分别为longissimoside A (18)、longissimoside B (19)、longissimoside C (20)、longissimoside D (21)、orobanchoside (22)、leucosceptoside A(23)、isocampneoside Ⅱ(24)、methyl caffeate (25)、acteoside(26)、isoacteoside(27)、forsythoside B(28)、alyssonoside (29)、poliumoside (30)、peiioside A (31)、2-(3-hydroxy-4-methoxy-phenyl)-ethyl-O-(R-L-rhamnosyl)-(1→3)-O-(R-L-rhamnosyl)- (1→6)-4-O-E-feruloyl-β-D-glucopyranoside (32)。高微等[13]利用柱色谱和制备型高效液相色谱法从尖尾枫的地上部位分离得到1个苯丙苷类化合物,即acteoside(26)。除化合物25为苷元外,以上各化合物均为苯丙苷类化合物,具体化学结构式如图 3所示。
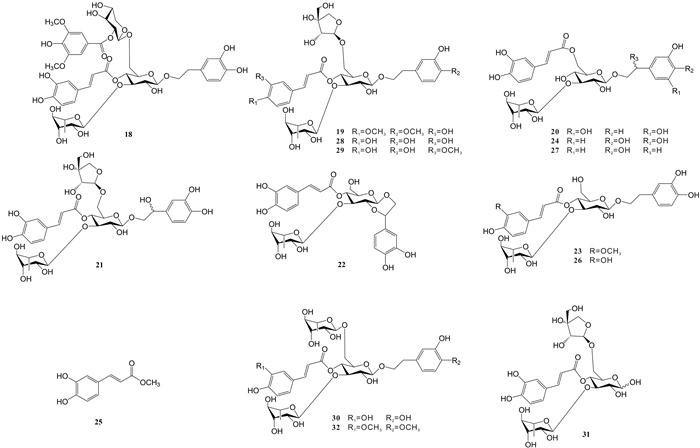
|
| 图 3 从尖尾枫中分离的苯丙素类化合物 Fig. 3 Phenylpropanoids isolated from Callicarpa longissima |
1.3 木脂素类
袁经权[11]从尖尾枫中分离得到10个木脂素类化合物,分别为arctiin (33)、lappaol F (34)、lappaol A(35)、lsolappaol A (36)、lappaol E (37)、matairesinol (38)、arctigan A (39)、(+)-lyoniresinol-3α-O-β-glucopyranoside (40)、(-)-lyoniresinol-3α-O-β-glucopyranoside (41)、(7S, 8S, 8′R)-4, 4′, 9-trihydroxy-3, 3′, 5, 5′, -tetramethoxy-7, 9′-epoxylignan-7′-one-9-O-β-D-glucopyranoside (42)。以上各化合物的化学结构式如图 4所示。
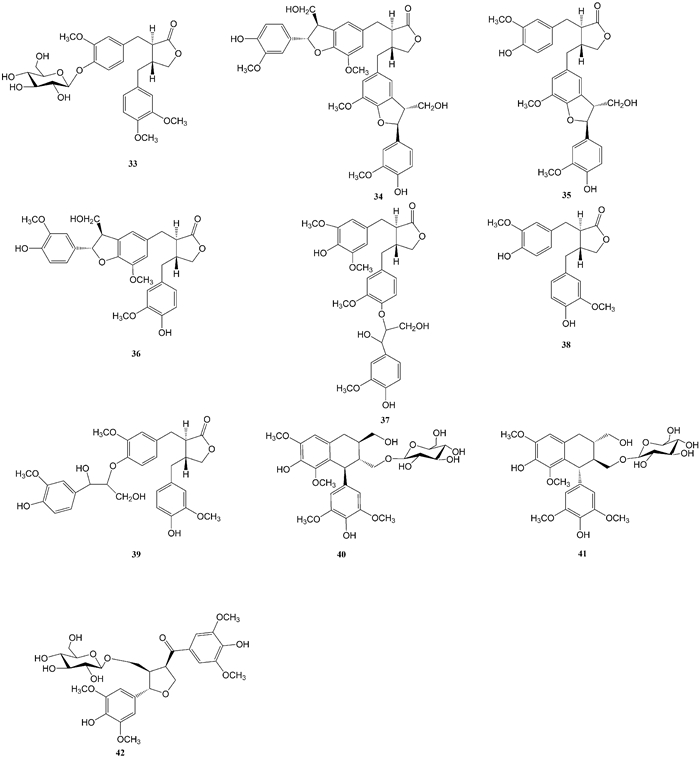
|
| 图 4 从尖尾枫中分离的木脂素类化合物 Fig. 4 Lignans isolated from Callicarpa longissima |
1.4 黄酮类
王红刚等[15]采用分光光度法测定出尖尾枫提取物中总黄酮的含量为6.86%。Liu等[8]从尖尾枫的乙酸乙酯部位中分离得到2个黄酮类化合物,即artemetin (43)、5-hydroxy-3, 6, 7, 4′-tetramethoxyflavone (44)。高微等[10]通过溶剂萃取及柱色谱法从尖尾枫氯仿部位分离得到1个黄酮类化合物金合欢素(acacetin,45)。袁经权[11]从尖尾枫中分离得到5个黄酮类化合物,分别为scutellarein 7-O-β-D-glucopyranoside (46)、casticin (47)、cirsimaritin (48)、apigenin (49)、luteolin-7-O-β-D-glucopyranoside (50)。以上各化合物的化学结构式如图 5所示。
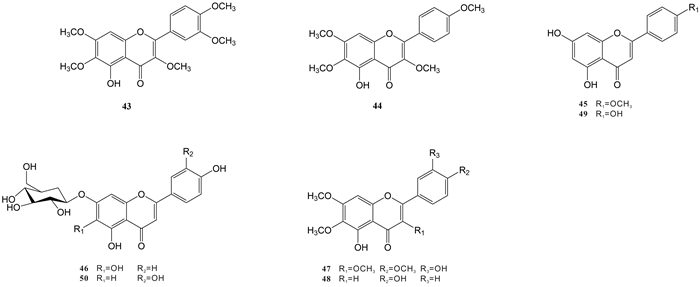
|
| 图 5 从尖尾枫中分离的黄酮类化合物 Fig. 5 Flavonoids isolated from Callicarpa longissima |
1.5 甾醇类
高微等[10]通过溶剂萃取及柱色谱法从尖尾枫氯仿部位分离得到2个甾醇类化合物,即β-谷甾醇(β-sitosterol,51)、胡萝卜苷(daucosterol,52)。袁经权[11]从尖尾枫中分离得到2个甾醇类化合物,即胡萝卜苷(daucosterol,52)、stigmasterol (53)。以上各化合物的化学结构式如图 6所示。
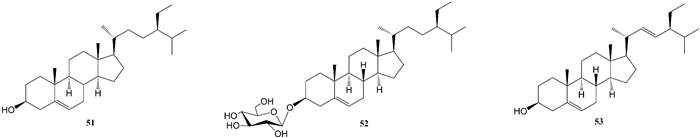
|
| 图 6 从尖尾枫中分离的甾醇类化合物 Fig. 6 Sterols isolated from Callicarpa longissima |
1.6 挥发性成分
高微等[9]采用硅胶柱层析、甲酯化和气相色谱-质谱法,用石油醚作洗脱溶剂, 从尖尾枫石油醚部位鉴定得到可巴烯(Copaene)、石竹烯(Caryophyllene)、香树烯(Alloaromadendrene)等11个化合物,占总量的76.18%,其中烯烃类占68.49%;用石油醚-乙酸乙酯混合溶剂作洗脱溶剂,从尖尾枫石油醚部位鉴定出棕榈酸(Palmitic acid)、肉豆蔻酸(Myristic acid)等19个化合物,占总量的83.27%,主要为脂肪酸、脂肪醇类,占50.68%,其中棕榈酸含量最高,达到14%。高微等[14]采用毛细管气相色谱、气相色谱-质谱联用(GC-MS)等现代色谱分析技术,从尖尾枫枝叶挥发油中鉴定出28个化合物,从尖尾枫花挥发油中鉴定出20个化合物;新鲜尖尾枫枝叶与花挥发油中的主要特征成分基本相同,主要含有α-红没药醇、β-石竹烯、(E)-β-金合欢烯等17个共有成分;α-红没药醇在花中含量为51.89%,在枝叶中含量为28.07%;β-石竹烯在花含量为4.67%,在枝叶中含量为12.02%。挥发性成分的化学组成如表 1。
| 化合物 Compounds |
分子式 Molecular formula |
分子量 Molecular weight |
文献来源 References |
| 可巴烯Copaene | C15H24 | 204 | [9] |
| 石竹烯Caryophyllene | C15H24 | 204 | [9] |
| 香树烯Alloaromadendrene | C15H24 | 204 | [9] |
| 菖蒲烯Calamenene | C15H22 | 202 | [9] |
| 1, 1,4,7-四甲基-1a,2,3,4,4a,5,6,7b-八氢-1H-环丙烯并[e]薁α-gurgnene | C15H24 | 204 | [9] |
| α-葎草烯α-caryophyllene | C15H24 | 204 | [9] |
| β-瑟临烯β-selinene | C15H24 | 204 | [9] |
| δ-荜澄茄烯δ-cadinene | C15H24 | 204 | [9] |
| 二十四烷Tetracosane | C24H50 | 338 | [9] |
| 9-辛基-十七烷9-octyl-heptadecane | C25H52 | 352 | [9] |
| 角鲨烯Squalene | C30H50 | 410 | [9] |
| 2-乙基己醇2-ethylhexanol | C8H18O | 130 | [9] |
| 邻苯二甲酸Pathalic acid | C8H6O4 | 166 | [9] |
| 石竹素Caryophyllene oxide | C15H24O | 220 | [9] |
| 肉豆蔻酸Myristic acid | C14H28O2 | 228 | [9] |
| 棕榈酸Palmitic acid | C16H32O2 | 256 | [9] |
| 亚油酸Linoleic acid | C18H32O2 | 280 | [9] |
| 亚麻酸Linolenic acid | C18H30O2 | 278 | [9] |
| 油酸Oleic acid | C18H34O2 | 282 | [9] |
| 叶绿醇Phytol | C20H40O | 296 | [9] |
| 硬脂酸Stearic acid | C18H36O2 | 284 | [9] |
| 花生酸Eicosanoic acid | C20H40O2 | 312 | [9] |
| 10,11-(4′,5′二甲基苯并)[3.2]二聚二甲苯 10,11-(4′,5′dime-thylbenzo)[3.2]paracyclophane |
C23H22 | 298 | [9] |
| 二十一碳酸Heneicosanoic acid | C21H42O2 | 326 | [9] |
| 二十二烷酸Docosanoic acid | C22H44O2 | 340 | [9] |
| 邻苯二甲酸单乙基己基酯Phthalic acid mono-2-ethylhexyl ester | C16H22O4 | 278 | [9] |
| 二十三碳酸Tricosanoic acid | C23H46O2 | 354 | [9] |
| 木质素酸Lignoceric acid | C24H48O2 | 368 | [9] |
| 叶醇cis-3-hexenol | C6H12O | 100 | [14] |
| α-蒎烯α-pinene | C10H16 | 136 | [14] |
| 1-辛烯-3-醇1-octen-3-ol | C8H16O | 128 | [14] |
| 3-辛酮3-octanone | C8H16O | 128 | [14] |
| 3-辛醇3-octanol | C8H18O | 130 | [14] |
| 蚽烯Limonene | C10H16 | 136 | [14] |
| 3,4-二甲基-3-环己烯-1-甲醛 3, 4-dimethyl-3-cyclohexen-1-carboxaldehyde |
C9H14O | 138 | [14] |
| 桉叶油醇Eucalyptol | C10H18O | 154 | [14] |
| 芳樟醇Linalol | C10H18O | 154 | [14] |
| 4-乙酰基-1-甲基-环乙烯4-acetyl-1-methyl-1-cyclohexene | C9H14O | 138 | [14] |
| 4-松油醇4-carvomenthenol | C10H18O | 154 | [14] |
| α-松油醇α-terpineol | C10H18O | 154 | [14] |
| 水杨酸甲酯Methyl salicylate | C8H8O3 | 152 | [14] |
| 橙花醇Nerol | C10H18O | 154 | [14] |
| α-柏木烯α-cedrene | C15H24 | 204 | [14] |
| 2,6-二甲基-6-(4-甲基-3-戊烯基)-二环[3.1.1]庚-2-烯 2, 6-dimethyl-6-(4-methyl-3-pentenyl)-bicyclo[3.1.1]hept-2-ene |
C15H24 | 204 | [14] |
| β-石竹烯β-caryophyllene | C15H24 | 204 | [14] |
| (E)-β-金合欢烯(E)-β-farnesene | C15H24 | 204 | [14] |
| β-姜黄烯β-curcumene | C15H24 | 204 | [14] |
| [S-(R*, S*)]-5-(1,5-二甲基-4-己烯)-2-甲基-1, 3环乙二烯 [S-(R*, S*)]-5-(1, 5-dimethyl-4-hexenyl)-2-methylene-1, 3-cyclohexene |
C15H24 | 204 | [14] |
| β-红没药烯β-bisabolene | C15H24 | 204 | [14] |
| [S-(R*, S*)]-3-(1,5-二甲基-4己烯)-6-甲烯基-环乙烯 [S-(R*, S*)]-3-(1, 5-dimethyl-4-hexenyl)-6-methylene-cyclohexene |
C15H24 | 204 | [14] |
| 7-表-顺-水和倍半香桧烯7-epi-cis-sesquisabinene hydrate | C15H26O | 222 | [14] |
| 7-表-反-水和倍半香桧烯7-epi-trans-sesquisabinene hydrate | C15H26O | 222 | [14] |
| 反-水和倍半香桧烯Trans-sesquisabinene hydrate | C15H26O | 222 | [14] |
| 顺-水和倍半香桧烯Cis-sesquisabinene hydrate | C15H26O | 222 | [14] |
| 橙花叔醇Nerolidol | C15H26O | 222 | [14] |
| 氧化石竹烯Caryophyllene oxide | C15H24O | 220 | [14] |
| β-红没药醇β-bisabolol | C15H26O | 222 | [14] |
| α-红没药醇α-bisabolol | C15H26O | 222 | [14] |
2 药理活性 2.1 抗炎作用
清热解毒是大部分马鞭草科药用植物共有的功效,通常认为,清热解毒类中药有抗炎作用,能够改善炎症早期的毛细管通透性增加、渗出、水肿等情况。Liu等[8]检测了分离化合物对人前列腺癌细胞(PC3)的体外抑制作用,以及在FMLP/CB作用下对人中性粒细胞产生超氧阴离子和释放弹性酶的影响,发现化合物1,4,5,11显示出显著的抗炎作用。袁经权[11]对脂多糖(LPS)诱导的小鼠巨噬细胞RAW264.7释放一氧化氮(NO)、肿瘤坏死因子ɑ(TNF-α)这两种炎症因子进行抑制活性实验,对主要化合物进行体外抗炎活性评价,发现化合物8,16,21—22,25,34—37,46,49对LPS诱导巨噬细胞释放NO具有明显的抑制活性,而化合物8,36,37,46则对LPS诱导巨噬细胞释放TNF-α具有明显的抑制活性。
2.2 抗补体活性焦杨等[16]采用细胞溶血法考察尖尾枫提取物经典途径和旁路途径的抗补体活性,发现尖尾枫水提取物和醇提取物有较强的经典途径抗补体活性,尖尾枫水提取物还具有旁路途径抗补体活性。由此推测尖尾枫的水提取物不仅可以有效抑制由抗原(Antigen)-抗体(IgG,IgM)复合物激活导致的补体系统紊乱,还可在抗体产生之前的感染早期或初次感染即可发挥作用。
2.3 美白作用Yamahara等[17]发现尖尾枫的乙醇提取物通过抑制微邻苯二甲酸相关转录因子(MITF)基因表达来抑制B16F10小鼠黑色素瘤细胞黑色素生成,表明尖尾枫具有明显的美白作用;通过液相色谱-质谱(LC-MS)、核磁共振(NMR)和生化分析法,证明尖尾枫提取物中起到抑制黑色素产生作用的成分是鼠尾草酸和鼠尾草酚。
3 质量标准何弘等[18]依据2010年版中国药典一部附录方法,对8批瑶药粘手风(尖尾枫)进行显微、薄层色谱鉴别,测定其水分、总灰分、酸不溶性灰分和浸出物含量,对粘手风药材的性状、显微特征进行描述,由此建立粘手风的薄层鉴别方法,得到的条带斑点清晰,分离度好。根据8批次粘手风测定结果,确定水分应≤12.0%,总灰分应≤8.0%,浸出物以水为溶剂,热浸法测定,浸出物应≥6.0%。杨先国等[19]采用高效液相色谱法,对市场流通中较常见的6种紫珠药材进行毛蕊花糖苷含量测定,发现其含量有明显的差异,其中尖尾枫药材中的毛蕊花糖苷的含量较高, 达到36.26 mg/g。高微等[13, 20]先是采用95%乙醇对尖尾枫药材进行提取,利用柱色谱和制备型高效液相色谱法对提取物进行分离纯化,采用高效液相色谱法测定尖尾枫中毛蕊花糖苷的含量,为尖尾枫药材的质量控制提供了可靠的方法;再将毛蕊花糖苷作为对照品,采用薄层色谱鉴别法和高效液相色谱法测定药材中毛蕊花糖苷的含量,并对10批药材进行测定,结果尖尾枫10个批次药材毛蕊花糖苷含量为0.797—43.279 mg/g,按干燥品计算,拟定毛蕊花糖苷含量限度不得少于0.5 mg/g。
4 展望综上所述,迄今从尖尾枫中分离得到的化合物,结构类型涉及二萜、三萜、苯丙素、木脂素、黄酮、甾体等。目前对该药材药理活性的研究还较少,仅有抗炎、抗补体和美白的药理活性报道。化学成分与药理活性研究的脱节导致其药效物质基础不明确。鉴于目前的研究现状,今后应加强以下4方面的研究:(1)应加强药材药效物质基础及其作用机制的研究,尤其是抗炎作用方面;(2)二萜化合物是尖尾枫的主要特征性活性成分,应重点加强对其提取纯化、药理活性、作用机制、构效关系等研究;(3)开展枝叶、果实、花、根等不同部位的研究,为其综合开发利用提供更多依据;(4)尖尾枫提取物中的鼠尾草酚和鼠尾草酸具有抑制黑色素合成的作用,且挥发油当中富含的α-红没药醇也具有美白、消炎作用,因此可以考虑将尖尾枫作为美白化妆品的新天然原料来源,进行更大程度地开发与利用。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志:第65(1)卷[M]. 北京: 科学出版社, 1982: 25-54.
|
| [2] |
江苏新医学院. 中药大辞典:上册[M]. 上海: 上海科技出版社, 1986: 875.
|
| [3] |
戴斌, 李钊东. "虎牛钻风"类传统瑶药的调查研究[J]. 中国民族民间医药杂志, 1998(2): 28-34. |
| [4] |
王红刚, 侯肖冰. 3种紫珠属中药的生药学鉴别[J]. 广东药学院学报, 2013, 29(4): 382-384. |
| [5] |
陈伟波. 紫珠类药材鉴别[J]. 中草药, 2004, 35(8): 947-951. |
| [6] |
杜勤, 王振华. 六种紫珠叶的生药比较鉴别[J]. 广州中医药大学学报, 2002, 19(1): 57-59. |
| [7] |
LIU J J, GU Z X, YAO S Z, et al. Rapid analysis of Callicarpa L.using direct spray ionization mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 124: 93-103. DOI:10.1016/j.jpba.2016.02.030 |
| [8] |
LIU Y W, CHENG Y B, LIAW C C, et al. Bioactive diterpenes from Callicarpa longissima[J]. Journal of Natural Products, 2012, 75(4): 689-693. |
| [9] |
高微, 刘布鸣, 冯军, 等. 尖尾枫脂溶性成分分析[J]. 广西科学, 2012, 19(2): 147-148, 151. |
| [10] |
高微, 刘布鸣, 黄艳, 等. 尖尾枫化学成分研究[J]. 中国实验方剂学杂志, 2013, 19(19): 153-155. |
| [11] |
袁经权.瑶药粘手风化学成分研究[D].厦门: 暨南大学, 2015.
|
| [12] |
YUAN J Q, QIU L, ZOU L H, et al. Two new phenylethanoid glycosides from Callicarpa longissima[J]. Helvetica Chimica Acta, 2015, 98(4): 482-489. DOI:10.1002/hlca.201400206 |
| [13] |
高微, 刘布鸣, 陈明生, 等. 尖尾枫中毛蕊花糖苷的分离鉴定及含量测定[J]. 中国实验方剂学杂志, 2014, 20(21): 60-62. |
| [14] |
高微, 刘布鸣, 柴玲, 等. 尖尾枫挥发油化学成分分析研究[J]. 香料香精化妆品, 2015(3): 1-3. |
| [15] |
王红刚, 潘利明. 分光光度法测定5种紫珠属中药总黄酮的含量[J]. 四川中医, 2013, 31(3): 57-58. |
| [16] |
焦杨, 邹录惠, 邱莉, 等. 5种马鞭草科药用植物的抗补体活性[J]. 中国药科大学学报, 2016, 47(4): 469-473. |
| [17] |
YAMAHARA M, SUGIMURA K, KUMAGAI A, et al. Callicarpa longissima extract, carnosol-rich, potently inhibits melanogenesis in B16F10 melanoma cells[J]. Journal of Natural Medicines, 2016, 70(1): 28-35. DOI:10.1007/s11418-015-0933-5 |
| [18] |
何弘, 邱莉, 邹录惠, 等. 瑶药粘手风质量标准研究[J]. 中国民族民间医药, 2017, 26(24): 10-13. |
| [19] |
杨先国, 谷陟欣, 颜冬兰, 等. 不同品种紫珠属药材中毛蕊花糖苷、木犀草素的含量比较研究[J]. 中南药学, 2015, 13(6): 641-644. |
| [20] |
高微, 韦广辉, 刘布鸣, 等. 尖尾风的质量标准研究[J]. 中医药导报, 2018, 24(13): 50-53. |



