2. 南宁庞博生物工程有限公司, 广西南宁 530004;
3. 广西民族大学化学化工学院, 广西林产化学与工程重点实验室, 广西南宁 530006;
4. 南宁穗肽生物技术有限公司, 广西南宁 530006
2. Nanning Pangbo Biological Engineering Co., Ltd., Nanning, Guangxi, 530004, China;
3. Guangxi Key Laboratory of Chemistry and Engineering of Forest Products, School of Chemistry and Chemical Engineering, Guangxi University for Nationalities, 530006, China;
4. Nanning Chemmatic Biotec Co., Ltd., Nanning, Guangxi, 530006, China
大米是全球范围内种植的主要粮食之一,大米中所含的蛋白质是公认的优质谷类蛋白,大米蛋白氨基酸组成合理,含有人体所需多种氨基酸,具有极高的营养价值[1]。目前大米蛋白主要被加工成高蛋白粉、蛋白胨和大米蛋白发泡粉等产品[2]。另外,大米蛋白是低抗原性蛋白质,过敏性低,适用作易过敏人群和婴幼儿的蛋白质补充剂[3]。同时,大米蛋白的保健功能也受到很多研究者的关注,比如大米蛋白能预防糖尿病、高血压等慢性疾病[4]。但是由于大米蛋白溶解性较差,导致其乳化性、胶凝性等性质不佳,进而影响大米蛋白在食品领域的进一步开发利用[5]。
为改善大米蛋白的功能性质,目前常用物理法、化学法或酶法对大米蛋白进行改性,主要以溶解度、乳化性和起泡性等性质的提升为目标[6]。物理法改性成本低、毒副作用小,但是改性效果不明显,提取率低[7]。化学法改性应用最为广泛,对大米蛋白的功能性质有较大改善,但缺点是有时会破坏蛋白质的原有营养特性,且存在化学试剂残留的隐患[8]。酶法改性专一性高、反应条件温和,对环境的污染小、适合工业化生产、水解产物营养价值高,是目前研究的热点[9],如汪洋等[10]研究中性蛋白酶制备大米蛋白抗氧化肽的酶解工艺。但是目前酶法水解大米蛋白的研究主要集中在考察蛋白质的水解度和蛋白肽的抗氧化活性,其中大多数研究的蛋白水解度不高(<30%)[5, 11-12],且不涉及蛋白质提取率。对工业生产而言,水解度和蛋白质提取率都是生产中决定产品质量和生产成本的重要指标。本实验以大米蛋白粉为原料,采用大米蛋白水解酶对大米蛋白进行酶解,以水解度和蛋白质提取率为指标,通过单因素实验和响应面分析实验确定最优条件,为酶解制备可溶性大米蛋白肽的工业化应用提供参考。
1 材料与方法 1.1 试剂大米蛋白粉(粗蛋白质70%),大海粮油工业(防城港)有限公司生产;大米蛋白水解酶(为木瓜酶、风味酶和碱性酶的复合物,8 000 U/g——在一定的条件下,每分钟水解酪蛋白生成1 μg酪氨酸所需的酶量,为1个酶活力单位U),南宁穗肽生物技术有限公司生产;其他试剂,国产分析纯。
1.2 仪器DK-8D型电热恒温水槽,上海精宏实验设备有限公司生产;DELTA320型pH计,梅特勒-托利多仪器(上海)有限公司生产;RD-50GAT型台式离心机,上海卢湘仪离心机仪器有限公司生产;KDN-1型凯氏定氮仪,上海仪电科学仪器股份有限公司生产。
1.3 方法 1.3.1 大米蛋白粉的酶法水解称取大米蛋白粉10 g,加入100 mL蒸馏水,用0.1 mol/L氢氧化钠或盐酸溶液调至酶的最适pH值,加入一定量的水解酶,在预定温度的水浴锅中恒温酶解,达到酶解时间后,于沸水中水浴15 min使酶失活,自然冷却,4 000 r/min离心20 min,取上清液测定游离氨基氮的含量和总氮含量,并计算大米蛋白的水解度和蛋白质提取率。
1.3.2 大米蛋白水解度和蛋白质提取率的计算游离氨基氮的测定采用甲醛电位滴定法,总氮含量测定采用凯氏定氮法。
大米蛋白水解度=氨氮/总氮×100%,蛋白质提取率=酶解液的粗蛋白质/原料的粗蛋白质×100%。
1.3.3 单因素实验设定初始水解条件:酶添加量2.0%(W:W),pH值为8,温度60℃,酶解时间9 h。在此基础上分别改变酶添加量(1.0%、1.5%、2.0%、2.5%、3.0%),pH值(6,7,8,9,10),温度(40,50,60,70,80℃),酶解时间(3,6,9,12,15 h),测定大米蛋白的水解度和蛋白质提取率。
1.3.4 响应面法分析实验根据单因素实验的结果,以大米蛋白水解度和蛋白质提取率为响应值,选取酶添加量、温度、pH值、酶解时间4个因素进行Box-Behnken实验设计,确定大米蛋白水解的最优条件。实验因素水平如表 1所示。
| 水平 Level |
因素Factors | |||
| 温度 Temperature (℃) |
酶添加量 Enzyme addition (%) |
pH值 pH value |
时间 Time (h) |
|
| -1 | 50 | 1.5 | 7 | 6 |
| 0 | 60 | 2.0 | 8 | 9 |
| 1 | 70 | 2.5 | 9 | 12 |
2 结果与分析 2.1 单因素实验结果 2.1.1 酶添加量对大米蛋白水解度和提取率的影响
由图 1可知,随着酶添加量的增加,大米蛋白的水解度和蛋白质提取率均有提高,当酶添加量达到2.0%之后,水解度和提取率增幅较小。这是由于酶作为一种催化剂,浓度的提高可以加快反应速度,但是在酶添加量达到一定限度时,酶在底物表面的作用已达到饱和,而底物上可供酶切割的位点有限,多出的酶不能在底物上起作用[13],因此水解度趋于平衡。从成本的角度考虑,初步确定酶添加量为2.0%较为合适。
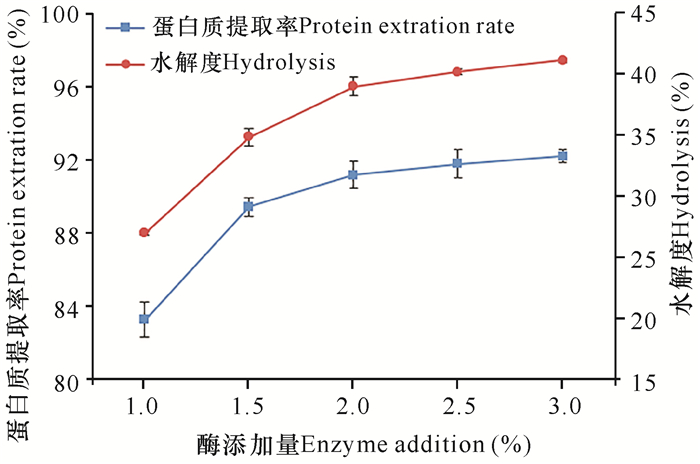
|
| 图 1 酶添加量对水解度和提取率的影响 Fig. 1 Effect of enzyme addition on the degree of hydrolysis and protein extraction rate |
2.1.2 温度对大米蛋白水解度和提取率的影响
从图 2可知,大米蛋白水解度和蛋白质提取率在60℃时最高,温度太低或太高时水解度和蛋白质提取率均会下降。这是由于酶对温度较为敏感,在其最适温度范围内活性最高。温度较低时,酶活力也较低,水解速度慢,而当温度过高时酶蛋白质会因变性而失活,造成水解度和提取率的下降[14]。因此初步选择反应温度为60℃。
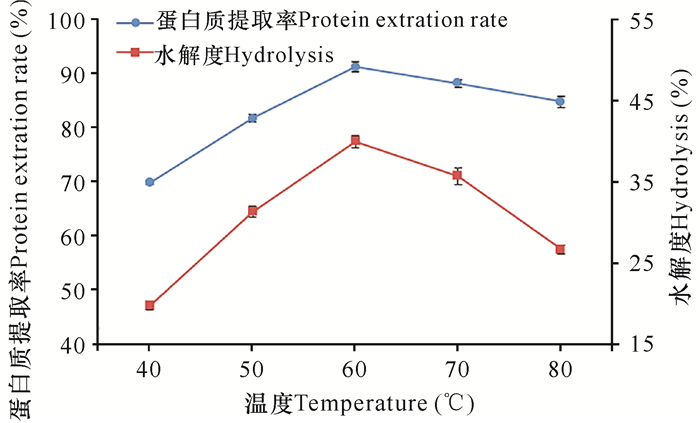
|
| 图 2 温度对水解度和提取率的影响 Fig. 2 Effect of temperature on the degree of hydrolysis and protein extraction rate |
2.1.3 pH值对大米蛋白水解度和提取率的影响
由图 3可见,在pH值为8时水解度和蛋白质提取率达到最大,pH值低于或高于8时,水解度和蛋白质提取率均有所降低。这是由于pH值会影响酶分子和底物分子上羧基、氨基等基团的解离状态,这些基团的解离状态会影响酶与底物的结合催化[15]。因此初步确定pH值为8。
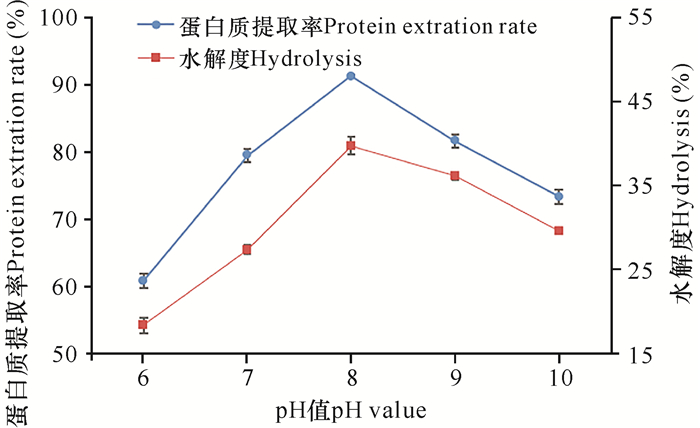
|
| 图 3 pH值对水解度和提取率的影响 Fig. 3 Effect of pH value on the degree of hydrolysis and protein extraction rate |
2.1.4 酶解时间对大米蛋白水解度和提取率的影响
从图 4可以看出,随着酶解时间的延长,水解度和提取率都会逐渐提高。但由于底物浓度不断降低,酶解9 h之后水解度和提取率的增长趋于平缓。因此,从节约成本角度考虑,初步将酶解时间定为9 h。

|
| 图 4 酶解时间对水解度和提取率的影响 Fig. 4 Effect of time on the degree of hydrolysis and protein extraction rate |
2.2 响应面实验数据分析 2.2.1 实验模型的建立
根据单因素实验结果,以温度(A)、酶添加量(B)、pH值(C)、酶解时间为自变量(D),水解度(DH)和蛋白质提取率(E)为响应值,进行响应面实验,实验方案和结果见表 2。
| 实验号 No. |
温度 Temperature |
酶添加量 Enzyme addition |
pH值 pH value |
酶解时间 Time |
水解度 Hydrolysis degree (%) |
提取率 Protein extraction rate (%) |
| 1 | -1 | -1 | 0 | 0 | 29.1 | 78.8 |
| 2 | 1 | -1 | 0 | 0 | 33.1 | 84.7 |
| 3 | -1 | 1 | 0 | 0 | 34.1 | 84.9 |
| 4 | 1 | 1 | 0 | 0 | 37.7 | 88.5 |
| 5 | 0 | 0 | -1 | -1 | 25.1 | 74.1 |
| 6 | 0 | 0 | 1 | -1 | 28.6 | 77.8 |
| 7 | 0 | 0 | -1 | 1 | 28.2 | 79.9 |
| 8 | 0 | 0 | 1 | 1 | 36.8 | 83.9 |
| 9 | -1 | 0 | 0 | -1 | 28.9 | 79.4 |
| 10 | 1 | 0 | 0 | -1 | 31.6 | 80.6 |
| 11 | -1 | 0 | 0 | 1 | 33.9 | 83.2 |
| 12 | 1 | 0 | 0 | 1 | 36.9 | 89.0 |
| 13 | 0 | -1 | -1 | 0 | 24.9 | 75.5 |
| 14 | 0 | 1 | -1 | 0 | 31.9 | 80.2 |
| 15 | 0 | -1 | 1 | 0 | 32.2 | 80.1 |
| 16 | 0 | 1 | 1 | 0 | 36.3 | 85.2 |
| 17 | -1 | 0 | -1 | 0 | 23.4 | 71.9 |
| 18 | 1 | 0 | -1 | 0 | 25.7 | 75.9 |
| 19 | -1 | 0 | 1 | 0 | 28.6 | 76.3 |
| 20 | 1 | 0 | 1 | 0 | 32.4 | 80.2 |
| 21 | 0 | -1 | 0 | -1 | 30.4 | 82.2 |
| 22 | 0 | 1 | 0 | -1 | 36.6 | 89.6 |
| 23 | 0 | -1 | 0 | 1 | 37.5 | 90.3 |
| 24 | 0 | 1 | 0 | 1 | 40.8 | 93.2 |
| 25 | 0 | 0 | 0 | 0 | 40.5 | 90.3 |
| 26 | 0 | 0 | 0 | 0 | 40.0 | 91.5 |
| 27 | 0 | 0 | 0 | 0 | 39.1 | 91.9 |
| 28 | 0 | 0 | 0 | 0 | 39.4 | 90.7 |
| 29 | 0 | 0 | 0 | 0 | 39.6 | 91.1 |
用Design Expert 8.06软件对表 2的结果进行多元回归分析,得到水解度(DH)与温度(A)、酶添加量(B)、pH值(C)、酶解时间(D)的二次多项式回归方程:
DH=39.72+1.62A+2.52B+2.98C+2.74 D-0.10AB+0.37AC+0.075AD-0.73BC-0.73BD+1.27CD-4.80A2-1.15B2-7.46C2-2.31 D2。
由表 3可知,模型P值<0.000 1,失拟项为0.704 2>0.05,表明该模型拟合程度较好;决定系数R2=0.995 7,说明水解度实测值与预测值之间有较好拟合度。由表 3中的F值大小顺序可知,各因素对水解度的影响顺序为C>D>B>A,即pH值>酶解时间>酶添加量>温度。温度(A)、酶添加量(B)、pH值(C)、酶解时间(D)的一次项及二次项均达到极显著水平;交互项BC、BD、CD对水解度的影响也达到极显著水平,交互项AB、AC和AD对水解度的影响不显著。综上分析可知该模型与实际情况拟合较好,可用于大米蛋白水解度的优化。
| 来源 Source |
平方和 Sum of squares |
自由度 Freedom |
均方 Mean squares |
F值 F value |
P值 P value |
| 模型Model | 759.23 | 14 | 54.23 | 231.79 | <0.000 1 |
| A | 31.36 | 1 | 31.36 | 134.05 | <0.000 1 |
| B | 76.00 | 1 | 76.00 | 324.85 | <0.000 1 |
| C | 106.21 | 1 | 106.21 | 453.95 | <0.000 1 |
| D | 90.20 | 1 | 90.20 | 385.53 | <0.000 1 |
| AB | 0.040 | 1 | 0.040 | 0.17 | 0.685 5 |
| AC | 0.56 | 1 | 0.56 | 2.40 | 0.143 3 |
| AD | 0.023 | 1 | 0.023 | 0.096 | 0.761 0 |
| BC | 2.10 | 1 | 2.10 | 8.99 | 0.009 6 |
| BD | 2.10 | 1 | 2.10 | 8.99 | 0.009 6 |
| CD | 6.50 | 1 | 6.50 | 27.79 | 0.000 1 |
| A2 | 149.29 | 1 | 149.29 | 638.10 | <0.000 1 |
| B2 | 8.54 | 1 | 8.54 | 36.51 | <0.000 1 |
| C2 | 360.98 | 1 | 360.98 | 1 542.90 | <0.000 1 |
| D2 | 34.61 | 1 | 34.61 | 147.94 | <0.000 1 |
| 失拟项Lack of fit | 2.09 | 10 | 0.21 | 0.70 | 0.704 2 |
| 纯误差Pure error | 1.19 | 4 | 0.30 | ||
| 总和Sum | 762.50 | 28 |
同样可得到提取率(E)与温度(A)、酶添加量(B)、pH值(C)、酶解时间(D)的二次多项式回归方程:
E=91.10+2.03A+2.50B+2.17C+2.98D-0.58AB-0.025AC+1.15AD+0.10BC-1.12BD+0.075CD-5.77A2-0.79B2-9.82C2-2.04D2。
由表 4可知,模型P值<0.000 1,失拟项为0.440 7>0.05,表明该模型拟合程度较好;决定系数R2=0.993 7,说明提取率实测值与预测值之间有较好拟合度。由表 4中的F值大小顺序可知,各因素对提取率的影响顺序为D>B>C>A,即酶解时间>酶添加量>pH值>温度。一次项A、B、C、D对蛋白质提取率的影响达到极其显著水平;交互项AD、BD对提取率的影响极显著,其余交互项均不显著。综上分析可知该模型与实际情况拟合较好,可用于优化蛋白质的提取率。
| 来源 Source |
平方和 Sum of squares |
自由度 Freedom |
均方 Mean squares |
F值 F value |
P值 P value |
| 模型Model | 1 047.34 | 14 | 74.81 | 156.71 | <0.000 1 |
| A | 49.61 | 1 | 49.61 | 103.93 | <0.000 1 |
| B | 75.00 | 1 | 75.00 | 157.11 | <0.000 1 |
| C | 56.33 | 1 | 56.33 | 118.00 | <0.000 1 |
| D | 106.80 | 1 | 106.80 | 223.73 | <0.000 1 |
| AB | 1.32 | 1 | 1.32 | 2.77 | 0.118 2 |
| AC | 0.002 5 | 1 | 0.002 5 | 0.005 2 | 0.943 3 |
| AD | 5.29 | 1 | 5.29 | 11.08 | 0.005 0 |
| BC | 0.040 | 1 | 0.040 | 0.084 | 0.776 5 |
| BD | 5.06 | 1 | 5.06 | 10.60 | 0.005 7 |
| CD | 0.022 | 1 | 0.022 | 0.047 | 0.831 3 |
| A2 | 215.70 | 1 | 215.70 | 451.85 | <0.000 1 |
| B2 | 4.07 | 1 | 4.07 | 8.52 | 0.011 2 |
| C2 | 625.08 | 1 | 625.08 | 1 309.40 | <0.000 1 |
| D2 | 27.04 | 1 | 27.04 | 56.64 | <0.000 1 |
| 失拟项Lack of fit | 5.08 | 10 | 0.51 | 1.27 | 0.440 7 |
| 纯误差Pure errol | 1.60 | 4 | 0.40 | ||
| 总和Sum | 1 054.03 | 28 |
2.2.2 水解度的因素交互效应分析
响应面图的等高线形状反映交互作用的强弱程度,圆形表示两个因素的交互作用不明显,而椭圆形则表示交互作用明显[16]。从图 5可以看出,水解度随着酶解时间和酶添加量的增加而升高;水解度随着pH值和温度的增加呈现先升高后降低的趋势。椭圆形的等高线说明交互作用对水解度影响显著;pH值与温度、酶添加量、酶解时间的交互作用显著,表明pH值对水解度的影响比其他因素要大,与方差分析结果一致。
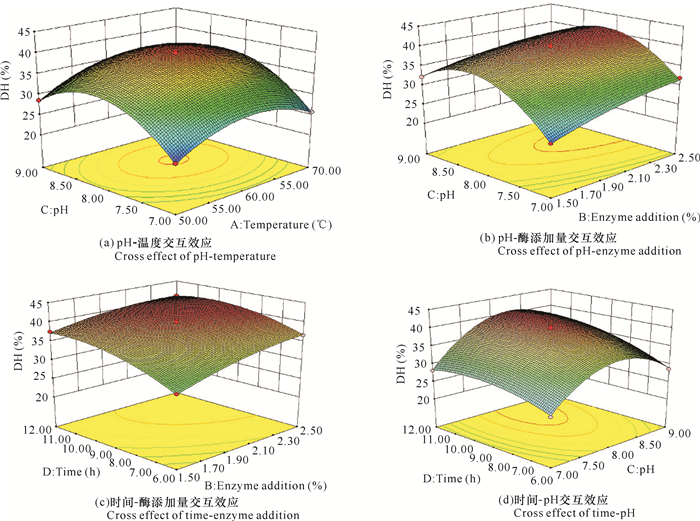
|
| 图 5 各因素交互效应的响应面曲线(水解度) Fig. 5 Response surface map of cross effect of each factors (degree of hydrolysis) |
2.2.3 蛋白质提取率的因素交互效应分析
从图 6a可以看出,温度一定时,随着酶解时间的增加提取率缓慢升高;酶解时间固定时,随着温度升高,提取率是先增加再降低。从图 6b可知,酶添加量固定时,随着酶解时间的增加提取率缓慢升高;当酶解时间一定时,随着酶添加量的增加,提取率逐渐上升。图 6a等高线为椭圆形,说明时间-温度交互作用显著;而时间-酶添加量之间的交互作用亦较明显(图 6b),与方差分析结果一致。
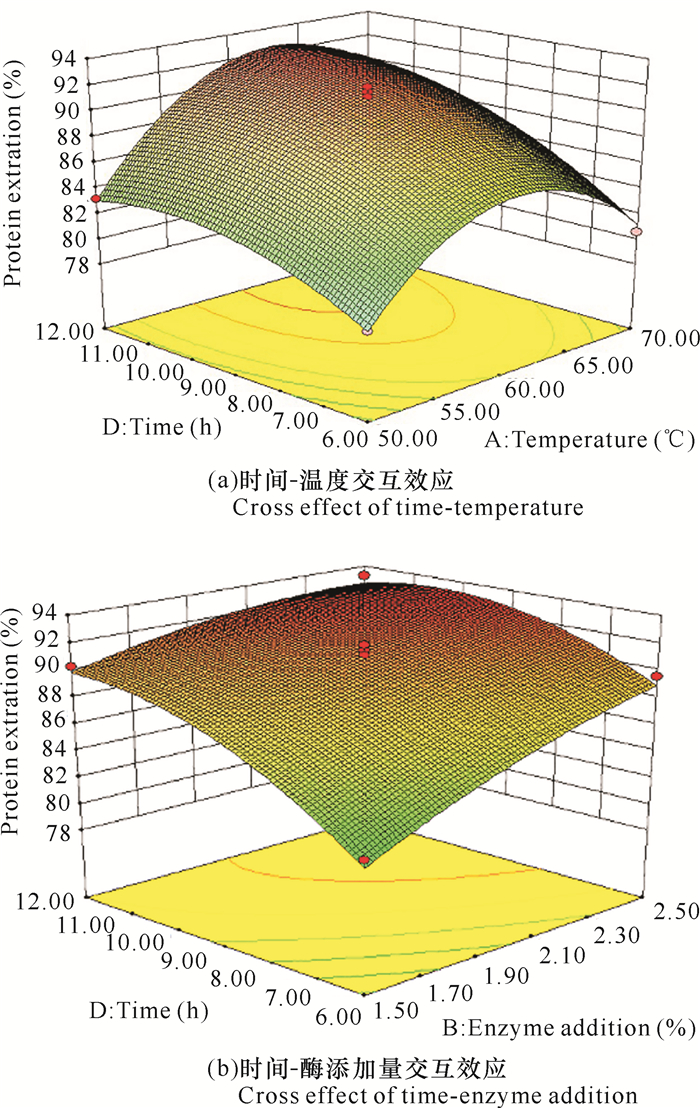
|
| 图 6 各因素交互效应的响应面曲线(蛋白质提取率) Fig. 6 Response surface map of cross effect of each factors (protein extraction rate) |
2.2.4 酶解实验的优化与验证
软件优化后的最佳水解条件:温度61.72℃,酶添加量2.5%,pH值8.16,时间10.48 h,此时预测水解度为41.93%,预测提取率为93.52%。考虑到实际生产的方便,水解条件调整为温度62℃,酶添加量2.5%,pH值8.2,时间10.5 h,预测水解度为41.93%,提取率为93.47%。按照优化条件验证实验得到实际水解度为41.5%,提取率93.1%,两者误差小于1%,说明方程拟合较好,响应面优化得到的酶解工艺参数准确。实验结果表明响应面优化得到的酶解条件相比现有的水解工艺在水解度(<30%)方面有较大提高,具有实用价值。
3 结论本实验通过响应面实验设计优化了大米蛋白的酶解工艺。通过响应面法分析发现,酶解的温度、酶添加量、酶解时间、pH值均对水解度和提取率有显著影响。最后通过软件得到优化的酶解工艺条件:温度62℃,酶添加量2.5%,pH值8.2,时间10.5 h,此时大米蛋白的水解度可达到41.5%,蛋白质提取率可达93.1%。本研究成果可为水解大米蛋白的实际生产提供参考。
| [1] |
李超楠, 鹿保鑫, 周义, 等. 大米蛋白提取分离的研究进展[J]. 农产品加工, 2017, 429(4): 63-64. |
| [2] |
张慧娟, 夏雪芬, 王静, 等. 大米蛋白及其酶解产物的功能性质[J]. 中国食品学报, 2015, 15(8): 63-70. |
| [3] |
徐鑫, 覃永华, 刘虹, 等. 大米蛋白综合利用研究进展[J]. 现代农业科技, 2019(6): 204-205, 209. |
| [4] |
王一侠, 陆路, 徐姗姗, 等. 大米过敏的研究进展[J]. 食品安全质量检测学报, 2017, 8(4): 1093-1098. |
| [5] |
崔沙沙, 钟俊桢, 方冲, 等. 不同低水解度的大米蛋白溶解性与结构变化的关系[J]. 食品工业科技, 2016, 37(7): 86-91. |
| [6] |
莫文敏, 曾庆孝. 蛋白质改性研究进展[J]. 食品科学, 2000, 21(6): 6-10. |
| [7] |
银波, 李亦蔚, 汪霞丽, 等. 大米蛋白改性技术的研究进展[J]. 食品与机械, 2011, 27(3): 147-151. |
| [8] |
鲁倩, 林亲录, 梁盈. 糖基化修饰对大米蛋白功能性质影响[J]. 粮食与油脂, 2013, 26(4): 11-14. |
| [9] |
吕乐, 刘冬, 万红霞, 等. 碱性蛋白酶Alcalase酶解大米蛋白制备小分子肽的动力学研究[J]. 现代食品科技, 2014, 30(7): 149-154. |
| [10] |
汪洋, 周晓瑞, 张浩, 等. 大米蛋白的提取及抗氧化肽的制备工艺[J]. 现代面粉工业, 2020, 34(1): 29-32. |
| [11] |
陈倩倩, 佟立涛, 钟葵, 等. 大米蛋白酶解物的ACE抑制活性研究[J]. 现代食品科技, 2015, 31(3): 91-96. |
| [12] |
孙通, 谭春明. 大米蛋白抗氧化肽的酶法制备工艺研究及其优化[J]. 粮油加工, 2016, 41(4): 23-28. |
| [13] |
陈新, 陈庆森, 庞广昌. 不同变性方式对Alcalaase AF2.4L酶解玉米蛋白水解度的影响[J]. 食品与发酵工业, 2005, 31(2): 42-44. |
| [14] |
温建丰, 杨文鸽, 徐大伦. 响应面法优化花蟹肉制备抗氧化肽的酶解工艺[J]. 核农学报, 2013, 27(12): 1881-1886. |
| [15] |
王嫱.钙离子、pH值以及成熟时间对干酪蛋白质降解的影响[D].泰安: 山东农业大学, 2006.
|
| [16] |
GHAEDI A M, GHAEDI M, VAFAEI A, et al. Adsorption of copper (Ⅱ) using modified activated carbon prepared from Pomegranate wood:Optimization by bee algorithm and response surface methodology[J]. Journal of Molecular Liquids, 2015, 206: 195-206. |



