2. 广西地表过程与智能模拟重点实验室, 广西南宁 530001
2. Key Laboratory of Earth Surface Processes and Intelligent Simulation, Nanning, Guangxi, 530001, China
红树林广泛分布于热带、亚热带低能海岸的潮间带上部,作为重要的海岸带湿地生态系统,提供一系列生态服务功能,包括海岸防护、木材生产、水产养殖和生态旅游等[1]。红树林具有很高的初级生产力,据保守估计,全球红树林的初级生产力(以碳计)平均值可达到(218±72) Tg/a[2]。同时,红树林内沉积速率快,周期性浸水形成的土壤厌氧环境使得有机物分解相对缓慢,从而在沉积过程中埋藏大量的有机碳[3]。尽管红树林只占全球海岸带面积的0.5%,其埋藏碳却占海岸带沉积物埋藏碳的10%-15%(24 Tg/a),相当于陆地输出到海洋颗粒有机碳的10%-11%[4]。这种碳库效应对于缓解当前大气二氧化碳总量的增加具有重要意义。深入研究红树林碳埋藏特征及其控制因素,探讨全球变化背景下红树林碳埋藏储量和通量的变化趋势,将有助于理解海岸带碳循环对于当前全球变化的响应,并为保护红树林提供理论依据和策略。本文对近年来关于红树林碳埋藏和沉积过程对于气候变化、海平面上升和人类活动响应的相关文献进行综述,分析气候变化、海平面上升和人类活动等因素对于红树林碳埋藏的影响,以期为今后深入探讨红树林碳库效应、研究红树林覆盖面积变化的动态过程和红树林保护提供有益的参考。
1 全球红树林碳储量、碳埋藏速率特征及控制因素全球红树林单位面积净初级生产力为11.1 Mg/(hm2·a),与热带陆地森林相当,红树林碳储量平均可达937 Mg/hm2[5]。红树林湿地的碳储量分为两个部分:其一为红树林生物碳储量,包括地面生物碳储量、地下生物碳储量以及地表凋落物;另一部分为土壤碳储量, 可占到红树林总碳储量的50%-90%[1]。印度洋-太平洋热带地区的红树林土壤碳储量平均为1 023 Mg/hm2,为全球最高[1]。亚热带红树林碳储量明显低于热带红树林。例如,我国红树林的平均碳储量为(355.25±82.19) Mg/hm2,仅相当于热带地区红树林的1/3[6]。热带地区高温多雨气候条件下生长的红树林具有植株高大和根系发达的特点,其根系可向地下延伸3-5 m,甚至可深达20 m[7]。红树林发达的地下根系代谢产物使得厚度很大的沉积土壤层中富含有机碳,因而具有很高的碳储量。相对而言,亚热带红树林由于植株普遍矮小,根系分布深度也有限,因此土壤碳储量较低。在我国红树林当中,超过80%的埋藏有机碳分布在1 m深度的土壤层以内[6]。值得注意的是,在一些亚热带地区,由于持续的海平面上升导致红树林滩面不断加积,可以形成厚度较大的红树林土壤层,从而具有很高的埋藏碳储量。例如,在干旱的美国佛罗里达西部Baja海岸,近1 500年来海平面以2 mm/a的平均速率上升,红树林以累积根系有机碳的方式保持着滩面高程增加速率与海平面上升速率相一致,长期以来发育了厚度超过3 m的红树林泥炭层,其碳埋藏储量高达900-3 000 Mg/hm2,甚至超过大多数热带红树林[8]。
碳埋藏速率是指在单位时间、单位面积内,被埋藏进沉积物的有机碳质量。这一参数可以反映红树林沉积物封存有机碳的能力,对于定量理解碳循环过程和评估红树林湿地碳库潜力具有重要意义。不少学者对全球红树林有机碳埋藏速率进行估算,Duarte等[9]的估算值为129 g/(m2·a), Bouillon等[2]的估算值为134 g/(m2·a),Alongi[5]的估算值为174 g/(m2·a)。本文根据已发表的部分文献中关于红树林碳埋藏速率和沉积速率的数据绘制图 1,并整理了相关研究区的沉积环境和树种等信息(表 1)。可以看出,当前对于红树林碳埋藏研究的热点区域主要集中在河口环境,并且碳埋藏速率主要受沉积速率控制。这是因为在有机物输入通量不变的情况下,较高的沉积速率有利于有机质被迅速埋藏,可以降低有机质分解率。此外,对于同一处红树林,较高的沉积速率一般意味着更长的滩面淹没时间和更加缺氧的滩面环境,同样有利于抑制有机质的分解,从而增加碳埋藏速率。在巴西Tamandaré红树林,沉积速率和有机碳埋藏速率从红树林前缘、过渡带到红树林内侧逐渐降低,沉积速率依次为7.3, 5.0, 2.8 mm/a,相应的有机碳埋藏速率分别为1 129, 949, 353 g/(m2·a)[10]。在该处红树林沉积速率最快的前缘地带,其有机碳埋藏速率是红树林内侧区域的3倍。
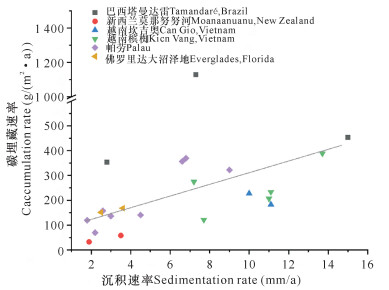
|
| 图 1 红树林沉积速率和有机碳埋藏速率的关系 Fig. 1 Relationship between mangrove sedimentation rate and organic carbon accumulation rate |
| 地理位置 Geographical location |
沉积环境 Sedimentary environment |
树种 Varieties |
沉积柱长度 Length of column (cm) |
潮差 Tidal range (m) |
文献 Literature |
| 巴西塔曼达雷 Tamandaré,Brazil |
海湾 Bay |
/ | 40, 34, 36 | / | [10] |
| 新西兰莫那努努河 Moanaanuanu, New Zealand |
河口 Estuary |
白骨壤 Avicennia marina |
50 | / | [11] |
| 越南坎吉奥 Can Gio, Vietnam |
河口 Estuary |
红树 Rhizophora apiculata |
34 | 4 | [12] |
| 越南槟椥 Kien Vang, Vietnam |
河口 Estuary |
红树 Rhizophora apiculata |
40 | / | [12] |
| 帕劳 Palau |
岛屿 Island |
海桑、红树 Sonneratia alba,Rhizophora apiculata |
40 | 2 | [12] |
| 佛罗里达大沼泽地 Everglades,Florida |
河口 Estuary |
红树、白骨壤 Rhizophora apiculata,Avicennia marina |
50 | / | [13] |
2 红树林碳埋藏过程对海平面上升、气候变化和人类活动的响应 2.1 红树林碳埋藏过程对海平面上升(SLR)的响应
图 2展示了红树林碳埋藏过程对海平面上升、气候变化和人类活动的响应,下面就这3种响应机制分别进行探讨。
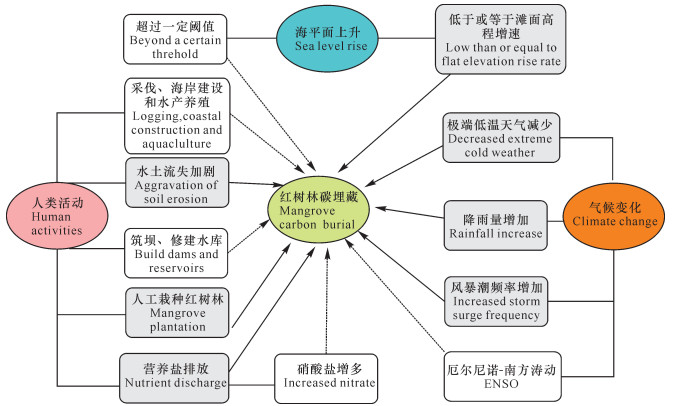
|
| 实线箭头代表正响应, 虚线箭头代表负响应 The solid arrow represents positive response, the dotted arrow represents negative response 图 2 红树林碳埋藏对海平面上升、气候变化和人类活动的响应 Fig. 2 Response of mangrove carbon sequestration to sea level rise, climate change and human activities |
在加勒比海伯利兹Twin Cays红树林和佛罗里达西部Baja海岸红树林,对其地质钻孔中红树林沉积层的年代学研究, 结果表明,红树林滩面高程增速在数千年里始终和海平面上升速率保持一致(图 3)[14]。在澳大利亚Moreton湾,对红树林滩面沉积速率的长期监测表明,海平面上升速率加快可以导致沉积速率增加(图 4)[15]。而在世界上其他区域也有红树林滩面沉积速率正相关于海平面上升速率的报道[16]。
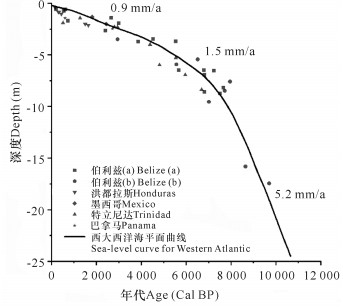
|
| 图 3 加勒比海地区红树林滩面高程增速与西大西洋海平面上升 Fig. 3 Mangrove elevation speed increase in the Caribbean area and SLR in Western Atlantic |
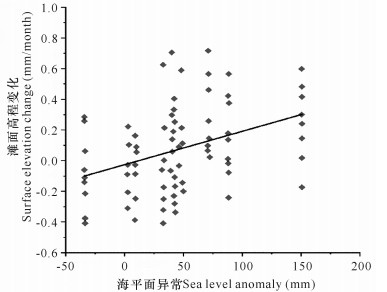
|
| 图 4 红树林滩面高程变化与海平面波动的关系 Fig. 4 Relationship between mangrove surface elevation change and sea level fluctuation |
可见,当海平面上升速率低于一定阈值时,红树林能够通过增加滩面沉积速率、促进地下根系生长的方式,使滩面高程增速与海平面上升速率保持一致。因此,适度的海平面上升有利于保持甚至增加滩面沉积速率和土壤有机碳含量,也就起到了保持或提高有机碳埋藏速率的效果。如果海平面上升速率过快,超过滩面高程增加速率,红树林则会因为淹没时间过长而死亡,封存在红树林土壤层中的有机碳会因侵蚀作用而暴露,进而分解并重新进入大气。在巴西南部海岸的观测显示,2012年海平面上升速率为4 mm/a,而滩面沉积速率仅为2 mm/a,红树林前缘位置呈现出向陆地方向显著退缩的趋势,原来的红树林泥质沉积层受到侵蚀[17]。相关研究表明:在印度洋-太平洋热带地区,以当前的红树林滩面高程增加速率,预期海平面上升将会在21世纪末威胁到约70%的红树林湿地,其中位于潮差较小和沉积物供给不足地区的红树林最早可能会在2070年被淹没[18]。
2.2 红树林碳埋藏过程对气候变化的响应在亚热带地区,随着全球变暖,冬季极端低温天气出现频率降低,有利于红树林幼苗存活,进而导致红树林取代原有盐沼,相应地增加了当地的碳埋藏总量和通量[19]。在佛罗里达东海岸,2003—2010年红树林向盐沼显著扩张,红树林面积增加69%,当地总碳储量则增加22%[19]。新生红树林单位面积的碳储量可达到盐沼的2倍,碳储量的增加速率为2.7 Mg/(hm2·a)[20]。在广西南流江河口区,一处大型红树林的覆盖面积在1988—2013年从60 hm2增加到134 hm2。其中,1988—1993年和2005—2013年是台风频率和冬季低温事件发生频率偏低的2个时期,红树林面积在这2个时期显著增加,截止2013年红树林埋藏碳储量增加约5 556 Mg[21]。
降雨量增加可以促进红树林碳埋藏过程。一方面,降雨量增加会导致红树林内土壤盐度降低,可以提高红树林的生产力和幼苗存活率,进而促进红树林面积扩张。如澳大利亚Moreton湾的红树林扩张侵入盐沼,其中以1972—1990年降雨量较多的年份红树林的扩张速率最快[22]。另一方面,降雨量增加一般意味着入海河流输送的更多泥沙供应,红树林沉积速率有可能加快,从而提高碳埋藏通量。再者,降雨量增加会导致沿岸水体盐度减小,有利于减缓表层土壤中有机碳的分解速率。反之,降雨量减少会造成沿岸水体和红树林土壤盐度升高,导致红树林生产力降低,进而降低红树林碳埋藏速率。极端干旱事件甚至可以造成红树林的死亡和土壤碳释放。如1997—1998年El-Nino事件期间,极端干旱导致密克罗尼西亚红树林土壤盐度升高,对红树林产生了胁迫,造成红树林死亡事件[23]。
全球变暖会导致强热带气旋出现频率增加[24],强热带气旋可能会引发风暴潮和河流洪水。林带宽度较宽,植株较为密集的红树林可以有效耗散潮流和波浪能量,从而在风暴潮过程中截留大量沉积物和颗粒有机碳。在广西北海大冠沙红树林的沉积物中,近30年来的风暴潮沉积所占比重超过50%,此处红树林的沉积速率与台风登陆频率之间呈明显正相关[25]。对佛罗里达大沼泽地红树林沉积速率和有机碳碳埋藏速率的分析显示:2005年Wilma飓风期间红树林沉积速率和有机碳埋藏速率分别为5.9-6.5 mm/a和260-393 g/(m2·a),显著高于多年平均沉积速率2.5-3.3 mm/a与151-168 g/(m2·a)的平均碳埋藏速率[13]。但是,对于林带宽度不够,植株较为稀疏的红树林,风暴潮过程可能会造成外侧红树林滩面侵蚀,降低其沉积速率,从而不利于碳埋藏。例如,越南Ba-Lat河口红树林湿地中,在正常天气状况下,红树林外侧区域的沉积通量远高于内侧,但是其长期沉积速率反而低于内侧,风暴事件造成的滩面侵蚀可能是主要原因[26]。
2.3 人类活动对红树林碳埋藏过程的影响人类对红树林的破坏性活动,主要包括采伐树木、开挖虾塘、海岸带开发建设等,是导致最近一百年来红树林面积缩减的主要原因,必然造成红树林碳储量减少[27]。红树林的大量破坏会导致土壤埋藏碳被释放,成为大气CO2的重要来源[28]。近100年来,人类活动造成红树林面积每年减少1%-2%,由此产生的碳排放为0.09-0.97 Pg[1]。在红树林面积覆盖最大的印度尼西亚,近30年来由于水产养殖业发展等原因损失约40%的红树林,红树林被破坏后每年排放的碳相当于0.07-0.21 Pg的CO2[29]。加勒比海地区的多米尼加红树林碳储量为706-1 131 Mg/hm2,在开挖成虾塘并被废弃后,其碳储量降低到95 Mg/hm2,仅为原来碳储量的11%,由红树林转变为虾塘,潜在的碳排放相当于2 244-3 799 Mg/hm2的CO2[30]。红树林的破坏和退化属于热带地区因土地利用转变导致的最大碳排放量之一。
此外,人类活动会破坏地表,加剧水土流失,导致河流输送泥沙增多,充足的沉积物物源供给使得红树林沉积速率增加,进而增加碳埋藏速率[31]。在入海河流中上游河段的筑坝和修建水库会截留泥沙,造成河口沉积物补给减少,使得部分地区红树林滩面高程增加速率无法与海平面上升速率保持一致,可能会成为未来这些地区红树林消亡的重要原因[18]。例如,在泰国湄南河三角洲,人类筑坝导致泥沙供应量降低,并且过度抽取地下水,导致红树林滩面高程降低,已经使得海岸线后退数千米[32]。另一方面,随着海岸带城市发展的加速,工业废水和生活污水排放导致近岸水体富营养化在许多地区已成为不争的事实。营养盐的增加会促进红树林根系和幼苗的生长,有利于红树林扩张和生产力的增加,但硝酸盐输入过多,会导致氧化还原电位增加,造成土壤碳的分解[14]。也有学者认为,相对于根系而言,营养盐的增加主要是促进嫩枝和幼苗的生长[33]。因此,在高盐度、低湿度的干旱环境下,当海岸带富营养化促进了嫩枝生长时,也增加了对根系吸收水分的需求。但根系可能无法满足这种需求,这就增加了高盐、干旱环境下的红树林死亡率,从而不利于碳埋藏过程[33]。
随着对于红树林生态效应认识的加深和红树林面积日益缩减的严峻形势,人们已经开始意识到保护红树林的重要性。在REDD+计划的框架下,许多国家和相关组织开展人工种植红树林的活动,并取得显著成果[34]。虽然,人工栽种的红树林土壤碳储量要低于自然生长的红树林,但远高于裸地和其他土地利用类型[35]。并且,随着红树林林龄的增加,人工红树林的生产力和碳储量会逐渐恢复到接近于自然状态的红树林水平[36]。
3 展望在全球变化背景下,红树林碳埋藏过程能够对气候变化、海平面上升(SLR)和人类活动做出不同的响应。降雨量增加可以促进红树林扩张,增加滩面沉积速率,从而有利于红树林碳埋藏;降雨量减少则会起到相反作用。全球变暖导致亚热带地区的冬季低温事件减少,已经造成许多地区红树林面积显著扩张,从而提高了红树林碳埋藏量。就当前而言,除去澳大利亚等少数区域外,全球变暖在大多数地区对于红树林碳埋藏具有促进作用。在短期内,较低的海平面上升速率背景下,红树林可以通过增加滩面沉积速率和促进根系代谢的方式,达到保持或提高碳埋藏速率的效果。但是从长期来看,不断增加的海平面上升速率可能会对红树林碳储量最高的热带地区红树林湿地造成严重威胁,如果不能采取有效措施维持这些红树林湿地的滩面高程增加速率,则这些红树林很有可能会在21世纪末由碳库转变为碳源。目前,人类对于红树林的破坏性活动已经造成红树林面积和碳埋藏储量的剧烈减少,沿岸水体富营养化总体上对于红树林碳埋藏有促进作用。
综合考虑以上各因素,为维持和增加红树林碳库储量,在热带地区应着眼于维持和提高大型红树林湿地的滩面高程增加速率,这就需要科学管理河流入海水沙通量、控制海岸带地下水开采量,并采取适当措施增加流域泥沙供应。在亚热带地区,应该在适宜红树林生长的地区开展人工种植活动,以期扩大红树林面积。
| [1] |
DONATO D C, KAUFFMAN J B, MURDIYARSO D, et al. Mangroves among the most carbon-rich forests in the tropics[J]. Nature Geoscience, 2011, 4(5): 293-297. DOI:10.1038/ngeo1123 |
| [2] |
BOUILLON S, BORGES A V, CASTAÑEDA-MOYA E, et al. Mangrove production and carbon sinks:A revision of global budget estimates[J]. Global Biogeochemical Cycles, 2008, 22(2): 1-12. |
| [3] |
FOURQUREAN J, JOHNSO B, CAUFFMAN J B, et al. Coastal blue carbon:Methods for assessing carbon stocks and emissions factors in mangroves, tidal salt marshes, and seagrasses[J]. Journal of American History, 2014, 4(14): 4-7. |
| [4] |
ALONGI D M. Carbon cycling and storage in mangrove forests[J]. Annual Review of Marine Science, 2014, 6(1): 195-219. DOI:10.1146/annurev-marine-010213-135020 |
| [5] |
ALONGI D M. Carbon sequestration in mangrove for-ests[J]. Carbon Management, 2014, 3(3): 313-322. |
| [6] |
LIU H, REN H, HUI D, et al. Carbon stocks and potential carbon storage in the mangrove forests of China[J]. Journal of Environmental Management, 2014, 133: 86-93. |
| [7] |
MURDIYARSO D, DONATO D C, KAUFFMAN J B, et al. Carbon storage in mangrove and peatland ecosystems:A preliminary account from plots in Indonesia[J]. Ecological Applications, 2010, 14(sup4): 232-246. |
| [8] |
EZCURRA P, EZCURRA E, GARCILLÁN P P, et al. Coastal landforms and accumulation of mangrove peat increase carbon sequestration and storage[J]. Proceedings of the National Academy of Sciences, 2016, 113(16): 4404-4409. DOI:10.1073/pnas.1519774113 |
| [9] |
DUARTE C M, MIDDELBURG J J, CARACO N F. Major role of marine vegetation on the oceanic carbon cycle[J]. Biogeosciences, 2005, 2(1): 1-8. |
| [10] |
SANDERS C J, SMOAK J M, NAIDU A S, et al. Organic carbon burial in a mangrove forest, margin and intertidal mud flat[J]. Estuarine, Coastal and Shelf Science, 2010, 90(3): 168-172. DOI:10.1016/j.ecss.2010.08.013 |
| [11] |
PÉREZ A, MACHADO W, GUTIERREZ D, et al. Changes in organic carbon accumulation driven by mangrove expansion and deforestation in a New Zealand estuary[J]. Estuarine, Coastal and Shelf Science, 2017, 192: 108-116. DOI:10.1016/j.ecss.2017.05.009 |
| [12] |
MACAKENZIE R A, FOULK P B, KLUMP J V, et al. Sedimentation and belowground carbon accumulation rates in mangrove forests that differ in diversity and land use:A tale of two mangroves[J]. Wetlands Ecology and Management, 2016, 24(2): 245-261. DOI:10.1007/s11273-016-9481-3 |
| [13] |
SMOAK J M, BREITHAUPT J L, SMITH T J, et al. Sediment accretion and organic carbon burial relative to sea-level rise and storm events in two mangrove forests in Everglades National Park[J]. Catena, 2013, 104: 58-66. DOI:10.1016/j.catena.2012.10.009 |
| [14] |
McKEE K L, CAHOON D R, FELLER I C. Caribbean mangroves adjust to rising sea level through biotic controls on change in soil elevation[J]. Global Ecology and Biogeography, 2007, 16(5): 545-556. DOI:10.1111/j.1466-8238.2007.00317.x |
| [15] |
LOVELOCK C E, ADAME M F, BENNION V, et al. Sea level and turbidity controls on mangrove soil surface elevation change[J]. Estuarine, Coastal and Shelf Science, 2015, 153: 1-9. DOI:10.1016/j.ecss.2014.11.026 |
| [16] |
MCIVOR A, SPENCER T, SPALDING M, et al.The response of mangrove soil surface elevation to sea level rise[R].Cambridge: Nature Conservancy & Wetlands International, 2013.
|
| [17] |
SANDERS C J, SMOAK J M, WATERS M N, et al. Organic matter content and particle size modifications in mangrove sediments as responses to sea level rise[J]. Marine Environmental Research, 2012, 77: 150-155. DOI:10.1016/j.marenvres.2012.02.004 |
| [18] |
LOVELOCK C E, CAHOON D R, FRIESS D A, et al. The vulnerability of Indo-Pacific mangrove forests to sea-level rise[J]. Nature, 2015, 526(7574): 559-563. DOI:10.1038/nature15538 |
| [19] |
CAVANAUGH K C, KELLNER J R, FORDE A J, et al. Poleward expansion of mangroves is a threshold response to decreased frequency of extreme cold events[J]. Proceedings of the National Academy of Sciences, 2014, 111(2): 723-727. DOI:10.1073/pnas.1315800111 |
| [20] |
DOUGHTY C L, LANGLEY J A, WALKER W S, et al. Mangrove range expansion rapidly increases coastal wetland carbon storage[J]. Estuaries and Coasts, 2016, 39(2): 385-396. DOI:10.1007/s12237-015-9993-8 |
| [21] |
LIU T, TAO Y, LIU Y. Mangrove swamp expansion controlled by climate since 1988:A case study in the Nanliu River estuary, Guangxi, Southwest China[J]. Acta Oceanologica Sinica, 2017, 36(12): 11-17. DOI:10.1007/s13131-017-1097-9 |
| [22] |
ESLAMI-ANDARGOLI L, DALE P, SIPE N, et al. Mangrove expansion and rainfall patterns in Moreton Bay, Southeast Queensland, Australia[J]. Estuarine, Coastal and Shelf Science, 2009, 85(2): 292-298. DOI:10.1016/j.ecss.2009.08.011 |
| [23] |
DREXLER J Z, EWEL K C. Effect of the 1997-1998 ENSO-related drought on hydrology and salinity in a micronesian wetland complex[J]. Estuaries, 2001, 24(3): 347-356. DOI:10.2307/1353237 |
| [24] |
HUQ S U, AHMED A U, KOUDSTAAL R.Vulnerability of bangladesh to climate change and sea level rise[M]//Climate Change and World Food Security.Berlin: Springer Berlin Heidelberg, 1996: 376-378.
|
| [25] |
LIU T, LIU Y, YUAN F Y. Response of mangrove swamp sedimentation rate to climate change[J]. Journal of Tropical Oceanography, 2017, 36(2): 40-47. |
| [26] |
SCHWARZER K, THANH N C, RICKLEFS K. Sediment re-deposition in the mangrove environment of Can Gio, Saigon River estuary (Vietnam)[J]. Journal of Coastal Research, 2016, 75(sp1): 138-142. DOI:10.2112/SI75-028.1 |
| [27] |
ALONGI D M. Present state and future of the world's mangrove forests[J]. Environmental Conservation, 2002, 29(3): 331-349. DOI:10.1017/S0376892902000231 |
| [28] |
KAUFFMAN J B, HEIDER C, COLE T G, et al. Ecosystem carbon stocks of micronesian mangrove forests[J]. Wetlands, 2011, 31(2): 343-352. |
| [29] |
MURDIYARSO D, PURBOPUSPITO J, KAUFF-MAN J B, et al. The potential of Indonesian mangrove forests for global climate change mitigation[J]. Nature Climate Change, 2015, 5(12): 1089-1092. DOI:10.1038/nclimate2734 |
| [30] |
KAUFFMAN J B, HEIDER C, NORFOLK J, et al. Carbon stocks of intact mangroves and carbon emissions arising from their conversion in the Dominican Republic[J]. Ecological Applications:A publication of the Ecological Society of America, 2014, 24(3): 518-527. DOI:10.1890/13-0640.1 |
| [31] |
LI D, XU Y, LI Y, et al. Sedimentary records of human activity and natural environmental evolution in sensitive ecosystems:A case study of a coral nature reserve in Dongshan Bay and a mangrove forest nature reserve in Zhangjiang River estuary, Southeast China[J]. Organic Geochemistry, 2018, 121: 22-35. DOI:10.1016/j.orggeochem.2018.02.011 |
| [32] |
KONDOLF G M, RUBIN Z K, MINEAR J T. Dams on the Mekong:Cumulative sediment starvation[J]. Water Resources Research, 2014, 50(6): 5158-5169. DOI:10.1002/2013WR014651 |
| [33] |
LOVELOCK C E, BALL M C, MARTIN K C, et al. Nutrient enrichment increases mortality of mangroves[J]. PLoS ONE, 2009, 4(5): e5600. DOI:10.1371/journal.pone.0005600 |
| [34] |
YEE S M.REDD and BLUE Carbon: Carbon paymen-ts for mangrove conservation[R].MAS Marine Biodiversity and Conservation, 2010. http://bluecarbonportal.org/wp-content/uploads/2012/08/MAS_REDD-BC_-Carbon-Payments-for-Mangrove-Conservation_2010.pdf
|
| [35] |
LUNSTRUM A, CHEN L. Soil carbon stocks and accumulation in young mangrove forests[J]. Soil Biology and Biochemistry, 2014, 75: 223-232. DOI:10.1016/j.soilbio.2014.04.008 |
| [36] |
NGUYEN H T, YONEDA R, NINOMIYA I, et al. The effects of stand-age and inundation on carbon accumulation in mangrove plantation soil in Namdinh, Northern Vietnam[J]. Tropics, 2004, 14(1): 21-37. DOI:10.3759/tropics.14.21 |



