2. 亚热带农业资源保护利用与利用国家重点实验室, 广西南宁 530005
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning, Guangxi, 530005, China
近年来,我国水体重金属污染现象越来越严重,我国七大水系——长江、黄河、淮河、松花江、辽河、海河和珠江水系沉积物中Cd、As、Zn、Pb、Cu、Hg和Cr等的污染现状不容乐观[1]。而这些污染的主要来源是矿石开采、废水灌溉、污水排放、化工生产、电镀行业,等等[2]。这些排放到环境的重金属不但不能被生物降解,还会参与食物链循环在生物体内富集,当人体器官中富集超标的铜后,就会出现溶血性黄瘟、肾功能衰竭等症状[3],对人体造成严重的伤害[4]。重金属污染治理的方法多种多样。微生物繁殖迅速,在直接处理低浓度重金属废水或者是二次处理重金属废水时,有着修复效果好、投资小、费用低、易于管理和操作、不产生二次污染的优点,因而日益受到人们的重视,成为重金属污染修复的研究热点[5]。目前微生物法处理铜离子污染废水多处于实验室阶段,如印度学者Dave等[6]筛选分离得到的Eichhornia spp.在24 h内对100 μg/L的铜离子去除率达到85%,但是这种菌株对铜离子的极限耐受程度却不够高。Andreazza等[7]从铜污染的葡萄园土壤筛选到Pseudomena ssp.,其在起始浓度为300 mg/L的废水中,24 h内对铜离子的吸附率达到36%,该菌株虽然耐受能力较强,但是吸附能力却很差。在国内,刘婷婷等[8]筛选到的放线菌对铜离子的耐受能力可以达到8 000 mg/L。因此,筛选到铜重金属离子耐受能力强同时吸附能力也强的菌株,对微生物治理水体重金属污染具有着一定的积极意义。生物技术在直接处理低浓度重金属废水或者是二次处理高浓度重金属废水时,有着投资小、不产生二次污染的优点,但是现在的生物治理技术实验材料大都是利用工业发酵中产生的废弃菌丝体和自然环境中的水藻类[9-10],细菌和真菌类较少。因此,本文期望筛选到能够在高浓度铜离子环境中生长并具有高吸附特性的细菌,进而扩充微生物治理铜离子水体污染的备选菌种,为铜离子污染的生态环境的生物治理提供依据。
1 材料与方法 1.1 材料 1.1.1 样品采集土壤样品为电镀厂周边的土壤、广西大学碧云湖底的淤泥和广西大学垃圾场的土壤。样品封装于灭菌后的离心管中,并置于—20℃冰箱备用。
1.1.2 基础培养基(1) 牛肉膏蛋白胨培养基(细菌):牛肉膏3 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 L。
(2) 高氏一号(放线菌):可溶性淀粉20 g,硝酸钾1 g,氯化钠0.5 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,硫酸铁0.01 g,蒸馏水1 L,pH值为7.2-7.4。配置时,先用少量冷水将淀粉调成糊状,倒入煮沸的水中,在火上加热,边搅拌边加入其他成分,融化后,补充水至1 L。
(3) 察氏培养基(霉菌):硝酸钠2 g,磷酸氢二钾1 g,氯化钾0.5 g,硫酸镁0.5 g,硫酸铁0.01 g,蔗糖30 g,蒸馏水1 L。
(4) 马丁氏琼脂培养基(真菌):葡萄糖10 g,蛋白胨5 g,磷酸二氢钾1 g,七水合硫酸镁0.5 g,1%虎红300 μL,蒸馏水1 L。
葡萄糖、蛋白胨、牛肉膏等试剂药品均为市售分析纯。(1)(2)(3)号培养基在121℃下灭菌20 min,(4)号培养基在112℃下灭菌20 min。
1.1.3 含重金属离子的培养基1.1.2节(1)(2)(3)(4)基础培养基灭菌后加入无菌的氯化铜溶液(使用孔径0.22 μm的滤膜过滤除菌),使其达到实验所设计的浓度。需要配制固体培养基时,在上述基础培养基中加入2%的琼脂即可。
1.2 方法 1.2.1 微生物的驯化与筛选称取5 g土壤样品加入到45 mL的无菌水中,加入适量玻璃珠,220 r/min充分震荡20 min,分散孢子,静置5 min后取上清液。将上清经过105倍梯度稀释后,接种到已灭菌的含有10 mmol/L铜离子的固体平板培养基上,恒温培养箱培养。细菌培养温度为37℃,培养时间为1 d;真菌、放线菌为28-30℃,培养时间分别为3-5 d和5-7 d。待微生物生长出来后,挑单菌落至装有灭菌的5 mL液体培养基中,恒温摇床振荡培养,转速为220 r/min。菌种经过培养后按5%的接种量,依次接种于铜离子浓度为20-300 mmol/L的新鲜液体培养基中,继续摇床振荡培养。如此通过不断提高培养基中的铜离子浓度对土壤中耐受重金属的微生物进行驯化[11]。
1.2.2 菌株的分离纯化选取对铜离子耐受性最好的菌株,在液体培养基中培养。在无菌操作的条件下,将菌液经过一定浓度的稀释,在不含重金属离子的固体培养基上划线分离,培养5 d后观察菌落形态。用平板培养基再转接培养分离纯化3次,以达到菌株彻底纯化的效果。纯化的菌株保存于—20℃冰箱中备用。
1.2.3 菌种鉴定(1) 细菌基因组DNA的提取参考文献[12]。
(2) 细菌16S rDNA的PCR扩增
PCR反应体系为50 μL。其中基因组DNA 1 μL作为反应模板,上下游引物混合物(正向引物5′-AGAGTTTGATCATGGCTCAG-3′,反向引物5′-TCAGGTTACCTTGTTACGTACTT-3′)1 μL,dNTP混合物4 μL,rTaq聚合酶0.5 μL,10×缓冲液5 μL,加灭菌的去离子水至50 μL。
PCR反应条件:98℃预变性1 min;98℃变性10 s,55℃复性10 s,72℃延伸1.5 min,35个循环;72℃延伸7 min。通过胶回收试剂盒纯化、回收扩增的DNA,送至广州睿博进行16S rDNA测序。
1.2.4 菌株生长特性测定配制细菌培养基,设定pH值(4,5,6,7,8,9)、铜离子浓度(0, 25, 50, 100, 150, 200 mg/L)、温度等3个因素,进行单因素实验,对其生长过程中的OD值与生长速率μ值(即为单位时间内菌株的绝对生长量,用于量化对数生长期的峰值生长速度)进行研究,以摸索出菌株的最佳生长环境,测定不同因素下菌体的生长情况,并测定在无铜离子、自然pH值、37℃条件时的标准生长曲线。生长曲线测定由rts仪器测定(测定波长800 nm,测定时转速2 000 r/min)。
1.2.5 吸附特性研究(a) 吸附试验[13]:配制细菌液体培养基,在250 mL三角瓶中加入100 mL液体培养基,灭菌后接入1 mL菌悬液,然后置于37℃、220 r/min摇床中培养16 h。使用吸附体系pH值(5,6,7,8,9)、吸附时间(2, 4, 6, 8 h)、起始铜离子浓度(50, 100, 150, 200 mg/L)、吸附温度(25, 30, 35, 40, 45℃)等4个因素设置单因素实验,对其进行吸附特性研究,实验处理之后的培养液经8 000 r/min冷冻离心,取上清液使用铜试剂法测其铜离子浓度,吸附率(%)=(Cu2+初始浓度—Cu2+终浓度)/Cu2+初始浓度×100%。
(b) 铜离子测定[14]:铜离子在溶液中可以和二乙基二硫代氨基甲酸钠生成有色络合物,当水样中铜离子浓度较高时,可在水相中直接测定,其最大吸收波长为450 nm,在测定条件下有色络合物可稳定1 h。将未经酸化的水样,通过0.45 μm滤膜过滤。用移液管移取适量的体积(含铜量不超过35 μg,最大加入体积不大于50 mL;若含铜量超过35 μg,则应该稀释一定倍数至含铜量小于35 μg)过滤后的试样,置于分液漏斗中,加水至50 mL。加入5.0 mL二乙基二硫代氨基甲酸钠溶液(ρ=2 mg/mL),摇匀,静置5 min,准确加入10 mL四氯化碳,震荡不少于2 min,静置分层。显色后1 h内,使用紫外吸收分光光度计测定吸光值。
(c) 标准曲线的建立:在8个分液漏斗中分别加入含有0, 6.4, 12.8, 19.2, 25.6, 32 μg的铜离子标准溶液,加水至50 mL总体积,配成系列校准溶液,使用铜试剂测定方法,建立标准曲线。根据实验数据绘制标准曲线,铜离子标准曲线方程为y=104.89x-6.498,R2=0.999 7。
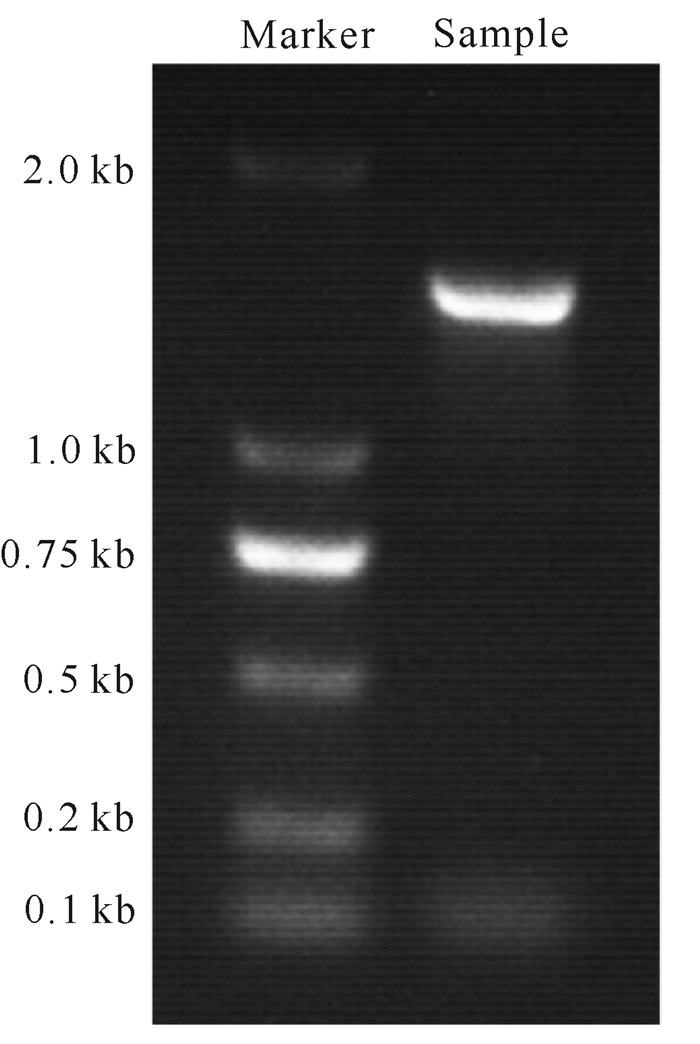
2 结果与分析 2.1 菌株分离纯化与鉴定按照1.1.1节所述配制含铜离子的固体筛选平板,将土壤样品处理后稀释涂布,筛选驯化后发现,在牛肉膏蛋白胨培养基上生长的一株菌株对铜离子的耐受最高,如图 1所示其耐受铜离子浓度最高可以达到19 000 mg/L,命名为KCY。之后按照1.2.3节所述,提取细菌KCY总DNA,并扩增其16S rDNA序列,其扩增产物如图 2所示。通过胶回收,扩增的产物由广州瑞博公司进行测序,获得16S rDNA的基因序列。将该序列与NCBI数据库进行BLAST比对,使用MEGA 7软件里面的最大似然法构建进化树[15-16],进化树分析如图 3所示,发现细菌KCY与Bacillus subtilis的同源性大于96%,可以确定该菌为枯草芽孢杆菌Bacillus subtilis,命名为Bacillus subtilis KCY。

|
| 图 1 菌株耐受情况 Fig. 1 Tolerance of the strain |
|
| 图 2 菌株16S rDNA琼脂糖凝胶电泳图 Fig. 2 Agarose gel electrophoresis of 16S rDNA of the strain |

|
| 图 3 菌株的进化树分析 Fig. 3 Phylogenetic tree analysis of the strain |
2.2 菌株的生长特性 2.2.1 菌株生长曲线
由图 4a可知,该菌株的生长周期较短,在37℃条件下培养3 h后就进入对数生长期,峰值生长速率可达1 h-1;11 h时进入稳定期,峰值OD800可达7;14 h后就进入衰亡期,OD800开始下滑;16 h后菌株OD800下滑速度开始减缓,最后OD800下降到一定数值便不再变化。对应的生长速率图也可以看出相应的结果(图 4b)。

|
| 图 4 菌株生长曲线(OD800与生长速率) Fig. 4 Strain growth curve (OD800 and growth rate) |
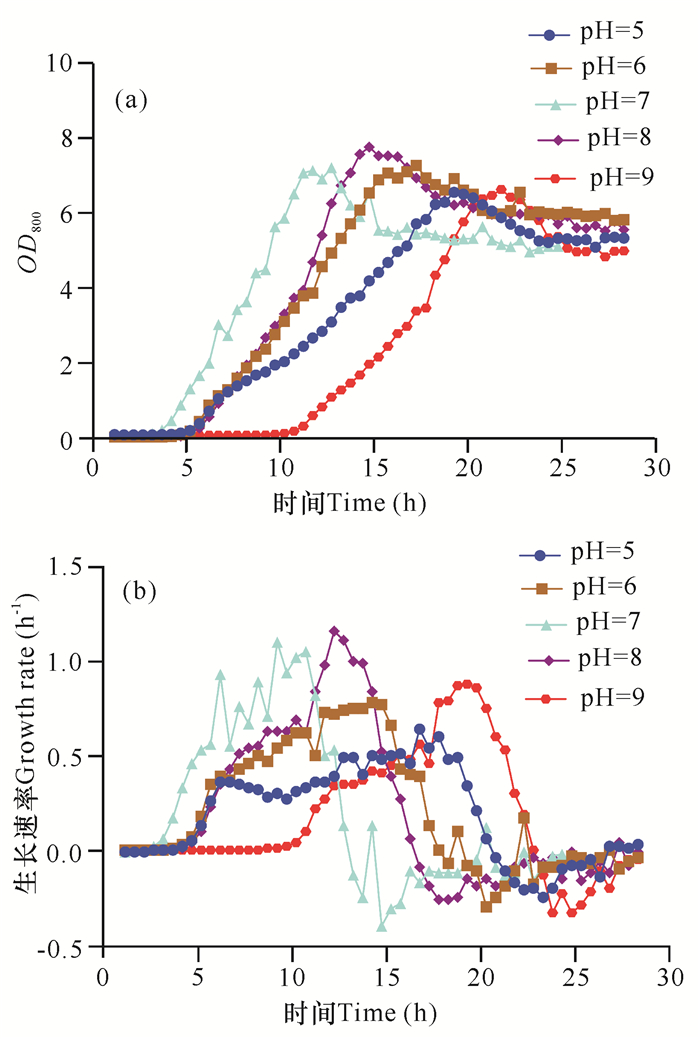
2.2.2 pH值对菌株生长特性的影响
由图 5可知,pH值为8时菌株的峰值OD800最高,可以达到7.84(图 5a);在此pH值条件下,菌株的对数生长期峰值生长速率也最大,可以达到1.1 h-1左右(图 5b),此条件应该是菌株生长的最佳pH值。在pH值分别为6和7时,菌株稳定期的OD800与pH值为8时相差不大,但是pH值为6时,菌株的对数生长期峰值生长速率偏低,仅为0.8 h-1左右。当pH值为5和9时,菌株整个生长期的OD800明显偏低,对数生长期生长速率相较于pH值为8时都有一定程度的下降。因此推测菌株生长的最佳pH值为6-8,在此范围下菌株可以较好地生长。其中,当pH值为8时菌株生长状态最好。
|
| 图 5 pH值对菌株生长的影响(OD800与生长速率) Fig. 5 Effect of pH value on strain growth (OD800 and growth rate) |
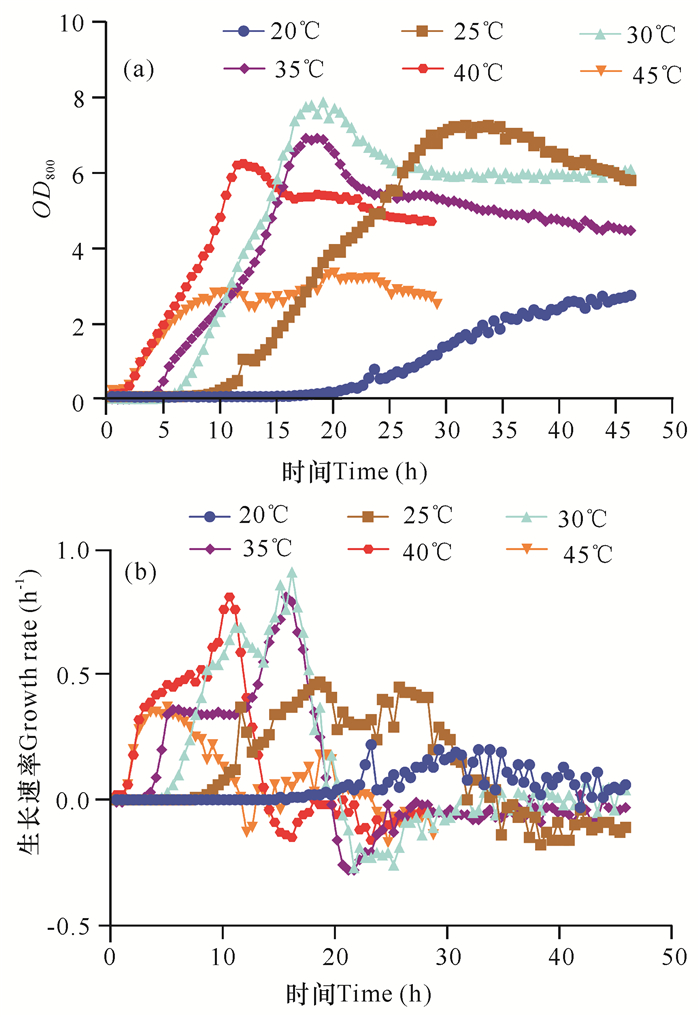
2.2.3 温度对菌株生长特性的影响
如图 6所示,菌株在25-40℃可以较好地生长,峰值OD800都可以达到7以上,当温度为30℃时菌株峰值OD800最高(图 6a),对数生长期的峰值生长速率也最高,可以达到0.9 h-1左右(图 6b)。当温度为40℃时,可以看到菌株的生长周期大大缩短,在15 h左右时,菌株就进入衰亡期,而此时其他温度条件下的菌株还没有进入稳定期。在温度大于等于45℃或小于等于20℃时,菌株已经不能正常生长。
|
| 图 6 温度对菌株生长的影响(OD800与生长速率) Fig. 6 Effect of temperature on strain growth(OD800 and growth rate) |
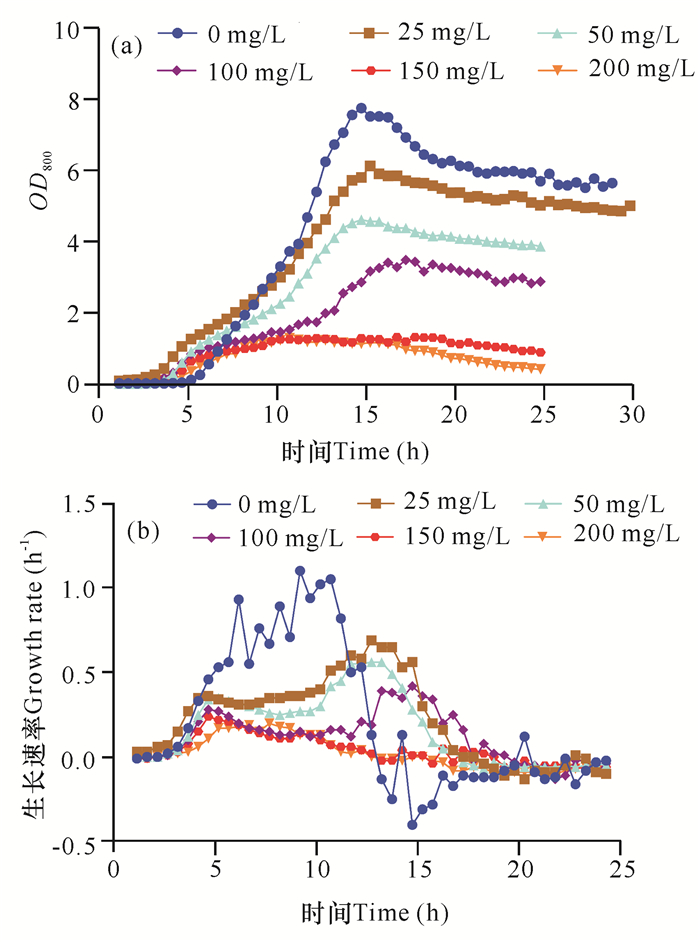
2.2.4 初始铜离子浓度对菌株生长特性的影响
由图 7可知,菌株在初始铜离子浓度为25 mg/L时,OD800相较于正常情况下就已经开始下降,但下降幅度不多,基本可以正常生长,而对数期生长速率却有较大下滑,表明菌株的生长还是一定程度受到铜离子的影响。当初始铜离子浓度开始增加,菌株的生长开始受到抑制。当铜离子浓度达到150 mg/L时,菌株的4个生长时期已经基本不能区分,此时菌株受到强抑制,不能正常生长。
|
| 图 7 初始铜离子浓度对菌株生长的影响(OD800与生长速率) Fig. 7 Effect of initial copper concentration on strain growth (OD800 and growth rate) |
2.3 菌株的吸附特性 2.3.1 吸附时间对菌株吸附特性的影响
由图 8可知,在起始铜离子浓度为200 mg/L条件下, 吸附5 h,枯草芽孢杆菌KCY对铜离子的吸附率达到最高(72%),之后吸附率便开始下降。值得注意的是,在最初的1 h内,菌株对铜离子的吸附率就已达到40%,这可能与吸附刚开始时,菌株吸附位点空余有关。在2 h后,吸附率增长缓慢,应该是因为表面空余位点都被占据,此时只有主动吸附起作用,所以增长缓慢,直到第5 h达到峰值(72%),之后吸附效率便开始大幅度下滑。
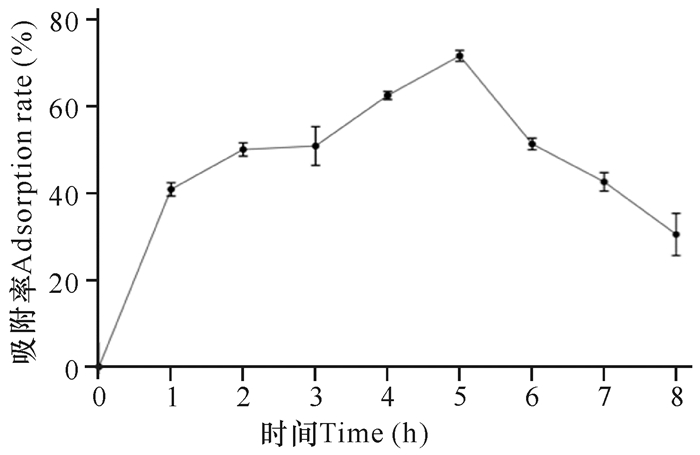
|
| 图 8 吸附时间对菌株吸附能力的影响 Fig. 8 Effect of adsorption time on adsorption capacity of strain |
2.3.2 吸附温度对菌株吸附特性的影响
由图 9可知,枯草芽孢杆菌KCY在20-25℃时,对重金属离子的吸附能力非常弱,可能是由于较低的温度影响吸附活性物质的合成[17]。当温度为30-40℃时,吸附效率逐渐上升,40℃到达峰值,之后开始下降,可能是过高的温度使菌株的吸附活性成分受到损伤。
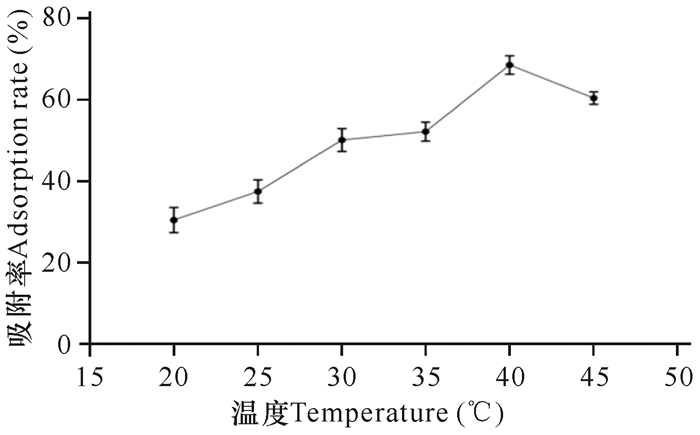
|
| 图 9 吸附温度对菌株吸附能力的影响 Fig. 9 Effect of temperature on adsorption capacity of strain |
2.3.3 pH值对菌株吸附特性的影响
由图 10可知最佳pH值为7,此时枯草芽孢杆菌KCY的吸附率达到最高(72%)。偏酸环境影响吸附效率,可能与溶液中的H+和H3O+占据吸附位点有关;偏碱环境影响吸附效率可能与溶液中形成Cu(OH)2有关。
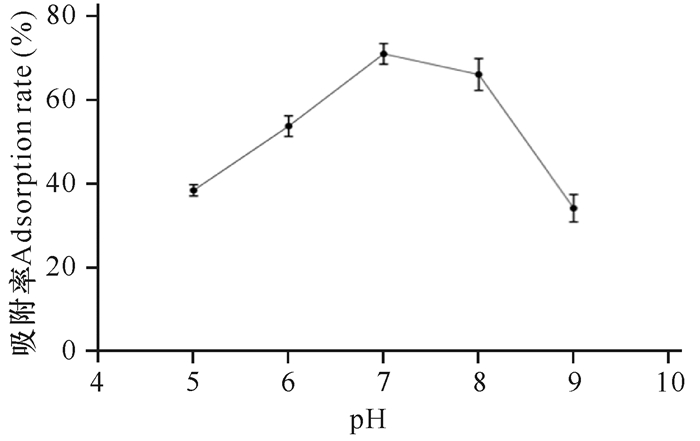
|
| 图 10 pH值对菌株吸附能力的影响 Fig. 10 Effect of pH value on adsorption capacity of strain |
2.3.4 起始铜离子浓度对菌株吸附特性的影响
由图 11可知,起始铜离子浓度为150, 200, 250 mg/L时,菌株吸附率都在70%左右,而在铜离子浓度为200 mg/L时枯草芽孢杆菌KCY吸附率达到最大(72%)。铜离子浓度超过250 mg/mL时,吸附能力开始下滑。当铜离子浓度超过300 mg/mL时,这种吸附能力的下滑开始变得缓慢。菌株的吸附率随着起始重金属铜离子的浓度增大而增大,可能是由于细胞壁上的结合位点较多,在铜离子浓度较低时没有完全与这些吸附位点结合。
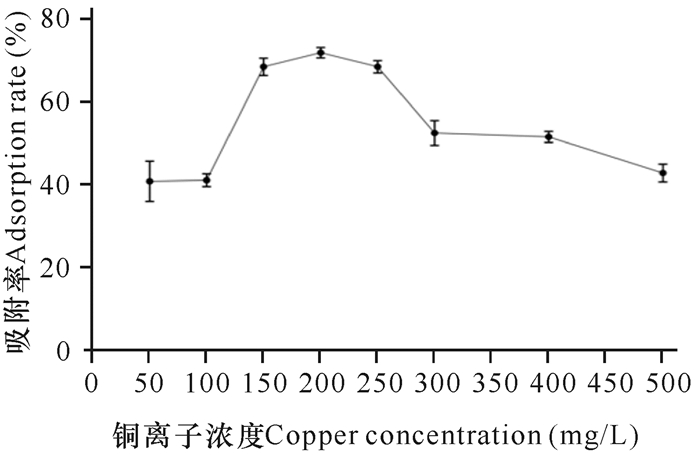
|
| 图 11 起始铜离子浓度对菌株吸附能力的影响 Fig. 11 Effect of initial copper concentration on adsorption capacity of strain |
3 讨论
对Bacillus subtilis KCY进行吸附特性研究,摸索出最佳吸附pH值为7。培养环境过碱性时,溶液内会形成氢氧化铜沉淀,影响吸附;而当培养环境偏酸性时,溶液内存在大量带正电的氢离子,这些带正电的氢离子会与溶液中游离的铜离子竞争活性吸附位点,因此会影响菌体对于铜离子的吸附;与此同时,氢离子与细胞表面细胞壁的吸附位点结合后,使得细胞壁表面的—COOH、—OH等官能团质子化而带上正电荷,由于同性相斥的静电斥力进一步限制带正电金属离子的靠近与吸附。
在吸附起始1 h内,吸附刚开始的时候,菌株里面所有的吸附位点都是空的,且溶液中金属离子的浓度含量比较高,质粒之间推动力非常大,所以吸附起来很快;随着吸附逐渐进行,菌体的细胞外部细胞壁上面的吸附位点被逐渐占满,未吸附的活性位点减少,所以金属离子吸附量的增加变得非常慢[18-19]。而且吸附的初始阶段来说,主要是金属离子和细胞壁表面的—COOH、—OH等官能团相结合,这种类型的吸附往往非常迅速[20-21];随着吸附的进行,重金属铜离子通过细胞的主动吸附进入细胞,细胞内的区隔作用开始显现,细胞壁上的重金属离子逐渐被转移至细胞内部,细胞外壁上的活性位点又开始暴露出来,所以吸附量还可以进一步增加。但由于这个过程非常缓慢,所以吸附率的增加也变得很缓慢[17-18, 22]。而之后的吸附率下降,猜测可能是因为重金属离子对菌株造成损伤,导致一些细胞开始分解,细胞量下降,所以吸附能力也开始下降。
从实验结果可以看出,菌株的吸附率随着起始重金属铜离子的浓度增大而增大,可能是开始时由于细胞壁上的结合位点较多,在铜离子浓度较低的时候不能完全与这些吸附位点结合,所以随着起始铜离子浓度的增大,吸附率也逐渐增大。还有一个可能的原因是当溶液中铜离子的浓度增大时,溶液中游离的铜离子间也会产生相当的排斥作用,使得铜离子更容易与细胞壁表面上的吸附位点结合,也就是说,重金属浓度的增加使得铜离子在溶液与微生物吸附剂之间的传质推动力增加,导致吸附率变大[23];然而,随着重金属铜离子浓度的进一步增加,重金属离子逐渐将细胞壁上的活性吸附位点全部占据,可利用的吸附位点减少,吸附率就呈现出降低的现象[21, 23-24]。从图 11中可以看出,当铜离子起始浓度超过200 mg/L时吸附率开始下降,但是经过计算可以发现,菌株吸附铜离子的总量却是在增加的。
在20℃和25℃时,菌株吸附率较低,推测可能是由于较低的温度影响吸附活性物质的合成[17]。当温度逐渐升高到30,35,40℃时,枯草芽孢杆菌KCY的重金属离子吸附能力逐渐上升。根据之前的优化发酵条件也可以看出,枯草芽孢杆菌比较适合35-40℃的温度环境,在这样的环境下,相对高的温度加速菌株体内的新陈代谢,使得菌株的胞内吸附作用得到活化,所以提高了菌株对重金属离子的吸附能力。而当温度继续升高到45℃时,枯草芽孢杆菌KCY的吸附能力开始下降,说明温度过高,对菌体内的一些生物质产生伤害,使得菌体的吸附能力下降。
微生物修复法在直接处理低浓度重金属污染水体或者是二次处理重金属污染水体时,相较于传统物理法、化学法有着更为高效、绿色的优点,其修复潜力巨大[25]。现阶段虽然已有耐铜微生物的报道,但其耐受性还不是很强, 如Pseudomonas USTB-E、Aspergillus fumigatus、Providencia alcalifaciens、Rhizopus的耐受浓度分别为560 mg/L[26],940 mg/L[27],450 mg/L[28],1 920 mg/L[29]。本实验筛选到的枯草芽孢杆菌对铜离子耐受浓度可以达到19 000 mg/L,是已发现的耐受微生物中较为优秀的菌种。菌株Providencia alcalifaciens在铜离子起始浓度为100 mg/L、pH值为5.5、温度为30℃、吸附时间为4 h的条件下,达到最大吸附效率82%[28],本实验菌株吸附效率与之相差不大,但在耐受性方面,从450 mg/L提升到19 000 mg/L,更能适应于高浓度的污染废水,扩增了微生物修复的菌株备选库,有利于以后微生物治理废水的工业化生产。
4 结论筛选到的枯草芽孢杆菌KCY在温度25-40℃,pH值为5-9时,可以基本正常生长;其最佳发酵条件为30℃,pH值为8;保持基本正常生长下的铜离子耐受浓度为0-150 mg/L,极限铜离子耐受浓度可以达到19 000 mg/L,吸附率可以达到72%。对于铜离子的最佳吸附条件为pH值7,温度40℃,起始铜离子浓度200 mg/L,吸附5 h。实验筛选到的菌株具有改善和治理铜离子污染废水的潜力。
| [1] |
朱青青, 王中良. 中国主要水系沉积物中重金属分布特征及来源分析[J]. 地球与环境, 2012, 40(3): 305-313. |
| [2] |
刘洪超, 魏学华, 何广宇. 我国重金属污染土壤修复技术的发展现状及选择策略[J]. 环境与发展, 2018(2): 82. |
| [3] |
于莎莎.锌和铜对镉胁迫下水稻幼苗生长及植物螯合肽合成的影响研究[D].北京: 中国农业科学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016174590.htm
|
| [4] |
郭玲. 土壤重金属污染的危害以及防治措施[J]. 中国资源综合利用, 2018, 36(1): 123-125. |
| [5] |
黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 3(3): 409-417. |
| [6] |
DAVE S, DAMANI M, TIPRE D, et al. Copper remediation by Eichhornia spp.and sulphate-reducing bacteria[J]. Journal of Hazardous Materials, 2010, 173(1/2/3): 231-235. |
| [7] |
ANDREAZZA R, PIENIZ S, WOLF L, et al. Characterization of copper bioreduction and biosorption by a highly copper resistant bacterium isolated from copper-contaminated vineyard soil[J]. Science of the Total Environment, 2010, 408(7): 1501-1507. |
| [8] |
刘婷婷, 滕金浩. 铜污染土壤中耐铜微生物的筛选与分离[J]. 安徽农业科学, 2019, 47(2): 60-63, 102. |
| [9] |
RAMÍREZ-PAREDES F I, MANZANO-MUÑOZ T, GARCIA-PRIETO G, et al. Biosorption of heavy metals from acid mine drainage onto biopolymers (chitin and α (1, 3) β-D-glucan) from industrial biowaste exhausted brewer's yeasts (Saccharomyces cerevisiae L.)[J]. Biotechnology and Bioprocess Engineering, 2011, 16(6): 1262-1272. |
| [10] |
HⅡ S L, YONG S Y, WONG C L. Removal of rhodamine B from aqueous solution by sorption on Turbinaria conoides (Phaeophyta)[J]. Journal of Applied Phycology, 2009, 21(5): 625-631. |
| [11] |
刘丽.耐Cu、Cd微生物的分离筛选及其吸附机理研究[D].合肥: 合肥工业大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10359-2010246768.htm
|
| [12] |
李兰松.重金属吸附菌的选育、吸附特性和机理研究[D].太原: 太原理工大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10112-1016714210.htm
|
| [13] |
彭国文, 丁德馨, 胡南, 等. 化学修饰啤酒酵母菌对铀的吸附特性[J]. 化工学报, 2011, 62(11): 3201-3206. |
| [14] |
殷亦文. 二乙基二硫代氨基甲酸钠分光光度法测定铜的简便快速方法的探讨[J]. 环境, 2011(s2): 53-56. |
| [15] |
TAMURA K, NEI M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees[J]. Molecular Biology and Evolution, 1993, 10(3): 512-526. |
| [16] |
KUMAR S, STECHER G, TAMURA K. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874. |
| [17] |
ABD-ALLA M H, MORSY F M, EL-ENANY A W E, et al. Isolation and characterization of a heavy-metal-resistant isolate of Rhizobium leguminosarum bv.viciae potentially applicable for biosorption of Cd2+ and Co2+[J]. International Biodeterioration & Biodegradation, 2012, 67: 48-55. |
| [18] |
CHAKREVARTY R, BANERJEE P C. Mechanism of cadmium binding on the cell wall of an acidophilic bacterium[J]. Bioresource Technology, 2012, 108: 176-183. |
| [19] |
SRIVASTAVA V C, SWAMY M M, MALL I D, et al. Adsorptive removal of phenol by bagasse fly ash and activated carbon:Equilibrium, kinetics and thermodynamics[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2006, 272(1/2): 89-104. |
| [20] |
ÇABUK A, AKAR T, TUNALI S, et al. Biosorption of Pb(Ⅱ) by industrial strain of Saccharomyces cerevisiae immobilized on the biomatrix of cone biomass of Pinus nigra:Equilibrium and mechanism analysis[J]. Chemical Engineering Journal, 2007, 131(1/2/3): 293-300. |
| [21] |
VELMURUGAN P, SHIM J, YOU Y, et al. Removal of zinc by live, dead, and dried biomass of Fusarium spp.isolated from the abandoned-metal mine in south Korea and its perspective of producing nanocrystals[J]. Journal of Hazardous Materials, 2010, 182(1/2/3): 317-324. |
| [22] |
刘希涛, 李广悦, 胡南, 等. 茶渣吸附U(Ⅵ)的特性[J]. 化工学报, 2012, 63(10): 3291-3296. |
| [23] |
MASOUMI F, KHADIVINIA E, ALIDOUST L, et al. Nickel and lead biosorption by Curtobacterium sp.FM01, an indigenous bacterium isolated from farmland soils of northeast iran[J]. Journal of Environmental Chemical Engineering, 2016, 4(1): 950-957. |
| [24] |
HAJAHMADI Z, YOUNESI H, BAHRAMIFAR N, et al. Multicomponent isotherm for biosorption of Zn(Ⅱ), CO(Ⅱ) and Cd(Ⅱ) from ternary mixture onto pretreated dried Aspergillus niger biomass[J]. Water Resources and Industry, 2015, 11: 71-80. |
| [25] |
董新姣, 陈文海. 耐铜细菌的筛选及其吸附条件优化[J]. 环境科学与技术, 2002, 25(5): 6-7, 19. |
| [26] |
王海鸥, 钟广蓉, 王立曼, 等. 一株耐铜细菌的鉴定及富集特性的研究[J]. 环境工程学报, 2011, 5(10): 2380-2384. |
| [27] |
傅冬和, 薛志慧, 姚亚丽, 等. 1株高耐铜真菌的分离鉴定及其在茶园土壤中的富铜应用研究[J]. 中国农学通报, 2012, 28(34): 268-273. |
| [28] |
李兰松, 杨永珍, 贾虎生, 等. 铜抗性菌株的筛选及其对Cu2+的吸附性能[J]. 化工学报, 2013, 64(9): 3381-3389. |
| [29] |
卢福芝, 李启虔, 钱丰, 等. 耐铜、铅、锡微生物的分离筛选[J]. 河池学院学报, 2012, 32(5): 15-20. |



