2. 广西农作物废弃物功能成分研究协同创新中心, 广西南宁 530200;
3. 中-加斑马鱼中药筛选联合实验室, 广西南宁 530200
2. Collaborative Innovation Center of Study on Functional Ingredients of Agricultural Residues, Nanning, Guangxi, 530200, China;
3. Sino-Canada Joint Zebrafish Lab for Chinese Herbal Drug Screening, Nanning, Guangxi, 530200, China
厚藤Ipomoea pes-caprae (Linn.) Sweet为旋花科(Convolvulaceae)番薯属草本植物,俗称马鞍藤、走马风、二叶红薯等,主要分布于热带及亚热带沿海地区,资源丰富[1]。厚藤味辛、苦,性微寒,归肺、肝、胃、大肠经,具有祛风除湿、消痈散结、拔毒消肿的功效,民间常用于治疗腰肌劳损、风湿关节痛、腰腿痛及疮疖、痔疮、皮炎等。厚藤是中国南方沿海的民间常用海洋中药和京族习用药,《中华海洋本草》《中华本草》《广西药用植物名录》等多部著作中均有该植物药用记载[2-3]。斑马鱼是一种亚热带淡水鱼类[4],具有体积小、繁殖快、易于培养、成本低、易于给药、容易观察等特点和优势,同时斑马鱼各种器官和组织在解剖学、生理学和分子水平上已被证实类似于哺乳动物,与人类基因组的相似度高达87%,已经成为脊椎动物中最适于做发育生物学和遗传学研究的模式生物[5],也是最有潜力的毒理模式脊椎动物之一[6-7]。目前,国内外已经广泛将斑马鱼应用于急、慢性毒性实验的高通量筛选[8-11]。厚藤在药物应用安全性评价方面的研究少见相关报道。本研究采用斑马鱼模型对厚藤水提物(Ipomoea pes-caprae(Linn.) Sweet water extract, IWE)及醇提物(Ipomoea pes-caprae(Linn.) Sweet alcohol extract, IAE)进行急性毒性、胚胎毒性、心脏毒性以及肝脏毒性评价,为其综合利用及产品开发提供参考依据。
1 材料与方法 1.1 材料 1.1.1 实验动物AB系野生型斑马鱼、gz15Tg/+(AB)肝脏荧光蛋白转基因斑马鱼均由广西中医药大学中-加斑马鱼中药筛选联合实验室提供。
1.1.2 样品厚藤采自广西合浦县,经广西中医药大学韦松基教授鉴定为旋花科番薯属植物厚藤Ipomoea pes-caprae (Linn.) Sweet,摘取其叶子后置于电热恒温鼓风干燥箱中,55℃恒温干燥厚藤叶子至恒重,保存备用。
1.1.3 仪器及试剂斑马鱼养殖系统(上海海圣生物实验设备有限公司,型号:Z-A-D5),层照培养箱(上海博讯实业有限公司医疗设备厂,型号:BXG-250);荧光立体显微镜(德国徕卡仪器有限公司,型号:M165 FC);体视显微镜(日本OLYMPUS株式会社,型号:SZX2-ILLT);丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)检测试剂盒购自南京建成生物科技有限公司。
1.2 方法 1.2.1 厚藤水提物及醇提取的制备称取厚藤叶粗粉100 g,加10倍量水,室温浸泡1 h,加热回流提取3次,每次1.5 h,过滤,合并3次滤液,用大型旋转蒸发仪减压浓缩至一定程度后,转移至蒸发皿中,水浴挥干得35.34 g。称取厚藤叶粗粉100 g,加15倍量的95%(V:V)乙醇,摇床提取过夜,转速120 r/min,温度35℃,提取3次,滤纸过滤,合并3次滤液,用大型旋转蒸发仪减压浓缩回收溶剂,干燥后得到乙醇提取物浸膏9.78 g。
1.2.2 斑马鱼急性毒性研究健康雌、雄AB系野生型斑马鱼成鱼在28℃、光照14 h/黑暗10 h条件下分开饲养,定时喂以颗粒状饵料和丰年虾。用卵时,取健康性成熟斑马鱼,按雌雄1:1或1:2放入交配缸内,次日9:00~10:00时获得受精卵。对受精卵进行清洗后放于28℃光照培养箱内,继续孵育至受精后至3 dpf (Days post-fertilization)大小备用。
根据前期预实验结果,厚藤水提物给药斑马鱼幼鱼72 h后全部死亡的最小剂量为4.5 mg/mL,无死亡的最大剂量为1.0 mg/mL。在此范围内将厚藤水提物用斑马鱼培养水配制成1.0 mg/mL,1.5 mg/mL,2.0 mg/mL,2.5 mg/mL,3.0 mg/mL,3.5 mg/mL,4.0 mg/mL,4.5 mg/mL的溶液作为实验组,以培养水为空白对照组,加入6孔板内,每孔终体积4 mL;厚藤醇提物给予斑马鱼幼鱼72 h后全部死亡的最小剂量为2.0 mg/mL,无死亡的最大剂量为0.5 mg/mL。在此范围内将厚藤醇提物用斑马鱼培养水配制成0.5 mg/mL,0.8 mg/mL,1.0 mg/mL,1.2 mg/mL,1.4 mg/mL,1.6 mg/mL,1.8 mg/mL,2.0 mg/mL的溶液作为实验组,以培养水为空白对照组,0.5%(V:V)DMSO为溶剂对照组,加入6孔板内,每孔终体积4 mL;将3 dpf斑马鱼移入各孔中,每孔20枚;每24 h更换孔中1/2的药液,并去除死亡斑马鱼,在6 dpf时观察记录各孔斑马鱼死亡数,实验重复3次,确定在给药72 h后通过Origin 8.0软件拟合药物浓度-致死曲线并计算最大非致死浓度(MNLC)、半数致死浓度(LC50)、10%致死浓度(LC10)。
1.2.3 斑马鱼胚胎发育毒性研究将厚藤水提物及醇提物用培养水稀释成1/10MNLC组,1/3MNLC组,MNLC组,LC10组及空白对照组,厚藤醇提物以0.5%DMSO为溶剂对照。待斑马鱼胚胎发育至10 hpf (Hours post fertilization)时在显微镜下挑选正常分裂的鱼卵,将受精鱼卵暴露于药液中,按15个/孔置于6孔板,每孔容积为4 mL,置于培养箱中孵化,分别在24 hpf、48 hpf、72 hpf于显微镜下观察胚胎在不同发育阶段的发育情况及形态变化,实验过程中每24 h更换1次受试药物溶液,统计药物作用于斑马鱼胚胎发育过程中的24 hpf的自主运动次数、孵化率等指标,并拍照记录胚胎发育过程的形态变化。
1.2.4 斑马鱼心脏毒性研究将48 hpf的斑马鱼胚胎随机分组放入24孔板中,每孔10枚,药物分组方法同1.2.3节。斑马鱼胚胎浸泡给药后,放入28℃培养箱内孵育,待斑马鱼胚胎给药72 h后,将斑马鱼胚胎浸入0.05%(V:V)的鱼安定中进行麻醉,然后将1%(W:V)甲基纤维素滴于载玻片中央,用吸管吸取斑马鱼胚胎,让胚胎轻轻落于载玻片上。调整体视显微镜,记录斑马鱼胚胎在1 min内的心跳次数,统计斑马鱼在24 hpf、48 hpf、72 hpf的心率变化情况,同时观察斑马鱼胚胎的心包及心脏形态并拍照,用体视显微镜分析测量工具计算静脉窦(Sinus venosus,SV)-动脉球(Bulbus arteriosus,BA)间距(SV-BA间距)的实际长度,静脉窦是血液流入心房的部位,而动脉球是血液由心室流出的部位。
1.2.5 斑马鱼肝脏毒性研究采用gz15Tg/+(AB)肝脏荧光蛋白转基因斑马鱼为试验动物,待斑马鱼胚胎发育至3 dpf时,挑选发育正常的斑马鱼幼鱼,移入6孔板中,每孔10尾,药物分组方法同1.2.3节。给药后放入28℃培养箱内孵育,连续给药48 h,每天换液。给药48 h后,将斑马鱼用质量分数为0.05%的鱼安定麻醉,然后用1%(W:V)甲基纤维素固定于载玻片上,侧面体位拍照,荧光显微镜下拍照记录斑马鱼肝脏荧光强度,利用图像处理软件Image-J计算肝脏面积。给药结束后,将斑马鱼幼鱼组织匀浆,测定组织中ALT、AST水平。
1.2.6 统计分析数据采用SPSS 21.0统计软件处理分析,单因素方差分析组间差异,P < 0.05表示具有显著性差异,P < 0.01表示具有极显著性差异。
2 结果与分析 2.1 急性毒性评价厚藤水提物LC50为2.84 mg/mL,LC10为1.46 mg/mL;厚藤醇提物LC50为1.32 mg/mL,LC10为0.76 mg/mL。根据各组死亡率(%)用Origin 8.0软件绘制药物浓度-致死曲线如图 1。
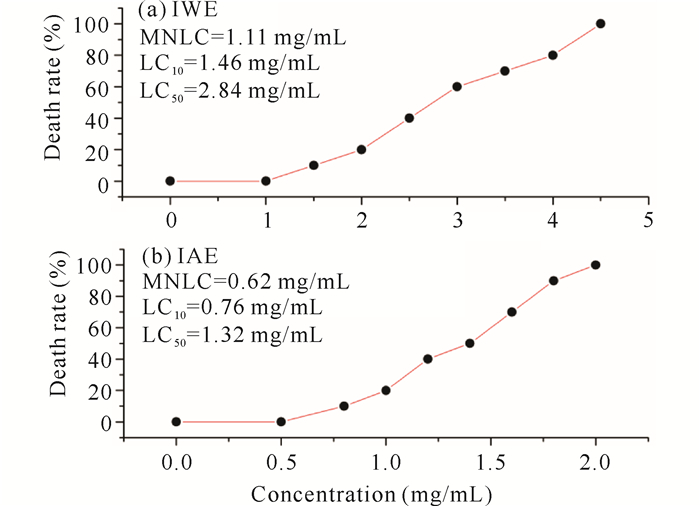
|
| 图 1 厚藤提取物给药斑马鱼72 h的药物浓度-致死曲线 Fig. 1 Drug concentration-lethal curve of zebrafish treated with Ipomoea pes-caprae (Linn.) Sweet extract for 72 h |
2.2 胚胎毒性评价
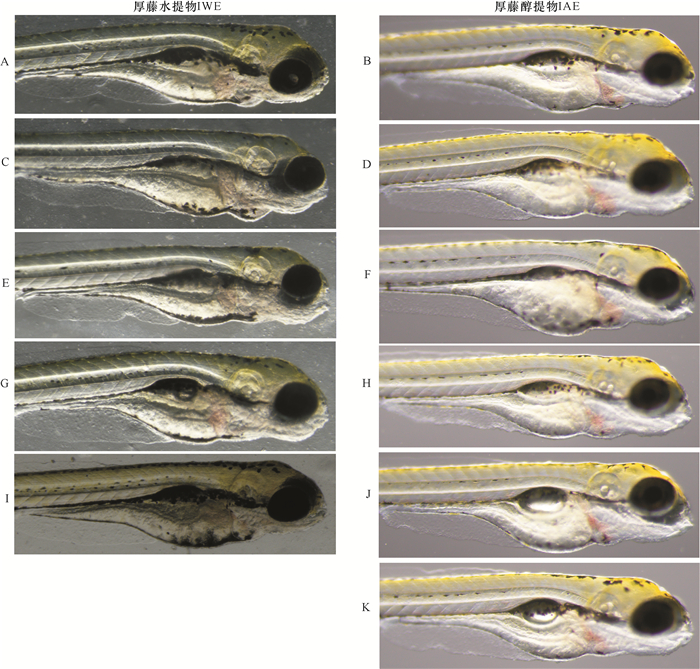
厚藤水提物MNLC组及LC10组干预24 h对斑马鱼胚胎未见尾部自主运动现象,其他各组间比较均无显著性差异;斑马鱼发育至72 hpf,厚藤水提物MNLC组及LC10组与空白对照组比较,出现心脏和软黄囊肿大;厚藤醇提物LC10组与空白对照组比较出现心包水肿,观察中各组未见胚胎发育畸形现象(表 1,图 2)。
| 受试组 Test group | 组别 Group | 药物浓度 Drug concentra- tion (mg/mL) | 胚胎孵化数 Embryo hatching number | 自主运动次数 Number of autonomous movements (times/min) | 孵化率 Hatching rate (%) |
| 厚藤水提物 IWE | 空白对照组 Blank control group | 0.000 | 30 | 3.55±1.58 | 100 |
| 1/10MNLC组 1/10MNLC group | 0.111 | 30 | 4.11±2.31 | 100 | |
| 1/3MNLC组 1/3MNLC group | 0.333 | 26 | 4.89±2.47 | 86.67 | |
| MNLC组 MNLC group | 1.110 | 20 | 未见运动None | 66.67 | |
| LC10组 LC10 group | 1.460 | 17 | 未见运动None | 56.67 | |
| 厚藤醇提物 IAE | 空白对照组 Blank control group | 0.000 | 30 | 3.55±0.72 | 100.00 |
| 0.5%DMSO组 0.5%DMSO group | 0.000 | 30 | 3.44±0.78 | 100.00 | |
| 1/10MNLC组 1/10MNLC group | 0.062 | 27 | 3.56±1.42 | 90.00 | |
| 1/3MNLC组 1/3MNLC group | 0.186 | 26 | 3.44±2.06 | 86.67 | |
| MNLC组 MNLC group | 0.620 | 24 | 3.25±1.21 | 80.00 | |
| LC10组 LC10 group | 0.760 | 23 | 2.77±0.98 | 76.67 |

|
| 厚藤水提物:A.空白对照组;C.1/10MNLC组;E.1/3MNLC组;G.MNLC组;I.LC10组。厚藤醇提物:B.空白对照组;D.0.5%DMSO组;F.1/10MNLC组;H.1/3MNLC组;J.MNLC组;K.LC10组 IWE:A.blank control group; C.1/10MNLC group; E.1/3 MNLC group; G.MNLC group; I.LC10 group.IAE:B.blank control group; D.0.5% DMSO group; F.1/10MNLC group; H.1/3 MNLC group; J.MNLC group; K.LC10 group 图 2 厚藤作用于10 hpf斑马鱼胚胎72 h对胚胎发育的影响 Fig. 2 Influence of Ipomoea pes-caprae (Linn.) Sweet on 10 hpf zebrafish embryo 72 h on embryo development |
2.3 心脏毒性评价
厚藤水提物及醇提物空白对照组斑马鱼胚胎心跳节律规则、搏动强有力;厚藤水提物及醇提物在各个时间点1/3MNLC组、MNLC组及LC10组分别与空白对照组比较均能明显减慢斑马鱼胚胎的心率(P < 0.01),且呈现剂量依赖性,提示有一定的心脏毒性。厚藤水提物及醇提物的1/3MNLC组、MNLC组及LC10组分别与空白对照组比较均能明显增加斑马鱼胚胎的SV-BA间距(P < 0.01)(表 2,图 3)。
| 受试组 Test group | 组别 Group | 药物浓度 Drug concen- tration (mg/mL) | 心率Heart rate (times/min) | SV-BA间距 SV-BA distance (μm) | ||
| 24 h | 48 h | 72 h | ||||
| 厚藤水提物 IWE | 空白对照组 Blank control group | 0.000 | 118.00±6.06 | 114.67±6.02 | 120.00±3.57 | 118.81±9.33 |
| 1/10MNLC组 1/10MNLC group | 0.111 | 117.30±3.26 | 105.33±9.04 | 118.27±3.26 | 116.57±1317 | |
| 1/3MNLC组 1/3MNLC group | 0.333 | 105.33±11.21** | 101.33±7.86* | 114.00±7.05 | 141.54±11.18** | |
| MNLC组 MNLC group | 1.110 | 100.66±6.88** | 95.33±8.16** | 109.33±7.33** | 166.97±5.33** | |
| LC10组 LC10 group | 1.460 | 96.00±5.65** | 91.33±6.40** | 110.67±7.45** | 198.45±7.21** | |
| 厚藤醇提物 IAE | 空白对照组 Blank control group | 0.000 | 120.67±1.33 | 122.67±7.44 | 118.67±3.26 | 108.57±11.26 |
| 0.5% DMSO组 0.5%DMSO group | 0.000 | 118.86±4.84 | 118.24±3.34 | 113.33±9.68 | 105.57±2.30 | |
| 1/10MNLC组 1/10MNLC group | 0.062 | 107.33±6.88** | 109.33±9.01** | 110.57±8.26 | 115.07±13.69* | |
| 1/3MNLC组 1/3MNLC group | 0.186 | 106.00±8.67** | 105.86±5.88** | 108.00±5.05* | 121.86±3.14** | |
| MNLC组 MNLC group | 0.620 | 102.00±5.51** | 99.24±5.11** | 98.00±10.03** | 126.03±3.38** | |
| LC10组 LC10 group | 0.760 | 93.33±6.53** | 95.24±5.11** | 96.58±5.51** | 137.18±5.18** | |
| 注:与空白对照组比较,*P < 0.05,**P < 0.01 Note:Compared with blank control group, *P < 0.05,**P < 0.01 | ||||||
|
| 厚藤水提物:A.空白对照组;C.1/10MNLC组;E.1/3MNLC组;G.MNLC组;I.LC10组; 厚藤醇提物:B.空白对照组;D.0.5%DMSO组;F.1/10MNLC组;H.1/3MNLC组;J.MNLC组;K.LC10组 IWE:A.blank control group; C.1/10MNLC group; E.1/3 MNLC group; G.MNLC group; I.LC10 group; IAE:B.blank control group; D.0.5% DMSO group; F.1/10MNLC group; H.1/3 MNLC group; J.MNLC group; K.LC10 group 图 3 厚藤作用于24 hpf斑马鱼72 h对胚胎心脏的影响 Fig. 3 Influenceof Ipomoea pes-caprae (Linn.) Sweet on 24 hpf zebrafish 72 h on heart development |
2.4 肝脏毒性评价
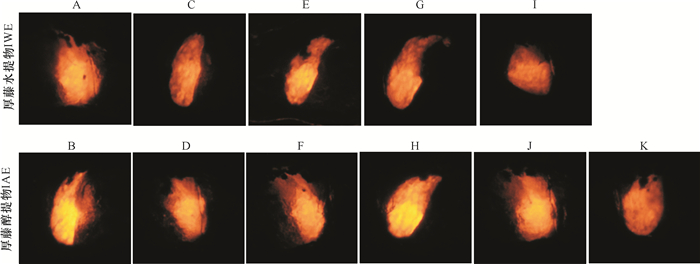
利用荧光显微镜观察厚藤水提物及醇提物对gz15Tg/+(AB)肝脏荧光蛋白转基因斑马鱼肝脏的影响,结果显示,厚藤水提物中各给药组与空白对照组比较,肝脏荧光面积均有减少趋势,但组间无差异性,提示为未发生肝脏毒性;厚藤醇提物中1/3MNLC组、MNLC组及LC10组与空白对照组比较,肝脏荧光面积均有增加趋势,但组间无差异性,提示为未发生肝脏毒性;药物干预斑马鱼72 h后,各给药组斑马鱼的ALT、AST水平与空白对照组比较均无显著差异(表 3,图 4)。
| 组别 Group | 受试组 Test group | 药物浓度 Drug concentra- tion (mg/mL) | ALT (U/mg) | AST (U/mg) | 肝脏荧光面积 Liver fluorescence area (μm2) |
| 厚藤水提物 IWE | 空白对照组 Blank control group | 0.000 | 5.47±0.94 | 5.64±0.35 | 51 785.42±6 293.52 |
| 1/10MNLC组 1/10MNLC group | 0.111 | 4.34±1.09 | 5.21±0.76 | 46 885.50±3 601.15 | |
| 1/3MNLC组 1/3MNLC group | 0.333 | 4.82±0.67 | 4.96±0.61 | 44 179.75±1 663.55 | |
| MNLC组 MNLC group | 1.110 | 4.61±0.75 | 4.64±0.78 | 44 721.25±4 998.64 | |
| LC10组 LC10 group | 1.460 | 4.32±0.53 | 4.48±1.25 | 45 860.43±7 013.39 | |
| 厚藤醇提物 IAE | 空白对照组 Blank control group | 0.000 | 5.34±0.31 | 4.94±0.33 | 49 910.51±6 957.54 |
| 0.5% DMSO组 0.5% DMSO group | 0.000 | 4.98±0.85 | 4.65±1.05 | 46 241.28±4 164.23 | |
| 1/10MNLC组 1/10MNLC group | 0.062 | 4.03±1.89 | 4.38±0.64 | 44 758.75±4 343.76 | |
| 1/3MNLC组 1/3MNLC group | 0.186 | 3.68±0.47 | 4.43±0.36 | 50 068.40±3 083.24 | |
| MNLC组 MNLC group | 0.620 | 3.52±1.04 | 3.85±0.94 | 52 548.75±3 723.30 | |
| LC10组 LC10 group | 0.760 | 3.71±1.32 | 3.79±0.88 | 53 625.25±3 213.92 |
|
| 厚藤水提物:A.空白对照组;C.1/10MNLC组;E.1/3MNLC组;G.MNLC组;I.LC10组; 厚藤醇提物:B.空白对照组;D.0.5%DMSO组;F.1/10MNLC组;H.1/3MNLC组;J.MNLC组;K.LC10组 IWE:A.blank control group; C.1/10MNLC group; E.1/3 MNLC group; G.MNLC group; I.LC10 group; IAE:B.blank control group; D.0.5% DMSO group; F.1/10MNLC group; H.1/3 MNLC group; J.MNLC group; K.LC10 group 图 4 厚藤作用于斑马鱼肝脏的影响 Fig. 4 Influence of Ipomoea pes-caprae (Linn.) Sweet on the liver of zebrafish |
3 讨论
中药毒性研究是中药现代化研究的重要组成部分,由于体外实验方法不能准确预测中药在体内的生物学特性,而传统的哺乳动物模型成本高、时间长、灵敏度有限,这些因素限制了对中药毒性的研究[12]。斑马鱼是近年来应用越来越广泛的重要模式生物,其整体模型具有细胞等体外实验用药量少、实验费用低、周期短、高通量等特点,同时具备整体动物实验可观察多个器官可评价药效学、药动学和评价代谢物活性等优势,已被越来越多的药物研发机构应用于药物毒性与安全性评价[13-14]。中药具有多效应、多成分、多靶点的作用特性,用体外研究方法对中药的安全性和药效学评价与人体实验结果相比较差,同时也很难对中药有效活性成分进行很好的评价和筛选,利用斑马鱼模型在药物开发的早期阶段对不安全的化合物进行快速筛除,可以大大提高药物筛选的效率,缩短新药研发周期,降低药物的研发成本,提高新药研发的成功率[15-16]。
厚藤是一种生长于滨海滩涂的海洋中药,分布范围广泛,资源丰富,目前对厚藤的研究主要集中于化学成分、药理作用及生物学等方面,其化学成分主要含树脂糖苷、萜类、酚酸类、黄酮类、挥发性成分、甾体类、生物碱等[17-19];药理作用主要有抗肿瘤、抗菌、抗炎镇痛、抗胶原酶、抗氧化、免疫调节等多种活性[3, 20-21];生物学方面的研究主要是组织培养及植株再生,生长适应性的研究等[22-23]。
斑马鱼整体急性毒性实验中,急性毒性是药物安全性评价的重要指标之一,处于药物毒理研究的早期阶段,对阐明药物的毒性作用和了解其毒性靶器官具有重要意义,以心脏停止跳动为死亡指标[24]。胚胎毒性实验中,以胚胎孵化率,自主运动次数,胚胎致畸性,心脏膨大、卵黄囊肿大、尾巴萎缩等为评判指标[25-26]。心脏毒性实验中,以心率变化,SV-BA间距,心包水肿,心脏畸形、脊柱弯曲等形态改变为评判指标[27]。肝脏毒性实验中,以肝脏面积,轮廓形态,肝细胞受损指标ALT、AST等为评判指标[28]。
4 结论本研究采用模式生物斑马鱼对海洋中药厚藤不同提取物进行急性毒性、胚胎毒性、心脏毒性以及肝脏毒性评价,结果显示,厚藤水提物的LC50显著高于醇提物;高剂量LC10组均对斑马鱼胚胎发育产生一定毒性作用,表现为心脏和卵黄囊肿大,心包淤血,但未出现胚胎发育畸形现象;厚藤水提物及醇提物随着给药剂量增加均能明显减慢斑马鱼胚胎的心率,同时SV-BA间距明显变长,提示产生一定心脏毒性作用;ALT、AST水平与肝脏相关,肝脏荧光面积变化均反映肝脏毒性的大小,厚藤水提物及醇提物各给药组与空白对照组比较均未引起明显的肝脏毒性。本实验为后期深入研究海洋中药厚藤的作用机理,及其综合利用及产品开发提供了参考依据。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志:第64卷[M]. 北京: 科学出版社, 1979.
|
| [2] |
管华, 王曙光. 中华海洋本草[M]. 上海: 上海科技出版社, 2009.
|
| [3] |
冯小慧, 邓家刚, 秦健峰, 等. 海洋中药厚藤的化学成分及药理活性研究进展[J]. 中草药, 2018, 49(4): 955-964. |
| [4] |
刘平怀, 陈德力, 汪春牛, 等. 海滩植物厚藤(Ipomoea pes-caprae)抗氧化活性研究[J]. 精细化工, 2010, 27(9): 866-869. |
| [5] |
YANG L, HO N Y, ALSHUT R, et al. Zebrafish embryos as models for embry-otoxic and teratological effects of chemicals[M]. Reprod Toxicol, 2009: 245-253.
|
| [6] |
彭伟, 张文娟, 薛钰. 斑马鱼作为骨骼疾病模型的研究进展[J]. 中国实验动物学报, 2019, 27(2): 248-253. DOI:10.3969/j.issn.1005-4847.2019.02.019 |
| [7] |
方薇, 曾静, 王付利. 模式生物斑马鱼在人类疾病研究中的应用[J]. 医学信息, 2010, 5(2): 337-338. DOI:10.3969/j.issn.1006-1959-C.2010.02.153 |
| [8] |
赵崇军, 田敬欢, 王金凤, 等. 斑马鱼在中药研究中的应用进展[J]. 中草药, 2015, 46(17): 2635-2648. DOI:10.7501/j.issn.0253-2670.2015.17.022 |
| [9] |
陈志亮. 斑马鱼在药物筛选中的应用[J]. 中国中药杂志, 2015, 40(7): 1235-1239. |
| [10] |
史建伟. 斑马鱼模型在中医药领域的研究与应用[J]. 临床医药文献杂志, 2019, 6(3): 189-190. |
| [11] |
李乙根, 黄文瑾, 黄诚. 斑马鱼在新药发现中的应用[J]. 生命科学, 2011, 23(3): 273-278. |
| [12] |
郭胜亚, 朱晓宇, 廖文瀚, 等. 斑马鱼模型评价5种中药肝脏毒性[J]. 实验动物科学, 2016, 33(5): 21-27. DOI:10.3969/j.issn.1006-6179.2016.05.004 |
| [13] |
田丽莉, 朱国福. 斑马鱼在中药研究中的应用[J]. 中国中药杂志, 2015, 40(5): 822-827. |
| [14] |
张勇, 贺剑辉, 刘洪翠, 等. 斑马鱼在药物临床前毒理学研究中的应用进展及现状[J]. 中国药理学与毒理学杂志, 2013, 27(3): 482-483. |
| [15] |
李铭源.斑马鱼药物筛选模型在中药活性成分发现及作用机理研究中的应用[A]//中国药理学会(the Chinese Pharmacological Society).中国药理学会第十次全国学术会议专刊.北京: 中国药理学会, 2009: 2.
|
| [16] |
张勇.斑马鱼在中药药效、安全性及质量控制中的应用[A]//中国毒理学会中药与天然药物毒理专业委员会.中国毒理学会中药与天然药物毒理专业委员会第二次(2017年)学术交流大会论文集.北京: 中国毒理学会中药与天然药物毒理专业委员会, 2017: 6.
|
| [17] |
王清吉, 王友绍, 何磊, 等. 厚藤Ipomoea pes-caprae (L.) Sweet的化学成分研究(Ⅰ)[J]. 中国海洋药物杂志, 2006, 25(3): 15-17. |
| [18] |
葛玉聪, 罗建光, 吴燕红, 等. 厚藤化学成分研究[J]. 中药材, 2016, 39(10): 2251-2255. |
| [19] |
AMOR-PRATS D, HARBORNE J B. New souces of ergoline alkaloids within the genus Ipomoea[J]. Biochemical Systematics and Ecology, 1993, 21(4): 455-461. DOI:10.1016/0305-1978(93)90104-Y |
| [20] |
KUMAR A, PAUL S, KUMARI P, et al. Antibacterial and phytochemical assessment on various extracts of Ipomoea pes-caprae (L.) R.Br through FTIR and GC-MS spectroscopic analysis[J]. Asian Journal of Pharmaceutical and Clinical Research, 2014, 7(3): 134-138. |
| [21] |
VENKATARAMAN D, ATLEE W C, PRABHU T P, et al. Evaluation of initro anti-arthritic potential of aerial parts of Ipomoea pes-caprae (L.) R.brand estabilishment of its mechanism of action[J]. Research Journal Pharmaceutical, Biological and Chemical Science, 2013, 4(2): 1560-1565. |
| [22] |
化彬.广西滨海沙生植物厚藤的生长适应性研究[D].南宁: 广西大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10593-1018133054.htm
|
| [23] |
黎海利, 谭飞理, 刘锴栋, 等. 厚藤的组织培养及植株再生[J]. 北方园艺, 2015(15): 104-106. |
| [24] |
姜玮.基于模式生物斑马鱼的"藻戟遂芫俱战草"急性毒性相互作用研究[D].南京: 南京中医药大学, 2012.
|
| [25] |
陈怡君, 钟玉绪, 董武, 等. 麝香酮对斑马鱼胚胎的发育毒性[J]. 中国药理学与毒理学杂志, 2014, 28(2): 267-273. DOI:10.3867/j.issn.1000-3002.2014.02.021 |
| [26] |
何贝轩, 杨雨婷, 何育霖, 等. 木香挥发油对斑马鱼胚胎发育毒性的初步研究[J]. 中华中医药杂志, 2016, 31(11): 4714-4716. |
| [27] |
江明金, 魏筱华, 温金华, 等. 青藤碱和美沙酮对斑马鱼胚胎心脏毒性的研究[J]. 中药药理与临床, 2016, 32(6): 70-72. |
| [28] |
全正扬, 孙震晓. 基于斑马鱼模型的何首乌水提物及其主要成分的肝毒性研究[J]. 中国药物警戒, 2018, 15(1): 1-5. DOI:10.3969/j.issn.1672-8629.2018.01.001 |



