2. 广西卫生职业技术学院, 广西南宁 530023;
3. 广西中医药大学第一附属医院, 广西南宁 530003
2. Guangxi Health College, Nanning, Guangxi, 530023, China;
3. The First Affiliated Hospital of Guangxi University of Traditional Chinese Medicine, Nanning, Guangxi, 530003, China
兰香草Caryopteris incana(Thunb.)Miq.是马鞭草科莸属植物[1],主要分布在亚洲东部和中部。在我国,广西分布较多。该属植物报道最多的化学成分是黄酮类,已报道的所含化学成分包括黄酮、烷酸、二烯豆甾醇、环烯醚萜、挥发油等[1]。兰香草作为药材入药,内服可用于治疗风寒感冒、风湿麻痹等症;外敷可用于治疗出血、疮疖肿痛等[2]。中药质量评价和控制是药材研究的热点之一,以往的评价方法只能针对单一的成分指标,难以反映药材的整体质量,而指纹图谱可以对中药材的多个成分指标作评价,能够全面反映药材的整体质量[3-11]。目前,对广西产兰香草指纹图谱未见有公开的报道,本文对广西产兰香草进行指纹图谱的研究,建立其高效液相色谱(HPLC)指纹图谱,为科学评价和有效鉴别兰香草提供方法和依据。
1 材料与方法 1.1 材料仪器:超声波清洗器(昆山市超声仪有限公司);Millipore Simplicity-185超纯水仪(美国密里博公司);高效液相色谱仪(Alliance e2695, 美国沃特世)。
试剂:乙腈、冰乙酸(色谱纯);水(超纯水);其他试剂均为分析纯。芦丁对照品(批号:0787-200102,中国药品生物制品检定所,供含量测定用)。
药材:本实验所用兰香草药材共10批(S1-S10),经广西一心药业副主任药师马利飞鉴定均为马鞭草科植物兰香草(C.incana(Thunb.)Miq)地上部分,详见表 1。
| 样品编号 Sample number |
产地 Place of origin |
采收时间 Collecting time |
| S1 | 广西隆安县 Longan County, Guangxi |
2014.03 |
| S2 | 广西钦州 Qinzhou, Guangxi |
2014.05 |
| S3 | 广西武鸣 Wuming, Guangxi |
2014.06 |
| S4 | 广西防城港 Fangchenggang, Guangxi |
2014.07 |
| S5 | 广西上思县 Shangsi County, Guangxi |
2014.09 |
| S6 | 广西浦北县 Pubei County, Guangxi |
2014.10 |
| S7 | 广西合浦县 Hepu County, Guangxi |
2014.12 |
| S8 | 广西东兴县 Dongxing County, Guangxi |
2015.05 |
| S9 | 广西中医药大学植物园 Botanical Garden of Guangxi University of Traditional Chinese Medicine |
2015.08 |
| S10 | 广西药用植物园 Guangxi Medicinal Herb Garden |
2015.10 |
1.2 实验方法 1.2.1 色谱柱的选择
进行预实验比较不同厂家色谱柱的分离效果。A:菲罗门Phenomenex 00G-4435-E0 C18 (250 mm×4.6 mm,5 μm);B:安捷伦Agilent Eclipse Plus-C18(250 mm×4.6 mm,5 μm);C:Wondasil C18-WR (250 mm×4.6 mm,5 μm)。结果表明A色谱柱分离效果最好,在实验过程中A色谱柱能有效地分离主要化合物,并且基线比较平稳,分析时间较短,因此选择A色谱柱作为指纹图谱分析的色谱柱。
1.2.2 流动相系统的选择从4种流动相系统中筛选适合的搭配:甲醇-水, 甲醇-0.1%冰乙酸, 乙腈-水, 乙腈-0.1%冰乙酸。HPLC图谱的考察结果显示,甲醇-水、甲醇-0.1%冰乙酸系统信息较少,甲醇-水系统整体峰形不均匀,且信息少;甲醇-0.1%冰乙酸系统峰分离度低,整体峰形不均匀,基线不稳;乙腈-水分离度相对于甲醇-水、甲醇-0.1%冰乙酸这两个系统比较好,但峰分布不均匀;乙腈-0.1%冰乙酸系统整体峰形较好,分离度较好,提供信息较多。因此,确定流动相统为乙腈-0.1%冰乙酸。
1.2.3 检测波长的选择使用2998-DAD检测器对样品进行190~400 nm全波长扫描,获得3D色谱图(图 1),并重点考查了250 nm、280 nm、300 nm、305 nm、310 nm波长处色谱峰,结果显示,图谱在300 nm处出峰较多,且各色谱峰峰形较好,分离较好,基线较平稳。因此,确定兰香草的检测波长为300 nm。

|
| 图 1 兰香草全波长扫描3D色谱图 Fig. 1 Full wave length scanning 3D chromatogram of frankincense |
1.2.4 柱温的选择
分别设定了25℃、30℃不同的柱温进行考察,在其他色谱条件相同情况下,两个柱温的分离效果相差不大,但25℃分离的效果相对较好,基于对色谱柱和仪器的保护,确定柱温为25℃。
1.2.5 流速的选择分别设定了0.5 mL/min、0.8 mL/min、1.0 mL/min不同的流速进行考察,在其他色谱条件相同情况下,两个流速的分离效果差别较大,0.8 mL/min分离效果较差,信息量较少,峰形整体分布不均匀,而1.0 mL/min分离效果较好,峰分布较均匀,分离度较高,因此选择流速为1 mL/min。
1.2.6 测定方法的确定色谱柱为菲罗门Phenomenex 00G-4435-E0 C18(250 mm×4.60 mm,5 μm);流动相为乙腈-0.1%冰乙酸进行梯度洗脱,检测波长为300 nm,流速为1 mL/min,柱温为25℃,进样量为10 μL。梯度洗脱时间程序见表 2,理论塔板数大于4 000,离度大于1.5。
| 时间 Time (min) |
乙腈 Acetonitrile (%) |
0.1%冰乙酸 0.1% Glacial acetic acid (%) |
| 0 | 7.0 | 93.0 |
| 5 | 11.5 | 88.5 |
| 15 | 13.7 | 86.3 |
| 20 | 17.5 | 82.5 |
| 30 | 18.0 | 82.0 |
| 35 | 20.0 | 80.0 |
| 40 | 23.0 | 77.0 |
| 50 | 24.0 | 76.0 |
| 65 | 25.0 | 75.0 |
| 70 | 38.5 | 61.5 |
| 75 | 48.0 | 52.0 |
| 80 | 95.0 | 5.00 |
1.2.7 延长冲洗时间确定
取一供试品溶液,按1.2.6的条件进样,梯度洗脱170 min。延长冲洗色谱图(图 2)显示,所有组分均在100 min内洗脱出柱,在100 min后已无峰,因此延长冲洗时间确定为100 min。
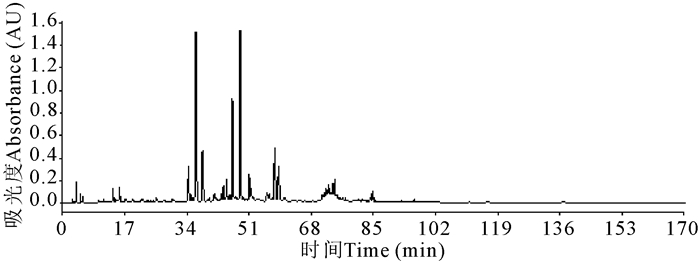
|
| 图 2 延长冲洗色谱图 Fig. 2 Extended rinse chromatogram |
1.3 方法学考察 1.3.1 考察提取溶剂
考察水、95%乙醇、乙酸乙酯、正丁醇的提取效果。进样2 g,超声提取45 min。结果显示,30 mL 95%乙醇提取效果最好,因此选择95%乙醇作为提取溶剂。
1.3.2 考察提取方法考察了超声提取和回流提取,结果回流提取供试品溶液色谱图峰较少且峰较弱小,因此选择超声提取方法。
1.3.3 供试品溶液制备综上预实验结果,确定供试品溶液制备方法:取兰香草药材粉末约2 g,精密称定,置50 mL锤形瓶中,加入30 mL 95%乙醇。超声45 min,放冷,过滤,水浴锅上挥干溶剂,加5 mL甲醇溶解,过0.22 μm微孔滤膜,即得供试品溶液。
1.3.4 参照物的选择与配制指纹图谱的建立必须设置参照峰,根据供试品中所含化学成分的性质,选择芦丁作为参照物,芦丁的色谱图见图 3。参照物溶液配置方法:精密称定芦丁对照品56.66 mg,置于25 mL容量瓶中用甲醇溶剂溶解,定容至标定刻度。
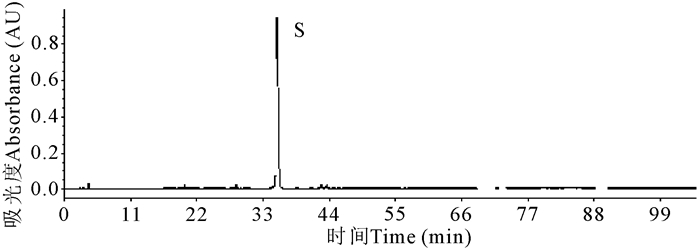
|
| 图 3 芦丁参照物色谱图 Fig. 3 Rutin reference chromatogram |
1.3.5 精密度试验
制备供试品溶液,在上述色谱条件下连续进样6针,记录色谱图,计算兰香草保留时间和峰面积的精密度。结果:保留时间相对标准偏差(Relative standard deviation, RSD)值为0.073%~0.305%,峰面积的RSD值为0.081%~0.782%,精密度符合要求。
1.3.6 重复性试验制备供试品溶液,在上述色谱条件下连续进样6针,记录色谱图,计算保留时间和峰面积的精密度。结果:保留时间RSD值为0.024%~0.376%,峰面积的RSD值为0.182%~0.714%,重复性符合要求。
1.3.7 稳定性试验制备供试品溶液,分别在0 h、2 h、4 h、8 h、12 h、24 h检测图谱,考察样品的稳定性。结果:各色谱峰的相对保留时间RSD值为0.050%~0.560%,相对峰面积的RSD值为0.160%~0.790%,稳定性符合要求。
2 结果与分析 2.1 兰香草的指纹图谱和共有峰从10个产地来源的药材中各取一批作为样本(S1—S10),进行色谱测定。结果(图 4)显示,这10批兰香草指纹图谱高度相似。
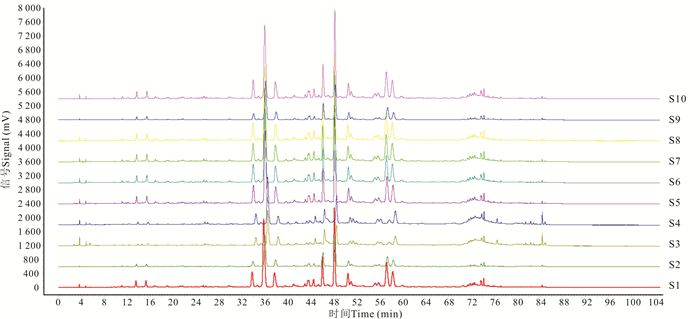
|
| 图 4 10批兰香草的指纹图谱 Fig. 4 Fingerprint of 10 batches of vanilla |
以1号药材为参照图谱,采用《中国药典》颁布的指纹图谱相似度评价软件,对10批兰香草的HPLC色谱图进行自动匹配,时间窗宽度为0.1 min,以平均数法生成对照指纹图谱(图 5)。由图可见,兰香草指纹图谱共有峰为8个,其中4号峰也是参照物芦丁的参照峰,说明芦丁为兰香草中成分含量比较稳定的成分。设定参照峰的相对保留时间和相对峰面积为1,以此为基准分别计算出10批兰香草的相对保留时间和相对峰面积,结果兰香草相对保留时间RSD值为0.067%~0.833%,相对峰面积RSD值为7.17%~24.50%,指纹图谱共有峰的面积占比为91.38%~94.66%,说明其重现性较好。

|
| 图 5 兰香草对照指纹图谱 Fig. 5 Control fingerprint of vanilla |
2.2 不同药材来源的兰香草指纹图谱比较
以1号样品图谱为参照谱,再自动匹配,以平均数的方式生成共有模式图谱R,进行整体相似度评价。结果表明,广西各产地10批兰香草的相似度,广西中医药大学植物园为0.875~1.000;钦州为0.879~1.000;武鸣为0.866~1.000;防城港为0.876~1.000;上思县为0.866~1.000;浦北县为0.892~1.000;合浦县为0.966~1.000;东兴县为0.865~1.000;广西药用植物园为0.892~1.000,经计算符合中药指纹图谱的规定均大于0.9,说明不同产地来源的兰香草质量相对都比较稳定,HPLC法可适用于兰香草的质量评价和控制。
3 结论采用色谱法对中药进行指纹图谱研究已有相应报道[3-11],本实验对不同来源的10批兰香草进行HPLC色谱分析,获得了兰香草指纹图谱对照指纹图谱。用95%乙醇提取兰香草化学成分,得到的指纹图谱杂质峰相对其他溶剂较少、信号较多,有效成分峰更具有代表性。通过对流动相系统的优化,确定流动相为乙腈-0.1%冰乙酸,此系统梯度洗脱分离效果较好,重现性良好。该洗脱系统参照峰出峰时间比较适宜,作为参照物进行相对保留时间和峰面积计算,符合指纹图谱研究要求。从实验的数据分析可看出,各批次的共有峰的相对保留时间与相对峰面积都非常接近。从相似度可看出,10批兰香草的相似度都大于0.9,符合中药指纹图谱的规定,说明兰香草质量比较稳定,可用于兰香草的内在质量控制。
| [1] |
将竞.唐古特获及青海毛冠菊的化学成分研究[D].南京: 东南大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1839359
|
| [2] |
陈红梅, 孙凌峰, 叶文峰. 兰香草挥发油化学成分的研究[J]. 井冈山师范学院学报:自然科学版, 2004, 25(6): 5-8. |
| [3] |
刘布鸣, 林霄, 董晓敏, 等. 香茅油的气相色谱指纹图谱研究[J]. 广西科学, 2010, 17(4): 343-346. |
| [4] |
杨辉, 林霄, 刘布鸣, 等. 巨尾桉挥发油的气相色谱指纹图谱研究[J]. 广西科学, 2012, 19(3): 241-243. |
| [5] |
刘布鸣, 柴玲. 色谱指纹图谱在精油质量分析中的应用研究进展[J]. 广西科学, 2015, 22(2): 135-142. |
| [6] |
喻军, 莫建光, 陈秋虹, 等. 金花茶叶多酚类成分HPLC指纹图谱研究[J]. 广西科学, 2019, 26(2): 238-244. |
| [7] |
黄红泓, 丘琴, 甄丹丹, 等. 不同产地龙利叶HPLC指纹图谱研究[J]. 广西师范大学学报:自然科学版, 2019, 37(3): 142-147. |
| [8] |
周曙光, 甄丹丹, 陈明伟, 等. 玉米苞叶HPLC指纹图谱的研究[J]. 广西中医药, 2019, 42(2): 65-71. |
| [9] |
丘琴, 甄汉深, 陈明伟, 等. 壮药龙利叶茎HPLC指纹图谱研究[J]. 广西师范大学学报:自然科学版, 2016, 34(2): 116-121. |
| [10] |
吴梅, 李宏哲, 薛咏梅, 等. 小白及高效液相指纹图谱分析[J]. 中国实验方剂学杂志, 2019, 25(5): 180-186. |
| [11] |
郭慧清, 李娅琦, 王梓轩, 等. 不同商品规格芜活药材的HPLC指纹图谱分析[J]. 中国实验方剂学杂志, 2019, 25(7): 184-188. |



