木榄(Bruguiera gymnorrhiza (Linn.) Savigny)是红树科木榄属植物,为我国传统药用红树植物,又名包罗剪定、鸡爪浪、剪定、枷定、大头榄、鸡爪榄、五脚里等,多散生于秋茄树的灌丛中。我国主要分布在广东、广西、福建、台湾及其沿海岛屿,国外主要分布在非洲东南部、印度、斯里兰卡等地[1]。木榄是一种很有价值的海洋药用植物,具有清热解毒、止泻、收敛止血等多种药理功效,民间用于治疗发烧、腹泻、止血、消除咽喉肿痛及对抗疟原虫等,被《海洋药物》《现代本草纲目》等中草药专著收摘[2-3]。木榄叶子中所含的化学成分十分丰富,含多种脂肪酸、氨基酸、多糖、黄酮以及萜类等化合物[4-6]。这些已知的化学成分或与木榄的药理功效有所关联。早期研究发现,木榄叶药材中含有多种黄酮类化学成分,但目前国内外对木榄的分析研究大多在性状、显微、化学成分和基因等方面[7-10],国家标准和地方标准也均未见收载木榄药材。鉴于此,笔者采用薄层色谱法对木榄进行定性鉴别,并测定其水分、总灰分、浸出物及总黄酮含量,为有效控制该药材质量提供依据。
1 材料与方法 1.1 材料 1.1.1 仪器HC-1000Y高速多功能粉碎机(永康市天祺盛世工贸有限公司),SQP电子分析天平(赛多利斯科学仪器有限公司),HYC-390医用冷藏箱(青岛海尔生物医疗股份有限公司),DHG9240A电热鼓风干燥箱(上海一恒科学仪器有限公司),UV-1780紫外可见分光光度计(岛津企业管理有限公司),TGL-16G高速台式离心机(上海安亭科学仪器厂),KQ5200超声波清洗器(昆山市超声仪器有限公司),ZF-7型暗箱式三用紫外分析(上海嘉鹏科技有限公司),Direct-Q5UV实验室超纯水器(广西南宁市博美生物科技有限公司)。
1.1.2 药品芦丁对照品(批号311F024,购于北京索莱宝科技有限公司,供含量测定用),硅胶板GF254(海洋牌,青岛海洋化工有限公司,批号20180308;银龙牌,烟台市化工研究所,批号20180118);水为纯水,亚硝酸钠、氢氧化钠、乙酸乙酯、甲酸、甲醇、乙醇等试剂均为分析纯。
10批木榄叶药材样品经广西中医药大学韦松基教授鉴定为木榄Bruguiera gymnorrhiza (Linn.) Savigny成熟叶。
1.2 方法 1.2.1 薄层色谱法鉴别木榄药材供试品溶液制备:将已晒干的木榄叶药材粉碎,过5号筛,分袋密封,保存至干燥器中,取木榄药材样品1 g,加75%甲醇溶液溶解,摇匀,称重后超声40 min,补足减失的质量,过滤至10 mL容量瓶中,定容即得。
对照品溶液制备:取芦丁标准品2 mg,加适量75%甲醇溶液,移至10 mL容量瓶中,定容即得。
定性鉴别:按照薄层色谱法[11]进行试验,吸取供试品溶液和对照药材溶液适量,点于同一薄层板,在乙酸乙酯:甲酸:水(7:1:1,V:V:V)中预饱和20 min后展开,取出,晾干,喷3%三氯化铝乙醇溶液,加热至斑点显色清晰,置紫外光灯(365 nm)下检视。
1.2.2 水分测定按照2015版《中国药典》四部通则0832第二法[12]进行木榄的水分测定。取供试品约2 g,平铺于干燥至恒重的扁形称量瓶中,厚度不超过5 mm,疏松供试品不超过10 mm,精密称定,打开瓶盖在105℃下干燥5 h后,把瓶盖盖好,转移到干燥器里面,放置冷却30 min,精密称定后,重新在105℃下干燥1 h后,放置在干燥器中冷却,进行称重,要求连续两次称重的质量差不超过5 mg即可。
1.2.3 总灰分测定按照2015版《中国药典》四部通则2302法[13]测定。测定用的供试品粉碎,过2号筛,混合均匀后,取供试品3 g,置炽灼至恒重的坩埚中,称定质量(准确至0.01 g),缓缓炽热,注意避免燃烧,至完全炭化时,逐渐升高温度至500~600℃,使完全灰化并至恒重,根据残渣质量,计算供试品中总灰分的含量(%)。
1.2.4 浸出物测定按照2015版《中国药典》四部通则2201法[14]测定。分别对木榄叶进行冷浸法、热浸法的考察。冷浸法:取样品约4 g,置250 mL锥形瓶中,精密加入水100 mL,塞紧冷浸,前6 h内时时振摇,再静置18 h,用干燥滤器迅速滤过,精密量取滤液20 mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105℃干燥3 h,移置干燥器中,冷却30 min, 迅速精密称定质量。热浸法:取供试品约2 g,置250 mL锥形瓶中,精密加入水50 mL,密塞,称定质量,静置1 h,连接回流冷凝管,加热至沸腾并保持微沸1 h。放冷后,取下锥形瓶,密塞,再称定质量,用水补足减失质量,摇匀,用干燥滤器滤过,精密量取滤液25 mL,置已干燥至恒重的蒸发皿中,水浴蒸干后,于105℃干燥3 h,置干燥器冷却30 min,迅速精密称定质量。醇溶物检查用50%的乙醇来代替水作为溶剂。
1.2.5 总黄酮含量测定 1.2.5.1 供试品溶液制备称定适量的木榄药材粉末,转移到50 mL离心管中,精密加入75%乙醇30 mL,使药材粉末得到充分浸泡,于室温下浸泡2 h,超声30 min后室温4 000 r/min离心20 min,分离上清液即得样品溶液。
1.2.5.2 对照品溶液制备精密称取芦丁标准品0.010 0 g,用75%乙醇溶解摇匀,定容至10 mL容量瓶中,再取1 mL此标准液于10 mL容量瓶,稀释并定容为0.1 mg/mL的芦丁标准品溶液,冷藏备用。
1.2.5.3 测定波长选择精密量取供试品溶液和0.1 mg/mL的芦丁标准品溶液各300 μL,分别置于10 mL容量瓶中,加入5% NaNO2溶液300 μL,摇匀,静置6 min后,加入10% Al(NO3)3溶液300 μL,摇匀,静置6 min后,加入4% NaOH溶液2 mL,用75%乙醇稀释至刻度,摇匀,转移至离心管中,室温下12 000 r/min离心3 min后,分离上清液,于350~700 nm下进行全波长扫描。取75%乙醇溶液作为空白对照,得到样品溶液和芦丁标准品溶液的全波长扫描图。
1.2.5.4 线性关系考察分别精密量取0.1 mg/mL的芦丁标准品溶液3 mL、4 mL、5 mL、6 mL、7 mL于10 mL容量瓶中,按照1.2.5.3节显色方法进行显色,用75%乙醇稀释至刻度,以75%乙醇作为空白对照,于508 nm下测定吸光度。以芦丁标准品溶液浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.5.5 精密度试验取同一份供试品溶液,按照1.2.5.3节显色方法进行显色,于508 nm下测定吸光度,连续6次,考察该方法的精密性。结果的RSD小于2.8%,表明该方法精密度良好。
1.2.5.6 重现性试验取6份相同批次的木榄药材,按照1.2.3.3节显色方法进行显色,于508 nm下分别测定吸光度,用以检测该方法的重现性。结果的RSD小于2.8%,时表明该方法重现性良好。
1.2.5.7 稳定性试验取同一份供试品溶液,按照1.2.5.3节显色方法进行显色,分别测定显色0 min、5 mim、10 min、20 min、40 min、60 min后于508 nm处的吸光度,考察该方法的稳定性。结果的RSD小于2.8%,表明该方法稳定性良好。
1.2.5.8 加样回收试验精密称取芦丁标准品0.085 3 g,用75%乙醇溶解摇匀,稀释并定容至10 mL容量瓶中,即得8.53 mg/mL的芦丁标准品溶液,冷藏备用。
精密称取6份相同批次的木榄药材粉末0.75 g,按照1.2.5.1节制备样品溶液。精密量取上述样品溶液各300 μL于10 mL容量瓶中,分别精密加入上述芦丁标准品溶液2 mL,按照1.2.5.3节显色方法进行显色,于508 nm下分别测定吸光度,计算加样回收率,用以检测该方法的准确度。结果的RSD小于5%,表明该方法准确度良好。
1.2.5.9 样品测定按1.2.5.3节方法,测定3批样品中总黄酮的含量。
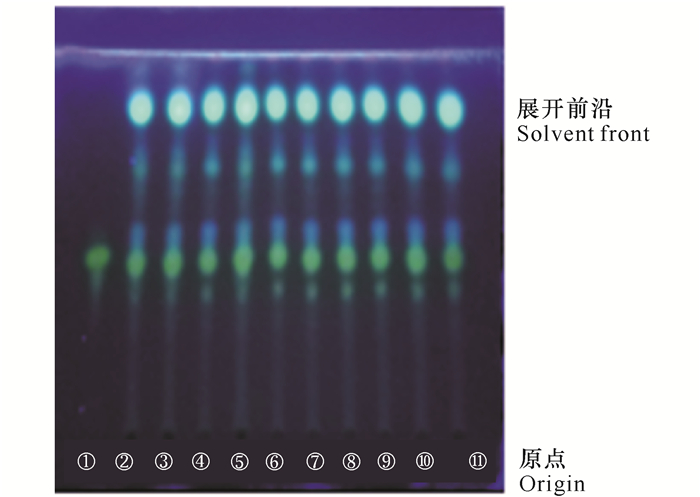
2 结果与分析 2.1 薄层色谱鉴别如图 1所示,在与对照品色谱相对应的位置上,10个批次木榄叶药材样品均有与芦丁相似的荧光斑点,但不同产地木榄药材的主荧光斑点大小稍有差别。
|
| ①芦丁对照品;②-⑪ 10批木榄药材 ① Rutin reference substance; ②-⑪ 10 batches of Bruguiera gymnorrhiza (Linn.) Savigny 图 1 薄层色谱图 Fig. 1 TLC Chromatograms |
2.2 水分、总灰分及浸出物测定结果 2.2.1 水分测定结果
结果如表 1所示,10批木榄药材的水分含量为7.95%~10.53%,水分含量上限为水分含量的最大值(10.53%)上浮10%,考虑到不同产地药材之间的差异,并且为了避免贮存过程中因水分含量过高而产生霉变,暂定木榄的水分含量不应超过12%。
| 药材编号 No. |
样品质量 Sample weight (g) |
烘干后质量 Weight after drying (g) |
水分含量 Moisture content (%) |
平均水分含量 Average content (%) |
| 1-1 | 2.003 4 | 1.805 7 | 9.87 | |
| 1-2 | 2.002 8 | 1.778 9 | 11.18 | 10.53 |
| 2-1 | 2.002 9 | 1.804 4 | 9.91 | |
| 2-2 | 2.003 1 | 1.841 2 | 8.08 | 9.00 |
| 3-1 | 2.000 6 | 1.843 6 | 7.85 | |
| 3-2 | 2.000 7 | 1.842 8 | 7.89 | 7.87 |
| 4-1 | 2.000 5 | 1.839 3 | 8.06 | |
| 4-2 | 2.000 5 | 1.839 9 | 8.03 | 8.04 |
| 5-1 | 2.000 0 | 1.834 8 | 8.26 | |
| 5-2 | 2.001 0 | 1.839 9 | 8.05 | 8.12 |
| 6-1 | 2.000 8 | 1.844 5 | 7.81 | |
| 6-2 | 2.000 8 | 1.839 8 | 8.09 | 7.95 |
| 7-1 | 2.000 7 | 1.813 6 | 9.35 | |
| 7-2 | 2.001 0 | 1.843 7 | 7.86 | 8.60 |
| 8-1 | 2.000 7 | 1.832 0 | 8.43 | |
| 8-2 | 2.000 7 | 1.840 0 | 8.03 | 8.23 |
| 9-1 | 2.000 9 | 1.840 4 | 8.02 | |
| 9-2 | 2.001 0 | 1.813 7 | 9.36 | 8.69 |
| 10-1 | 2.000 2 | 1.790 6 | 10.48 | |
| 10-2 | 2.000 8 | 1.833 3 | 8.37 | 9.42 |
2.2.2 总灰分测定结果
结果如表 2所示,10批木榄药材的总灰分含量为8.53%~9.52%,上限即总灰分含量的最大值(9.52%)上浮10%,为保证药品的纯度,结合实际情况暂定木榄的总灰分含量不得超过11%。
| 药材编号 No. |
样品质量 Sample weight (g) |
坩埚质量 Crucible weight (g) |
灰化后总质量 Total weight after ashing (g) |
总灰分 Total ash(%) |
灰分平均含量 Average content(%) |
| 1-1 | 3.003 2 | 41.337 8 | 41.608 6 | 9.02 | |
| 1-2 | 3.006 8 | 40.369 5 | 40.643 4 | 9.11 | 9.06 |
| 2-1 | 3.003 6 | 40.955 8 | 41.229 6 | 9.11 | |
| 2-2 | 3.004 7 | 40.872 4 | 41.126 5 | 8.46 | 8.79 |
| 3-1 | 3.000 3 | 35.031 6 | 35.312 5 | 9.36 | |
| 3-2 | 3.001 0 | 40.655 4 | 40.925 2 | 8.99 | 9.18 |
| 4-1 | 3.000 7 | 28.780 1 | 29.055 6 | 9.18 | |
| 4-2 | 3.000 2 | 33.422 3 | 33.712 4 | 9.67 | 9.43 |
| 5-1 | 3.000 6 | 34.482 5 | 34.703 3 | 7.36 | |
| 5-2 | 3.001 0 | 37.634 3 | 37.925 7 | 9.71 | 8.53 |
| 6-1 | 3.000 7 | 30.449 3 | 30.705 6 | 8.54 | |
| 6-2 | 3.000 4 | 31.033 9 | 31.319 9 | 9.53 | 9.04 |
| 7-1 | 3.000 6 | 35.188 0 | 35.462 5 | 9.15 | |
| 7-2 | 3.000 5 | 33.251 6 | 33.531 5 | 9.33 | 9.24 |
| 8-1 | 3.000 9 | 32.612 1 | 32.872 4 | 8.67 | |
| 8-2 | 3.000 9 | 31.580 2 | 31.848 9 | 8.95 | 8.81 |
| 9-1 | 3.000 4 | 31.632 9 | 31.914 0 | 9.37 | |
| 9-2 | 3.000 5 | 37.401 3 | 37.691 3 | 9.67 | 9.52 |
| 10-1 | 3.000 4 | 30.297 7 | 30.572 0 | 9.14 | |
| 10-2 | 3.000 6 | 40.085 0 | 40.363 4 | 9.28 | 9.21 |
2.2.3 醇溶性浸出物测定结果
结果见如表 3所示,10批木榄的热浸法醇溶性浸出物含量在13.05%~16.14%,将最低测定值下浮10%作为含量下限值,规定醇溶性浸出物不得少于12%。
| 药材编号 No. |
样品质量 Sample weight(g) |
浸出物质量 Weight of alcohol-soluble extract (g) |
浸出物含量 Content of alcohol-soluble extract (%) |
浸出物平均含量 Average content(%) |
| 1-1 | 2.001 3 | 0.264 8 | 13.23 | |
| 1-2 | 2.004 6 | 0.258 2 | 12.88 | 13.05 |
| 2-1 | 2.000 1 | 0.309 6 | 15.48 | |
| 2-2 | 2.000 4 | 0.253 3 | 12.66 | 14.07 |
| 3-1 | 2.000 3 | 0.316 7 | 15.83 | |
| 3-2 | 2.000 6 | 0.249 5 | 12.47 | 14.15 |
| 4-1 | 2.000 6 | 0.332 9 | 16.64 | |
| 4-2 | 2.000 5 | 0.312 9 | 15.64 | 16.14 |
| 5-1 | 2.000 3 | 0.310 7 | 15.53 | |
| 5-2 | 2.000 5 | 0.305 0 | 15.25 | 15.39 |
| 6-1 | 2.000 6 | 0.317 6 | 15.88 | |
| 6-2 | 2.000 3 | 0.319 0 | 15.95 | 15.91 |
| 7-1 | 2.000 6 | 0.309 7 | 15.48 | |
| 7-2 | 2.000 5 | 0.325 1 | 16.25 | 15.87 |
| 8-1 | 2.000 7 | 0.316 6 | 15.82 | |
| 8-2 | 2.000 6 | 0.319 6 | 15.98 | 15.90 |
| 9-1 | 2.000 1 | 0.326 4 | 16.32 | |
| 9-2 | 2.000 1 | 0.317 8 | 15.89 | 16.10 |
| 10-1 | 2.000 2 | 0.315 9 | 15.79 | |
| 10-2 | 2.000 4 | 0.308 9 | 15.44 | 15.62 |
2.2.4 总黄酮测定结果 2.2.4.1 测定波长的确定
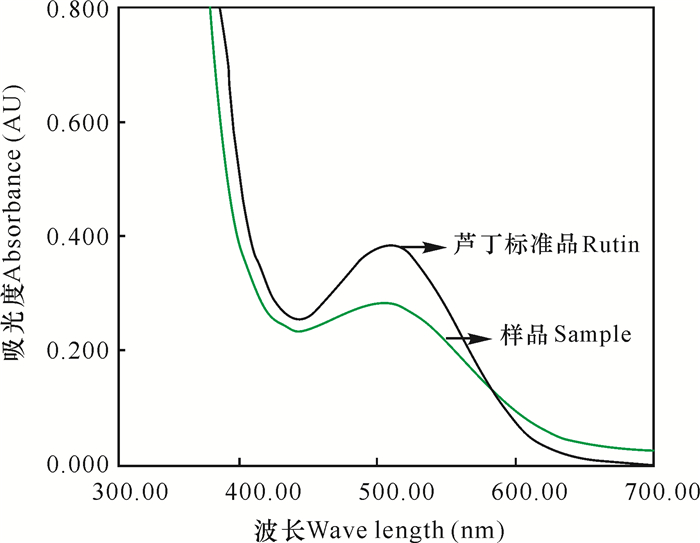
如图 2所示,样品溶液和芦丁标准品溶液的波峰均在505 nm附近,可选择作为测定波长。
|
| 图 2 吸收曲线图 Fig. 2 Absorption curve |
2.2.4.2 线性关系
以芦丁标准品溶液浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到线性方程为y=10.709x-0.0744,相关系数r=0.999 80,样品溶液浓度在0.03~0.07 mg/mL呈现良好的线性关系。
2.2.4.3 精密度试验6次测定总黄酮的吸光度,测定结果的RSD为0.09%(n=6),表明该方法精密度良好。
2.2.4.4 重现性试验测得6份供试品溶液的总黄酮平均含量为35.54 mg/g,测定结果的RSD为2.2%(n=6),说明该方法重现性好。
2.2.4.5 稳定性试验6个不同时间点测定的总黄酮的吸光度平均值为0.406,测定结果的RSD为1.9%(n=6),证明该方法比较稳定。
2.2.4.6 加样回收试验6份供试品的回收率在101.6%~104.4%,平均回收率约为103.2%,测定结果的RSD为1.1%,表明该方法准确度良好。
2.2.4.7 样品测定如表 5所示,样品中总黄酮含量在33.36~37.57 mg/g。
| 药材编号 No. |
样品质量 Sample weight (g) |
吸光度 Absorbance (AU) |
浓度 Concentration(mg/mL) |
含量 Content(mg/g) |
平均含量 Average content (%) |
RSD |
| 1-1 | 1.500 5 | 0.473 2 | 0.051 1 | 34.08 | ||
| 1-2 | 1.500 4 | 0.499 3 | 0.053 6 | 35.71 | ||
| 1-3 | 1.500 5 | 0.523 4 | 0.055 8 | 37.20 | 35.66 | 4.4% |
| 2-1 | 1.500 8 | 0.474 3 | 0.051 2 | 34.14 | ||
| 2-2 | 1.500 7 | 0.461 7 | 0.050 1 | 33.36 | ||
| 2-3 | 1.500 1 | 0.458 8 | 0.049 8 | 33.19 | 33.56 | 1.5% |
| 3-1 | 1.500 4 | 0.499 2 | 0.053 6 | 35.70 | ||
| 3-2 | 1.500 2 | 0.515 4 | 0.055 1 | 36.71 | ||
| 3-3 | 1.500 8 | 0.529 5 | 0.056 4 | 37.57 | 36.66 | 2.6% |
3 结论
本研究建立的木榄质量标准中的定性和定量方法,符合中药质量标准制订技术要求,操作简捷,可用于木榄药材质量评价和控制。
| [1] |
中国科学院《中国植物志》编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1983: 35-36.
|
| [2] |
庞冠兰.红树植物木榄胚轴降糖活性成分的筛选[D].南宁: 广西医科大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10602-1013246043.htm
|
| [3] |
刘英.红树植物木榄胚轴胰α-淀粉酶抑制剂活性成分的筛选[D].桂林: 广西师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10602-1015409022.htm
|
| [4] |
陈志勇, 曲彩红, 卢静, 等. 木榄胚轴中一个新生物碱及其抗乙肝病毒活性研究[J]. 广西植物, 2016, 36(2): 236-239. |
| [5] |
郑燕影, 张少华, 刘睿, 等. 影响木榄叶片总黄酮含量的主因素分析[J]. 中国天然药物, 2008, 6(5): 362-366. |
| [6] |
尚随胜.红树林植物木榄化学成分及生物活性研究[D].南宁: 广西医科大学, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y903313
|
| [7] |
李雅琦, 郭庆梅, 周凤琴. 木榄的性状鉴别及显微鉴别[J]. 华西药学杂志, 2018, 33(2): 210-213. |
| [8] |
黄丽, 谭芳林, 林捷, 等. 木榄幼苗对淹水-盐胁迫的生理响应[J]. 防护林科技, 2018(12): 1-4. |
| [9] |
高程海, 龙彬, 苏志维, 等. 红树木榄胚轴中芳香环类化学成分研究[J]. 广西科学院学报, 2015, 31(1): 28-31. DOI:10.3969/j.issn.1002-7378.2015.01.005 |
| [10] |
赵杨敏, 庞俊峰, 张占路, 等. 木榄ERF转录因子基因的克隆及功能分析初探[J]. 中国农业科技导报, 2012, 14(4): 66-72. DOI:10.3969/j.issn.1008-0864.2012.04.10 |
| [11] |
国家药典委员会.中华人民共和国药典: 四部通则0502[S].2015年版.北京: 中国医药科技出版社, 2015: 57-58.
|
| [12] |
国家药典委员会.中华人民共和国药典: 四部通则0832[S].2015年版.北京: 中国医药科技出版社, 2015: 65-67.
|
| [13] |
国家药典委员会.中华人民共和国药典: 四部通则2302[S].2015年版.北京: 中国医药科技出版社, 2015: 204.
|
| [14] |
国家药典委员会.中华人民共和国药典: 四部通则2201[S].2015年版.北京: 中国医药科技出版社, 2015: 202.
|



