2. 广西中药药效研究重点实验室, 广西南宁 530200;
3. 广西农作物废弃物功能成分研究协同创新中心, 广西南宁 530200
2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medicia, Nanning, Guangxi, 530200, China;
3. Guangxi Collaborative Innovation Center for Research on Functional Ingredients of Agricultural Residues, Nanning, Guangxi, 530200, China
厚藤(Ipomoea pes-caprae (Linn.) Sweet),又名二叶红薯、马鞍藤,为旋花科番薯属草本植物,是我国南方沿海的民间常用海洋中药,中医认为其味辛、苦,性微寒,归肺、肝、胃、大肠经,具祛风除湿、消痈散结、拔毒消肿的功效[1-2]。现代研究表明,其活性成分酚酸类、黄酮类具有抗胶原酶、抗氧化等显著药理活性,在食品添加剂及药品食品领域具有很大的开发前景[3-5]。鉴于厚藤化学成分复杂[6]、不同产地成分含量差异大,制订厚藤药材的质量标准以评判其优劣,具有重大意义。迄今为止,国内外文献聚焦于厚藤的化学成分、药理活性等领域的探索,未见其质量标准的相关报道。本研究通过对厚藤所含主要药效成分的定性定量分析,建立其质量标准。采用薄层色谱法对厚藤进行薄层鉴别;采用HPLC色谱法,通过波长切换方式完成绿原酸、咖啡酸、异槲皮苷、异绿原酸B、异绿原酸A、异绿原酸C等6个成分的含量测定。
1 材料与方法 1.1 仪器与试药Waters HPLC高效液相色谱仪,包括四元超高压溶剂系统、自动进样样本管理器、PDA检测器、Empower 2色谱工作站(Waters公司);十万分之一电子分析天平(赛多利斯科学仪器北京有限公司,型号:SQP);超声波清洗机(宁波新芝生物科技股份有限公司,型号:SB25-12D);电热恒温水浴锅(北京市永光明医疗仪器有限公司,型号:DZKW-D-6);双槽展开缸(型号:200 mm×100 mm);点样毛细管(泰州市兆华贸易有限公司,型号:0.3 mm×100 mm);硅胶G薄层板(青岛海洋化工集团)。
药品:绿原酸(批号:20170903)、咖啡酸(批号:20171224)、异槲皮苷(批号:20180105)、异绿原酸B(批号:20171029)、异绿原酸A(批号:20170913)、异绿原酸C(批号:20171106),含量≥98%,均购自于上海融禾医药科技发展有限公司;铁氰化钾(成都金山化学试剂有限公司,批号:20160110);六水三氯化铁(成都金山化学试剂有限公司,批号:20160316),香草醛(天津市大茂化学试剂厂,批号:20160711)。
试剂:甲醇、95%乙醇、无水乙醇、乙酸乙酯等(成都市科龙化工试剂厂,均为分析纯);石油醚(60~90℃,成都市科龙化工试剂厂),分析纯;乙腈、甲醇(色谱纯,美国飞世尔试剂公司);磷酸(分析纯,成都金山化学试剂有限公司);水为实验室自制超纯水。
药材:厚藤采集于广西及海南,总计10批(表 1),经广西中医药大学李永华教授鉴定为旋花科植物厚藤Ipomoea pes-caprae (Linn.) Sweet的干燥茎叶,新鲜药材置烘箱中55℃烘干,粉碎,药材粉末过55目筛备用。
| 编号 No. |
产地 Habitat |
采集时间 Collecting time |
| IP-1 | 广西防城港Fangchenggang, Guangxi | 2016-03-26 |
| IP-2 | 广西防城港Fangchenggang, Guangxi | 2016-06-24 |
| IP-3 | 广西防城港Fangchenggang, Guangxi | 2016-06-24 |
| IP-4 | 广西防城港Fangchenggang, Guangxi | 2016-06-24 |
| IP-5 | 广西防城港Fangchenggang, Guangxi | 2016-06-24 |
| IP-6 | 广西防城港Fangchenggang, Guangxi | 2016-07-10 |
| IP-7 | 广西北海Beihai, Guangxi | 2016-10-15 |
| IP-8 | 海南陵水Lingshui, Hainan | 2017-02-17 |
| IP-9 | 广西钦州Qinzhou, Guangxi | 2017-06-12 |
| IP-10 | 海南海口Haikou, Hainan | 2017-07-15 |
1.2 方法 1.2.1 薄层色谱鉴别 1.2.1.1 供试品溶液的制备
分别称取10个批次厚藤药材粉末各1 g,置具塞锥形瓶中,加入乙酸乙酯10 mL,超声30 min,过滤,将滤液转移至蒸发皿,经60℃水浴浓缩至干,加入1 mL乙酸乙酯溶解,作为供试品溶液。
1.2.1.2 对照品溶液的配制精密称取咖啡酸对照品2.211 0 mg,加入甲醇定容于5 mL容量瓶,配制成0.442 2 mg/mL的对照品溶液。
1.2.1.3 供试品溶液提取溶媒的优选照1.2.1.1节的制备方法,以50%乙酸乙酯、80%乙酸乙酯、乙酸乙酯、乙醇、甲醇为提取溶媒制备供试品溶液,点样于硅胶G薄层板上,在一定温湿度下,以一定比例展开剂预饱和30 min,展开,取出薄层板晾干,浸泡于1%铁氰化钾-2%三氯化铁显色剂中,取出,吹风机吹干,日光下检视。
1.2.1.4 厚藤药材鉴别方法的优化显色剂的优选:照1.2.1.1节的制备方法,以一定浓度溶媒制备供试品溶液,点样于硅胶G薄层板上,在一定温湿度下,以一定比例展开剂预饱和30 min,展开,取出薄层板晾干,喷显色剂,吹风机吹干,日光下检视。
展开剂的优选:照1.2.1.1节的制备方法,以一定浓度溶媒制备供试品溶液,点样于硅胶G薄层板上,在一定温湿度下,以石油醚:乙酸乙酯:氯仿:甲醇(4:1:1:0.3, V:V:V:V)、正己烷:氯仿:正丁醇(4:1:1, V:V:V)、环己烷:丙酮:乙酸乙酯:甲酸(6:2:1:0.15, V:V:V:V) 3种展开系统,预饱和30 min,展开,取出薄层板晾干,喷显色剂,吹风机吹干,日光下检视。
不同湿度的优选:照1.2.1.1节的制备方法,以一定浓度溶媒制备供试品溶液,点样于硅胶G薄层板上,在一定温度下,分别在50%、70%的湿度下,以一定比例展开剂预饱和30 min,展开,取出薄层板晾干,喷显色剂,吹风机吹干,日光下检视。
不同温度的优选:照1.2.1.1节的制备方法,以一定浓度溶媒制备供试品溶液,点样于硅胶G薄层板上,在一定湿度下,在10℃、25℃、30℃温度下,以一定比例展开剂预饱和30 min,展开,取出薄层板晾干,喷显色剂,吹风机吹干,日光下检视。
1.2.1.5 厚藤药材的薄层色谱鉴别照《中国药典》2015年版第四部薄层色谱法(通则0502),在温度25℃,湿度50%条件下,分别吸取10批厚藤的供试品溶液、对照品咖啡酸溶液各5 μL,依次点于同一硅胶G薄层板上,以环己烷:丙酮:乙酸乙酯:甲酸(6:2:1:0.15, V:V:V:V)为展开系统,预饱和30 min,展开,取出晾干后,喷显色剂1%铁氰化钾-2%三氯化铁,快速吹干后,在日光下检视。
1.2.2 厚藤中6个成分的含量测定 1.2.2.1 成分提取本实验参照笔者的Box-behnken响应面法优化厚藤中6个成分的提取工艺[7],采用最佳工艺即乙醇浓度69%,液料比为63 mL/g,提取时间1.5 h,提取厚藤中6个成分,对10批厚藤进行测定。
1.2.2.2 色谱条件色谱柱:Anglient HC-C18(2)色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%磷酸水溶液(B);流速:1.0 mL/min;柱温:(30±5)℃;进样量:5 μL;洗脱梯度:0~10 min,7%~8%A;10~30 min,8%~16%A;30~40 min,16%~17%A;40~50 min,17%~19%A;50~65 min,19%~24%A;65~67 min,24%~95%A;67~70 min,95%~95%A。检测波长:0~30 min,λ=325 nm;30~50 min,λ=353 nm;50~70 min,λ=325 nm。
1.2.2.3 溶液的制备对照品溶液的配制:精密称定适量绿原酸、咖啡酸、异槲皮苷、异绿原酸B、异绿原酸A、异绿原酸C等对照品,分别加入甲醇定容于5 mL容量瓶,配制成一定浓度的混合对照品溶液。
供试品溶液的制备:精密称定10个批次厚藤药材粉末各1 g,置于具塞锥形瓶中,加入69%乙醇63 mL,85℃水浴回流提取3次,每次1.5 h,抽滤,合并滤液,将滤液转移至250 mL旋蒸瓶,旋干,吸取少许提乙醇洗出,转移并定容于25 mL容量瓶,超声30 min,摇匀,吸取2 mL过0.22 μm微孔滤膜,转移至进样瓶备用。
1.2.2.4 线性关系试验精密移取上述混合对照品溶液,依次稀释一定倍数,配制成一系列不同浓度的混合标准品溶液,注入色谱仪,以6个成分的峰面积为纵坐标(Y),质量浓度为横坐标(X),绘制标准曲线。
1.2.2.5 精密度试验精密吸取上述混合对照品溶液,连续进样6次,计算6个成分峰面积的RSD值,考察仪器的精密度。
1.2.2.6 重复性试验称取同一批厚藤药材粉末6份,按照1.2.2.3节方法制备供试品溶液,按相应色谱条件进行分析测定,计算6个成分质量浓度的RSD值,考察该方法的重复性。
1.2.2.7 稳定性试验取同一厚藤样品溶液,按相应色谱条件,分别在0 h、2 h、4 h、8 h、12 h和24 h进样,计算6个成分在不同时间点峰面积的RSD值,考察样品的稳定性。
1.2.2.8 加样回收率试验精密称取已知含量的厚藤药材粉末0.5 ɡ,共计6份,分别加入本品中6个成分质量1倍量的对照品,按照1.2.2.3节制备供试品溶液,按相应色谱条件进行分析测定,计算6个成分的加样回收率。
1.2.2.9 含量测定照1.2.2.3节供试品制备方法制备供试品溶液,照1.2.2.2节色谱条件进样,分别对10个批次厚藤进行测定,按外标一点法计算绿原酸、咖啡酸、异槲皮苷、异绿原酸B、异绿原酸A、异绿原酸C的含量。
2 结果与分析 2.1 薄层鉴别 2.1.1 供试品溶液提取溶媒的优选80%乙酸乙酯提取物的TLC色谱图斑点数量多,且与咖啡酸对照品色谱图相同位置呈现蓝色斑点,斑点颜色深且不拖尾(图 1),所以,选择80%乙酸乙酯作为提取溶媒。
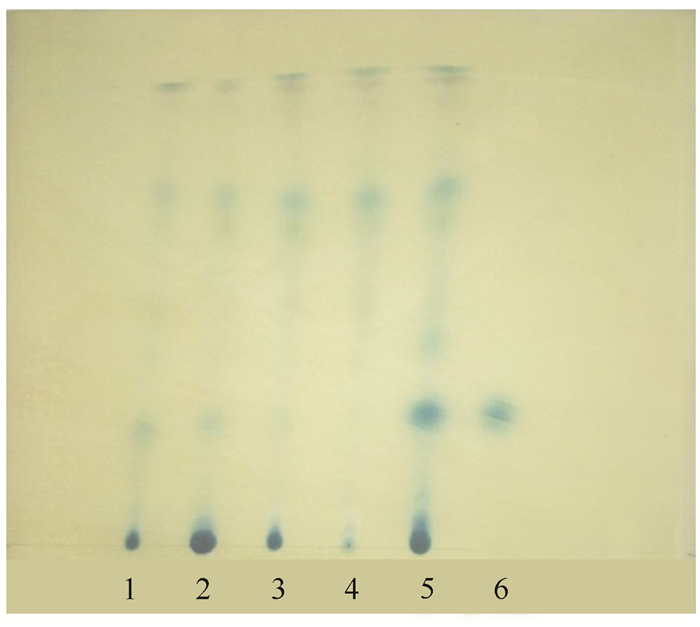
|
| 1~5依次为50%乙酸乙酯提取物、甲醇提取物、无水乙醇提取物、100%乙酸乙酯提取物、80%乙酸乙酯提取物;6:咖啡酸对照品 1-5:50% ethyl acetate extract, methanol extract, ethanol extract, 100% ethyl acetate extract, 80% ethyl acetate extract of Ipomoea pes-caprae; 6:Caffeic acid reference solution 图 1 不同溶媒厚藤提取物的薄层色谱 Fig. 1 TLC chromatogram of Ipomoea pes-caprae extract from different solvent |
2.1.2 显色剂的优选
咖啡酸在1%铁氰化钾-2%三氯化铁作用下显色灵敏,且厚藤药材TLC色谱图斑点较多(图 2)。所以,选用1%铁氰化钾-2%三氯化铁作为显色剂。
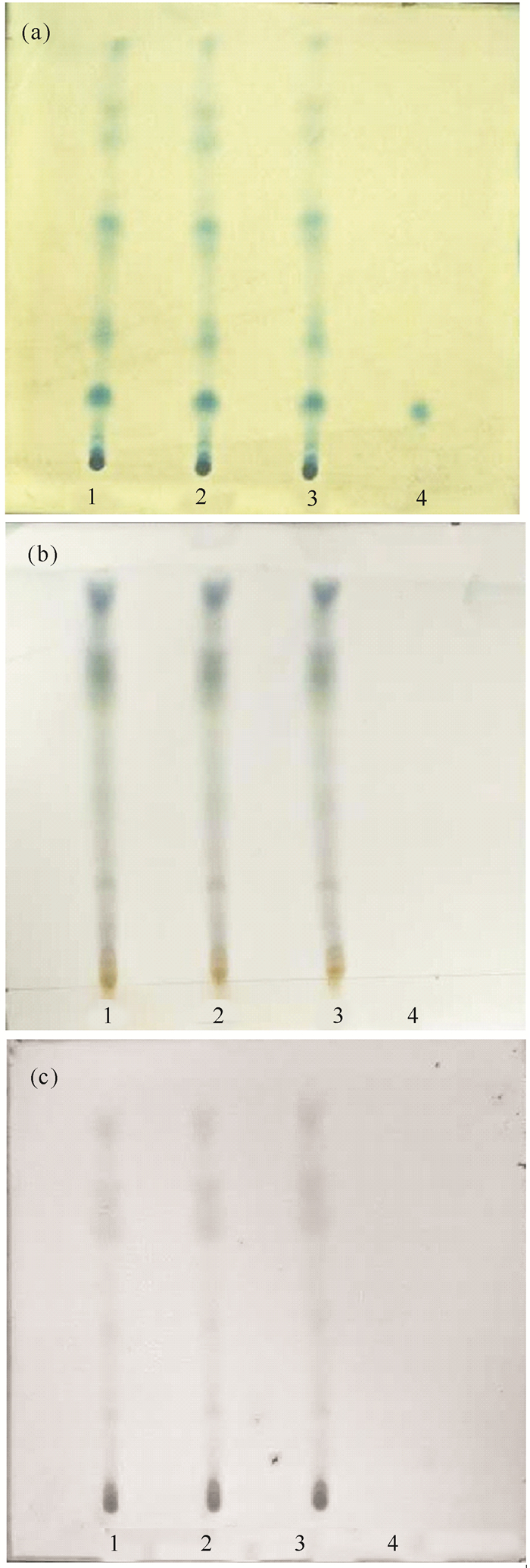
|
| 1~3:80%乙酸乙酯提取物;4:咖啡酸对照品溶液;(a)1%铁氰化钾-2%三氯化铁;(b)1%香草醛溶液;(c)10%硫酸乙醇溶液 1-3:80% ethyl acetate extract of Ipomoea pes-caprae; 4:Caffeic acid reference solution; (a)1% potassium ferricyanide-2% ferric chloride; (b)1% vanillin solution; (c)10% alcoholic solution of sulfuric acid 图 2 不同显色剂的薄层色谱 Fig. 2 TLC chromatogram of Ipomoea pes-caprae coulor by different chromogenic reagent |
2.1.3 展开剂的选择
由图 3a~c可知,图 3c斑点数量多且清晰,故选用环己烷:丙酮:乙酸乙酯:甲酸(6:2:1:0.15, V:V:V:V)作为展开剂。

|
| 1~3:80%乙酸乙酯提取物;4:咖啡酸对照品溶液;(a)石油醚:乙酸乙酯:氯仿:甲醇(4:1:1:0.3, V:V:V:V)展开剂;(b)正己烷:氯仿:正丁醇(4:1:1, V:V:V)展开剂;(c)环己烷:丙酮:乙酸乙酯:甲酸(6:2:1:0.15, V:V:V:V)展开剂 1-3:80% ethyl acetate extract of Ipomoea pes-caprae; 4:Caffeic acid; (a) petroleum ether:ethyl acetate:chloroform:methanol (4:1:1:0.3, V:V:V:V)developer; (b) n-hexane:chloroform:butanol (4:1:1, V:V:V)developer; (c) cyclohexane:acetone:ethyl acetate:formic acid (6:2:1:0.15, V:V:V:V) developer 图 3 不同展开剂的薄层色谱 Fig. 3 TLC chromatogram of Ipomoea pes-caprae expanded by different developer |
2.1.4 不同湿度的考察
当温度25℃时,50%湿度比70%湿度条件下显色的斑点多且清晰(图 4)。所以选择湿度为50%作为本实验的最佳湿度。
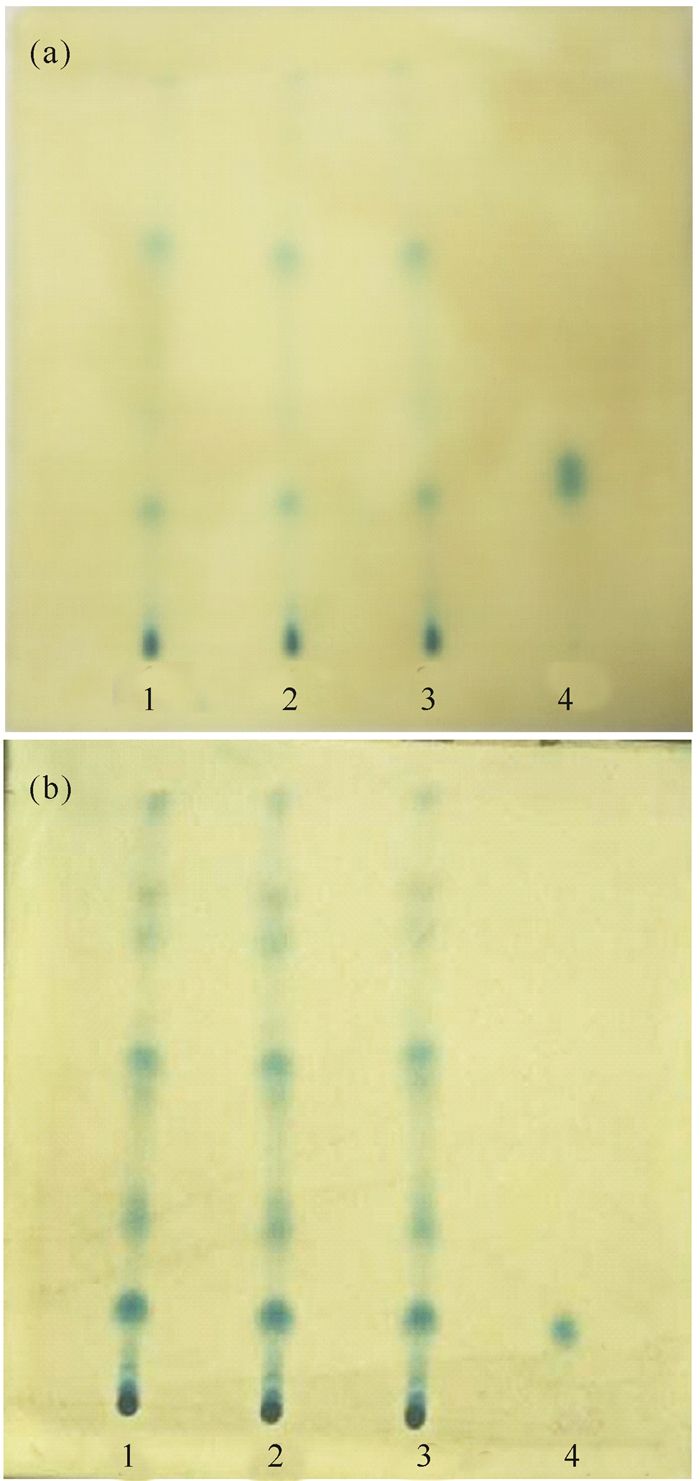
|
| 1~3:80%乙酸乙酯提取物;4:咖啡酸对照品溶液; (a)温度25℃,湿度70%;(b)温度25℃,湿度50% 1-3:80% ethyl acetate extract of Ipomoea pes-caprae; 4:Caffeic acid reference solution; (a) temperature 25℃ and humidity 70%;(b) temperature 25℃ and humidity 50% 图 4 不同湿度的薄层色谱 Fig. 4 TLC chromatogram of Ipomoea pes-caprae expanded at different humidity |
2.1.5 不同温度的考察
由图 5可知,图 5b的TLC色谱图的样品斑点最多,即在相同的点样量条件及相同的展开条件下,温度越低,厚藤的薄层色谱图分离度越好,所以,25℃是最佳环境温度。
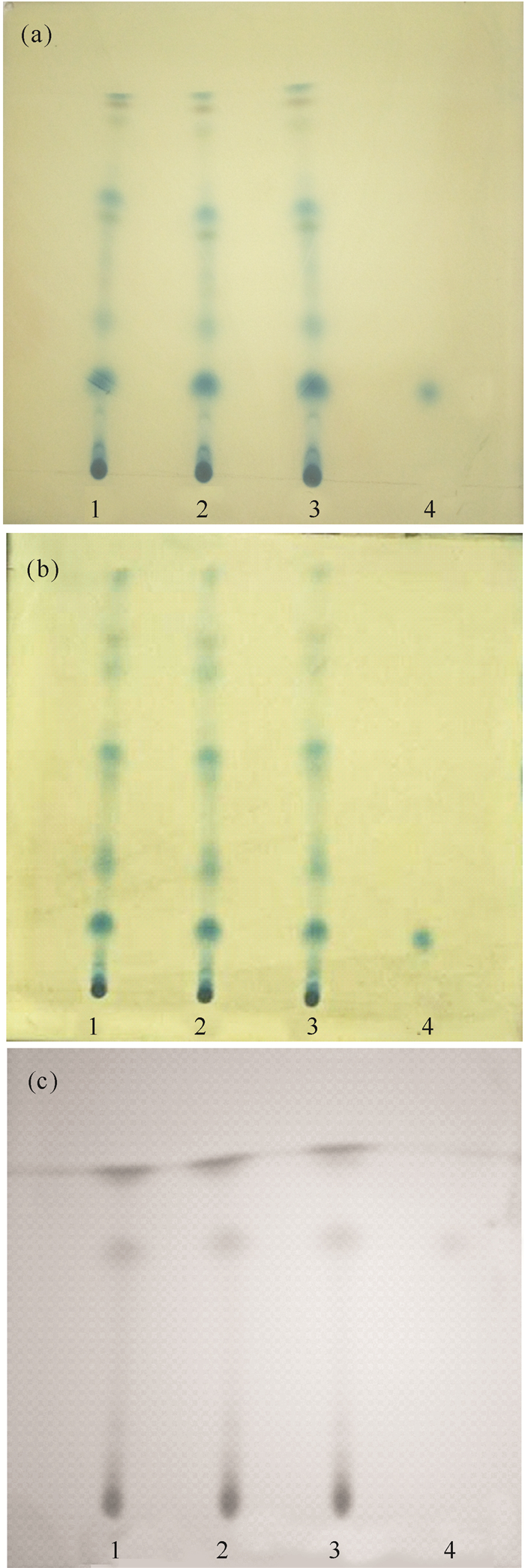
|
| 1~3:80%乙酸乙酯提取物;4:咖啡酸对照品溶液; (a)温度10℃,湿度50%;(b)温度25℃,湿度50%;(c)温度30℃, 湿度50% 1-3:80% ethyl acetate extract of Ipomoea pes-caprae; 4:Caffeic acid reference solution; (a) temperature 10℃, humidity 50%;(b)temperature 25℃, humidity 50%;(c)temperature 30℃, humidity 50% 图 5 不同温度的薄层色谱 Fig. 5 TLC chromatogram of Ipomoea pes-caprae expanded at different temprature |
2.1.6 厚藤的薄层色谱鉴别
在对照品咖啡酸溶液色谱图相应的水平位置上,10批厚藤供试品溶液均显相同颜色斑点(图 6),该薄层色谱鉴别法具有较好的适用性,可适用于厚藤药材的鉴别。
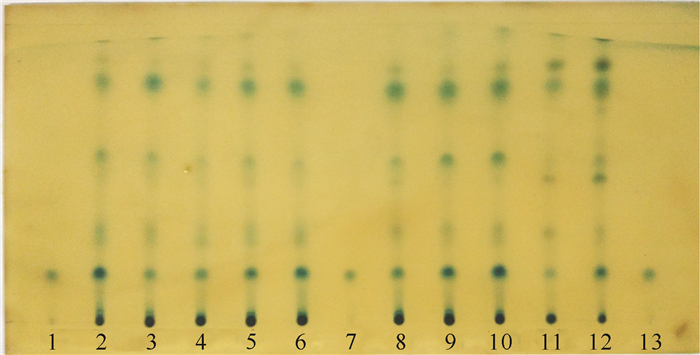
|
| 1, 7, 13:咖啡酸对照品;2~6,8~12:厚藤样品(1~10) 1, 7, 13:caffeic acid reference solution; 2-6, 8-12:samples of Ipomoea pes-caprae (batch number 1-10) 图 6 10批厚藤的薄层色谱 Fig. 6 TLC of 10 samples of Ipomoea pes-caprae |
2.2 厚藤中6个成分的含量测定 2.2.1 专属性考察
供试品色谱图中绿原酸、咖啡酸、异槲皮苷、异绿原酸B、异绿原酸A、异绿原酸C等色谱峰与对照品溶液色谱峰的保留时间一致,且与相邻色谱峰的分离度均大于1.5(图 7)。该方法的专属性较好。
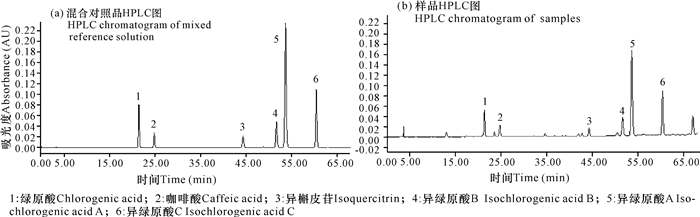
|
| 图 7 专属性考察结果 Fig. 7 Result of specific investigation experiment |
2.2.2 线性关系试验
照1.2.2.2节色谱条件,将一系列浓度的混合对照品分别进样,r在0.999 4~0.999 6,回归方程与浓度面积曲线的拟合度较高(表 2)。绿原酸、咖啡酸、异槲皮苷、异绿原酸B、异绿原酸A、异绿原酸C的浓度与峰面积呈现较好的线性关系。
| 成分 Components |
回归方程 Linear equation |
回归系数r Regression coefficient r |
线性范围 Linear range (μg) |
| 绿原酸 Chlorogenic acid |
Y=16184X+97543 | 0.999 4 | 6.000~599.800 |
| 咖啡酸 Caffeic acid |
Y=26971X+10287 | 0.999 5 | 0.500 0~50.300 0 |
| 异槲皮苷 Isoquercitrin |
Y=11692X+6231.4 | 0.999 6 | 0.700 0~69.830 0 |
| 异绿原酸 B Isochlorogenic acid B |
Y=18665X+67084 | 0.999 5 | 4.000~400.100 |
| 异绿原酸 A Isochlorogenic acid A |
Y=18747X+135001 | 0.999 5 | 8.000~800.100 |
| 异绿原酸 C Isochlorogenic acid C |
Y=17651X+97774 | 0.999 5 | 6.000~600.500 |
2.2.3 精密度试验
测定连续进样6次色图谱的峰面积,6个成分色谱峰峰面积的RSD值均小于1%,表明仪器的精密度较好。
2.2.4 重复性试验测定同一批次6个样品依次进样的色谱图,6个成分质量浓度的RSD值均小于3%,表明该方法的重复性较好。
2.2.5 稳定性试验测定厚藤在0 h、2 h、4 h、8 h、12 h和24 h不同时间点色谱图,6个成分在不同时间点峰面积的RSD值均小于1.5%,表明供试品溶液在24 h内稳定性较好。
2.2.6 加样回收率试验6个成分的加样回收率在95%~105%内,表明该方法的回收率符合要求。
2.2.7 含量测定按照上述色谱条件,检测得到10个批次厚藤含量,广西区及海南等地的10批厚藤的质量极不均衡。以活性成分总含量为指标,第2,8,9批的质量较好,第1,5批质量较差(表 3)。
| 编号 No. |
绿原酸 Chlorogenic acid (mg/g) |
咖啡酸 Caffeic acid (mg/g) |
异槲皮苷 Isoquercitrin (mg/g) |
异绿原酸 B Isochlorogenic acid B (mg/g) |
异绿原酸 A Isochlorogenic acid A (mg/g) |
异绿原酸 C Isochlorogenic acid C (mg/g) |
总含量 Content (mg/g) |
| IP-1 | 1.035 5 | 0.369 1 | 0.695 5 | 0.921 3 | 4.633 2 | 2.006 2 | 9.660 8 |
| IP-2 | 5.113 7 | 0.395 3 | 1.278 5 | 6.183 9 | 8.196 3 | 8.132 0 | 29.299 6 |
| IP-3 | 1.967 2 | 0.349 6 | 0.913 6 | 1.406 3 | 5.045 0 | 2.816 0 | 12.497 7 |
| IP-4 | 1.543 9 | 0.422 2 | 0.786 7 | 3.308 2 | 6.620 7 | 3.906 5 | 16.588 2 |
| IP-5 | 0.760 4 | 0.681 4 | 0.477 8 | 1.576 0 | 2.697 4 | 1.922 5 | 8.115 5 |
| IP-6 | 1.247 4 | 0.491 2 | 1.078 9 | 2.023 8 | 6.370 7 | 3.120 4 | 14.332 4 |
| IP-7 | 2.482 5 | 0.452 7 | 0.3731 | 2.018 2 | 5.741 7 | 3.264 8 | 14.333 1 |
| IP-8 | 5.864 6 | 0.372 6 | 0.363 7 | 3.614 7 | 9.209 0 | 4.887 9 | 19.059 9 |
| IP-9 | 4.352 4 | 0.500 5 | 0.549 4 | 2.721 7 | 6.381 5 | 4.554 5 | 24.312 4 |
| IP-10 | 1.895 8 | 0.736 7 | 0.445 1 | 2.111 3 | 5.202 1 | 3.511 6 | 13.902 7 |
3 结论
本研究建立了海洋中药质量标准中的定性鉴别方法,具有较好的适用性。检测得到厚藤中6个活性成分的含量范围,为厚藤在食药应用方面的质量评价和控制提供科学依据。
| [1] |
管华诗, 王曙光. 中华海洋本草[M]. 上海: 上海科技出版社, 2009: 421-423.
|
| [2] |
中国科学院中国植物志编辑委员会. 中国植物志:第64卷[M]. 北京: 科学出版社, 1979: 96.
|
| [3] |
TERAMACHI F, KOYANO T, KOWITHAYAKORN T, et al. Collagenase inhibitory quinic acid esters from Ipomoea pes-caprae[J]. Journal of Natural Products, 2005, 68(5): 794-796. DOI:10.1021/np0500631 |
| [4] |
QASIM M, ABIDEEN Z, ADNAN M Y, et al. Antioxidant properties, phenolic composition, bioactive compounds and nutritive value of medicinal halophytes commonly used as herbal teas[J]. South African Journal of Botany, 2017, 110: 240-250. DOI:10.1016/j.sajb.2016.10.005 |
| [5] |
刘平怀, 陈德力, 汪春牛, 等. 海滩植物厚藤(Ipomoea pes-caprae)抗氧化活性研究[J]. 精细化工, 2010, 27(9): 866-869. |
| [6] |
冯小慧, 邓家刚, 秦健峰, 等. 海洋中药厚藤的化学成分及药理活性研究进展[J]. 中草药, 2018, 49(4): 955-964. |
| [7] |
冯小慧, 秦健峰, 邓家刚, 等. Box-Behnken响应面法优化厚藤中6个成分的提取工艺[J]. 中药材, 2019, 42(5): 1118-1121. |



