2. 广西民族医药研究院, 广西南宁 530001
2. Guangxi Academy of Minority Nationality Medicine and Pharmacology, Nanning, Guangxi, 530001, China
十味参归灌肠液是在南宁市妇幼保健院临床十多年中药经验方的基础上,采用现代制剂技术研制而成的中成药制剂。处方由丹参、延胡索、桃仁、赤芍等十味中药组成,具清热解毒、活血祛瘀、行气止痛、软坚散结等功效,主要用于瘀毒内结型、湿热蕴结型、湿热瘀结型、气滞血瘀型急慢性盆腔炎。丹参作为君药,具有活血祛瘀,凉血消肿的功效[1],对淤血所致的各种病症包括盆腔炎具有显著的疗效[2]。丹参主要含脂溶性的多种菲醌衍生物成分和水溶性的丹酚类成分[3],其中丹酚酸B是水溶性成分中含量及活性最高的主要有效成分,具有保护内皮细胞、改善微循环、促进组织的修复与再生作用。此外还有抗纤维化、抗癌等作用[4]。延胡索主要含延胡索甲素、延胡索乙素等成分[4-5],可活血行气止痛,用于闭经、症瘕、产后瘀阻[6]。桃仁主含苦杏仁苷[7]。桃仁对炎症初期有抗渗出及扩张血管、增加血流作用,可用于妇人诸症,包括急性盆腔炎,产后感染[4]。赤芍含芍药苷等多种成分[8],可清热凉血、祛瘀止痛,对多种病原微生物均有抑制作用[4]。
由于该药剂为南宁市妇幼保健院近年来研究的医院制剂,迄今为止尚未发现有关该制剂的定性定量质量控制方法的报道。因此,本研究以处方中的君药或臣药所含成分或主要成分如丹酚酸B、延胡索乙素、苦杏仁苷、芍药苷等作为定性或定量指标,采用薄层鉴别方法解决十味参归灌肠液处方中延胡索、丹参、桃仁、赤芍等药材的鉴别问题;采用高效液相色谱法方法测定丹酚酸B,解决十味参归灌肠液处方中丹参的含量测定问题。本研究在于建立十味参归灌肠液的质量控制标准,以确保制剂质量可控、临床用药安全有效。
1 材料与方法 1.1 材料LC-20A高效液相色谱仪(岛津公司),YOKO-ZS紫外分析摄影仪(武汉药新技术开发有限公司),XS205DuaLRange型电子分析天平(瑞士特勒公司),SB3200DTS双频超声波清洗机(宁波新芝生物科技股份有限公司),EASYPURE Ⅱ超纯水器(美国热电公司),HP250HS型恒温恒湿箱(武汉瑞华仪器设备有限责任公司)。
延胡索乙素对照品(批号:110726-201112)、胡索对照药材(批号:120928-201007)、苦杏仁苷对照品(批号:110820-201004)、芍药苷对照品(批号:110736-201136), 上述对照品均由中国食品药品检定研究院提供;丹酚酸B对照品(批号:ES-AS-0260)由上海亿欣生物科技有限公司提供。十味参归灌肠液制剂共9批,批号为130702,130704,130708,131104,131106,131111,140401,140403,140405,由南宁市妇幼保健院委托广西中医药大学附属瑞康医院制剂中心制备; 阴性对照样品由南宁市妇幼保健院制备。硅胶F254薄层板、硅胶G、硅胶H由青岛海洋化工分厂提供;硅胶G加0.1%氢氧化钠和硅胶G加0.1%羧甲基纤维素钠的薄层板为自制板,使用青岛海洋化工有限公司的薄层层析硅胶制备。HPLC测定用甲醇、乙腈均为色谱纯,其余试剂均为分析纯,水为超纯水。
1.2 方法 1.2.1 延胡索的薄层色谱(TCL)鉴别(1) 供试品溶液的制备
取样品溶液30 mL,加浓氨试液调至碱性(pH值为9.6~9.8),加乙醚振摇提取3次,每次20 mL,合并乙醚液,蒸干,残渣以甲醇1 mL溶解,即得。
(2) 对照药材溶液的制备
取延胡索对照药材1 g,加甲醇50 mL,超声处理30 min,滤液蒸干,残渣以水10 mL溶解,加浓氨试液调至碱性,用乙醚振摇提取3次,每次10 mL,合并乙醚液,蒸干,残渣以甲醇1 mL溶解,即得。
(3) 对照品溶液的制备
取延胡索乙素对照品适量,加甲醇制成浓度为0.5 mg/mL的溶液,即得。
(4) 延胡索阴性供试品溶液的制备。
取缺延胡索的阴性制剂(处方去除延胡索,其余各味按一日处方量投料,按处方制法共制成100 mL)20 mL,参照供试品溶液的制备方法制得相应缺延胡索的阴性供试品溶液。
(5) 薄层色谱鉴别方法
吸取供试品溶液和阴性供试品溶液各3~6 μL,对照药材溶液和对照品溶液各2~3 μL,分别点于由1%氢氧化钠溶液制备的硅胶G薄层板上,以甲苯-丙酮(V:V=9:2)为展开剂,展开,取出并置碘缸中约3 min后取出,挥尽板上吸附的碘,置紫外光灯(365 nm)下检视。
1.2.2 丹参的薄层色谱(TCL)鉴别(1) 供试品溶液的制备。
取样品溶液10 mL,加乙醚10 mL振摇提取2次,弃去乙醚液,下层水液加乙酸乙酯振摇提取2次,每次10 mL。合并乙酸乙酯层,蒸干,残渣以无水乙醇1 mL溶解,即得。
(2) 对照品溶液的制备。
取丹酚酸B对照品,加无水乙醇制成浓度为2 mg/mL的溶液,即得。
(3) 丹参阴性供试品溶液的制备
取缺丹参的阴性制剂(处方除去丹参,其余各味按一日处方量投料,按处方制法共制成100 mL)10 mL,按照供试品溶液的制备方法制成缺丹参的阴性供试品溶液。
(4) 薄层色谱鉴别方法
取供试品溶液、对照品溶液、阴性供试品溶液各5~6 μL,分别点于硅胶F254薄层板上,以甲苯-三氯甲烷-乙酸乙酯-甲醇-甲酸(体积比为2:3:4:0.5:2)为展开剂,展开,取出,置紫外光灯(254 nm)下检视。
1.2.3 桃仁的薄层(TCL)鉴别(1) 供试品溶液的制备
取样品溶液10 mL,加石油醚(60~90℃)振摇提取2次,每次10 mL,弃去石油醚液,下层水液通过D101型大孔吸附树脂柱(内径1.5 cm,长8 cm,加水20 mL预洗一次),弃去水液,用氨试液(4 mL→10 mL) 30 mL洗脱,弃去氨液,再用水10 mL洗脱,弃去水液,继用20%乙醇30 mL洗脱,收集洗脱液,蒸干,残渣以甲醇1 mL溶解,即得。
(2) 对照品溶液的制备
取苦杏仁苷对照品适量,加甲醇制成浓度为2 mg/mL的溶液,即得。
(3) 桃仁阴性供试品溶液的制备
取缺桃仁的阴性制剂(处方除去桃仁,其余各味按一日处方量投料,按处方制法共制成100 mL)10 mL,同法制备阴性供试品溶液。
(4) 薄层色谱鉴别方法
取供试品溶液、对照品溶液和阴性供试品溶液各2 μL,分别点于硅胶G-CMCNa薄层板上,以氯仿-乙酸乙酯-甲醇-水(体积比为15:40:22:10)为展开剂,展开,取出后喷以磷钼酸硫酸溶液显色,置在日光下检视。
1.2.4 赤芍的薄层(TCL)鉴别(1) 供试品溶液的制备
与1.2.3节供试品溶液的制备方法相同。
(2) 对照品溶液的制备
取芍药苷对照品,加乙醇制成浓度为1 mg/mL的溶液,即得。
(3) 赤芍阴性供试品溶液的制备
取缺赤芍的阴性制剂(处方除去赤芍,其余各味按一日处方量投料,按处方制法共制成100 mL)10 mL,同供试品溶液制备法制备阴性供试品溶液。
(4) 薄层色谱鉴别方法
参照1.2.3节方法。
1.2.5 丹酚酸B的含量测定(1) 专属性及系统适应性试验
色谱柱为岛津Inertsil ODS-SP C18(4.6 mm×250 mm,5 μm),流动相为甲醇-乙腈-甲酸-水混合液(体积比为27:8:2:63),流速为1.0 mL/min,检测波长286 nm,柱温为室温,进样量为供试品溶液和对照品溶液各10 μL。
(2) 供试品溶液的制备
精密吸取样品溶液2 mL置于5 mL量瓶中,加甲醇至刻度,摇匀,即得。
(3) 对照品溶液的制备
取丹酚酸B (C36H30O16)对照品适量,精密称定,加75%甲醇制成浓度约为0.2 mg/mL的丹酚酸B溶液,即得。
(4) 缺丹参的阴性制剂供试品溶液的制备
精密吸取缺丹参的阴性制剂2 mL,参照上述供试品溶液的制备方法制备。
(5) 高效液相色谱法
分别取丹酚酸B对照品溶液、供试品溶液和缺丹参的阴性制剂供试品溶液各10 μL,注入高效液相色谱仪,测定。
(6) 线性关系考察
精密称取丹酚酸B对照品10.91 mg置10 mL量瓶中,加75%甲醇至刻度,摇匀,备用。分别吸取上述对照品溶液0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL置5 mL量瓶中,分别加入75%甲醇稀释至刻度,摇匀,作为不同浓度的对照品溶液。精密吸取上述对照品溶液各10 μL进样,分别测定丹酚酸B峰面积,以对照品的进样量(μg)为横坐标,峰面积值为纵坐标,绘制标准曲线。
(7) 精密度试验
取同一份供试品溶液(批号131111),连续测定6次。
(8) 稳定性试验
取同一供试品溶液(批号131111), 分别在0 h、2 h、4 h、6 h、8 h、12 h、24 h进样测定。
(9) 重复性试验
取同一样品(批号131111),分别平行制备6份供试品溶液,并测定各自丹酚酸B含量。
(10) 回收率试验
丹酚酸B对照品溶液的制备:取丹酚酸B对照品适量,加甲醇制成浓度为0.118 9 mg/mL的对照品溶液。
精密吸取样品(批号131111)1 mL共6份,分别置5 mL量瓶中,分别加入上述丹酚酸B对照品溶液至刻度,摇匀,各精密吸取10 μL进样测定,计算加样回收率。
(11) 耐用性试验
不同色谱柱的试验:分别采用规格相同(4.6 mm×250 mm、5 μm)的菲罗门Gemini C18柱和岛津Inertsil ODS-SP C18柱,测定同一供试品溶液(批号131111)中的丹酚酸B含量。
不同色谱仪的试验:分别采用岛津LC-20AT和Agilent 1200两台不同品牌的色谱仪,测定同一供试品溶液(批号140401)中丹酚酸B的含量。
1.2.6 样品测定及含量限度的确定取十味参归灌肠液样品6批,按上述色谱条件测定,计算样品中丹酚酸B的含量。
2 结果与分析 2.1 延胡索的薄层鉴别6批样品供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,均可检出相同颜色(黄绿色或绿色)的荧光斑点;阴性供试品溶液色谱则未检出这些斑点。另外,层析斑点分离较好,Rf值适中,说明本法层析效果较好,重现性好,专属性强,无阴性干扰(图 1)。
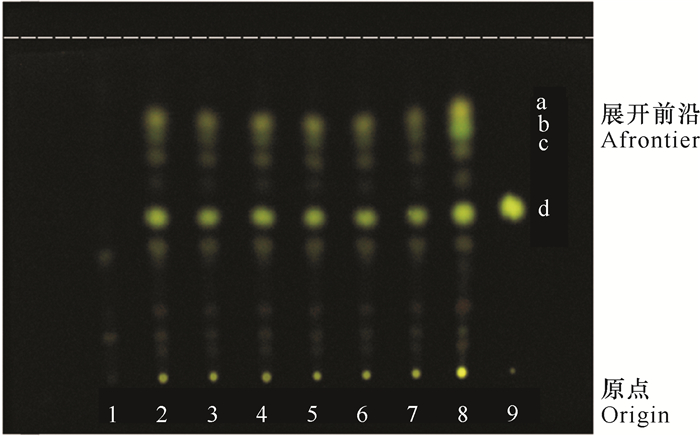
|
| 1:延胡索阴性供试品溶液;2~7:不同批次的样品;8:延胡索对照药材;a~d:特征荧光斑点(a:黄绿色;b~d:绿色); 9:延胡索乙素对照品 1:Negative reference solution of rhizoma Corydalis; 2—7:Samples from different batches; 8:Reference herbs of rhizoma corydalis; a—d:A characteristic fluorescent spot (a:yellow-green, b—d:green); 9:Reference substance of tetrahydropalmatine 图 1 十味参归灌肠液中延胡索的薄层鉴别色谱图(365 nm) Fig. 1 TLC chromatographic chart of rhizoma Corydalis in Shiweishengui filling and intestinal juice (365 nm) |
2.2 丹参的薄层鉴别
6批样品供试品溶液色谱中,在与对照品相对应的位置上,均显示相同的暗斑;阴性对照溶液色谱则无此暗斑。另外,层析斑点分离较好,Rf值适中, 说明本法层析效果较好,重现性好,专属性强,无阴性干扰(图 2)。
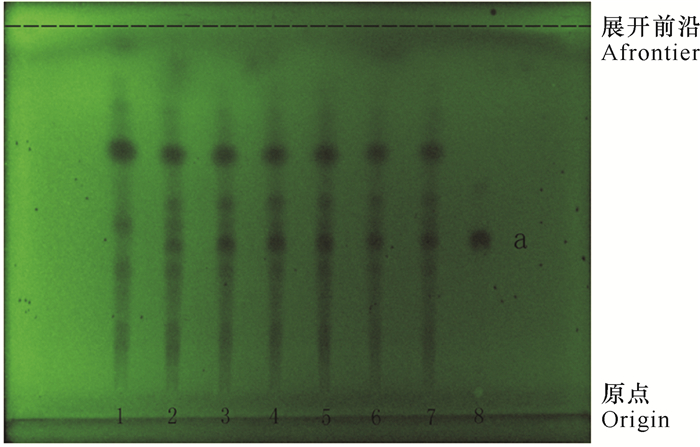
|
| 1:丹参的阴性供试品溶液; 2~7:不同批次的样品;8:丹酚酸B对照品;a:丹酚酸B对照品特征斑点(棕黑色) 1:Negative reference solution of Salvia miltiorrhiza; 2—7:Samples from different batches; 8:Reference substance of Dan phenolic acid B; a:Characteristic spots of Dan phenolic acid B reference substance (brown and black) 图 2 十味参归灌肠液中丹参的薄层鉴别色谱图(254 nm) Fig. 2 TLC chromatography of Salvia miltiorrhiza in shiwei Shiweishengui filling and intestinal juice (254 nm) |
2.3 桃仁与赤芍的薄层鉴别
6批样品供试液色谱图中,在与苦杏仁苷对照品溶液相对应的位置上,均显相同颜色(蓝黑色)的斑点;在与芍药苷对照品相应的位置上有分离较好、清晰且集中的蓝黑色斑点。另外,层析斑点分离较好,Rf值适中,说明本法层析效果较好,重现性好,专属性强,无阴性干扰(图 3)。
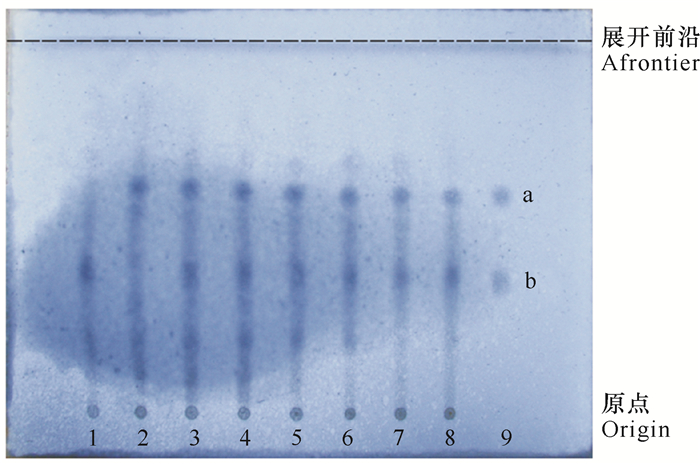
|
| 1:赤芍阴性供试品溶液;2:桃仁阴性供试品溶液;3—8:不同批次的样品; 9:苦杏仁苷与芍药苷对照品;a:芍药苷对照品特征斑点(蓝黑色);b:苦杏仁苷对照品特征斑点(蓝黑色) 1:Negative reference solution of Radix Paeoniae Rubra; 2:Negative reference solution of peach kernel; 3-8:Samples from different batches; 9:Reference substance of Amygdalin; Reference substance of paeoniflorin; a:Characteristic spots of paeoniflorin reference substance (blue and black); b:Characteristic spots of Amygdalin reference substance (blue and black) 图 3 十味参归灌肠液中桃仁、赤芍的薄层鉴别色谱图 Fig. 3 TLC of peach kernel and Radix Paeoniae Rubra in Shiweishengui filling and intestinal juice |
2.4 丹酚酸B含量测定 2.4.1 专属性及系统适应性试验
供试品溶液的色谱图中有与丹酚酸B保留时间相同的吸收峰;样品丹酚酸B峰可达到基线分离,分离度均>1.5;阴性制剂供试品溶液的色谱图则无此吸收峰。说明采用本方法测定丹酚酸B含量无阴性干扰,专属性强;理论板数以丹酚酸B峰计应不低于3 000(图 4)。
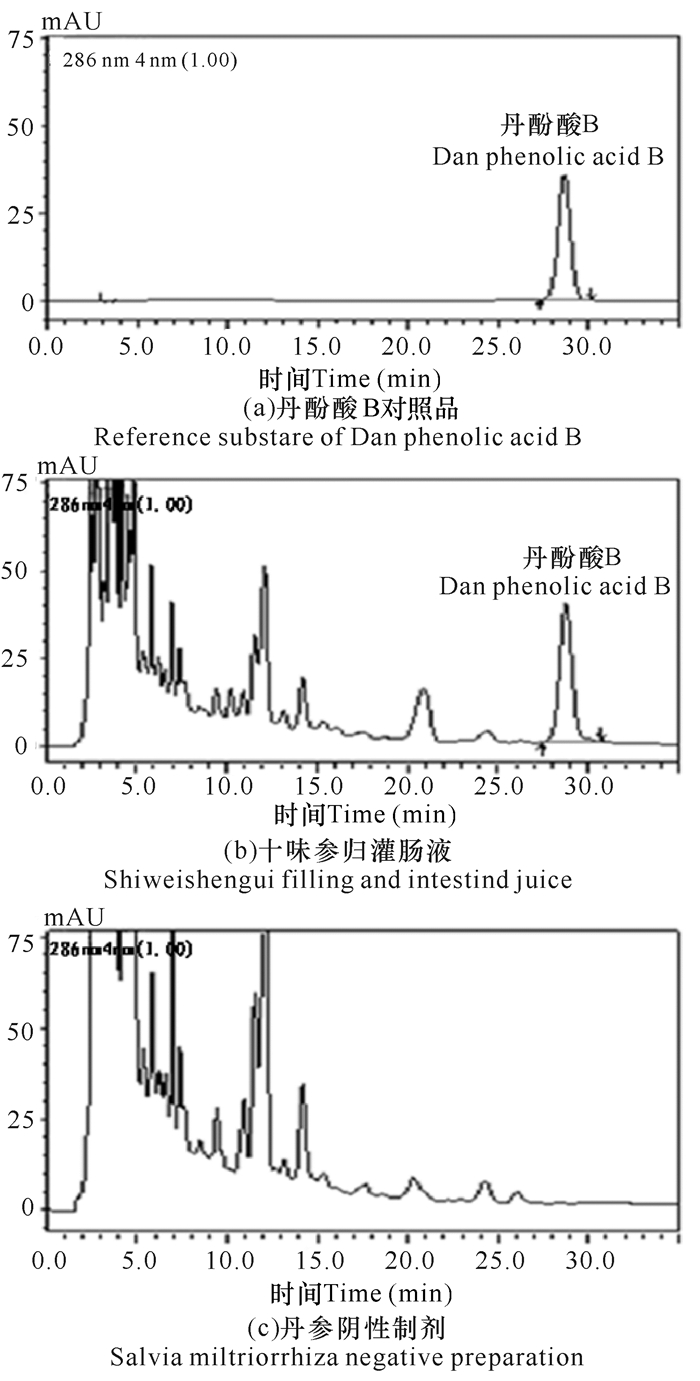
|
| 图 4 十味参归灌肠液中丹酚酸B含量测定HPLC色谱图 Fig. 4 HPLC chromatography of Dan phenolic acid B in Shiweishengui filling and intestinal juice |
2.4.2 线性关系考察
当丹酚酸B对照品进样量在54.55~545.50 μg时,进样量与峰面积呈良好的线性关系,回归方程为y=11321x-274412,r=0.999 6(图 5)。

|
| 图 5 丹酚酸B进样量与峰面积值线性关系图 Fig. 5 Linear relationship between the amount of Dan phenolic acid B injection and the peak area value |
2.4.3 精密度试验
6次测定的丹酚酸B峰面积分别为1931820, 1902552, 1957857, 1956873, 1948326, 1965612,RSD=1.20%(n=6), 表明本方法的精密度良好。
2.4.4 稳定性试验7次测定的丹酚酸B峰面积分别为1931820, 1957857, 1948326, 1945136, 1954849, 1938928, 1948462,RSD=0.460%(n=7),表明供试品溶液在24 h内稳定。
2.4.5 重复性试验6份供试品溶液丹酚酸B含量分别为0.426 mg/mL、0.427 mg/mL、0.430 mg/mL、0.427 mg/mL、0.433 mg/mL、0.428 mg/mL,RSD=0.624%(n=6), 表明本方法重复性良好。
2.4.6 回收率试验丹酚酸B平均回收率为102.77%,RSD=1.01%(n=6),表明本供试品溶液的制备方法是可行的(表 1)。
| 序号 No. |
取样中丹酚酸B量 Dan phenolic acid B content in the sample (mg) |
加入丹酚酸B量 Dan phenolic acid B content added (mg) |
测出丹酚酸B量 Dan phenolic acid B content measured(mg) |
回收率 Recovery rate(%) |
平均回收率 Average recovery rate(%) |
标准偏差 RSD (%) |
| 1 | 0.421 | 0.475 | 0.908 | 102.60 | ||
| 2 | 0.421 | 0.475 | 0.901 | 101.05 | ||
| 3 | 0.421 | 0.475 | 0.916 | 104.18 | ||
| 4 | 0.421 | 0.475 | 0.912 | 103.32 | ||
| 5 | 0.421 | 0.475 | 0.910 | 102.91 | ||
| 6 | 0.421 | 0.475 | 0.908 | 102.58 | 102.77 | 1.01 |
2.4.7 耐用性试验
不同品牌的C18色谱柱测出丹酚酸B含量分别为0.497 mg/mL和0.520 mg/mL,RSD=3.19%(n=2);不同品牌的高效液相色谱仪测得丹酚酸B含量分别为0.320 mg/mL和0.327 mg/mL,平均含量为0.323 mg/mL,RSD=1.53%(n=2)。试验结果表明,本方法对不同品牌的C18色谱柱和不同品牌的高效液相色谱仪均具有良好的耐用性。
2.4.8 样品测定及含量限度的确定6批样品中丹酚酸B含量为0.398~0.433 mg/mL,平均含量为0.415 mg/mL(表 2)。
| 批号 Batch number |
丹酚酸B含量 Dan phenolic acid B content(mg/mL) |
| 131104 | 0.398 |
| 131106 | 0.403 |
| 131111 | 0.433 |
| 140401 | 0.423 |
| 140403 | 0.419 |
| 140405 | 0.416 |
考虑生产时药材含量波动因素,建议本品含丹酚酸B(C36H30O16)限度应定为每1 mL不得少于0.20 mg。
3 结论本文建立的十味参归灌肠液中的延胡索、丹参、桃仁、赤芍TLC鉴别方法操作简易,专属性和重复性高,可有效控制制剂的原料药材真伪;建立的丹酚酸B的高效液相色谱定量检测方法专属性较强,精密度高,重现性好,具有可操作性,可作为控制该制剂质量优劣的方法。经方法学及耐受性考察,本文建立的十味参归灌肠液定性定量方法,均符合中药质量标准制订的技术要求,可作为十味参归灌肠液的质量控制的标准。
| [1] |
马丙祥, 董宠凯. 丹参的药理作用研究新进展[J]. 中国药房, 2014, 25(7): 663-665. |
| [2] |
于金玲. 丹酚酸B药理作用研究进展[J]. 天津药学, 2012, 24(3): 64-68. |
| [3] |
叶剑. 丹参的药用成分与药理作用探析[J]. 陕西中医学院学报, 2012, 35(5): 71-73. |
| [4] |
刘庆华, 刘彦辰. 实用植物本草[M]. 天津: 天津科学技术出版社, 1998.
|
| [5] |
蔡梅超. 延胡索的化学成分及质量标准研究[J]. 化工时刊, 2012, 26(3): 45-46, 66. |
| [6] |
鲁春梅, 张春森, 姜立勇. 延胡索化学成分及药理作用研究进展[J]. 中国现代药物应用, 2011, 5(15): 126-127. |
| [7] |
赵永见, 牛凯, 唐德志, 等. 桃仁药理作用研究近况[J]. 辽宁中医杂志, 2015, 42(4): 888-890. |
| [8] |
陆小华, 马骁, 王建, 等. 赤芍的化学成分和药理作用研究进展[J]. 中草药, 2015, 46(4): 595-602. |


