2. 南宁师范大学, 北部湾环境演变与资源利用教育部重点实验室, 广西南宁 530000
2. Key Laboratory of Environment Change and Resources Use in Beibu Gulf, Nanning Normal University, Nanning, Guangxi, 530000, China
近江牡蛎(Crassostrea rivularis)属于动物界(Animalia)、软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、翼形亚纲(Pteriomorphia)、牡蛎目(Osteroida)、牡蛎科(Ostreidae),广温性潮间带底栖生物[1-2]。有研究表明,近江牡蛎热胁迫后,热休克蛋白90(Heat shock protein 90,Hsp90)的mRNA表达显著升高,可促进受损蛋白复性[3-4],但目前还未见关于这一调控机制的相关研究报道。DNA甲基化作为一种表观遗传的重要形式,可以对内源及外界环境变化做出反应,因此,通过甲基化修饰(DNA甲基化和去甲基化)调控基因表达,被认为在生物适应性中扮演重要角色[5-6]。为揭示高温胁迫对近江牡蛎Hsp90 mRNA表达及核心启动子CpG甲基化的影响,本研究以近江牡蛎成贝为实验对象,明确Hsp90 mRNA在成贝中的组织分布,以及在高温胁迫条件下,Hsp90 mRNA组织表达、核心启动子CpG平均甲基化率、核心启动子各CpG位点甲基化率及与核心启动子RNA polymeraseⅡ结合等情况。该实验结果可丰富广温性潮间带底栖生物的温度调控机制研究。
1 材料与方法 1.1 材料 1.1.1 实验动物近江牡蛎(约2年龄)成贝样品采集于广西钦州湾茅尾海地区的两个养殖区(21°43′0″ N,108°35′8″ E和21°39′21″N,108°51′58″E),养殖条件如下:温度31.5℃和31.7℃,盐度17.7‰和17.9‰,pH值分别为7.72和7.81,电导率分别为28.86 μs/cm和29.17 μs/cm,样品采集后放入采集箱中,立即送回实验室处理。
1.1.2 主要试剂RNAzol试剂,购自MRC公司;SYBR®Select Master Mix试剂盒,购自ABI公司;QIA quick Gel Extraction试剂盒,购自QIAGEN公司;rTaq E、10×PCR Buffer、2.5 mmol/L dNTP、DNA Marker 2000、基因组DNA提取试剂盒和克隆载体PMD19-T Vectors,购自TaKaRa公司;DH5α感受态细胞和X-gal,购自北京全式金公司;DNA MethylationTM kit,购自EZ Research公司;EZ ChIP assay kit,购自Millipore公司;引物均由上海英骏生物技术有限公司合成。
1.1.3 主要仪器电泳仪(型号为Powerpac HV 164-5056),购自Bio-Rad公司;超微量紫外分光光度计(型号为NanoDrop-1000),购自NanoDrop公司;全自动凝胶成像系统(型号为Syngene Genius),购自Syngene公司;低温恒温槽(型号为DC-1006),购自无锡沃信仪器有限公司;梯度热循环仪(型号为T100),购自Bio-Rad公司;荧光定量PCR仪(型号为7500FAST),购自ABI公司;高速离心机(型号为5810R)、离心机(型号为mini spin plus),购自Eppendorf公司;紫外分光光度计(型号为Cary 50),购自Varian公司;生物安全柜(型号为HF Safe 760S),购自Heal Force公司;电热恒温鼓风干燥箱(型号为DHG-9070A),购自上海精宏设备有限公司。
1.2 方法 1.2.1 近江牡蛎Hsp90核心启动子序列分析依据GenBank数据库中已登录的近江牡蛎Hsp90序列(登录号:HQ450642),利用在线生物信息学软件和Meth Primer软件分析近江牡蛎Hsp90启动子序列并设计MSP引物。
1.2.2 近江牡蛎热胁迫1.1.1节实验动物采集后,成贝放入28℃、盐度18.0‰、pH值为7.70的水环境中驯养一周,每天换水一次(换水量约达总体积的一半),上午和下午各投喂适量扁藻;驯养一周后,将实验组水温升高至40℃,其余条件保持不变,对照组所有条件均保持不变,热胁迫24 h;取实验组和对照组各12只成贝进行解剖,取其消化腺、腮、唇瓣、外套膜、肌肉柱和心脏组织于液氮速冻后-80℃保存,用于后续实验分析。
1.2.3 荧光定量PCR及数据分析运用RNAzol法提取1.2.2节中成贝消化腺、腮、唇瓣、外套膜、肌肉柱和心脏组织样品中的总RNA,取1.0 μg总RNA进行反转录制备cDNA模板。根据GenBank已登录序列设计Hsp90(登录号:HQ450642)和β-actin(登录号:AF026063)qPCR引物(表 1),在7500 FAST real-time PCR检测系统(Applied Bio systems)进行荧光定量分析,以2-△△CT法计算结果。
| 引物名称 Primer name |
引物序列 Primer sequence (5′-3′) |
产物长度 Product length (bp) |
| Hsp90 qPCR | Forward:5′-AAAAGGCAGAGGCAGACAAA-3′ Reverse:5′-ACGGGTTCTTGTGTTTCTGG-3′ |
187 |
| β-actin qPCR | Forward:5′-CTGTGCTACGTTGCCCTGGACTT-3′ Reverse:5′-TGGGCACCTGAATCGCTCGTT-3′ |
129 |
| Hsp90 MSP | Forward:5′-TTTTCGTAAAAATTTATAGGAACGA-3′ Reverse:5′-TACATCAACCATTAATAAACCCGA-3′ |
149 |
| Hsp90 ChIP PCR | Forward:5′-TATCATTTTTCCCTCGTAAAA-3′ Reverse:5′-TCAATACACATCCCAAAATAG-3′ |
202 |
1.2.4 MSP及数据分析
运用TaKaRa基因组DNA提取试剂盒提取1.2.2节中成贝消化腺、腮、唇瓣、外套膜、肌肉柱和心脏组织的基因组DNA,再依据DNA MethylationTM kit试剂盒说明书将每个组织样品的0.5 μg基因组DNA进行亚硫酸氢盐处理,制备MSP模板。根据GenBank已登录序列设计Hsp90(登录号:HQ450642) MSP引物(表 1)。MSP实验中每个组织样品,平行测序一次,计算核心启动子CpG平均甲基化率(%)及各CpG位点甲基化率(%)。
1.2.5 染色质免疫共沉淀实验依据EZ ChIP assay kit试剂盒说明书进行:取1.2.2节中成贝消化腺、腮、唇瓣、外套膜、肌肉柱和心脏组织各0.1 g,在含有1 μg/mL蛋白酶抑制剂cocktail Ⅱ的400 μL PBS缓冲液中充分消化,消化后的组织加入1 mL SDS Lysis缓冲液裂解,运用微尖超声破碎仪将基因组破碎为0.2~0.8 kb长度的小片段,再将2 μg的特异性RNA聚合酶Ⅱ抗体加入破碎小片段中4℃过夜孵育,孵育结束后,以此为模板,根据GenBank已登录序列设计Hsp90(登录号:HQ450642) ChIP引物(表 1),进行ChIP PCR实验,PCR产物进行3%琼脂糖凝胶检测及灰度分析。
2 结果与分析 2.1 近江牡蛎Hsp90核心启动子序列近江牡蛎Hsp90核心启动子含有1个CpG岛、1个HSE、1个TATA box元件,CpG岛含有7个CpG位点(图 1),其中CpG1、CpG6和CpG7位于MSP引物中(图 1),所研究的4个CpG位点从CpG2到CpG5位置信息为-125, -84, -74, -64(表 1)。
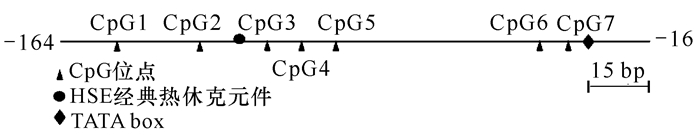
|
| 图 1 近江牡蛎Hsp90核心启动子序列 Fig. 1 `The core promoter sequence of C.rivularis Hsp90 |
2.2 近江牡蛎Hsp90 mRNA表达及核心启动子CpG平均甲基化率
Hsp90基因在近江牡蛎消化腺、腮、唇瓣、外套膜、肌肉柱和心脏组织中均有表达(图 2a);与对照组比较,热胁迫24 h后实验组消化腺、腮和心脏组织中Hsp90 mRNA表达升高,差异显著(P<0.05)(图 2a),Hsp90核心启动子CpG平均甲基化率降低,差异显著(P<0.05)(图 2b)。

|
| 图 2 热胁迫24 h前后Hsp90 mRNA相对表达及核心启动子平均甲基化率变化 Fig. 2 The Hsp90 mRNA expression and core promoter methylation levels of C.rivularis before and after treatment by high temperature stress for 24 h |
2.3 近江牡蛎Hsp90 mRNA核心启动子各CpG位点平均甲基化率
热胁迫后,与对照组比较,实验组腮组织的CpG2平均甲基化率显著降低(P<0.05)(图 3a);实验组消化腺组织和腮组织的CpG3平均甲基化率显著降低(P<0.05)(图 3b);实验组心脏组织的CpG4平均甲基化率显著降低(P<0.05)(图 3c),而较远距离的CpG5位点甲基化水平无显著变化(图 3d)。
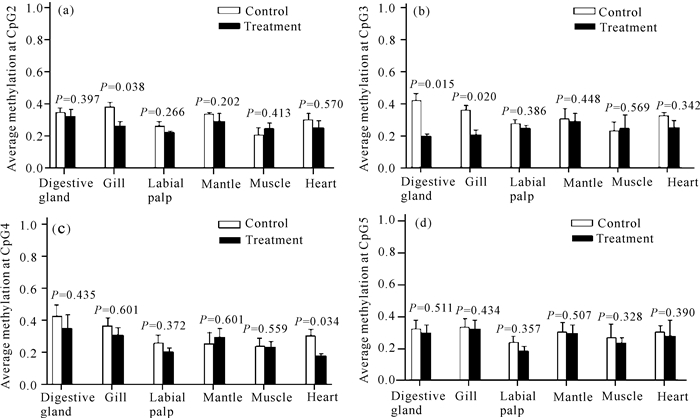
|
| 图 3 热胁迫前后Hsp90核心启动子CpG位点甲基化 Fig. 3 The Hsp90 CpGs methylation levels of C.rivularis before and after treatment by high temperature stress for 24 h |
2.4 染色质免疫共沉淀实验
热胁迫后,灰度分析显示,与对照组比较,实验组消化腺和心脏组织Hsp90核心启动子与RNA polymeraseⅡ结合增强,腮出现弱结合现象(图 4)。

|
| 图 4 热胁迫前后Hsp90核心启动子与RNA polymeraseⅡ结合 Fig. 4 Binding status of RNA polymeraseⅡ to Hsp90 promoter in C.rivularis before and after treatment by high temperature stress for 24 h |
3 讨论
荧光定量PCR结果显示:在非胁迫状态下,Hsp90 mRNA在近江牡蛎消化腺、腮、唇瓣、外套膜、肌肉柱和心脏组织中均有表达;热胁迫(40℃,24 h)后,与对照组比较,实验组消化腺、腮和心脏组织中Hsp90 mRNA相对表达都出现了显著性升高(图 2a),这一结果与陈晨[3]在近江牡蛎中的热胁迫实验结果一致,也与Farcy等[7]在欧洲鲍螺(Haliotis tuberculata)中所得结果较一致,表明Hsp90 mRNA在短时间内极显著增加,是热胁迫中的机体应激调节现象,高热产生的Hsp90可增强细胞对下一次损伤的耐受,维持细胞的正常代谢,提高生存率[8],但是这仅仅是几种特例还是普遍现象,需在多种物种中做进一步研究。
根据GenBank已登录近江牡蛎Hsp90序列(登录号:HQ450642),分析其5′端调控区的核心启动子,其含有1个CpG岛(-164~-16),1个HSE、1个TATA box(图 1)。利用亚硫酸氢盐处理基因组DNA结合MSP法,比较热胁迫前后Hsp90核心启动子CpG平均甲基化率,结果显示:与对照组比较,实验组消化腺、腮和心脏组织中核心启动子区CpG平均甲基化率降低,差异显著(P<0.05)(图 2b),表明甲基化可能参与调控Hsp90在热胁迫后的基因表达,从而提高近江牡蛎对热胁迫环境的适应性。以往在植物中的研究已经证明,拟南芥(Arabidopsis thaliana)[9]、玉米(Zea mays)[10]、蒲公英(Taraxacum mongolicum)[11]和水稻(Oryza glaberrima)[12]均可因被环境条件所胁迫从而修饰基因组DNA甲基化水平,调控环境胁迫下的基因表达,提高植物对环境的适应性[13-16]。与植物相比,在水产动物皱纹盘鲍(Haliotis discus hannai)的研究中也显示,在环境因子胁迫下,基因组DAN甲基化模式的改变可启动胁迫响应机制,通过调控相关抗逆基因的表达,促使表型性状发生变异,增强皱纹盘鲍对不良环境的适应能力[17]。
比较热胁迫前后Hsp90核心启动子各CpG位点平均甲基化率,与对照组比较,实验组腮组织的CpG2平均甲基化率显著降低;实验组消化腺组织和腮组织的CpG3平均甲基化率显著降低;实验组心脏组织的CpG4平均甲基化率显著降低;而较远距离的CpG5位点甲基化水平无显著变化。HSE是位于Hsp90基因5′端上游的一段特殊重复排列序列,热休克时,HSE可增加对热休克因子(Heat shock factor,HSF)的结合,是Hsp90热休克反应中的重要元件[18],推测去甲基的发生可降低HSE与HSF结合的空间位阻,从而更有利于Hsp90转录发生。
染色质免疫共沉淀实验结果显示,热胁迫后,与对照组比较,实验组消化腺和心脏组织Hsp90核心启动子与RNA polymeraseⅡ结合显著增强,而腮也出现弱结合现象(图 4)。这一实验结果证实了MSP实验的结果,邻近HSE的CpG2、CpG3和CpG4位点甲基化水平显著降低,可提高Hsp90核心启动子与RNA polymeraseⅡ结合强度,从而增加在热胁迫后Hsp90 mRNA表达。
4 结论Hsp90是近江牡蛎抵御高温胁迫的主要表达基因,核心启动子甲基化模式参与调控Hsp90在热胁迫后的mRNA表达,从而提高近江牡蛎对热胁迫环境的适应性。
| [1] |
冯士笮, 李凤岐, 李少菁. 海洋科学导论[M]. 北京: 高等教育出版社, 1999: 280-313.
|
| [2] |
王如才, 王昭萍. 海水贝类养殖学[M]. 青岛: 中国海洋大学出版社, 2008: 72-94.
|
| [3] |
陈晨.近江牡蛎HSP90基因及其对理化胁迫和病原菌感染的反应[D].广州: 暨南大学, 2011.
|
| [4] |
NATHAN D F, VOS M H, LINDQUIST S. In vivo functions of the Saccharomyces cerevisiae Hsp90 chaperone[J]. Proceedings of the National Academy of Sciences, 1997, 94(24): 12949-12956. DOI:10.1073/pnas.94.24.12949 |
| [5] |
ELANGO N, HUNT B G, GOODISMAN M A, et al. DNA methylation is widespread and associated with differential gene expression in castes of the honeybee, Apis mellifera[J]. Proceeding of the National Academy of Sciences, 2009, 106(27): 11206-11211. DOI:10.1073/pnas.0900301106 |
| [6] |
BIRD A P, TAGGART M H. Variable patterns of total DNA and rDNA methylation in animals[J]. Nucleic Acids Research, 1980, 8(7): 1485-1497. DOI:10.1093/nar/8.7.1485 |
| [7] |
FARCY E, SERPENTINI A, FIEVET B, et al. Identification of cDNA encoding Hsp70 and Hsp90 in the abalone Haliotis tuberculata:Transcriptional induction in response to thermal stress in hemocyte primary culture[J]. Comparative Biochemistry and Physiology B:Biochemistry and Molecular Biology, 2011, 146(4): 540-550. |
| [8] |
RIABOWOL K T, MIZZEN L A, WELCH W J. Heat shock is lethal to fibroblasts microinjected with antibidies against Hsp70[J]. Science, 1998, 242(4877): 433-436. |
| [9] |
KAKUTANI T, MUNAKATA K, RICHARDS E J, et al. Meiotically and mitotically stable inheritance of DNA hypomethylation induced by ddm1 mutation of Arabidopsis thaliana[J]. Genetics, 1999, 151(2): 831-838. |
| [10] |
STEWARD N, ITO M, YAMAGUCHI Y, et al. Periodic DNA methylation in maize nucleosomes and demethylation by environmental stress[J]. Journal of Biological Chemistry, 2002, 277(40): 37741-37746. DOI:10.1074/jbc.M204050200 |
| [11] |
VERHOEVEN K J, JANSEN J J, VAN DIJK P J. Stress-induced DNA methylation changes and their heritability in asexual dandelions[J]. The New Phytologist, 2010, 185(4): 1108-1118. DOI:10.1111/j.1469-8137.2009.03121.x |
| [12] |
KOU H P, LI Y, SONG X, et al. Heritable alteration in DNA methylation induced by nitrogen-deficiency stress accompanies enhanced tolerance by progenies to the stress in rice (Oryza sativa L.)[J]. Journal of Plant Physiology, 2011, 168(14): 1685-1693. DOI:10.1016/j.jplph.2011.03.017 |
| [13] |
CÁCERES-PUIG J I, ABASOLO-PACHECO F, MAZON-SUASTEGUI J M, et al. Effect of temperature on growth and survival of Crassostrea corteziensis spat during late-nursery culturing at the hatchery[J]. Aquaculture, 2007, 272(1/2/3/4): 417-422. |
| [14] |
WADA Y, MIYAMOTO T, KUSANO T, et al. Association between up-regulation of stress-responsive genes and hypomethylation of genomic DNA in tobacco plants[J]. Molecular Genetics and Genomics, 2004, 271(6): 658-666. |
| [15] |
ROMO Z M, RE A D, DÍAZ F, et al. Physiological responses of pink abalone Haliotis corrugata (Gray, 1828) exposed to different combinations of temperature and salinity[J]. Aquaculture Research, 2010, 41(7): 953-960. |
| [16] |
ROBERTS S B, GAVERY M R. Is there a relationship between DNA methylation and phenotypic plasticity in invertebrates?[J]. Frontiers in Physiology, 2011, 2: 116. |
| [17] |
孔宁.温度、盐度对皱纹盘鲍"97"选群生长发育的影响[D].北京: 中国科学院大学, 2016.
|
| [18] |
BONNER J J, BALLOU C, FACKENTHAL D L. Interactions between DNA-bound trimers of the yeast heat shock factor[J]. Molecular and Cellular Biology, 1994, 14(1): 501-508. DOI:10.1128/MCB.14.1.501 |


