2. 广西科学院, 广西南宁 530007
2. Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
单细胞蛋白(Single cell protein,SCP)是微生物的干燥细胞,如真菌、藻类和细菌等,在人类食物或动物饲料中用作蛋白质补充剂。近年来,越来越多的廉价原料和工农业废弃物被用来生产SCP。由于微生物的多样性,SCP生产的常用底物有农业废弃物(如麦秆、甘蔗渣、稻壳渣、桔皮、玉米芯、葡萄渣、芒果渣、木薯废渣等)、农副产品加工废弃物(酒糟、糖蜜、造纸厂废渣)以及非常规培养基如石油副产品、天然气、乙醇和甲醇等[1-4]。Saejung等[5]使用光合细菌——红假单胞菌CSK01处理城市污水并生产单细胞蛋白,在最佳培养条件下处理3 d,所获得的最大单细胞蛋白量为6.2 g·L-1。Somda等[6]通过添加不同氮源,利用产朊假丝酵母菌FJM12发酵芒果废弃物,结果表明,添加酵母提取物作为氮源,72 h后可获得最大生物量(6.48±0.03) g·L-1,且酵母提取物与硫酸铵对提高单细胞蛋白产量具有积极作用。Yadav等[7]在极端发酵条件下,使用马克斯克鲁维酵母和克鲁斯假丝酵母分批连续好氧发酵乳清蛋白来获取单细胞蛋白,认为混合培养所获取的生物量最大,为0.38 g·L-1·h-1,所得单细胞蛋白富含赖氨酸。Abarshi等[8]采用酿酒酵母深层发酵的方法,使用西瓜皮和菠萝皮生产单细胞蛋白,结果表明,采用菠萝皮水解液深层发酵,所得酿酒酵母的单细胞蛋白产量(9.8%)比西瓜皮水解液高(2.42%);另外,两种果皮水解液组合发酵所得的单细胞蛋白产量高于西瓜皮水解液,但仍然低于菠萝皮水解液。Mensah等[9]以菠萝榨汁后的菠萝渣为底物,利用酿酒酵母生产单细胞蛋白,当菠萝渣提取物浓度为60%(V:V)时,单细胞蛋白产量最高。Jalasutram等[10]以未消化的家禽舍垃圾和消化的家禽舍垃圾为原料,利用假丝酵母菌生产单细胞蛋白,发现未消化的家禽舍垃圾比消化的更适合于假丝酵母菌生产单细胞蛋白。dos Reis等[11]选择10株酵母菌好氧发酵处理酒糟并生产单细胞蛋白,其中酿酒酵母(CCMA0187和CCMA0188)、光滑假丝酵母菌(CCMA0193)和近平滑假丝酵母(CCMA0544)的生物量相对较高,分别为306 mg·L-1、312 mg·L-1、388 mg·L-1和306 mg·L-1,而近平滑假丝酵母的蛋白质含量最高。Magalhães等[12]以甘蔗渣半纤维素水解物为底物,使用热带假丝酵母KP276650生产酵母单细胞蛋白,发酵96 h所得的最终生物量为16.97 g·L-1,蛋白质含量为60.05%。Tian等[13]选择5种工业酵母菌,即白地霉(Geotrichum candidumlink)、产朊假丝酵母(Candida utilis)、扣囊复膜酵母(Saccharomycopsis fibuligera)、热带假丝酵母(Candida tropicalis)和酿酒酵母(Saccharomyces cerevisiae),对马铃薯淀粉加工废水进行发酵,结果表明,产朊假丝酵母、白地霉和热带假丝酵母共培养是马铃薯淀粉加工废水发酵的最佳组合。
在众多的研究报道中,单细胞蛋白的发酵底物种类繁多,而利用沼液(Biogass slurry,BS)和香蕉秆压榨汁(Banana pseudostem juice,BPJ)生产SCP的报道研究很少。沼液是沼气发酵的副产物,其主要成分包括发酵过程中产生的各种无机物、有机物、微量元素等可溶性物质,以及一些具有特殊活性的生物物质,营养成分全面,养分可利用率高,具有较高的应用价值。香蕉秆为农业废弃物,含水量极高,利用其压榨汁生产单细胞蛋白可变废为宝,进一步延长香蕉产业链。由于单细胞蛋白的生产菌株大多为假丝酵母菌,因此本研究使用热带假丝酵母以及实验室已有的其他酵母菌、芽孢杆菌为筛选菌株,以沼液和香蕉秆压榨汁为培养基,对能利用沼液和香蕉秆压榨汁生长的微生物进行筛选,为进一步的单细胞蛋白生产提供参考。
1 材料与方法 1.1 原料发酵沼液来自广西大学生命科学与技术学院发酵与酶工程实验室的发酵样品。取发酵后的沼液在10 000 r/min下离心10 min,至少离心2次以充分去除原液中的总悬浮固体并收集上清液,过滤好的沼液放入—80℃冰箱保存备用。
香蕉秆来自广西大学农学院,压榨后使用。
1.2 菌株热带假丝酵母C.tropicalis(编号CICC 31949,购买于中国工业微生物菌种保藏管理中心),酿酒酵母S.cerevisiae Y49(保藏于广西科学院国家非粮生物质能源工程技术研究中心,由该实验室筛选选育),毕赤酵母Pichia pastoris GS115,枯草芽孢杆菌Bacillus subtilis WB600,地衣芽孢杆菌S.licheniformis(后3种菌均为模式菌株,保藏于广西科学院国家非粮生物质能源工程技术研究中心)。
1.3 培养基与试剂YPD液体培养基:10 g/L yeast extract,20 g/L tryptone,10 g/L葡萄糖,于高压蒸汽灭菌锅中121℃灭菌20 min(葡萄糖单独在115℃条件下灭菌15 min,于超净台混合后使用)。
YPD固体培养基:YPD液体培养基配制时加入15 g/L琼脂粉,其余操作相同。
LB液体培养基:5 g/L yeast extract,10 g/L tryptone,10 g/L NaCl,用5 mol/L NaOH调pH值至7.0后定容,于高压蒸汽灭菌锅中121℃灭菌20 min,备用。
LB固体培养基:LB液体培养基配制时加入15 g/L琼脂粉,其余操作相同。
无机盐溶液:1 g/L Na2HPO4,2 g/L K2HPO4,2 g/L KH2PO4,1 g/L MgSO4,0.1 g/L Fe2SO4,0.5 g/L ZnSO4,0.2 g/L MnCl2,1 g/L CaCl2。
1.4 方法 1.4.1 种子液培养(1) 从保存于-80℃冰箱的菌株保藏管中吸取0.2 mL菌液加入装有10 mL培养基的指形瓶中(酵母菌的培养基为YPD液体培养基,芽孢杆菌的培养基为LB液体培养基),在不同摇床中培养至对数期(酵母菌的培养条件为30℃,220 r/min;芽孢杆菌的培养条件为37℃,220 r/min),活化菌种。
(2) 将培养好的菌种分别划线至各自的固体培养基继续活化(酵母菌的培养基为YPD固体培养基,芽孢杆菌的培养基为LB固体培养基;培养条件:酵母菌为30℃培养箱培养,芽孢杆菌为37℃培养箱培养)。
(3) 挑取平板上的单菌落放入装有10 mL培养基的指形瓶中培养,培养基以及培养方法同步骤(1),即得种子液。
1.4.2 菌株筛选控制1.4.1节步骤(3)培养好的菌液浓度为1×107个/mL左右,此时酵母菌的OD600约为1.0,芽孢杆菌的OD540约为0.6。发酵底物:沼液(BS)、香蕉秆压榨汁(BPJ)以及两者按体积比1:1混合的混合物(Mixture medium,MM)。
(1) 取10 mL发酵底物置于指形瓶中,接入10%(V:V)种子液,按照各自的培养条件放入摇床中培养,间隔一定时间取样测定吸光度(酵母菌为8 h,芽孢杆菌为4 h,并随着培养时间的增长,取样时间间隔适当延长,以下取样时间相同处理),绘制生长曲线。每个实验设置3个平行。
(2) 取10 mL含有葡萄糖与无机盐(葡萄糖终浓度为20 g/L,无机盐添加比例1:10,V:V)的发酵底物置于指形瓶中,接入10%(V:V)种子液,按照各自的培养条件放入摇床中培养,间隔一定时间取样测定吸光度,绘制生长曲线。每个实验设置3个平行。
(3) 取10 mL发酵底物置于指形瓶中,接入10%(V:V)种子液,按照各自的培养条件放入摇床中培养,培养36 h后按照比例加入葡萄糖和无机盐(葡萄糖终浓度为20 g/L,无机盐添加比例1:10,V:V)继续培养。间隔一定时间取样测定吸光度,绘制生长曲线。每个实验设置3个平行。
2 结果与分析 2.1 菌株在不同培养基中的生长情况从图 1可以看出,热带假丝酵母C.tropicalis和毕赤酵母P.pastoris GS115在YPD培养基中的生长情况显著优于其他培养基,酿酒酵母S.cerevisiae Y49在香蕉秆压榨汁中(BPJ)的生长状态稍微优于YPD培养基,整体上来看3种菌株在YPD培养基中生长最优,其次为香蕉秆压榨汁(BPJ)、混合培养基(MM),生长最差的为沼液培养基(BS)。其可能原因是YPD培养基营养成分全面丰富;香蕉秆压榨汁的糖分含量高;沼液的碳氮比低,COD含量高,氨氮浓度高,对细胞有一定的毒害作用。

|
| 图 1 酵母菌在不同培养基中的生长情况 Fig. 1 Growth of yeast in different medium |
枯草芽孢杆菌B.subtilis WB600、地衣芽孢杆菌S.licheniformis在沼液、香蕉秆压榨汁、混合培养基和LB培养基中的生长变化没有规律,平行对照误差较大(图 2);再加上由于沼液、香蕉秆压榨汁、混合培养基等培养基未经过灭菌处理,芽孢杆菌在发酵过程中易出现杂菌污染现象,故在实际生产中不宜使用芽孢杆菌。
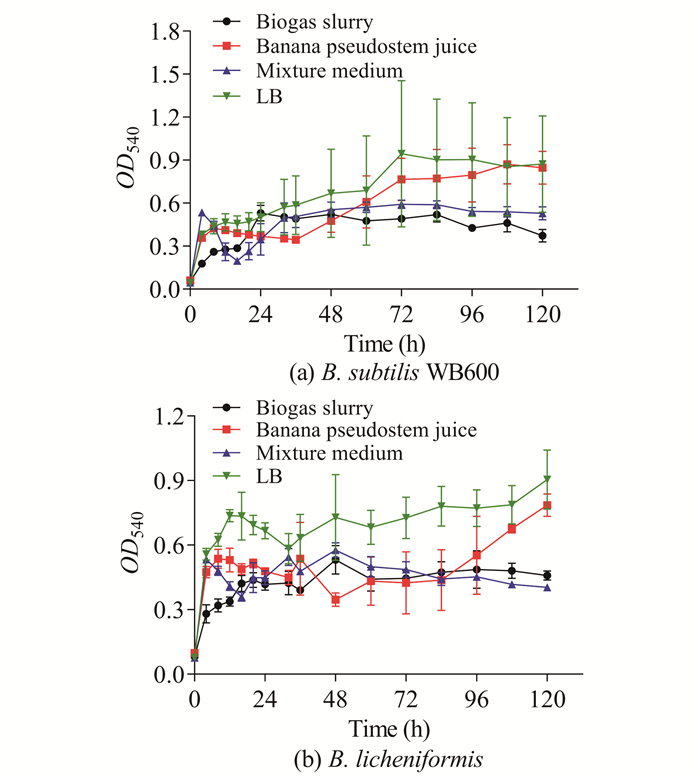
|
| 图 2 芽孢杆菌在不同培养基中的生长情况 Fig. 2 Growth of Bacillus sp.in different medium |
2.2 酵母菌在沼液中的生长情况
由图 3可知,C.tropicalis、S.cerevisiae Y49和P.pastoris GS115在沼液中都能生长,且各菌株的生长趋势基本一致。接种前,在沼液中加入葡萄糖和无机盐(用“BS+G+I-before”表示),C.tropicalis、S.cerevisiae Y49以及P.pastoris GS115的生长速率、OD600值皆高于其他两种培养基(图 3b),未添加其他物质的沼液(BS)的生长速率最慢、菌体浓度最低(图 3a)。发酵36 h后,往沼液中添加终浓度一致的葡萄糖和无机盐(用“BS+G+I-during”表示),菌株生长加快,OD600值大幅度上涨,其后一直保持上升趋势(图 3c)。在未添加其他物质的沼液中,培养36 h时3种酵母菌的生长浓度达到最高,继续培养则进入衰亡期,说明外源碳源与氮源的添加,对酵母菌的生长有促进作用。

|
| 图 3 酵母菌在沼液中的生长情况 Fig. 3 Growth of yeast in biogas slurry |
2.3 酵母菌在香蕉秆压榨汁中的生长情况
从图 4中可以看出,在整个培养过程中,3种酵母能很好地利用香蕉秆压榨汁(BPJ)以及添加葡萄糖和无机盐的香蕉秆压榨汁(发酵前添加和发酵36 h后添加,分别用“BPJ+G+I-before”“BPJ+G+I-during”表示)。在BPJ中,Y49、GS115和C.tropicalis的生长差异比较显著(图 4a);而在BPJ+G+I-before和BPJ+G+I-during中,3种酵母菌的生长差异不显著(图 4b、c)。由于实验期间香蕉秆压榨汁出现染杂菌现象,不易保存,故不宜将其作为发酵培养基。
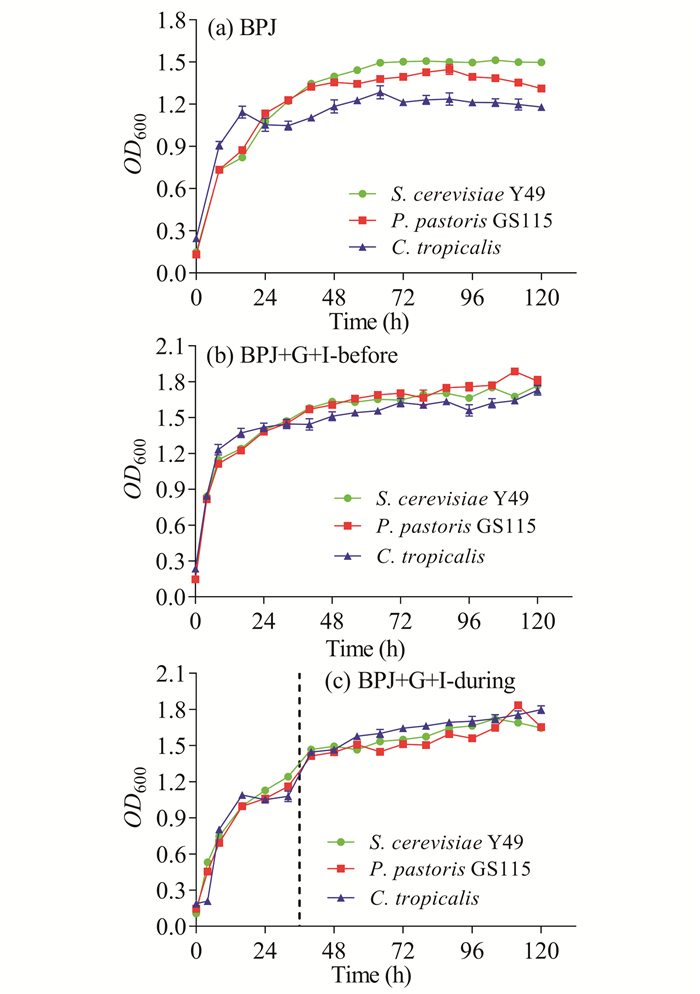
|
| 图 4 酵母菌在香蕉秆压榨汁中的生长情况 Fig. 4 Growth of yeast in banana pseudostem juice |
2.4 酵母菌在混合培养基中的生长情况
将沼液和香蕉秆压榨汁按体积比1:1混合作为培养基,考察3种酵母菌的生长情况(图 5)。从图 5可以看出,MM中酵母菌的生长变化趋势与在BPJ中大体一致,菌株在添加有葡萄糖和无机盐培养基中的OD600一直保持增长趋势(图 5b、c),而未添加其他物质的混合培养基中的菌株到发酵后期则进入衰亡期(图 5a)。

|
| 图 5 酵母菌在混合培养基中的生长情况 Fig. 5 Growth of yeast in mixture medium |
2.5 酵母菌的菌体干重比较
酵母菌、芽孢杆菌在沼液和香蕉秆压榨汁中都能生长。由于香蕉秆压榨汁在培养时易染杂菌,生产成本也随之增加,因此就两者而言,沼液更适合酵母菌单细胞蛋白的生产。单纯从生长浓度上来看,Y49、GS115和C.tropicalis三者在沼液中的生产能力不分伯仲,为找出更适合在沼液中生长的酵母菌,对菌体干重随时间变化的情况进行研究。虽然3种酵母菌生长状态趋于一致,但C.tropicalis的菌体干重明显大于其他两种菌,差异显著(图 6),因此C.tropicalis更适合用于沼液发酵产单细胞蛋白。
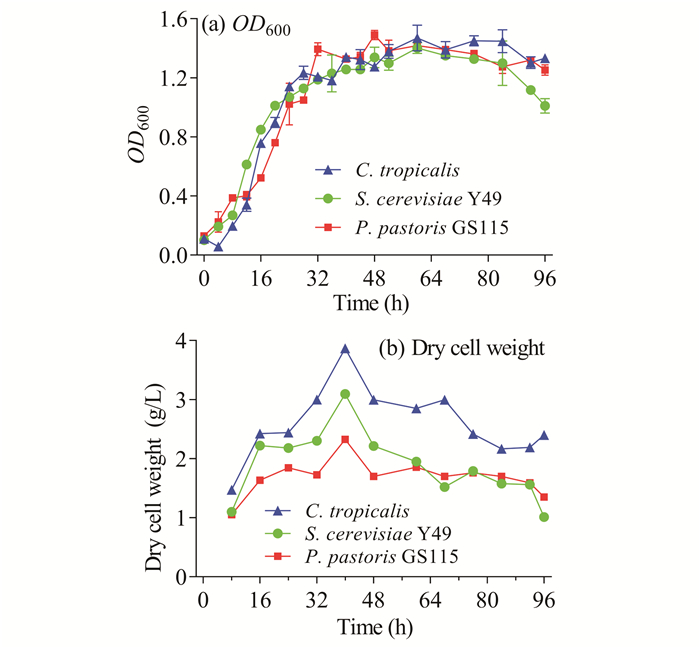
|
| 图 6 酵母菌OD600与细胞干重随时间变化关系 Fig. 6 Relationship between yeast OD600 and dry cell weight over time |
3 结论
香蕉秆压榨汁易染杂菌,因此不宜用作单细胞蛋白的发酵底物。从生长状态以及细胞干重来看,C.tropicalis更适用于发酵沼液生产单细胞蛋白。外源碳源和氮源的添加有利于酵母菌的生长发育。
C.tropicalis是重要的工业酵母,除作为工业化生产长链二元酸、木糖醇等化工原料的主要生产菌之外,也是食品造纸等工业废水的处理中,利用废弃物生产单细胞蛋白的重要微生物。在本研究中,热带假丝酵母单细胞蛋白的产量较低,下一步可研究其他碳源与氮源对热带假丝酵母单细胞蛋白产量的影响,以实现单细胞蛋白的高产;或者筛选出更适合的生产菌株以及采用共培养的方式来提高单细胞蛋白的生物量。
| [1] |
REIHANI S F S, KHOSRAVI-DARANI K. Influencing factors on single-cell protein production by submerged fermentation:A review[J]. Electronic Journal of Biotechnology, 2019, 37: 34-40. DOI:10.1016/j.ejbt.2018.11.005 |
| [2] |
UÇKUN KIRAN E, TRZCINSKI A P, LIU Y.Platform chemical production from food wastes using a biorefinery concept[J].J Chem Technol Biotechnol, 2015, 90(8): 1364-1379.https://doi.org/10.1002/jctb.4551.
|
| [3] |
SUMAN G, NUPUR M, ANURADHA S, et al. Single cell protein production:A review[J]. Int J Curr Microbiol App Sci, 2009, 4(9): 251-269. |
| [4] |
BHALLA T C, SHARMA N N, SHARMA M. Production of metabolites, industrial enzymes, amino acids, organic acids, antibiotics, vitamins and single cell proteins[J]. J Environ Issues, 2011, 6: 34-78. |
| [5] |
SAEJUNG C, THAMMARATANA T. Biomass recovery during municipal wastewater treatment using photosynthetic bacteria and prospect of production of single cell protein for feedstuff[J]. Environmental Technology, 2016, 37(23): 3055-3061. DOI:10.1080/09593330.2016.1175512 |
| [6] |
SOMDA M K, NIKIEMA M, KEITA I, et al. Production of single cell protein (SCP) and essentials amino acids from Candida utilis FMJ12 by solid state fermentation using mango waste supplemented with nitrogen sources[J]. African Journal of Biotechnology, 2018, 17(23): 716-723. DOI:10.5897/AJB2017.16361 |
| [7] |
YADAV J S S, BEZAWADA J, AJILA C M, et al. Mixed culture of Kluyveromyces marxianus and Candida krusei for single-cell protein production and organic load removal from whey[J]. Bioresource Technology, 2014, 164: 119-127. DOI:10.1016/j.biortech.2014.04.069 |
| [8] |
ABARSHI M M, MADA S B, AMINM I, et al.Effect of nutrient supplementation on single cell protein production fromwatermelon and pineapple peels[J].Nigerian Journal of Basic and Applied Science, 2017, 25(1): 130-136.DOI: http://dx.doi.org/10.4314/njbas.v25i1.17.
|
| [9] |
MENSAH J K M, TWUMASI P.Use of pineapple waste for single cell protein (SCP) production and the effect of substrate concentration on the yield[J].J Food Biochem, 2017, 40(3): e12478.https://doi.org/10.1111/jfpe.12478.
|
| [10] |
JALASUTRAM V, KATARAM S, GANDU B, et al. Single cell protein production from digested and undigested poultry litter by Candida utilis:Optimization of process parameters using response surface methodology[J]. Clean Techn Environ Policy, 2013(15): 265-273. |
| [11] |
DOS REIS K C, COIMBRA J M, DUARTE W F, et al. Biological treatment of vinasse with yeast and simultaneous production of single-cell protein for feed supplementation[J]. International Journal of Environmental Science and Technology, 2019, 16(2): 763-774. DOI:10.1007/s13762-018-1709-8 |
| [12] |
MAGALHĀES C E B, SOUZA-NETO M S, ASTOL-FI-FILHO S, et al. Candida tropicalis able to produce yeast single cell protein using sugarcane bagasse hemicellulosic hydrolysate as carbon source[J]. Biotechnology Research and Innovation, 2018, 2(1): 9-21. DOI:10.1016/j.biori.2018.08.001 |
| [13] |
TIAN Y, ZHANG Y, SUN Z, et al.Yeast compound for single-cell protein production by potato starch processing wastewater fermentation[M]//2nd International Conference on Environmental Science and Engineering (ESE 2017).Lancaster, United States: DEStech Publications, Inc., 2017.DOI: 10.12783/dteees/ese2017/14332.
|



