2. 广西壮族自治区分析测试研究中心, 广西南宁 530022;
3. 广西中医药研究院, 广西南宁 450103
2. Guangxi Zhuang Autonomous Region Analysis and Testing Research Center, Nanning, Guangxi, 530022, China;
3. Guangxi Traditional Chinese Medicine Research Institute, Nanning, Guangxi, 450103, China
金花茶(Camellia nitidissima Chi)为山茶科(Theaceae)山茶属(Camellia)金花茶组植物(Camellia Section Chrysantha Chang),味微苦、涩,性平,具有清热解毒、利尿消肿之功效,主治痢疾、疮疡等[1],主要分布于我国广西防城港地区[2]。现代研究表明,金花茶含有多种多酚类、黄酮类、皂苷类及其他对人体有益的活性成分,具有抗氧化、抗肿瘤、调节代谢等药理作用[3]。目前,对于金花茶指纹图谱研究有部分关于黄酮类物质的文献报道,邹登峰等[4]对金花茶叶中黄酮类成分进行指纹图谱研究,以芦丁、槲皮素、木犀草素、山奈素为参照物,确定了15个共有峰。杨立芳等[5]采用微波法对金花茶茶花水提液进行有效成分提取,建立了金花茶茶花HPLC特征指纹图谱共有模式,以芦丁为参照物,标示了34个共有峰。而关于金花茶其他成分指纹图谱的研究还鲜有报道。本研究针对金花茶叶中多酚类化合物,建立不同产地金花茶叶HPLC指纹图谱,利用液相色谱-质谱联用仪(LC-MS)技术对部分共有峰进行结构推测。同时运用聚类分析及主成分分析两种方法,分析金花茶叶药材化学成分种类及含量的差异,为更全面评价金花茶药材的质量提供实验依据。
1 材料与方法 1.1 仪器与试剂Waters2695型高效液相色谱系统(美国Waters公司);Waters UPLC-QTOF-MS仪(型号XEVO G2-S);KQ520013型超声波清洗器(昆山市超声仪器有限公司);XS205电子分析天平(1/10万天平,瑞士梅特勒-托利多公司);DHG9246A(立式)电热恒温鼓风干燥箱(上海精宏实验设备有限公司)、RE-52AA旋转蒸发仪(上海亚荣生化仪器厂)。
所用试剂除甲醇、乙腈为色谱纯外,其余为分析纯。对照品3, 4-o, o-次甲基-鞣花酸-4′-葡萄糖苷(okicamelliaside)由广西中医药研究院重点实验室提供,经UV、IR、1HNMR、13CNMR、MS波谱鉴定结构,经HPLC进样进行峰面积归一化法检测,纯度在98%以上。
10批不同产地金花茶叶均由广西中医药研究院赖茂祥研究员鉴定,金花茶叶来源信息及采集时间见表 1。
| No. | 产地Producing areas | 采集时间Acquisition time |
| S1 | 广西防城区Fangcheng District, Guangxi Province | 2016.06 |
| S2 | 广西防城区Fangcheng District, Guangxi Province | 2016.08 |
| S3 | 广西东兴市Dongxing City, Guangxi Province | 2016.06 |
| S4 | 广西东兴市Dongxing City, Guangxi Province | 2016.08 |
| S5 | 广西南宁市金花茶公园Camellia nitidissima Chi park of Nanning, Guangxi Province | 2016.06 |
| S6 | 广西防城港市南山景区Nanshan scenic spot of Fangchenggang City, Guangxi Province | 2016.08 |
| S7 | 广西防城港市南山景区Nanshan scenic spot of Fangchenggang City, Guangxi Province | 2016.06 |
| S8 | 广西上林县Shanglin county, Guangxi Province | 2016.08 |
| S9 | 广西防城港市炮台镇Fort town of Fangchenggang City, Guangxi Province | 2016.09 |
| S10 | 广西防城港市炮台镇Fort town of Fangchenggang City, Guangxi Province | 2016.08 |
1.2 方法 1.2.1 色谱条件
采用Agilent ZORBAX C18色谱柱(4.6 mm×250 mm, 5 μm),流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱,其中流动相A的比例变化为0—5 min,4%;5—47 min,4%~18%;47—65 min,18%~30%;65—75 min,30%~40%;75—90 min,40%~70%;90—91 min,70%~4%;流速:1 mL/min;柱温:30℃;检测波长:254 nm;进样量:10 μL,记录时间90 min。
1.2.2 质谱色谱条件色谱柱:Acquity HSS T3 C18(100 mm×2.1 mm, 1.7 μm),流动相:乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱,其中流动相A的比例变化为0.0—6.0 min,4%~18%;6.0—10.8 min,18%~30%;10.8—13.0 min,30%~40%;13.0—15.0 min,40%~70%;15.0—15.1 min,70%~4%;15.1—18.0 min,4%;流速:0.5 mL/min;柱温:30℃,分析时间为18 min,样品用0.22 μm滤膜过滤。进样量0.8 μL,采用自动进样方式。
质谱参数:电喷雾电离离子源(ESI),负离子模检测,质量扫描范围m/z 100~1 500 Da,毛细管电压2.8 kV,锥孔电压40 V,离子源温度100℃,脱溶剂温度350℃,脱溶剂气体流速700 L/h,在线校准物质为亮氨酸脑啡肽,低能量碰撞能6 V,高能量碰撞能35~50 V。
1.2.3 溶液制备(1) 对照品溶液的制备
精密称取okicamelliaside对照品适量,加甲醇溶液制成每1 mL含okicamelliaside 2.621 mg的对照品溶液。
(2) 供试品溶液的制备
将金花茶叶置于电热恒温鼓风干燥箱中65℃干燥,粉碎机粉碎后过40目筛备用。取金花茶叶粗粉0.5 g,精密称定,置于100 mL具塞锥形瓶中,加入50%乙醇-0.1 mol/min盐酸(1:1)溶液35 mL,密塞,超声提取90 min,抽滤,减压浓缩至干,甲醇溶解定容至10 mL容量瓶中,经0.45 μm微孔滤膜滤过,即得。
1.2.4 方法学考察取金花茶叶(广西防城区,2016-06),按1.2.3节方法制备供试品溶液,按“1.2.1”项色谱条件:(1)连续进样6次,记录色谱图,考察仪器的精密度情况;(2)进样分析,记录色谱图,考察该方法的重复性情况;(3)分别于0 h,2 h,4 h,8 h,12 h,24 h进样10 μL,记录色谱图,考察该供试品溶液在24 h内的稳定性情况。
1.2.5 指纹图谱的建立及相似度分析取10批金花茶叶(S1~S10),按1.2.3节的方法制备供试品溶液,按1.2.1节色谱条件进行测定,得到10批金花茶的指纹图谱;采用“中药色谱指纹图谱相似度评价系统(2012.1版)”对10批样品进行谱图处理分析,采用平均数相关系数法,时间窗宽度为0.2 min,经多点校正和数据匹配生成金花茶的色谱指纹共有模式。
1.2.6 指纹图谱主要成分初步推断为了得到更加丰富的共有峰成分信息,采用Waters UPLC-QTOF-MS仪对金花茶指纹图谱中共有峰化学成分进行分析鉴定。应用MassLynx 4.1软件对上述色谱峰进行成分推测,联合元素组成、质谱裂解途径分析并参考相关文献做进一步鉴定。
1.2.7 金花茶药材指纹图谱聚类分析及主成分分析以10批样品的10个明显的共有色谱峰面积为指标,运用SPSS 22.0统计分析软件,进行聚类分析,采用Ward法,平方Euclidean距离度量标准进行聚类分析。应用SPSS统计分析软件对10批金花茶药材进行了主成分分析。
2 结果与分析 2.1 方法学考察结果 2.1.1 精密度考察测试结果显示,共有峰相对保留时间的RSD<0.29%,相对峰面积的RSD<1.80%,小于指纹图谱规定的1%和3%,说明该仪器的精密度符合分析方法的要求。
2.1.2 重复性考察测试结果显示,主要色谱峰相对保留时间的RSD为<0.52%,相对峰面积的RSD为<2.50%,小于指纹图谱规定的1%和3%,说明该方法重复性良好。
2.1.3 稳定性考察测试结果显示,主要色谱峰相对保留时间的RSD为<0.46%,相对峰面积的RSD为<1.62%,各指标RSD均小于指纹图谱规定的1%和3%,表明该供试品溶液在24 h内稳定性良好。
2.2 指纹图谱的建立及相似度分析如图 1和图 2所示,10批金花茶叶共标定共有峰10个,其中,7号色谱峰(Okicamellia)与相邻峰分离度最好,分离度>1.5。10批金花茶叶中,Okicamellia含量均最高,稳定性好且保留时间居中,因此将其定为参照峰。将S1号样品色谱图设为参照图谱,经相似度计算,10批样品相似度为0.905~0.995。共有峰相对保留时间及相对标准偏差、共有峰相对峰面积及相对标准偏差分别详见表 2和表 3。
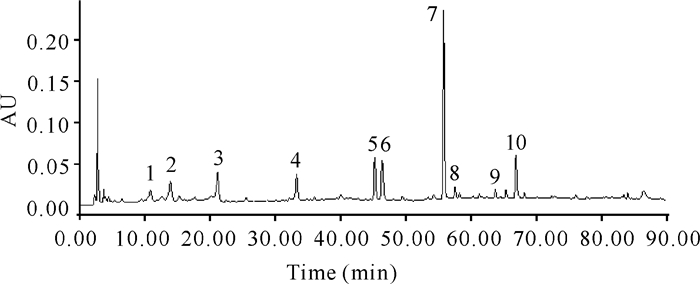
|
| 5号峰:3′-甲基鞣花酸-4′-葡萄糖苷;6号峰:鞣花酸;7号峰:Okicamellia;8号峰:3′-甲基鞣花酸;10号峰:3, 4-o, o-次甲基-鞣花酸 Peak No.5:3′-methyl ellagic acid-4′-glucoside; Peak No.6:ellagic acid; Peak No.7:Okikilimia; Peak No.8:3′-methyl ellagic acid; Peak No.10:3, 4-o, o-methine-ellagic acid 图 1 对照指纹图谱 Fig. 1 Comparison of fingerprint |
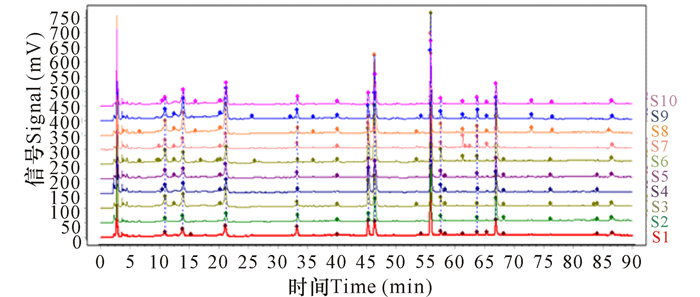
|
| 图 2 10批金花茶叶的指纹图谱 Fig. 2 10 batches fingerprint of Camellia nitidissima Chi leaf |
| 样品Sample | 1 | 2 | 3 | 4 | 5 | 6 | 7(S) | 8 | 9 | 10 |
| S1 | 0.195 | 0.249 | 0.380 | 0.597 | 0.811 | 0.831 | 1.000 | 1.031 | 1.141 | 1.199 |
| S2 | 0.195 | 0.250 | 0.380 | 0.596 | 0.811 | 0.830 | 1.000 | 1.031 | 1.141 | 1.198 |
| S3 | 0.196 | 0.250 | 0.380 | 0.596 | 0.811 | 0.830 | 1.000 | 1.031 | 1.141 | 1.198 |
| S4 | 0.195 | 0.250 | 0.379 | 0.596 | 0.811 | 0.830 | 1.000 | 1.031 | 1.141 | 1.198 |
| S5 | 0.195 | 0.249 | 0.379 | 0.595 | 0.811 | 0.831 | 1.000 | 1.031 | 1.141 | 1.198 |
| S6 | 0.194 | 0.249 | 0.379 | 0.595 | 0.811 | 0.830 | 1.000 | 1.031 | 1.142 | 1.198 |
| S7 | 0.195 | 0.249 | 0.380 | 0.597 | 0.810 | 0.829 | 1.000 | 1.031 | 1.141 | 1.198 |
| S8 | 0.195 | 0.249 | 0.379 | 0.595 | 0.811 | 0.830 | 1.000 | 1.031 | 1.142 | 1.198 |
| S9 | 0.195 | 0.250 | 0.379 | 0.596 | 0.811 | 0.829 | 1.000 | 1.031 | 1.141 | 1.198 |
| S10 | 0.195 | 0.250 | 0.379 | 0.596 | 0.811 | 0.830 | 1.000 | 1.031 | 1.141 | 1.198 |
| 平均值 Average |
0.195 | 0.250 | 0.379 | 0.596 | 0.811 | 0.830 | 1.000 | 1.031 | 1.141 | 0.195 |
| RSD (%) | 0.18 | 0.17 | 0.10 | 0.10 | 0.03 | 0.06 | 0.00 | 0.01 | 0.03 | 0.00 |
| 样品Sample | 1 | 2 | 3 | 4 | 5 | 6 | 7(S) | 8 | 9 | 10 |
| S1 | 0.133 | 0.208 | 0.273 | 0.198 | 0.259 | 0.290 | 1.000 | 0.064 | 0.043 | 0.274 |
| S2 | 0.108 | 0.174 | 0.254 | 0.172 | 0.175 | 0.562 | 1.000 | 0.092 | 0.056 | 0.496 |
| S3 | 0.191 | 0.214 | 0.294 | 0.063 | 0.290 | 0.427 | 1.000 | 0.090 | 0.021 | 0.335 |
| S4 | 0.114 | 0.169 | 0.233 | 0.045 | 0.293 | 0.473 | 1.000 | 0.075 | 0.032 | 0.250 |
| S5 | 0.193 | 0.201 | 0.282 | 0.082 | 0.272 | 0.274 | 1.000 | 0.076 | 0.037 | 0.277 |
| S6 | 0.190 | 0.128 | 0.181 | 0.035 | 0.267 | 0.562 | 1.000 | 0.083 | 0.026 | 0.350 |
| S7 | 0.145 | 0.156 | 0.213 | 0.054 | 0.253 | 0.239 | 1.000 | 0.049 | 0.078 | 0.193 |
| S8 | 0.278 | 0.389 | 0.652 | 0.101 | 0.234 | 1.416 | 1.000 | 0.114 | 0.069 | 0.410 |
| S9 | 0.286 | 0.538 | 0.752 | 0.186 | 0.234 | 0.534 | 1.000 | 0.097 | 0.109 | 0.349 |
| S10 | 0.144 | 0.367 | 0.569 | 0.171 | 0.201 | 0.637 | 1.000 | 0.097 | 0.085 | 0.377 |
| RSD (%) | 35.22 | 51.97 | 55.56 | 57.93 | 15.19 | 62.15 | 0.00 | 22.23 | 52.18 | 35.22 |
2.3 指纹图谱主要成分初步推断
初步鉴定了5个色谱峰,通过与对照品保留时间、特征离子等相关信息比对可确认5号峰为3′-甲基鞣花酸-4′-葡萄糖苷、6号峰为鞣花酸、7号峰为okicamelliaside、8号峰为3′-甲基鞣花酸、10号峰为3, 4-o, o-次甲基鞣花酸(表 4~5)。
| 编号 No. |
时间 Time(min) |
分子量 Mr |
分子式 Molecular formula |
一级碎片 Primary debris |
二级碎片 Secondary debris |
推测化合物 Speculative compound |
| 1 | 6.8 | 478 | C21H18013 | 477.06 | 477.06, 315.01, 299.99, 270.96, 242.99, 199.55 | 3′-甲基鞣花酸-4′-葡萄糖苷 3′-methyl ellagic acid-4′-glucoside |
| 2 | 7.0 | 301 | C14H6O8 | 300.99 | 623.19, 300.99, 254.99, 245.00, 229.00, 216.00 | 鞣花酸 Ellagic acid |
| 3 | 8.5 | 476 | C21H16O13 | 475.05 | 475.05, 312.99, 285.00, 254.99, 240.00, 212.01 | Okicamellia |
| 4 | 8.9 | 316 | C15H8O8 | 315.01 | 315.01, 299.98, 270.96, 244.00, 216.00, 200.01 | 3′-甲基鞣花酸 3′-methyl ellagic acid |
| 5 | 10.9 | 314 | C15H6O8 | 312.99 | 312.99, 285.00, 254.99, 241.01, 213.01, 185.02 | 3, 4-o, o-次甲基-鞣花酸 3, 4-o, o-methine-ellagic acid |
| 母核Nucleus | 化合物Compound | R1 | R2 | R3 | R4 |
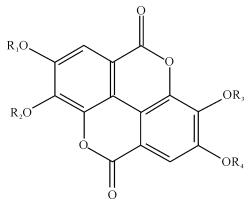 |
3′-甲基鞣花酸-4′-葡萄糖苷 3′-methyl ellagic acid-4′-glucoside |
H | H | CH3 | Glc |
| 鞣花酸Ellagic acid | H | H | H | H | |
| Okicamellia | -CH2- | -CH2- | H | Glc | |
| 3′-甲基鞣花酸 3′-methyl ellagic acid |
H | H | CH3 | H | |
| 3, 4-o, o-次甲基-鞣花酸 3, 4-o, o-methine-ellagic acid |
-CH2- | -CH2- | H | H |
2.4 金花茶药材指纹图谱聚类分析
从图 3可以看出,10批样品可以分为4类:S3、S4、S7为一类,S6为一类,S7为一类,S1、S2、S5、S9、S10号样品为一类。原因可能是不同产地与不同月份采摘药材的差异。
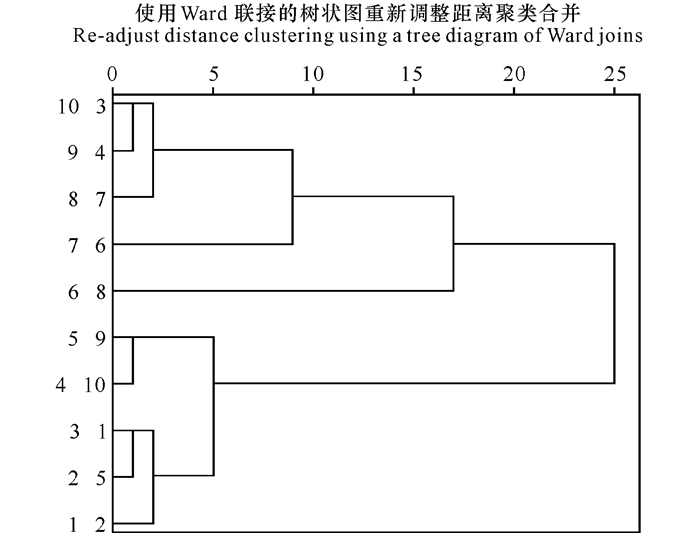
|
| 图 3 样品聚类分析 Fig. 3 Analysis of sample cluster |
2.5 金花茶药材指纹图谱主成分分析
由表 6分析结果可知,前5个成分累积贡献率可达97.90%,其中前3个成分贡献较大。将提取的10个成分和对应的特征值做散点图(图 4),观察散点图发现前3个成分的斜率非常陡,第4,5个成分的斜率较缓,而剩余的其他成分之间的斜率则非常平缓。斜率越陡贡献率越大,主要是前3个成分贡献。
| 成分 Component |
初始特征值 Initial eigenvalue |
||
| 特征值 Eigenvalue |
贡献率 Contribution rate (%) |
累积贡献率 Cumulative contribution rate (%) |
|
| 1 | 4.912 | 49.116 | 49.116 |
| 2 | 2.895 | 28.952 | 78.068 |
| 3 | 1.176 | 11.763 | 89.831 |
| 4 | 0.502 | 5.022 | 94.853 |
| 5 | 0.305 | 3.045 | 97.898 |
| 6 | 0.126 | 1.265 | 99.163 |
| 7 | 0.080 | 0.796 | 99.960 |
| 8 | 0.004 | 0.038 | 99.998 |
| 9 | 0.000 | 0.002 | 100.000 |
| 10 | 4.314E-17 | 4.314E-16 | 100.000 |
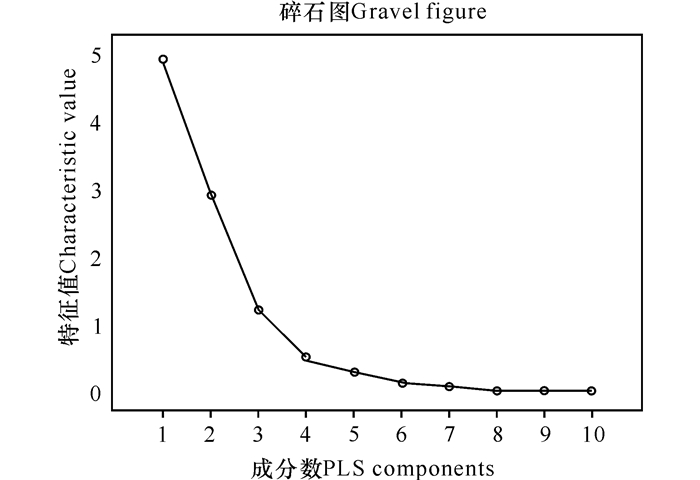
|
| 图 4 金花茶叶特征值散点图 Fig. 4 Scatter diagram of characteristic value of Camellia nitidissima Chi leaves |
通过SPSS统计分析软件计算出因子负荷矩阵,见表 7,可以看出1,5,6,7,8,10号色谱峰在主成分1中有明显的正相负荷,表明其增加,第一主成分增大;4号色谱峰在第一主成分中有明显的逆相负荷,表明其增加,第一主成分减少;其他的色谱峰对第一主成分影响相对较小。2,3,4,6,9号色谱峰在主成分2中有明显的正相负荷,表明其增加,第二主成分增大;5,7号色谱峰在第二主成分中有明显的逆相负荷,表明其增加,第二主成分减少;其他的色谱峰对第二主成分影响相对较小。对数据矩阵进行PCA后,以第一、二主成分(贡献值较大成分)建立坐标系即将得所有样本的PCA平面得分图见图 5。
| 峰号 Peak number |
成分1 Component 1 |
成分2 Component 2 |
成分3 Component 3 |
| 1 | 0.904 | 0.286 | 0.109 |
| 2 | 0.282 | 0.928 | 0.041 |
| 3 | 0.288 | 0.940 | -0.073 |
| 4 | -0.625 | 0.564 | -0.067 |
| 5 | 0.807 | -0.388 | 0.375 |
| 6 | 0.701 | 0.310 | -0.464 |
| 7 | 0.839 | -0.326 | 0.415 |
| 8 | 0.961 | 0.022 | -0.235 |
| 9 | 0.041 | 0.616 | 0.694 |
| 10 | 0.877 | -0.132 | -0.296 |

|
| 图 5 主成分平面分析 Fig. 5 Plane analysis of principal component |
3 结论
本研究通过对10批金花茶叶进行指纹图谱分析,共标识出10个共有指纹峰,10批样品的相似度均大于0.900,说明不同产地金花茶叶的化学组成一致性较好。在建立指纹图谱的基础上,采用UPLC-QTOF-MS技术分析金花茶叶中共有成分,鉴定出其中5个多酚类成分。本实验采用指纹图谱对金花茶叶质量进行控制,通过考察,该方法简便且专属性强,所建立的指纹图谱具有较好的稳定性,对进一步研究其药效物质基础有重要意义。
| [1] |
张可锋, 陈旭. 金花茶叶中3种黄酮苷元的含量测定[J]. 中国实验方剂学, 2011, 17(23): 60-62. DOI:10.3969/j.issn.1005-9903.2011.23.018 |
| [2] |
贺栋业, 王丽丽, 曹振辉, 等. 金花茶抗肿瘤功效研究进展[J]. 亚太传统医药, 2015, 11(3): 68-72. |
| [3] |
韦锦斌, 农彩丽, 苏志恒, 等. 金花茶体外抗肿瘤活性及物质基础的初步研究[J]. 中国实验方剂学杂志, 2014, 20(10): 169-174. |
| [4] |
邹登峰, 张伟, 梁臣艳, 等. 金花茶叶中黄酮类成分的HPLC指纹图谱研究[J]. 华西药学杂志, 2015, 30(4): 462-464. |
| [5] |
杨立芳, 刘洪存, 罗佳, 等. 金花茶茶花HPLC指纹图谱的研究[J]. 食品工业科技, 2016, 37(6): 86-89. |



