枯草芽孢杆菌(Bacillus subtilis)是一种十分重要的工业生产菌株,具有非致病性、遗传背景清晰、易分离培养、分泌蛋白能力强等优点,是表达异源蛋白的理想宿主。实现外源蛋白的高效表达影响因素有很多,其中高效可控的启动子是关键因素之一。根据诱导机制,启动子可分为组成型启动子、诱导型启动子、自诱导启动子和时期特异性启动子[1]。因此研究启动子的作用机理与各区域的协调作用,获得新的高效启动子十分关键。对于典型的原核启动子,其保守区域特征有转录起始位点(TSS)、Sextama-35区(TTGACA)、Pri-bmow-10区(TATAAT)[2],其中,Sextama-35区和Pri-bmow-10区序列之间的间隔距离通常为16~18 bp。枯草芽孢杆菌表达载体常用的启动子按照其诱导的方式可以分为组成型和诱导型启动子[3]。已经报道的枯草芽孢杆菌启动子有Papre、P43、PHpaⅡ、Plapsd等[4]。Phan等[5]在IPTG诱导型启动子Pspac的基础上进行调控元件的优化,获得强启动子Pgrac100。目前常见的诱导型启动子是麦芽糖诱导型启动子Pglv,该启动子上含有一个能与葡萄糖代谢蛋白CcpA结合进而抑制启动子表达的Cre序列,Yang等[6]将Cre序列上的CG碱基突变为AT后,得到新的启动子Pglv-M1使葡萄糖的抑制作用大大降低。此后,Yang等[6]还尝试通过突变启动子上的关键区域再次提高其启动能力,以获得更加高效的、可供工业化应用的启动子。本研究从实验室保藏的枯草芽孢杆菌中克隆到一个Pglv基因,并将其与实验室现有载体pHCMC04-sva连接,通过一系列定点突变获得连接有新的启动子的载体,转入枯草芽孢杆菌诱导表达后取粗酶液测酶活力,对新启动子的启动能力进行初步分析。
1 材料与方法 1.1 材料菌株:枯草芽孢杆菌B.subtilis 1A857、大肠杆菌Escherichia coli DH5α由本实验室保藏。
试剂:PrimeSTARTMHS DNA聚合酶、dNTP、λ/HindⅢ DNA Marker、In-Fusion HD Cloning Kit等均购买于TaKaRa公司;质粒DNA小量提取试剂盒、胶回收试剂盒均购买于BioFlux公司;SDS、丙烯酰胺、TEMED、过硫酸铵、N, N′-甲叉双丙烯酰胺、磷酸二氢钠、磷酸氢二钠、柠檬酸等试剂购买于上海生工生物工程公司,其他试剂为国产分析纯。
仪器:PCR仪(Biometra),离心机(Eppendorf Centrifuge 5415D),恒温培养箱(Binder),恒温摇床(ZHWY-211B),超净工作台(CLEAN BENCH ZHJH-C1109B)、恒温水浴锅(SHEL LAB W20M-2)、酶标仪(U Quamt TM)、扫描仪(Bio-RAD GS 800)、SDS-PAGE电泳系统(Amershan Biosciences)、凝胶成像系统(SYNGENE PTC-200)等。
1.2 方法 1.2.1 重组质粒pHCMC04-sva-Pglv的构建设计引物,上游引物P1:5′-CAGTGAGCTGAGCTGAGCTGAGCTCGGCATGTATCCGAA-TCGTACAAA-3′,下游引物P2:5′-CATGGATCGGATCGGATCGGATCCACGACCTCCTTGATAA-ATTTTACA-3′。以枯草芽孢杆菌B.subtilis WB600为模板,通过PCR获得Pglv的克隆序列。PCR反应程序:98℃ 10 min;98℃ 30 s,69℃ 15 s,72℃ 30 s,进行30个循环;72℃ 10 min。
设计引物,上游引物PH1:5′-GGATCCGATCCGATCCGATCCATGAAACAACAA-3′,下游引物PH2:5′-GAGCTCAGCTCAGCTCAGCTCACTGGCCGTCGTTT-3′。以实验室保存的pHCMC04-sva为模板,通过PCR获得载体pHCMC04-sva的克隆序列。PCR反应程序:98℃ 3 min;98℃ 30 s,64℃ 15 s,72℃ 7 min 36 s,进行30个循环;72℃ 10 min。PCR得到的两个片段分别进行胶回收处理,处理后使用In-Fusion HD Cloning Kit进行连接,连接体系:5X In-Fusion HD Enzyme Premix 2 μL,Pglv片段2 μL,pHCMC04-sva片段2 μL,dH2O 4 μL。将反应体系置于37℃孵育15 min,然后50℃孵育15 min,后置于冰上2 min,即可得到连接产物pHCMC04-sva-Pglv。将连接产物转入大肠杆菌E.coli DH5α,转入成功后从E.coli DH5α中提取重组质粒pHCMC04-sva-Pglv。
1.2.2 改造获得质粒pHCMC04-sva-Pglv-35利用引物,上游引物Cre-1:5′-GTAAACGTTATCAAGGAGGTCGTG-3′,下游引物Cre-2:5′-GATAACGTTTACAATTCCATTTAT-3′。以重组质粒pHCMC04-sva-Pglv为模板,进行Cre序列的突变,获得连接有Pglv-M1的序列。反应程序:98℃ 3 min;98℃ 30 s,56.5℃ 15 s,72℃ 8 min,进行30个循环;72℃ 10 min。PCR得到的片段经过胶回收纯化后,转入大肠杆菌E.coli DH5α,转化成功后提取质粒即可获得质粒pHCMC04-sva-Pglv-M1。
通过软件分析找到启动子Pglv-M1的关键区域Sextama-35区和Pri-bmow-10区,模拟在这两处的随机突变,通过软件分析得到得分较高的突变体,最终确定Sextama-35区的一处突变,即将Pglv-M1序列上的TTGTAA突变为TTGACA。设计引物,上游引物35-1:5′-GCT ATCTCATGGTATAAATGGAATTGACAAATTTA-3′;下游引物35-2:5′-CACGACCTCCTTGATAAATTTGTCAATTCCATTTA-3′。以重组质粒pHCMC04-sva-Pglv-M1为模板,通过PCR进行定点突变,反应程序:98℃ 3 min;98℃ 30 s,64℃ 15 s,72℃ 8 min,进行30个循环;72℃ 10 min。PCR产物胶回收后转入大肠杆菌E.coli DH5α,转入成功后从E.coli DH5α中提取改造过的质粒pHCMC04-sva-Pglv-35。
1.2.3 高温淀粉酶sva粗酶活力的测定分析用化学转化的方法将重组质粒pHCMC04-sva-Pglv-M1和pHCMC04-sva-Pglv-35分别转入宿主菌B.subtilis 1A857,表达后分别以4%的接种量接种于50 mL培养基中(含100 μg/mL的Cm),在37℃、180 r/min摇床中震荡培养,同时相同条件下培养没有转入质粒的B.subtilis 1A857作为对照。做出葡萄糖标准曲线,并且从接种开始,每隔12 h取发酵液一次,采用DNS法测定发酵液粗酶酶活力。选取二者粗酶酶活力最高时间点的发酵液,浓缩后进行SDS-PAGE分析。
2 结果与分析 2.1 重组质粒构建及突变改造 2.1.1 启动子及载体的克隆以枯草芽孢杆菌B.subtilis WB600为模板,利用引物P1、P2克隆出Pglv;以质粒载体pHCMC04-sva为模板,利用引物PH1和PH2克隆出pHCMC04-sva,经过琼脂糖凝胶电泳条带大小分别位于500 bp附近和6.6 kb附近(图 1)。
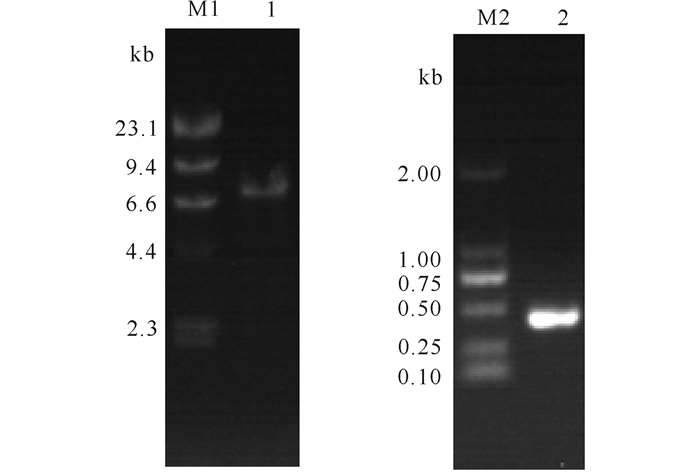
|
| M1:λDNA/Hind Ⅲ DNA Mark; M2: DL2000 DNA Mark; 1:PCR product of pHCMC04-sva; 2:PCR product of Pglv 图 1 质粒载体pHCMC04-sva和Pglv启动子的PCR产物琼脂糖凝胶电泳分析 Fig. 1 The agarose gel electrophoresis analysis of pHCMC04-sva DNA and Pglv promoter DNA |
将PCR产物胶回收后,用In-Fusion HD Cloning Kit连接,转入大肠杆菌E.coli DH5α,提取得到重组质粒pHCMC04-sva-Pglv,测序结果正确,得到该重组质粒。
2.1.2 pHCMC04-sva-Pglv-35的构建以重组质粒pHCMC04-sva-Pglv为模板,Cre-1、Cre-2为引物,对Cre序列进行定点突变,得到质粒pHCMC04-sva-Pglv-M1,启动子测序结果如图 2所示。经过软件分析打分,Pglv-M1的Sextama-35区为TTGTAA,分数为47分;将其中的TA突变为AC后,分数提高为66分。以pHCMC04-sva-Pglv-M1作为模板,35-1、35-2为引物对其进行定点突变,得到pHCMC04-sva-Pglv-35,琼脂糖凝胶检测和测序结果完全正确(图 3),表明pHCMC04-sva-Pglv-35构建成功。

|
| 图 2 启动子测序结果比对 Fig. 2 The comparison of the promoters sequencing results |

|
| 图 3 启动子测序结果比对 Fig. 3 The comparison of the promoters sequencing results |
2.2 高温淀粉酶sva粗酶活力的测定 2.2.1 最高粗酶活力时间的测定
由图 4可知,在发酵过程中,pHCMC04-sva-Pglv-M1和pHCMC04-sva-Pglv-35的粗酶活力最高点是在36 h处,分别为4.95 U/mL和6.32 U/mL,经改造后的启动子构建的质粒使菌体酶活力较改造前提高1.28倍。

|
| 图 4 重组菌的生长曲线与不同培养时间下的粗酶活力 Fig. 4 Growth cure of recombinant strain and the enzyme activity in different incubation time |
如图 5所示,二者的单位酶活力最高点仍出现在36 h处,分别为0.91 U/mL和1.19 U/mL,经改造后的启动子构建的质粒使菌体酶活力较改造前提高1.31倍。
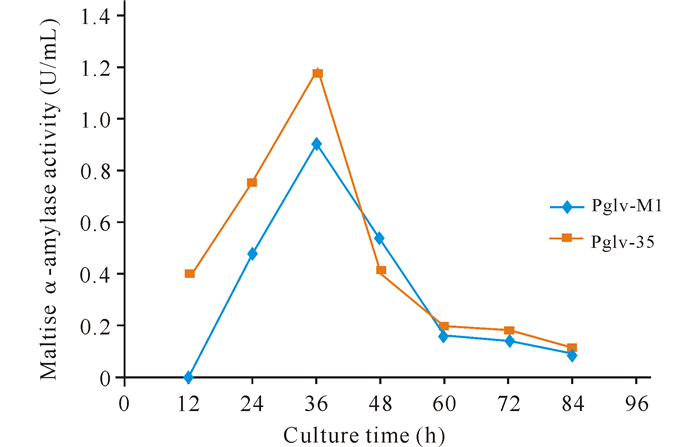
|
| 图 5 不同培养时间下重组菌的单位酶活 Fig. 5 The unit enzyme activity in different incubation time |
2.2.2 菌体分泌蛋白的确定
将分别含有重组质粒pHCMC04-sva-Pglv-M1、pHCMC04-sva-Pglv-35的重组菌和原始菌种B.subtilis 1A857的发酵液浓缩适当的倍数后进行SDS-PAGE分析,结果如图 6所示,在55 kDa附近有明显的条带,与sva淀粉酶蛋白质的分子量大小一致,说明启动子Pglv-M1与Pglv-35均成功表达了麦芽糖α-淀粉酶基因。

|
| M:Protein marker; 1:Total soluble proteins in B. subtilis 1A857 of pHCMC04-sva-Pglv-M1;2:Total soluble proteins in B. subtilis 1A857 of pHCMC04-sva-Pglv-35;CK:Total soluble proteins in B. subtilis 1A857 图 6 重组菌表达产物的SDS-PAGE电泳分析 Fig. 6 SDS-PAGE electrophoresis analysis of expression products for recombinant strain |
3 讨论
枯草芽孢杆菌表达系统具有非致病性、分泌表达等优点,比大肠杆菌表达系统更适合应用在食品医药行业[7]。缺点是枯草芽孢杆菌表达系统的基因表达能力较差。启动子作为调控基因表达的关键元件,可在转录水平上调控目的基因表达的时机与强度[8],因此得到更强的启动子十分关键。通过对启动子进行区段操作、易错PCR、定点突变、DNA shuffling和启动子串联[9]等改造方式,可以提高其启动能力。改变麦芽糖启动子的碳代谢调节蛋白CcpA的Cre结合序列,可以减弱葡萄糖代谢反馈抑制[10],提高转录水平。杨燕芳[11]通过串联两个启动子的关键位点,得到较之前提高1.2倍和1.6倍的启动子。
在前人改造的基础上[6],本研究再次改造诱导型启动子Pglv-M1,通过定点分析得到可能提高其启动能力的碱基,分别进行单次、多次的定点突变,通过报告基因的表达情况,分析比较启动子Pglv-M1改造前后启动能力的高低。通过把启动子Sextama-35区的TTGTAA序列突变为TTGACA,获得改造后的启动子Pglv-35。以pHCMC04为表达载体,以高温淀粉酶sva为报告基因,并在枯草芽孢杆菌B.subtilis 1A857中表达,使用DNS法测定每12 h发酵液的粗酶酶活力,比较分析启动子改造前后启动能力的高低。在发酵进行到36 h时,pHCMC04-sva-Pglv-M1和pHCMC04-sva-Pglv-35的粗酶活力最高,分别为4.95 U/mL和6.32 U/mL,经改造后的启动子构建的质粒载体使宿主菌表达的粗酶活力较改造前提高1.28倍。二者的单位酶活力最高点仍出现在36 h处,分别为0.91 U/mL和1.19 U/mL,经改造后的启动子构建的质粒使菌体酶活力较改造前提高1.31倍,成功实现了启动子Pglv的进一步正向改造,表明将启动子的核心保守序列进行突变,可能会带来正向影响。
| [1] |
熊海涛, 韦宇拓. 枯草芽孢杆菌表达系统及其启动子的研究进展[J]. 广西科学, 2018, 25(3): 233-241. |
| [2] |
BRON S, MEIJER W, HOLSAPPEL S, et al. Plasmid instability and molecular cloning in Bacillus subtilis[J]. Research in Microbiology, 1991, 142(7/8): 875-883. |
| [3] |
张晓舟.枯草杆菌新型表达系统和遗传操作体系的建立及应用[D].南京: 南京农业大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10307-2007010271.htm
|
| [4] |
王金斌, 陈大超, 李文, 等. 食品级枯草芽孢杆菌表达系统的最新研究进展[J]. 上海农业学报, 2014, 30(1): 115-120. DOI:10.3969/j.issn.1000-3924.2014.01.028 |
| [5] |
PHAN T T P, NGUYEN H D, SCHUMANN W. Development of a strong intracellular expression system for Bacillus subtilis by optimizing promoter elements[J]. Journal of Biotechnology, 2012, 157(1): 167-172. DOI:10.1016/j.jbiotec.2011.10.006 |
| [6] |
YANG M M, ZHANG W W, CHEN Y L, et al. Development of a Bacillus subtilis, expression system using the improved Pglv promoter[J]. Microbial Cell Factories, 2010, 9: 55. DOI:10.1186/1475-2859-9-55 |
| [7] |
RAO B, FAN J Y, SUN J A, et al. An auto-inducible expression system based on the RhlI-RhlR quorum-sensing regulon for recombinant protein production in E. coli[J]. Biotechnology and Bioprocess Engineering, 2016, 21(1): 160-168. DOI:10.1007/s12257-015-0507-0 |
| [8] |
王靖宇, 陈涛, 班睿, 等. 蜡样芽孢杆菌ATCC14579核黄素操纵子的克隆及在枯草芽孢杆菌中的表达[J]. 生物加工过程, 2004, 2(2): 68-73. DOI:10.3969/j.issn.1672-3678.2004.02.014 |
| [9] |
孙先花, 苏小运. 丝状真菌启动子的基因工程改造进展[J]. 广西科学, 2017, 24(1): 73-76. |
| [10] |
张云雁, 杨明明, 周煌凯, 等. 麦芽糖诱导耐碱性木聚糖酶基因在枯草芽孢杆菌中的表达[J]. 西北农业学报, 2011, 20(1): 14-17, 23. DOI:10.3969/j.issn.1004-1389.2011.01.003 |
| [11] |
杨燕芳.枯草芽孢杆菌启动子的克隆及功能分析[D].南宁: 广西大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10593-1017228466.htm
|



