含高浓度N、P的畜禽养殖废水是重大农业面源污染来源之一,严重威胁自然水体和土壤生态,造成水华暴发、水生生物死亡、土壤生产力恶化等问题[1]。传统的畜禽养殖废水处理工艺通常由过滤、厌氧发酵、好氧曝气、沉淀等工序组成[2],但是这样的工艺常常需要较高曝气耗能和较长的水力停留时间,而且N、P去除效果不稳定,直接影响工艺效果和排出水水质,是急需解决的突出问题。另一方面,N、P是可被植物高效吸收转化的重要营养元素,栽种植物因而已经发展成为一种降低畜禽养殖废水对环境影响的技术方法[3]。微藻是一类单细胞植物,相比陆生植物具有更高的光合作用效率、更高的碳氮磷利用效率,以及更高的细胞生长和物质合成速率[4]。一些微藻还能在细胞内积累大量的油脂,是重要的可再生能源原料[5]。近年来许多研究表明,利用畜禽养殖废水等有机废水可以低成本培养和收获微藻生物质,同时减少废水中的碳氮磷营养盐,减轻废水排放对环境的压力[6]。目前大部分研究主要用活性污泥法去除水体中的N、P。N的去除主要依靠活性污泥中硝化细菌的硝化和反硝化作用[7];磷酸盐的去除主要依靠噬磷菌在好氧阶段大量吸收P元素,并以富磷剩余污泥的形式被沉淀,从而带离水体,此过程需要强烈曝气,耗能巨大[8]。而利用微藻与活性污泥微生物共同作用,能耦合藻类生物质生产与废水净化,是当前的发展趋势。2018年,Ji等[9]表明悬浮小球藻(Chlorella vulgaris)和悬浮地衣芽孢杆菌(Bacillus licheniformis)共生培养体系在去除废水营养物的过程中存在相互促进的共生关系。2017年,Shen等[10]表明用共固定化的微藻和活性污泥处理废水效果最好,菌与藻显示出相互促进的共生关系。Mujtaba等[11]报道较低接种比例的悬浮微藻和活性污泥共生体系对N、P有较好的去除效果,在接种比例R=0.5(微藻:活性污泥,W:W)时显示出最佳的处理效果。目前大部分研究主要用悬浮污泥法或附着污泥法去除水体中的N、P,用固定化微藻和固定化污泥共培养技术,有望为处理畜禽养殖废水提供新的工艺参考和研究方向。因此,本研究建立不同比例的固定化小球藻和固定化活性污泥的共培养体系,以污水氨氮(NH4+-N)、总磷(TP)的处理效率为指标,与传统的悬浮污泥、悬浮小球藻、固定化污泥以及固定化小球藻等方法进行比较,通过方便地回收固定化的藻-菌共生体系进行重复批次操作,考察和评估技术方案的稳定性和可行性,为新工艺的探索提供参考。
1 材料与方法 1.1 藻-菌来源及培养小球藻(Chlorella sp.)分离自中国农业科学院水牛研究所的养殖废水Up-flow Anaerobic Sludge Bed/Blanket (USAB)工艺的出水沉淀池。藻种接入500 mL灭菌废水中,在30℃、130 r/min以及约5 000 Lux的光照强度下培养至稳定期后,转入2 L相同培养基中,在相同且无外部曝气条件下培养至稳定期,3 500 r/min、10 min离心富集藻细胞,去除上清液后用灭菌生理盐水清洗3次并重悬至所需体积备用, 为悬浮小球藻样品。
活性污泥采集于南宁中诺生物工程有限责任公司AB法污水处理工艺的好氧池,经过曝气培养驯化72 h后,3 500 r/min、10 min离心富集细胞,去除上清液后用灭菌生理盐水清洗3次并重悬至所需要体积备用,为悬浮污泥样品。
1.2 养殖废水本实验以进一步降低养殖废水处理工艺出水中的N、P元素,减轻其对环境的富营养化威胁为目标,因此选用的养殖废水为中国农业科学院水牛研究所USAB工艺出水沉淀池的真正废水,取回后于4℃冰箱保存待用。废水预处理:自然沉降,取上清液用100目滤布滤除大颗粒固体,再经过3 500 r/min,10 min离心收集上清液,最后用0.45 μm孔径whatman滤膜过滤并于121℃、20 min条件下灭菌,以去除生物类污染。经预处理后,废水的各项指标如下:化学需氧量(COD)为(677.35±117.00) mg/L,NH4+-N为(46.89±5.88) mg/L,总磷(TP)为(4.18±0.42) mg/L,pH值为8.92±0.16。
1.3 小球藻和活性污泥的包埋按de-Bashan等[12]的方法包埋小球藻和活性污泥。按实验设计量取重悬在灭菌生理盐水中的小球藻和活性污泥转入500 mL、2%(W/V)海藻酸钠溶液(室温条件下)中搅拌15 min,用蠕动泵缓缓滴加至2%(W/V)的CaCl2溶液中,并控制所形成的小球直径约为4 mm,最后用磁力搅拌器在120 r/min下固定至少1 h,捞出小球用无菌生理盐水冲洗3次,置于灭菌实验废水中,4℃保存待用。
1.4 实验设计选用5组不同培养系统,研究其去除畜禽养殖废水中污染物的能力:悬浮污泥、悬浮小球藻、固定化活性污泥、固定化小球藻,以及不同浓度比例R(固定化污泥/固定化小球藻)的小球藻和活性污泥共固定化体系。
各实验组不同体系的初始组成如表 1所示。在含有500 mL预处理废水的1 000 mL锥形瓶中接入相应活性污泥或小球藻,在30℃、130 r/min、不曝气、光照强度约5 000 Lux条件下培养3 d,每12 h取出30 mL水样与5粒泥珠或藻珠,进行分析。
| 处理体系 Treatment system |
接种比例 Inoculum ratio (R) |
活性污泥 Activated sludge (g/L) |
小球藻 Chlorella vulgaris(g/L) |
| 空白 Control |
— | — | — |
| 悬浮污泥 Activated sludge |
— | 0.4 | — |
| 悬浮小球藻 C.vulgaris |
— | — | 0.4 |
| 固定化污泥 Immobilized sludge |
— | 0.4 | — |
| 固定化小球藻 Immobilized Chlorella |
— | — | 0.4 |
| 共培养 Co-culture |
5 | 0.333 | 0.067 |
| 3 | 0.3 | 0.1 | |
| 1 | 0.2 | 0.2 | |
| 1/3 | 0.1 | 0.3 | |
| 1/5 | 0.067 | 0.333 |
1.5 分析方法
NH4+-N用纳氏试剂法,总磷(TP)用钼酸铵法测定。
悬浮小球藻测定(OD680):悬浮藻液摇匀后取5 mL于5 000 r/min、5 min离心收集细胞,加入5 mL纯水,充分摇匀后于680 nm处测定其吸光度A680。
小球藻干重测定(DCW):预先烘干0.45 μm孔径的滤膜并称重(m1),过滤5 mL悬浮小球藻后置于80℃下烘干4 h称重(m2),则(m2—m1)为小球藻干重。建立小球藻干重(DCW)与A680(OD)的对应曲线:A680=1.211 5x-0.004,R2=0.999。
固定化小球藻测定:取5粒固定化藻球,加入2 mL柠檬酸钠溶液(4%,W/V)充分溶解,其他操作同测定悬浮小球藻方法,用A680间接反映微藻生物量变化[13]。
悬浮污泥含量测定:悬浮污泥摇匀后取5 mL于5 000 r/min、5 min离心收集细胞,加入5 mL纯水清洗2次,再用预先已烘干称重的0.45 μm滤膜过滤,然后在80℃下烘干4 h并称重,计算膜过滤前后的质量差。
固定化污泥含量测定:取5粒固定化污泥,加入2 mL柠檬酸钠(4%,W/V)溶解,测定方法同悬浮污泥。
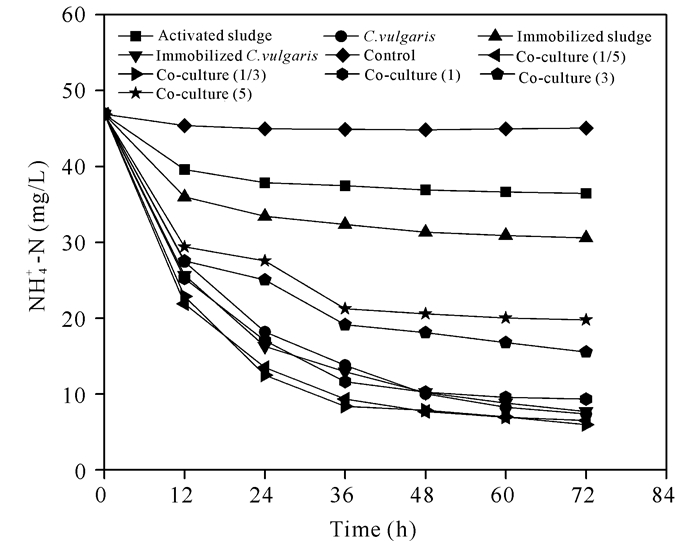
2 结果与分析 2.1 不同体系对NH4+-N的去除由图 1可知,空白对照组NH4+-N略有下降后保持不变;悬浮污泥体系的NH4+-N在2 d中被去除21.3%,之后缓慢降低;固定化污泥的NH4+-N去除效率略优于悬浮污泥。结果表明,海藻酸钠小球能吸附少量NH4+-N,活性污泥无论是否固定均与现有工艺效果相似,NH4+-N吸收效果不够理想。
|
| 图 1 不同废水处理体系的NH4+-N Fig. 1 The NH4+-N in different wastewater systems |
而所有加入小球藻的体系,无论是否被包埋,对NH4+-N的吸收率都高于不含藻的污泥处理组,表明小球藻在吸收NH4+-N方面起主要作用[14]。固定化小球藻对NH4+-N的去除效果优于悬浮小球藻,这一结果表明,包埋工艺提高微生物的相对浓度,进而提高摄取NH4+-N的速率和去除效果[11, 15]。此外,多种微生物共同固定在有限空间内,能提高小球藻或活性污泥微生物与O2、CO2等代谢物质接触并吸收利用的几率,促进细胞生长和繁殖。
另外,在NH4+-N摄取趋势方面,固定化小球藻和固定化共培养体系表现相似,即在36 h前NH4+-N去除速率较大,之后变缓。总体上,随着接种比例R值增大(活性污泥增加),NH4+-N去除率呈现逐步下降趋势,R较低时体系含有相对多的小球藻,降解NH4+-N能力更强。其中,当R=1/3和R=1/5得到最大的降解速率,培养36 h分别降解约83.6%和83.2%的NH4+-N,大约是悬浮污泥的4倍或固定化污泥的2.5倍,也高于不含活性污泥的微藻体系,表明加入一定浓度的固定化污泥后,藻-菌之间存在促进NH4+-N摄取的效应[16]。但随着R值逐渐升高,活性污泥浓度升高后共培养体系摄取NH4+-N能力低于单独使用小球藻的体系,其中当R=5时,NH4+-N去除率比悬浮小球藻低22.5%,但仍比悬浮污泥高34.8%,表明加入微藻的体系去除NH4+-N的能力还是优于单纯的活性污泥体系,并再次证明藻类在摄取NH4+-N方面起主要作用。
在传统污水处理工艺中,通常需要大量耗能进行强烈曝气或剧烈搅拌,促使好氧菌将NH4+-N氧化为NO2-和NO3-,或在高pH值条件下促使NH4+-N被气提去除[17]。而图 1所示的结果是在没有曝气和剧烈搅拌(仅130 r/min下摇动)下取得的,因此气提脱除、活性污泥摄取与氧化NH4+-N的水平较低,都不是主要除氨机制。
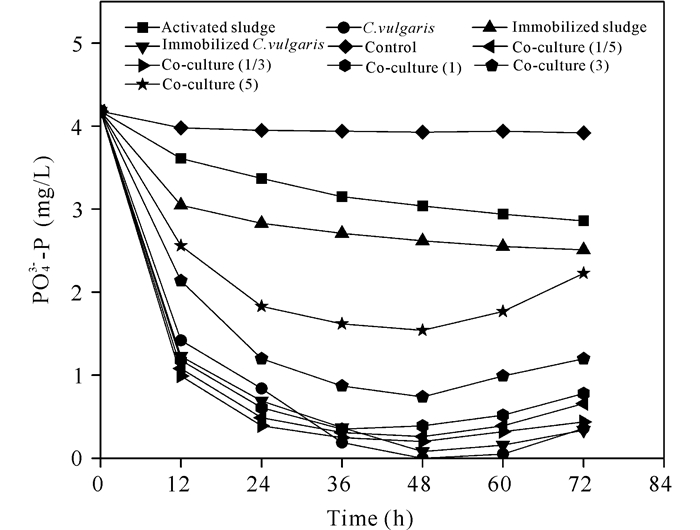
2.2 不同体系对磷酸盐的去除如图 2所示,悬浮污泥体系在24 h去除19.4%的PO43--P,然后PO43--P下降程度趋缓;固定化污泥表现相似,但24 h的PO43--P去除率略高,为35.1%;与单纯的污泥体系相比,悬浮小球藻、固定化小球藻、固定化共培养体系对PO43--P的摄取量更大,在5种共培养体系中,R=1/3和1/5时PO43--P去除率最高,36 h分别去除95.1%和93.7%的PO43--P,这表明高细胞密度和适当藻-菌比例可能更有利于去除PO43--P。
|
| 图 2 不同废水处理体系的PO43--P Fig. 2 The PO43--P in different wastewater systems |
与活性污泥体系相比,小球藻体系展现出较好的去除PO43--P性能,固定化小球藻前24 h的PO43--P去除率为88.6%,高于悬浮小球藻,但之后的去除率低于悬浮小球藻体系。这表明在共培养体系中,微藻是PO43--P去除率的主要贡献者。
所有体系在最初的12 h内都表现出较快摄取PO43--P的趋势,之后去除率逐渐降低,甚至共培养体系在48 h后出现PO43--P去除率降低、浓度升高的情况。这与处理体系环境(如溶解氧和pH值)变化,及固定化体系的传质限制及对细胞生长的空间限制有关。
2.3 不同体系中生物量的变化图 3为不同处理体系中小球藻初始生物量全部拟合为0.4 g/L后得到的小球藻生物量变化。R=3和R=5的共培养体系在最初12 h内小球藻生物量略减少,然后缓慢增加,72 h时生长率分别为11.3%和7.5%。R值逐渐增大时小球藻浓度降低,灰色污泥增加,减弱了小球藻的光照强度,导致固定化小球藻生长受限,生物量增长不明显。尽管固定化体系在培养初期具有更高的小球藻生物量浓度,被包埋的N、P等元素也能提供浓度较高的营养物质,帮助小球藻的生长,但是36 h后固定化小球藻的生物量浓度低于悬浮小球藻,光照受限使处于体系内部的小球藻不能光合作用,进而限制细胞增殖,结果导致固定化小球藻整体浓度低于悬浮小球藻[18]。

|
| 图 3 不同废水处理体系中小球藻生物量 Fig. 3 Biomass of Chlorella in different wastewater systems |
当R值较低时,共培养体系小球藻的生物量高于悬浮小球藻和固定小球藻,表明接种少量污泥能促进藻细胞对废水中N、P的有效利用,显著提高藻类的生物量。R=1/5和R=1/3的共培养体系72 h的生长率分别为29.3%和34%。
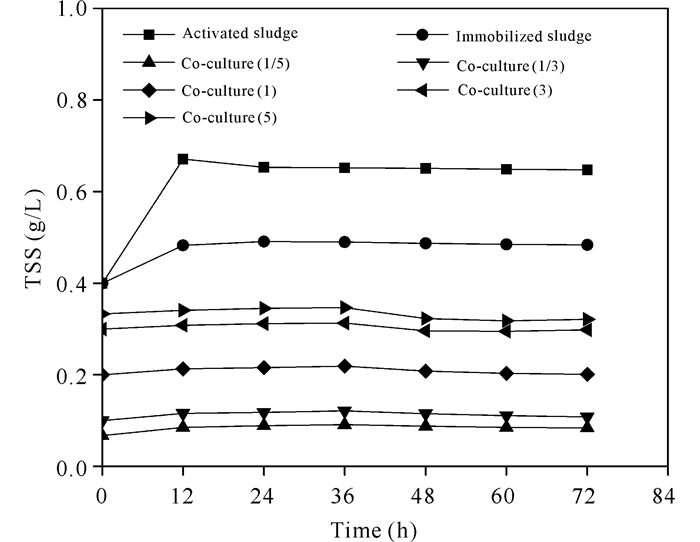
由图 4可知,固定化和悬浮活性污泥浓度在初始12 h内先增加,之后趋于平衡,这与前12 h内体系含有较多溶解氧(DO)支持好氧菌代谢增殖的趋势一致(图 5a);12 h后DO水平逐渐降低,好氧菌代谢受到抑制,增殖变慢;共培养体系中活性污泥浓度整体上均趋于平衡状态,并在36 h后开始下降,这可能与体系中碳源已经下降到不能继续支持菌代谢增殖有关[19],这一趋势与城市污水处理36 h后活性污泥浓度下降的现象相似。
|
| 图 4 不同废水处理体系中活性污泥的浓度 Fig. 4 Concentration of activated sludge in different wastewater systems |
|
| 图 5 不同处理体系中DO、pH值的变化 Fig. 5 Changes of DO and pH in different treatment systems |
经过海藻酸盐包埋,传质和空间的限制影响研究体系中活性污泥和小球藻细胞数量的增加,尤其是小球藻生物量的增长对NH4+-N、PO43--P的去除效果有更为突出的影响。
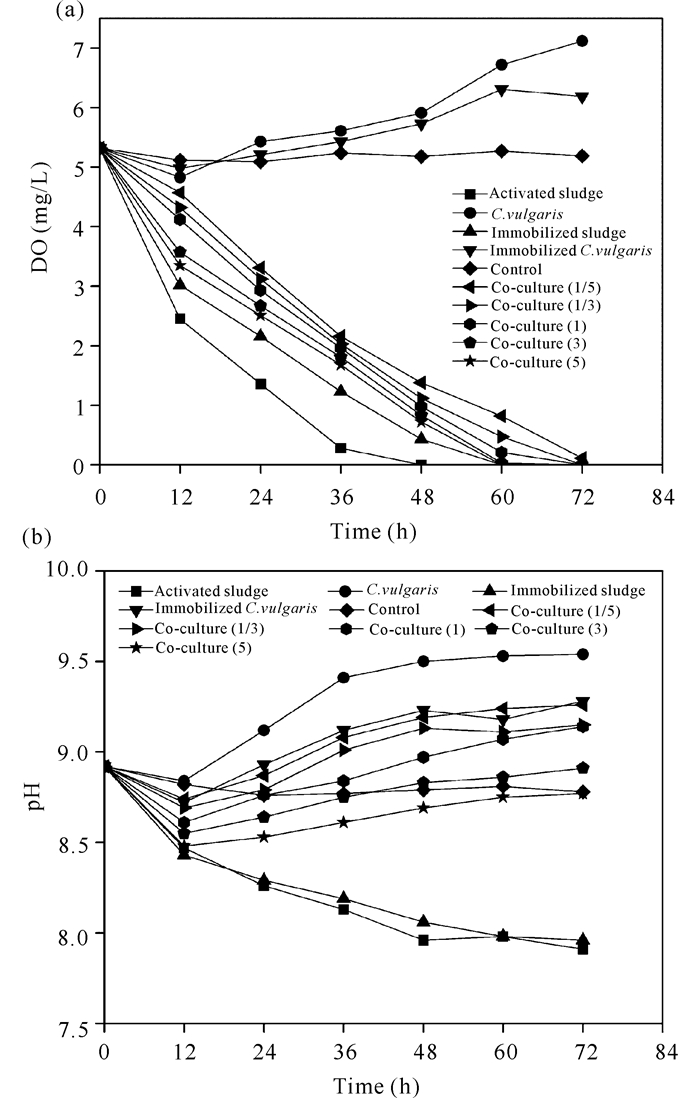
2.4 不同体系溶解氧和pH值的变化如图 5a所示,除悬浮小球藻、固定化小球藻和空白对照组外,其他所有体系的溶解氧均逐步降低,并处于较低水平,并在72 h处全部消耗完。悬浮污泥体系的DO在48 h降至0;而悬浮小球藻和固定化小球藻体系的DO在开始12 h内缓慢下降,12 h后逐步上升,说明小球藻光合作用产生O2为共培养体系提供DO,但随着R值由1/5变化为5,共培养体系中的小球藻含量逐渐减少,共培养体系的DO也随R值增大而减小(图 5a)。在12 h内,各体系的pH值均下降(图 5b),表明存在活性污泥细菌厌氧分解有机物产生有机酸使pH值下降的过程;另一方面,小球藻在摄取NH4+-N过程中释放H+也会降低体系pH值[20]。12 h后,小球藻体系和共培养体系的pH值由于微藻光合作用消耗CO2而逐渐升高。但最高pH值仍小于10,不足以促进PO43--P与Ca2+形成沉淀[21-22]。因为没有额外曝气和提升pH值,使活性污泥中优势异养微生物的硝化或反硝化作用较弱,不足以成为降解NH4+-N的主要机制。气提也不是主要去除氨氮的机制,所以本研究表明小球藻生物摄取利用是增加NH4+-N、PO43--P去除效果的主要途径(图 1~2)。
2.5 共培养体系稳定性通过重复3个循环批次来研究最佳固定化污泥和固定化小球藻共培养体系(R=1/3)的稳定性。在第一批次处理结束后,滤出处理后的上清液,并补充500 mL新鲜灭菌畜禽养殖废水,重复操作两次,每个批次测定2 d,结果如图 6所示。在3个批次中,NH4+-N去除率为80.11%~83.2%,PO43--P去除率为91.38%~ 95.22%。对3个批次进行按时间顺序进行连续性拟合,拟合后的固定化小球藻增长量逐渐升高,生长率为31.5%~38%。整体上,在3个循环批次中N、P去除率变化不大,增长率也逐渐趋于平稳,表明在处理或资源化利用处理后的畜禽养殖废水中,共培养体系表现具有一定的稳定性。

|
| 图 6 共培养体系(R=1/3)在半连续模式下N、P和小球藻的变化 Fig. 6 Changes in N/P and Chlorella in co-cultured system (R=1/3) under semi-continuous mode |
3 结论
较低接种比例的固定化污泥/固定化小球藻的共培养系统显示出对N、P较好的去除效率,48 h后NH4+-N最大去除率为83.6%(R=1/5),PO43--P最大去除率为95.1%(R=1/3);微藻在共培养体系中是N、P去除率的主要贡献者,生物摄取是其主要去除途径。
共培养体系中微藻/活性污泥比例影响体系的总体效率,总体上与藻细胞浓度以及藻所接受的有效光照成正相关关系。过高浓度的活性污泥对微藻生长并没有促进作用,而在较低接种比例时,体系中的活性污泥降解废水中有机物和无机物,释放CO2及其他碳氮磷、无机盐等微藻需要的营养物质,而较少数量的微生物也较少地消耗这些物质,结果有更多的营养物质促进了藻细胞的生长增殖。
在最佳接种比例R=1/3的条件下,半连续批次处理模式下可获得稳定的NH4+-N、PO43--P去除率,整体上有助于进一步降低畜禽养殖废水处理装置排出水的N、P元素含量,提升处理效果,减轻环境压力。本研究仍需针对不同废水开展更多工作,以完善工艺,推动菌-藻共培养体系在处理真实畜禽养殖废水、居民生活废水等有机废水中的应用。
| [1] |
龚诣, 吴洁, 苏衍菁, 等. 规模化奶牛场废水处理技术研究进展[J]. 中国奶牛, 2018(8): 64-67. |
| [2] |
李大荣, 叶姜瑜, 杨平, 等. 畜禽养殖废水处理现状研究——以渝北区某养猪场为例[J]. 环境影响评价, 2018, 40(4): 80-84. |
| [3] |
张郁婷.水生植物对养殖废水处理效果比较研究[D].长沙: 中南林业科技大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10538-1018134920.htm
|
| [4] |
吴晓莉.人工湿地植物筛选及其对畜禽养殖废水的净化研究[D].雅安: 四川农业大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1800702
|
| [5] |
宋瑞雪. 能源微藻的应用[J]. 生物化工, 2018, 4(4): 132-133, 136. DOI:10.3969/j.issn.2096-0387.2018.04.039 |
| [6] |
刘艺琳, 陈弘培, 龚世禹, 等. 微藻油的提取与功能研究进展[J]. 食品工业科技, 2019, 40(5): 333-337, 342. |
| [7] |
吕锡武, 李峰, 稻森悠平, 等. 氨氮废水处理过程中的好氧反硝化研究[J]. 给水排水, 2000, 26(4): 17-20. |
| [8] |
韩云婷, 王拯, 方晓航, 等. 改性给水污泥对高磷酸盐废水的吸附研究[J]. 环境工程学报, 2011, 5(4): 772-776. |
| [9] |
JI X, JING M, ZHANG J, et al. The interactions of algae-bacteria symbiotic system and its effects on nutrients removal from synthetic wastewater[J]. Bioresource Technology, 2018, 247: 44-50. DOI:10.1016/j.biortech.2017.09.074 |
| [10] |
SHEN Y, GAO J, LI L. Municipal wastewater treatment via co-immobilized microalgal-bacterial symbiosis:Microorganism growth and nutrients removal[J]. Bioresource Technology, 2017, 243: 905-913. DOI:10.1016/j.biortech.2017.07.041 |
| [11] |
MUJTABA G, LEE K. Treatment of real wastewater using co-culture of immobilized Chlorella vulgaris and suspended activated sludge[J]. Water Research, 2017, 120: 174-184. DOI:10.1016/j.watres.2017.04.078 |
| [12] |
DE-BASHAN L E, HERNANDEZ J P, MOREY T, et al. Microalgae growth promoting bacteria as "helpers" for microalgae:A novel approach for removing ammonium and phosphorus from municipal wastewater[J]. Water Research, 2004, 38(2): 466-474. DOI:10.1016/j.watres.2003.09.022 |
| [13] |
何淑雯, 于菲, 刘玉, 等. 广州市谷河黑臭评价及其与裸藻丰度和生物量相关性分析[J]. 环境科学学报, 2019, 39(3): 696-705. |
| [14] |
MUJTABA G, RIZWAN M, KIM G, et al. Removal of nutrients and COD through co-culturing activated sludge and immobilized Chlorella vulgaris[J]. Chemical Engineering Journal, 2018, 343: 155-162. DOI:10.1016/j.cej.2018.03.007 |
| [15] |
ZHU L, WANG Z, SHU Q, et al. Nutrient removal and biodiesel production by integration of freshwater algae cultivation with piggery wastewater treatment[J]. Water Research, 2013, 47(13): 4294-4302. DOI:10.1016/j.watres.2013.05.004 |
| [16] |
MUJTABA G, LEE K. Advanced treatment of waste-water using symbiotic co-culture of microalgae and bacteria[J]. Journal of the Korean Industrial and Engineering Chemistry, 2016, 27(1): 1-9. |
| [17] |
牟帅, 梁大伟, 姜海波. 气提脱氨处理工艺在高氨氮污水处理中的应用[J]. 地下水, 2018, 40(5): 77-78. DOI:10.3969/j.issn.1004-1184.2018.05.028 |
| [18] |
DE-BASHAN L E, MORENO M, HERNANDEZ J P, et al. Removal of ammonium and phosphorus ions from synthetic wastewater by the microalgae Chlorella vulgaris coimmobilized in alginate beads with the microalgae growth-promoting bacterium Azospirillum brasilense[J]. Water Research, 2002, 36(12): 2941-2948. DOI:10.1016/S0043-1354(01)00522-X |
| [19] |
RUIZ-MARTINEZ A, GARCIA N M, ROMERO I, et al. Microalgae cultivation in wastewater:Nutrient removal from anaerobic membrane bioreactor effluent[J]. Bioresource Technology, 2012, 126: 247-253. DOI:10.1016/j.biortech.2012.09.022 |
| [20] |
王旭阳, 赵乐军. 水解酸化在城市综合废水处理应用中的小试研究[J]. 山西建筑, 2018, 44(29): 136-137. DOI:10.3969/j.issn.1009-6825.2018.29.075 |
| [21] |
贾丹, 李卓然, 钟志国. pH对新型后置反硝化系统生物脱氮除磷的影响[J]. 水处理技术, 2018, 44(5): 79-83. |
| [22] |
陈文玲, 王如意, 李咏梅. 富磷污泥厌氧发酵过程中乙酸浓度对磷释放的影响[J]. 中国环境科学, 2015, 35(6): 1763-1770. DOI:10.3969/j.issn.1000-6923.2015.06.020 |



