2. 广西友谊关森林生态系统定位观测研究站, 广西凭祥 532600
2. Guangxi Youyiguan Forest Ecosystem Research Station, Pingxiang, Guangxi, 532600, China
生物安全和土壤安全是当今国际生态学和土壤学研究的前沿和热点[1-3],桉树连栽对生物安全和土壤安全的影响备受关注[4],深入研究桉树高代次连栽对林下植物、土壤肥力和酶活性的影响对科学了解桉树人工林的生态环境压力,防范外来植物入侵风险和土壤质量退化,保持桉树人工林的可持续经营意义重大。目前关于桉树连栽对生态环境的影响研究已有很多报道。例如,余雪标等[5]采用空间代替时间的方法对连栽1~4代的桉树林分的植物多样性进行比较研究,发现连栽使植物多样性显著减少;温远光等[6-7]对东门林场连栽1~3代的桉树林分的植物多样性开展研究,也证明连栽导致植物的物种丰富度显著降低,但植物多样性指数无显著差异;还有许多学者只是对第一代桉树人工林的植物多样性开展研究[8-12]。温远光[13]对东门林场1~2代桉树人工林土壤理化特性进行了比较研究;王纪杰[14]研究了桉树人工林土壤质量的变化;不少学者对桉树人工林土壤微生物群落组成和酶活性等开展研究[15-17]。但是,关于桉树人工林高代次连栽背景下,植物多样性、土壤肥力和土壤酶活性的整合研究并不深入,急需加强这方面的研究。本研究以空间代替时间的方法,以桉树低代次(第1~2代,Eucalytus plantations in rotations 1 and 2, EP12)、中代次(第3~4代,Eucalytus plantations in rotations 3 and 4, EP34)和高代次(第5~6代,Eucalytus plantations in rotations 5 and 6, EP56)连栽林分为对象,通过多因子、大尺度、跨区域、高代次的观测研究,深入揭示桉树连栽对林下植物、土壤肥力和土壤酶活性的影响及内在机制,阐明桉树高代次连栽对植物多样性、土壤肥力、土壤酶活性等的影响规律及作用机制。
1 材料与方法 1.1 研究区概况研究区位于广东省(3°28′~25°31′N,108°13′~119°59′E)雷州、肇庆、清远三地的主要桉树种植区。该区域属于典型的亚热带季风气候,热量充足,1月平均气温13℃,7月为28℃,雨量充沛,年平均降水量1 500~2 000 mm。受地壳运动、岩性、褶皱和断裂构造以及外力作用的综合影响,广东省地貌类型复杂多样。研究区域以滨海台地和丘陵为主,并由雷州的滨海台地向清远丘陵逐渐变化;土壤多为砖红壤和赤红壤,地带性植被类型属亚热带季雨林和季风常绿阔叶林,桉树人工林面积1.35×104 hm2,仅次于广西,居全国第二位[18]。
1.2 实验设计与取样在对研究区域的桉树人工林进行全面踏查的基础上,在每一个区域,选择立地条件相似,经营措施一致,桉树林龄在4 a生左右,近一年来已无施肥、除草抚育等人为干扰,且同时存在1或2代(EP12)、3或4代(EP34)、5或6代(EP56)3类不同连栽代次的林分。在选定的不同连栽代次林分中随机设置9个20 m ×20 m样地,3个区域共有81个样地(3×9×3=81)。
在每个20 m ×20 m样地中随机设置3个5 m×5 m的小样方,用于调查林下植物种类、数量及盖度。在距离样地中心9~10 m处,按“米”字形每隔45°设置一个采样点,共9个采样点,用内径为8.5 cm的不锈钢土钻采集0~10 cm土层的土样,制成混合土样后过2 mm孔径筛,将样品分为2份,一份风干用于测定土壤理化性质,另一份冷藏于4℃冰箱用于土壤酶活性测定。
1.3 样品分析土壤全氮含量采用连续流动分析仪(AA3, Bran Luebbe公司)测定;土壤全磷含量采用氢氧化钠碱熔-钼锑抗比色法测定;土壤全钾含量采用氢氧化钠碱熔-火焰光度计法测定;土壤速效钾含量用乙酸铵浸提-火焰光度计法测定;土壤速效磷含量用双酸浸提-钼锑抗比色法测定;土壤有机质含量采用重铬酸钾氧化-外加热法测定[19]。
通过测定土壤氧化还原酶类(过氧化物酶、酚氧化酶)及水解酶类(β-1, 4-葡萄糖苷酶和N-乙酰-β-氨基-葡萄糖苷酶、脲酶、磷酸酶)的活性来评价土壤微生物功能[20]。过氧化物酶活性和酚氧化酶采用左旋多巴胺(L-DOPA)为底物进行测定[21]。β-1, 4-葡萄糖苷酶和N-乙酰-β-氨基葡萄糖苷酶活性采用对硝基苯乙酰基氨基葡萄糖苷(p-Nitrophenyl-N-acetyl-β-glucosaminide,NAG)为底物进行测定[22-23]。酸性磷酸酶以对-硝基酚磷酸钠为底物进行测定。
1.4 数据统计分析采用单因素方差分析(one-way ANOVA)检验不同连载代次间林下植物多样性、土壤肥力及土壤酶活性的差异显著性,采用LSD法进行多重比较;采用Pearsom相关分析进行林下植物多样性、土壤肥力与土壤酶活性间的关联分析,以上分析采用SPSS 19.0(SPSS,Inc,Chicago,IL)运行,显著性水平设置为P < 0.05。数据绘图由Sigmaplot 11.0软件完成。
林下植物重要值(Importance value, Ⅳ)计算公式为:Ⅳ=相对盖度+相对密度+相对频度。
相对盖度=(样方内某个种的盖度/所有种的总盖度)×100%;
相对密度=(样方内某个种的株数/所有种的总株数)×100%;
相对频度=(样方内某个种出现的次数/所有种出现的总次数)×100%。
物种丰富度指数为样地内出现的物种数。
香农威纳(Shannon-Wiener)指数[24]:
| $ H=-\sum\limits_{i=1}^{S} p_{i} \ln p_{i}, $ |
Pielou均匀度指数[25]:
式中,S是样地出现的物种数,
计算群落谱系多样性指数时,首先根据所有样地物种的名录,基于被子植物分类系统APGⅢ利用在线软件Phylomatic (Version 3, http://phylodiversity.net/phylomatic/)构建具有进化枝长度的谱系树[26-27],利用PhyloCom 4.2的bladj模块计算群落的谱系多样性指数[28-29]。
2 结果与分析 2.1 不同连栽代数桉树人工林林下植物种类和功能群组成研究表明,随着连栽代数的增加,林下植物种类和功能群组成均发生显著变化(表 1)。从表 1可以看出,EP12林下以乡土木本植物种类和功能群为主,以红背山麻杆、木姜子和白背叶为共优势种,乡土木本植物功能群的重要值占67.46%,乡土草本植物功能群占26.37%,入侵植物功能群只占6.17%;在EP34林分中,乡土木本植物种类显著减少,其功能群的重要值只占12.70%,乡土草本植物小花露籽草和蔓生莠竹占绝对优势,乡土草本植物功能群的重要值占78.69%,入侵植物种类和功能群的比例有所增加,其重要值占8.94%;进入EP56高连栽代数林分,入侵植物鬼针草、飞机草和阔叶丰花草占明显优势,入侵植物功能群的重要值占86.25%,乡土木本植物和草本植物功能群的比例显著降低,分别为6.66%和7.10%。
| 植物功能群 Plant functional groups |
物种 Plant species |
拉丁名 Species latin name |
重要值Important value | ||
| EP12 | EP34 | EP56 | |||
| 乡土木本植物功能群 Native woody plant functional groups |
红背山麻杆 | Alchornea trewioides | 50.36 | 2.82 | 1.74 |
| 木姜子 | Litsea pungens | 42.31 | 4.40 | 4.15 | |
| 白背叶 | Mallotus apelta | 23.79 | 2.41 | 2.12 | |
| 大青 | Clerodendrum cyrtophyllum | 7.21 | 8.75 | 1.77 | |
| 车桑子 | Dodonaea viscosa | 7.09 | 1.13 | - | |
| 野牡丹 | Melastoma candidum | 6.46 | 4.75 | 2.13 | |
| 女贞 | Ligustrum lucidum | 4.62 | - | - | |
| 破布叶 | Microcos paniculata | 4.46 | - | - | |
| 方叶五月茶 | Antidesma ghaesembilla | 3.84 | 0.55 | - | |
| 细叶黄皮 | Clausena anisum-olens | 3.71 | - | - | |
| 秤星树 | Ilex asprella | 3.69 | - | - | |
| 大花菟丝子 | Cuscuta reflexa | 3.49 | - | - | |
| 三桠苦 | Melicope pteleifolia | 2.50 | 0.47 | - | |
| 酸藤子 | Embelia laeta | 2.48 | - | - | |
| 潺槁木姜子 | Litsea glutinosa | 2.42 | - | - | |
| 素馨花 | Jasminum grandiflorum | 2.36 | - | - | |
| 玉叶金花 | Mussaenda pubescens | 2.18 | 1.67 | - | |
| 山油麻 | Trema cannabina var.dielsiana | 2.06 | 1.02 | 0.76 | |
| 土密树 | Bridelia tomentosa | 1.99 | - | - | |
| 羊角拗 | Strophanthus divaricatus | 1.99 | - | - | |
| 粗叶悬钩子 | Rubus alceaefolius | 1.87 | - | - | |
| 白花酸藤果 | Embelia ribes | 1.79 | - | - | |
| 鹅掌柴 | Schefflera octophylla | 1.67 | - | - | |
| 厚叶算盘子 | Glochidion hirsutum | 1.41 | - | - | |
| 野漆 | Toxicodendron succedaneum | 1.23 | - | - | |
| 黑面神 | Breynia fruticosa | 1.12 | - | - | |
| 黄牛木 | Cratoxylum cochinchinense | 0.98 | - | - | |
| 水茄 | Solanum torvum | 0.96 | - | - | |
| 簕欓花椒 | Zanthoxylum avicennae | 0.86 | - | - | |
| 两面针 | Zanthoxylum nitidum | 0.85 | - | - | |
| 土茯苓 | Smilax glabra | 0.85 | 0.37 | - | |
| 高粱泡 | Rubus lambertianus | 0.72 | - | 0.72 | |
| 木竹子 | Garcinia multiflora | 0.57 | - | - | |
| 构树 | Broussonetia papyrifera | 0.56 | - | - | |
| 铁仔 | Myrsine africana | 0.55 | - | - | |
| 南方荚蒾 | Viburnum fordiae | 0.49 | 0.56 | - | |
| 酒饼簕 | Atalantia buxifolia | 0.47 | - | - | |
| 光荚含羞草 | Mimosa bimucronata | 0.46 | - | 1.44 | |
| 野牡丹 | Melastoma malabathricum | 0.44 | 0.37 | - | |
| 石岩枫 | Mallotus repandus | 0.43 | - | - | |
| 对叶榕 | Ficus hispida | 0.43 | 1.15 | - | |
| 鸡矢藤 | Paederia foetida | 0.43 | - | 0.72 | |
| 剑叶山芝麻 | Helicteres lanceolata | 0.41 | - | - | |
| 毛麻楝 | Chukrasia tabularis var.velutina | 0.41 | - | - | |
| 细圆藤 | Pericampylus glaucus | 0.40 | - | - | |
| 桃金娘 | Rhodomyrtus tomentosa | 0.40 | - | - | |
| 华南毛柃 | Eurya ciliata | 0.36 | 0.37 | - | |
| 盐肤木 | Rhus chinensis | 0.35 | 1.86 | - | |
| 舶梨榕 | Ficus pyriformis | 0.35 | - | - | |
| 菝葜 | Smilax china | 0.33 | 0.55 | - | |
| 舞草 | Codariocalyx motorius | 0.33 | - | - | |
| 美丽胡枝子 | Lespedeza thunbergii subsp. formosa | 0.31 | - | - | |
| 中华黄花稔 | Sida chinensis | 0.30 | - | 0.58 | |
| 楤木 | Aralia elata | 0.29 | - | - | |
| 海通 | Clerodendrum mandarinorum | - | 1.73 | - | |
| 葛 | Pueraria lobata | - | 1.72 | - | |
| 杜茎山 | Maesa japonica | - | 0.58 | - | |
| 楝 | Melia azedarach | - | 0.51 | - | |
| 赪桐 | Clerodendrum japonicum | - | 0.57 | - | |
| 叶下珠 | Phyllanthus urinaria | - | - | 1.76 | |
| 木莓 | Rubus swinhoei | - | - | 0.64 | |
| 赛葵 | Malvastrum coromandelianum | - | - | 0.72 | |
| 粗叶榕 | Ficus hirta | - | - | 0.72 | |
| 乡土草本植物功能群 Native herbaceous functional groups |
小花露籽草 | Ottochloa nodosa var.micrantha | 30.25 | 138.05 | 2.10 |
| 鸭舌草 | Monochoria vaginalis | 7.13 | - | 0.73 | |
| 高秆珍珠茅 | Scleria terrestris | 6.38 | 0.37 | - | |
| 海金沙 | Lygodium japonicum | 5.81 | 1.40 | - | |
| 圆果雀稗 | Paspalum orbiculare | 5.34 | 0.58 | 2.13 | |
| 山菅 | Dianella ensifolia | 5.17 | 3.57 | - | |
| 姬蕨 | Hypolepis punctata | 4.98 | 10.50 | 7.20 | |
| 蔓生莠竹 | Microstegium vagans | 3.87 | 69.03 | - | |
| 火炭母 | Polygonum chinense | 2.34 | 1.08 | 2.83 | |
| 五节芒 | Miscanthus floridulus | 2.14 | 1.34 | 1.40 | |
| 半边旗 | Pteris semipinnata | 1.65 | 0.37 | 0.76 | |
| 白茅 | Imperata cylindrica | 0.92 | 0.58 | - | |
| 扭鞘香茅 | Cymbopogon tortilis | 0.58 | - | - | |
| 荩草 | Arthraxon hispidus | 0.50 | 0.83 | - | |
| 扇叶铁线蕨 | Adiantum flabellulatum | 0.49 | - | - | |
| 粽叶芦 | Thysanolaena maxima | 0.46 | - | - | |
| 艳山姜 | Alpinia zerumbet | - | 0.55 | - | |
| 杠板归 | Polygonum perfoliatum | 0.39 | - | - | |
| 淡竹叶 | Lophatherum gracile | 0.39 | - | - | |
| 乌毛蕨 | Blechnopsis orientalis | 0.31 | 6.01 | 0.68 | |
| 一点红 | Emilia sonchifolia | - | 0.73 | 1.03 | |
| 黑莎草 | Gahnia tristis | - | 0.64 | - | |
| 铁芒萁 | Dicranopteris linearis | - | 0.45 | - | |
| 苦荬菜 | Ixeris polycephala | - | - | 1.26 | |
| 十字马唐 | Digitaria cruciata | - | - | 0.60 | |
| 华南毛蕨 | Cyclosorus parasiticus | - | - | 0.58 | |
| 入侵植物功能群 Invasive plant functional groups |
地桃花 | Urena lobata | 6.70 | 9.89 | 14.01 |
| 鬼针草 | Bidens pilosa | 5.69 | - | 111.71 | |
| 飞机草 | Eupatorium odoratum | 4.64 | 3.02 | 48.34 | |
| 假臭草 | Praxelis clematidea | 1.10 | 5.52 | 18.54 | |
| 马缨丹 | Lantana camara | 0.39 | 0.56 | 4.07 | |
| 阔叶丰花草 | Borreria latifolia | - | 6.42 | 37.26 | |
| 鸡眼草 | Kummerowia striata | - | 0.37 | - | |
| 藿香蓟 | Ageratum conyzoides | - | 0.45 | 20.83 | |
| 野茼蒿 | Crassocephalum crepidioides | - | 0.58 | 0.58 | |
| 小蓬草 | Erigeron canadensis | - | - | 3.40 | |
方差分析结果表明,随着桉树连栽代数的增加,林下植被物种丰富度、相对盖度和重要值均存在显著差异。EP12林分乡土木本植物和草本植物的物种丰富度显著高于EP34和EP56,EP34显著高EP56,EP56的入侵种丰富度高于EP12和EP34,但差异不显著。相对盖度和重要值的变化相似,EP12的乡土木本植物功能群的相对盖度和重要值显著高于EP34和EP56;EP34的乡土草本植物功能群的相对盖度和重要值显著高于EP12和EP56,EP12显著高于EP56;EP56的入侵植物功能群的相对盖度和重要值显著高于EP12和EP34,EP12和EP34差异不显著(图 1)。
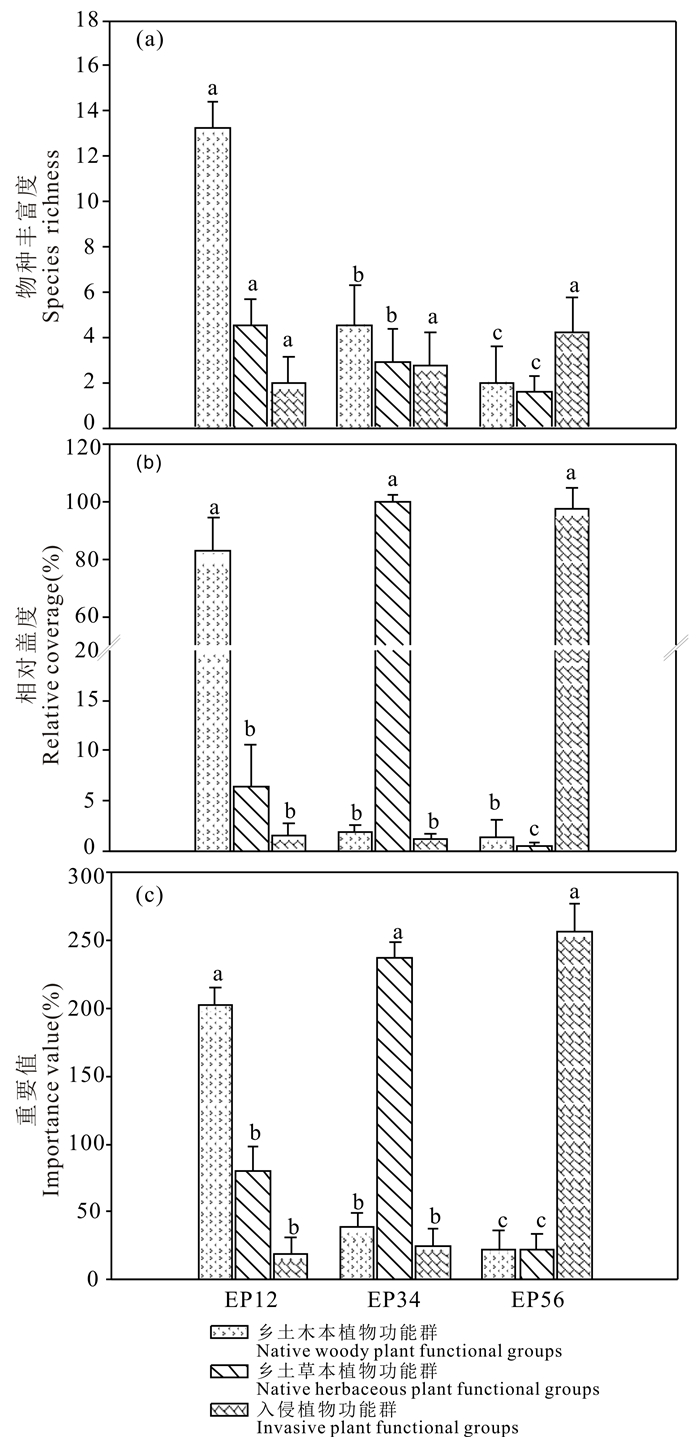
|
| 不同字母表示同一连栽代次不同功能群间差异显著 Different letters indicate significant difference among different plant functional groups in the continuous generations 图 1 不同连载代数桉树人工林林下植物功能群的物种丰富度、相对盖度和重要值 Fig. 1 Species richness, relative coverage and importance value of understory plant functional groups in different rotations of Eucalyptus plantations |
2.2 不同连栽代数桉树人工林林下植物多样性指数
从图 2可以看出,随着桉树连栽代数的增加,林下植物多样性各指数显著下降。EP12、EP34、EP56林下植物物种丰富度指数分别为12.7, 7.6, 5.2,与EP12相比,EP34和EP56的物种丰富度分别下降了40.16%和59.06%;EP12、EP34、EP56的谱系多样性指数分别为1 904.3, 1 359.3, 944.3,EP34和EP56的谱系多样性指数分别比EP12下降了28.62%和50.41%;相应的,EP12、EP34、EP56林分香农威纳指数分别为2.0, 0.1, 0.3,EP34和EP56的香农威纳指数分别比EP12下降了95%和85%;同样,EP12、EP34、EP56林分的均匀度指数分别为0.80, 0.05, 0.21,EP34和EP56分别比EP12下降了93.75%和73.75%(图 2)。

|
| 不同字母表示同一连栽代次不同功能群间差异显著 Different letters indicate significant difference among different plant functional groups in the continuous generations 图 2 不同连载代数桉树人工林林下植物多样性指数 Fig. 2 Diversity indices of undergrowth plant species in different rotations of Eucalyptus plantations |
2.3 不同连栽代数桉树人工林土壤肥力
随着桉树连栽代数的增加,本研究所测定的土壤有机质、全氮、全钾、全磷、铵态氮、硝态氮、速效磷和速效钾8种肥力指标均显著降低(图 3)。由图 3可以看出,EP12林分中,土壤有机质含量为(67.41±3.35) g·kg-1,EP34和EP56的土壤有机质含量分别为(57.61±3.71) g·kg-1、(42.41±4.09) g·kg-1,分别比EP12降低了14.54%、37.09%,方差分析表明,EP34和EP56显著低于EP12,EP56显著低于EP34(P < 0.05)。土壤全氮含量由EP12的(1.43±0.04) g·kg-1,下降到EP34、EP56的(0.82±0.06) g·kg-1和(0.82±0.08) g·kg-1,EP34与EP56差异不显著;土壤全磷含量由EP12的(0.42±0.04) g·kg-1,下降到EP34、EP56的(0.35±0.03) g·kg-1和(0.33±0.03) g·kg-1,分别降低了16.67%、21.43%;土壤全钾含量由EP12的(8.14±0.22) g·kg-1,下降到EP34、EP56的(7.45±0.50) g·kg-1和(6.55±0.40) g·kg-1。以乡土草本植物功能群为优势的EP34林分中土壤速效钾含量明显降低,显著低于EP12和EP56;而土壤速效磷含量则由EP12的(10.01±0.67) mg·kg-1,下降到EP34、EP56(6.86±1.85) mg·kg-1和(7.44±0.52) mg·kg-1,分别降低了31.47%、25.67%(图 3),EP34与EP56差异不显著。

|
| 不同字母表示同一连栽代次不同功能群间差异显著 Different letters indicate significant difference among different plant functional groups in the continuous generations 图 3 不同连载代数桉树人工林土壤肥力指标 Fig. 3 Soil fertility indices in different rotations of Eucalyptus plantations |
2.4 不同连栽代数桉树人工林土壤酶活性
随着桉树连栽代数的增加,土壤酚氧化酶、过氧化物酶、酸性磷酸酶、脲酶、β-1, 4-葡糖苷酶和N-乙酰-β-氨基葡糖苷酶活性均显著下降(图 4)。

|
| 不同字母表示不同连栽代次间差异显著 Different letters indicate significant difference among different continuous generations 图 4 不同连载代数桉树人工林土壤酶活性 Fig. 4 Soil enzyme activities in different rotations of Eucalyptus plantations |
图 4显示出,土壤酚氧化酶活性由EP12的(0.67±0.09) μmol·g-1·h-1下降到EP34和EP56的(0.43±0.11) μmol·g-1·h-1和(0.53±0.05) μmol·g-1·h-1;土壤过氧化物酶活性由EP12的(0.80±0.06) μmol·g-1·h-1下降到EP34和EP56的(0.57±0.13) μmol·g-1·h-1和(0.65±0.13) μmol·g-1·h-1。随着桉树人工林连栽代次的增加,土壤脲酶活性的变化尤为显著,由EP12的(0.88±0.08) μmol·g-1·h-1下降到EP34和EP56的(0.68±0.08) μmol·g-1·h-1和(0.63±0.06) μmol·g-1·h-1;土壤酸性磷酸酶活性由EP12的(4.40±0.52) μmol·g-1·h-1下降到EP34和EP56的(4.25±0.56) μmol·g-1·h-1和(3.81±0.88) μmol·g-1·h-1;除此之外,土壤β-1, 4-葡糖苷酶活性由EP12的(47.77±2.84)nmol·g-1·h-1下降到EP34和EP56的(33.72±3.28) nmol·g-1·h-1和(33.89±6.83) nmol·g-1·h-1;土壤N-乙酰-β-氨基葡糖苷酶活性由EP12的(34.02±3.11) nmol·g-1·h-1下降到EP34和EP56的(21.57±1.96) nmol·g-1·h-1和(27.66±3.59) nmol·g-1·h-1。
2.5 植物多样性、土壤肥力和土壤酶活性的相关分析相关分析结果表明,桉树人工林林下植物多样性与土壤肥力指标和土壤酶活性(土壤酸性磷酸酶除外)指标呈极显著的正相关关系(P < 0.01),土壤酸性磷酸酶与香农威纳指数、Pielou均匀度指数呈显著正相关关系(P < 0.05)(表 2)。
| 指标 Index |
物种丰富度 Species richness |
谱系多样性 Phylogenentic diversity |
香农威纳指数 Shannon-Wiener index |
Pielou均匀度指数 Pielou's evenness index |
辛普森指数 Simpson index |
| 有机质 Organic matter |
0.805** | 0.767** | 0.669** | 0.548** | 0.669** |
| 全氮 Total nitrogen |
0.814** | 0.726** | 0.941** | 0.877** | 0.941** |
| 全磷 Total phosphorus |
0.684** | 0.677** | 0.674** | 0.585** | 0.674** |
| 全钾 Total potassium |
0.762** | 0.766** | 0.665** | 0.603** | 0.665** |
| 铵态氮 Ammonium nitrogen |
0.741** | 0.728** | 0.630** | 0.540** | 0.630** |
| 硝态氮 Nitrate nitrogen |
0.739** | 0.712** | 0.657** | 0.566** | 0.657** |
| 速效磷 Available phosphorus |
0.580** | 0.466** | 0.743** | 0.696** | 0.743** |
| 速效钾 Available potassium |
0.409** | 0.289** | 0.732** | 0.749** | 0.732** |
| 注:*和**分别代表在P < 0.05和P < 0.01上的显著性 Note: * and ** indicate significant correlations at P < 0.05 and P < 0.01, respectively |
|||||
相关分析还发现,除土壤酸性磷酸酶外,8个土壤肥力指标与酚氧化酶、过氧化物酶、脲酶、β-1, 4-葡糖苷酶和N-乙酰-β-氨基葡糖苷酶呈极显著的正相关关系(P < 0.01),而土壤全氮、全磷、全钾、有机质和铵态氮与土壤酸性磷酸酶呈显著正相关(P < 0.05)(表 3)。
| 指标 Index |
酚氧化酶 Phenoloxidase |
过氧化物酶 Peroxidase |
脲酶 Urease |
酸性磷酸酶 Acid phosphatase |
β-1, 4-葡糖苷酶 β-1, 4-glucosidase |
N-乙酰-β-氨基葡糖苷酶 N-acetyl-β-glucosaminidase |
| 有机质 Organic matter |
0.407** | 0.392** | 0.669** | 0.244* | 0.667** | 0.378** |
| 全氮 Total nitrogen |
0.638** | 0.618** | 0.806** | 0.235* | 0.838** | 0.760** |
| 全磷 Total phosphorus |
0523** | 0.500** | 0.720** | 0.321** | 0.650** | 0.466** |
| 全钾 Total potassium |
0.430** | 0.388** | 0.557** | 0.228* | 0.612** | 0.349** |
| 铵态氮 Ammonium nitrogen |
0.360** | 0.346** | 0.684** | 0.263* | 0.540** | 0.296** |
| 硝态氮 Nitrate nitrogen |
0.391** | 0.358** | 0.660** | 0.189 | 0.602** | 0.387** |
| 速效磷 Available phosphorus |
0.551** | 0.357** | 0.542** | 0.038 | 0.614** | 0.671** |
| 速效钾 Available potassium |
0.698** | 0.603** | 0.462** | -0.063 | 0.615** | 0.833** |
| 注:*和**分别代表在P < 0.05和P < 0.01上的显著性 Note: * and ** indicate significant correlations at P < 0.05 and P < 0.01, respectively |
||||||
3 讨论 3.1 桉树高代次连栽对林下植物种类和功能群组成的影响
在森林生态系统中,物种多样性影响森林生态系统的组成,进而影响其结构与功能,决定着森林生态系统的功能特征及稳定性[30]。林下植被作为森林生物多样性和森林生态可持续性的指示者,对人工林的可持续经营有着重要影响。近年来,国内外许多学者都对人工林林下植被物种组成结构和物种多样性进行了研究。余雪标等[5]采用空间代替时间方法对经营1~4代的桉树人工林的植物多样性进行了对比研究,指出连栽导致植物多样性显著减少。温远光等[6]在同一片林地对1~2代林进行了5年的监测研究,发现第2代林分的植物物种丰富度和Shannon-Wiener指数分别比第1代林分降低39.39%和17.76%。目前,就桉树高代次连栽对林下植物种类和功能群的影响研究几乎是空白。本研究表明,随着桉树进入高代次连栽,林下植物物种丰富度和多样性均显著降低,特别是林下植物功能群组成发生极显著变化,即从以乡土木本植物功能群为优势逐渐演变成以乡土草本植物功能群为优势,进入高代次连栽后,迅速转变为以外来入侵植物为优势。表明现行的短周期高代次连栽和高强度经营的营林方式将显著改变桉树林下的植物物种和功能群组成,导致严重的外来植物入侵风险,必须给予高度重视。
3.2 桉树高代次连栽对土壤肥力的影响土壤有机质是土壤肥力的物质基础,其含量的高低是评价土壤肥力的重要标志。明安刚等[31]研究表明桉树连栽导致土壤有机质含量减少,且主要表现在表土层(0~20 cm),第2代桉树林土壤有机质含量(11.57±2.53) g·kg-1比第1代林土壤有机质含量(16.81±6.22) g·kg-1下降31.17%。叶绍明等[32]的研究也表明桉树人工林土壤有机质随连栽代次的增加而减少,第3代桉树人工林土壤的综合肥力较第1代、第2代显著下降。刘红英[33]的研究结果显示,不同连栽代数下桉树人工林土壤有机质含量大小为灌草坡>1代林>2代林>3代林。氮、磷、钾作为植物活细胞的组成部分是植物生长的必需养分,其在土壤中含量的高低直接影响着植物的生长与产量的形成。明安刚等[31]研究表明,第2代桉树林土壤全氮、全钾含量比第1代林分别下降了29.97%、32.5%,第2代桉树林土壤磷含量相比第1代林则上升了32.65%。余雪标等[34]在桉树人工林土壤养分的研究中指出,随着连栽代次的增加,养分的回归量呈下降趋势,土壤中氮、磷、钾含量随着连栽代次的增加而表现出下降趋势。温远光[13]的研究结果表明,第2代尾巨桉人工林土壤全氮、全钾、水解氮、速效磷和有效钾分别比第1代林下降了9.20%、4.10%、3.28%、52.05%和24.59%。诚然,上述研究结果只反映了低中代次连栽的影响,缺乏高代次连栽的认识。在本研究中,所测定的土壤有机质、全氮、全钾、全磷、铵态氮、硝态氮、速效磷和速效钾等8种肥力指标均随着桉树的高代次连栽而显著降低(图 3)。这一结果与前人研究结果一致,但桉树高代次连栽导致的土壤有机质降低速率远高于低中代次,而土壤全氮、速效磷并未持续降低,速效钾甚至出现EP56显著高于EP34的现象。这是否与全球氮沉降、大量氮素施用和多次炼山引起钾素积累有关,尚需进一步研究。
3.3 桉树高代次连栽对土壤酶活性的影响土壤酶是土壤中具有生物活性的蛋白质,与土壤微生物共同推动土壤的生物化学过程和物质循环,其活性反映了土壤生物化学过程的强度和方向,是可靠的土壤微生物活性和土壤肥力指标之一,也是评价土壤自净能力的一个重要指标[35]。土壤磷酸酶可加速有机磷的脱磷速度[36],积累磷酸酶对土壤磷素的有效性具有重要作用。土壤脲酶能够将土壤中的有机化合物尿素水解转化为有效养分以供植物体吸收利用,对促进土壤氮素循环具有非常重要的意义[37]。杨远彪等[38]研究结果表明,各代林地之间土壤中果聚糖蔗糖酶活性差异显著,而且表现出随着连栽代次的增加酶活性逐渐降低的趋势;不同样地土壤中磷酸酶活性差异不显著。在连栽桉树人工林土壤中这两种酶活性基本随代数的增加而呈下降趋势,这也与李志辉等[39]的研究结果一致。本研究结果表明,随着桉树进入高代次连载,土壤酚氧化酶、过氧化物酶、脲酶、酸性磷酸酶、β-1, 4-葡糖苷酶和N-乙酰-β-氨基葡糖苷酶酶活性均显著下降。这说明林下植物功能群、土壤养分和土壤微生物是一个有机整体,植物功能群的显著退化将导致土壤碳、氮、磷及生态化学计量学特征的变化[40-41]。
3.4 桉树高代次连栽植物、土壤肥力和酶活性退化的主要因素土壤退化的原因错综复杂,主要由气候变化、土地利用和人类活动引起[42-43]。早期的研究认为人工林土壤退化是土壤物理、化学、生物性状的退化,其机理主要是树种生物学特性与不合理的栽培方式相互作用引起[44-46]。最近的研究认为,土壤退化是以土壤质量下降和生态系统产品和服务功能减弱为特征,包括土壤物理、化学、生物和生态性状的改变[47]。研究发现,单一树种的人工纯林模式会出现凋落物不易分解或分解速度较慢,养分归还速率低[48],容易造成某些土壤养分元素的亏缺[49],引起土壤退化。最近的研究发现,土壤微生物组成结构和功能群的改变是导致人工林土壤质量退化的主要原因[50-51],特别是原有的植物-土壤微生物共存关系发生改变,导致人工林土壤关键微生物功能群丧失或微生物菌群关系失衡[52-53]。在本研究中,桉树高代次连栽产生的高强度干扰(如反复地炼山、整地、施除草剂应用)直接导致乡土木本植物种类多样性降低,引起乡土木本植物功能群退化。桉树林下植物功能群去除试验表明,木本植物功能群提供或维持土壤生态系统多功能性的能力显著强于草本植物功能群[16]。导致此种现象的主要原因是木本植物为优势的林分植物多样性高,因而能提供更多样化的凋落物及根系分泌物,能为地下微生物群落提供更多底物和生境,从而增强了土壤养分循环、养分储量、氮转化及酶活性等土壤生态系统多功能性[16]。因此,桉树高代次连栽使林下乡土木本植物功能群退化将导致土壤肥力和酶活性的显著降低。
4 结论本研究表明,桉树高代次连栽对林下植物种类和功能群组成、土壤肥力和酶活性具显著的负效应。桉树进入高连栽代次,林下植物功能群从乡土木本植物、乡土草本植物向入侵植物功能群转变的趋势明显,存在极高的外来植物入侵风险。同时桉树高代次连栽会导致土壤有机质明显下降,引起土壤氮、磷、钾含量和土壤酶活性显著下降,最终导致土壤综合肥力衰退,危及土壤质量安全。因此,今后需改变桉树短周期高代次纯林连栽的营林方式,提倡生态营林,以避免生物入侵风险和保障桉树人工林的土壤质量安全。
| [1] |
PAUL OBADE DE V, LAL R. Towards a standard technique for soil quality assessment[J]. Geoderma, 2016, 265: 96-102. DOI:10.1016/j.geoderma.2015.11.023 |
| [2] |
张学雷. 从20届世界土壤学大会主题发言看土壤学某些重要问题[J]. 土壤通报, 2015, 46(1): 1-3. |
| [3] |
BRANCO S, VIDEIRA N, BRANCO M, et al. A review of invasive alien species impacts on eucalypt stands and citrus orchards ecosystem services:Towards an integrated management approach[J]. Journal of Environmental Management, 2015, 149: 17-26. DOI:10.1016/j.jenvman.2014.09.026 |
| [4] |
温远光, 周晓果, 喻素芳, 等. 全球桉树人工林发展面临的困境与对策[J]. 广西科学, 2018, 25(2): 107-116. |
| [5] |
余雪标, 钟罗生, 杨伟东, 等. 桉树人工林林下植被结构的研究[J]. 热带作物学报, 1999, 20(1): 66-72. |
| [6] |
温远光, 刘世荣, 陈放. 连栽对桉树人工林下物种多样性的影响[J]. 应用生态学报, 2005, 16(9): 1667-1671. DOI:10.3321/j.issn:1001-9332.2005.09.017 |
| [7] |
温远光, 左花, 朱宏光, 等.连栽对桉树人工林植被盖度、物种468, 483.
|
| [8] |
吴钿, 刘新田, 杨新华. 雷州半岛桉树人工林林下植物多样性研究[J]. 林业科技, 2003, 28(4): 10-13. |
| [9] |
赵一鹤, 杨宇明, 杨时宇, 等. 培育措施对桉树人工林林下物种多样性的影响[J]. 云南农业大学学报, 2008, 23(3): 309-315. DOI:10.3969/j.issn.1004-390X.2008.03.005 |
| [10] |
梁宏温, 杨健基, 温远光, 等. 桉树造林再造林群落植物多样性的变化[J]. 东北林业大学学报, 2011, 39(5): 40-43. DOI:10.3969/j.issn.1000-5382.2011.05.013 |
| [11] |
李伟, 张翠萍, 魏润鹏. 广东中西部桉树人工林植物多样性与林龄和土壤因子的关系[J]. 生态学报, 2014, 34(17): 4957-4965. |
| [12] |
温远光, 严宇航, 陶彦良, 等. 不同林地清理和培肥措施对桉树人工林植物多样性的影响[J]. 广西科学, 2018, 25(2): 117-127. |
| [13] |
温远光.连栽桉树人工林植物多样性与生态系统功能关系的长期实验研究[D].成都: 四川大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10610-2007225241.htm
|
| [14] |
王纪杰.桉树人工林土壤质量变化[D].南京: 南京林业大学, 2011.
|
| [15] |
谭宏伟, 杨尚东, 吴俊, 等. 红壤区桉树人工林与不同林分土壤微生物活性及细菌多样性的比较[J]. 土壤学报, 2014, 51(3): 575-584. |
| [16] |
周晓果.林下植物功能群丧失对桉树人工林生态系统多功能性的影响[D].南宁: 广西大学, 2016.
|
| [17] |
覃林, 马雪珍, 吴水荣, 等. 南亚热带典型乡土阔叶人工林与桉树人工林土壤微生物量氮及可溶性氮特征[J]. 应用与环境生物学报, 2017, 23(4): 678-684. |
| [18] |
中国林学会. 桉树科学发展问题调研报告[M]. 北京: 中国林业出版社, 2016.
|
| [19] |
鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000.
|
| [20] |
杨洋, 王继富, 张心昱, 等. 凋落物和林下植被对杉木林土壤碳氮水解酶活性影响机制[J]. 生态学报, 2016, 36(24): 8102-8110. |
| [21] |
SINSABAUGH R L, ANTIBUS R K, LINKINS A E, et al. Wood decomposition:Nitrogen and phosphorus dynamics in relation to extracellular enzyme activity[J]. Ecology, 1993, 74(5): 1586-1593. DOI:10.2307/1940086 |
| [22] |
VAN ELSAS J D. Soil enzymes.Methods of soil analysis:Part 2-Microbiological and biochemical properties[J]. Scientia Horticulturae, 1995, 63(1): 131-133. |
| [23] |
PARHAM J A, DENG S P. Detection, quantification and characterization of β-glucosaminidase activity in soil[J]. Soil Biology and Biochemistry, 2000, 32(8/9): 1183-1190. |
| [24] |
MAGURRAN A E. Ecological diversity and its measurement[M]. Heidelberg: Springer Science+Business Media, B Y, 1996.
|
| [25] |
PIELOU E C. The measurement of diversity in different types of biological collections[J]. Journal of Theoretical Biology, 1966, 13: 131-144. DOI:10.1016/0022-5193(66)90013-0 |
| [26] |
WEBB C O, DONGHUE M J. Phylomatic:Tree assembly for applied phylogenetics[J]. Molecular Ecology Notes, 2005, 5(1): 181-183. DOI:10.1111/men.2005.5.issue-1 |
| [27] |
ZANNE A E, TANK D C, CORNWELL W K, et al. Three keys to the radiation of angiosperms into freezing environments[J]. Nature, 2014, 506(7486): 89-92. DOI:10.1038/nature12872 |
| [28] |
WEBB C O, ACKERLY D D, KEMBEL S W. Phylocom:Software for the analysis of phylogenetic community structure and trait evolution[J]. Bioinformatics, 2008, 24(18): 2098-2100. DOI:10.1093/bioinformatics/btn358 |
| [29] |
FAITH D P. Conservation evaluation and phylogenetic diversity[J]. Biological Conservation, 1992, 61(1): 1-10. |
| [30] |
于立忠, 朱教君, 史建伟, 等. 辽东山区人工阔叶红松林植物多样性与生产力研究[J]. 应用生态学报, 2005, 16(12): 2225-2230. DOI:10.3321/j.issn:1001-9332.2005.12.001 |
| [31] |
明安刚, 温远光, 朱宏光, 等. 连栽对桉树人工林土壤养分含量的影响[J]. 广西林业科学, 2009, 38(1): 26-30. DOI:10.3969/j.issn.1006-1126.2009.01.007 |
| [32] |
叶绍明, 温远光, 张慧东. 连栽桉树人工林土壤理化性质的主分量分析[J]. 水土保持通报, 2010, 30(5): 101-105. |
| [33] |
刘红英.连栽桉树人工林土壤酶活性及其与土壤养分的关系[D].南宁: 广西大学, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2406783
|
| [34] |
余雪标, 白先权, 徐大平, 等. 不同连栽代次桉树人工林的养分循环[J]. 热带作物学报, 1999, 20(3): 60-66. |
| [35] |
FATEMI F R, FERMANDEZ I J, SIMON K S, et al. Nitrogen and phosphorus regulation of soil enzyme activities in acid forest soils[J]. Soil Biology and Biochemistry, 2016, 98: 171-179. DOI:10.1016/j.soilbio.2016.02.017 |
| [36] |
周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987.
|
| [37] |
李跃林, 彭少麟. 桉树人工林地土壤酶活性与营养元素含量关系研究[J]. 福建林业科技, 2002, 29(3): 6-9, 29. DOI:10.3969/j.issn.1002-7351.2002.03.002 |
| [38] |
杨远彪, 吕成群, 黄宝灵, 等. 连栽桉树人工林土壤微生物和酶活性的分析[J]. 东北林业大学学报, 2008, 36(12): 10-12. DOI:10.3969/j.issn.1000-5382.2008.12.005 |
| [39] |
李志辉, 李跃林, 杨民胜, 等. 桉树林地土壤酶分布特点及其活性变化研究[J]. 中南林学院学报, 2000, 20(3): 29-33. DOI:10.3969/j.issn.1673-923X.2000.03.005 |
| [40] |
REVILLINI D, GEHRING C A, JOHNSON N C. The role of locally adapted mycorrhizas and rhizobacteria in plant-soil feedback systems[J]. Functional Ecology, 2016, 30(7): 1086-1098. DOI:10.1111/fec.2016.30.issue-7 |
| [41] |
MIKI T, YOKOKAWA T, KE P J, et al. Statistical re-cipe for quantifying microbial functional diversity from EcoPlate metabolic profiling[J]. Ecological Research, 2018, 33(1): 249-260. DOI:10.1007/s11284-017-1554-0 |
| [42] |
FERRARA A, SALVATI L, SABBI A, et al. Soil resources, land cover changes and rural areas:Towards a spatial mismatch?[J]. Science of the Total Environment, 2014, 478: 116-122. DOI:10.1016/j.scitotenv.2014.01.040 |
| [43] |
SALVATI L, MAVRAKIS A, COLANTONI A, et al. Complex adaptive systems, soil degradation and land sensitivity to desertification:A multivariate assessment of Italian agro-forest landscape[J]. Science of the Total Environment, 2015, 521/522: 235-245. DOI:10.1016/j.scitotenv.2015.03.094 |
| [44] |
刘世荣, 温远光. 杉木生产力生态学[M]. 北京: 气象出版社, 2005.
|
| [45] |
盛伟彤, 范少辉. 杉木人工林长期生产力保持机制研究[M]. 北京: 科学出版社, 2005.
|
| [46] |
杨承栋. 中国主要造林树种土壤质量演化与调控机理[M]. 北京: 科学出版社, 2009.
|
| [47] |
LAL R. Sequestering carbon and increasing productivity by conservation agriculture[J]. Journal of Soil and Water Conservation, 2015, 70(3): 55A-62A. DOI:10.2489/jswc.70.3.55A |
| [48] |
郭婧, 喻林华, 方晰, 等. 中亚热带4种森林凋落物量、组成、动态及其周转期[J]. 生态学报, 2015, 35(14): 4668-4677. |
| [49] |
EPRON D, MOUANDA C, MARESCHAL L, et al. Impacts of organic residue management on the soil C dynamics in a tropical eucalypt plantation on a nutrient-poor sandy soil after three rotations[J]. Soil Biology and Biochemistry, 2015, 85: 183-189. DOI:10.1016/j.soilbio.2015.03.010 |
| [50] |
RAIESI F, BEHESHTI A. Microbiological indicators of soil quality and degradation following conversion of native forests to continuous croplands[J]. Ecological Indicators, 2015, 50: 173-185. DOI:10.1016/j.ecolind.2014.11.008 |
| [51] |
MITCHELL P J, SIMPSON A J, SOONG R, et al. Biochar amendment and phosphorus fertilization altered forest soil microbial community and native soil organic matter molecular composition[J]. Biogeochemistry, 2016, 130(3): 227-245. DOI:10.1007/s10533-016-0254-0 |
| [52] |
ZECHMEISTER-BOLTENSTERN S, KEIBLINGER K M, MOOSHAMMER M, et al. The application of ecological stoichiometry to plant-microbial-soil organic matter transformations[J]. Ecological Monographs, 2015, 85(2): 133-155. DOI:10.1890/14-0777.1 |
| [53] |
LIANG C, SCHIMEL J P, JASTROW J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2(8): 17105. DOI:10.1038/nmicrobiol.2017.105 |



