2. 广西科学院广西红树林研究中心, 广西红树林保护与利用重点实验室, 广西北海 536007
2. Guangxi Key Lab of Mangrove Conservation and Utilization, Guangxi Mangrove Research Center, Guangxi Academy of Sciences, Beihai, Guangxi, 536007, China
【研究意义】红树蚬属贝类是红树林中个体最大的可食用双壳贝类[1],它们通过食物网在红树林物质能量循环中扮演着重要角色[2]。红树林中常见的红树蚬属贝类有红树蚬(Polymesoda erosa)、歪红树蚬(Polymesoda expansa)和Polymesoda bengalensis 3种,前2种分布范围广,后者主要分布在印度洋沿岸红树林区[3]。随着对红树蚬属贝类的营养价值[4]、抗菌作用[5]和生物监测[6-8]等方面研究的开展,其经济价值和利用潜能正在被逐步挖掘。广西北海是一个三面环海的旅游城市,市区的北部、东南部分布有红树林,是当地居民赶海采捕滩涂经济动物以及游客亲海体验活动的主要场所,牛屎螺(当地对红树蚬属贝类的俗称)是常见的赶海渔获物。“红树林”“纯天然”等标签,让昔日只在当地居民餐桌上可见的牛屎螺搬到了海鲜餐馆,牛屎螺的消费日益旺盛,北海城市红树林中牛屎螺的采捕量不断攀升,如果不及时监测种群动态,适时采取保护管理措施,采捕过度将会导致牛屎螺物种资源衰退。【前人研究进展】广西红树林中有红树蚬和歪红树蚬分布,二者生态位重叠,形态极为相似难以辨别,运用多变量形态度量学分析方法所建立的判别函数,综合判别率为86.0%[9]。红树蚬的分布密度从高潮滩向低潮滩递减,不同红树植物树种根际红树蚬的分布密度无显著差异[10]。廉州湾红树蚬1年1个生殖周期,繁殖期从6月延续到11月[11]。Dolorosa和Dangan-Galon[12]运用von Bertalanffy生长方程(von Bertalanffy Growth Formula)和变换体长渔获曲线(Length Converted Catch Curve)等数学模型,对菲律宾巴拉望省Iwahig河口红树林区红树蚬种群动态进行分析评估,结果认为该区域红树蚬已处于过度采捕状态,建议采取限制采捕的保护管理措施并发展人工养殖。【本研究切入点】掌握保护地的物种资源状况、生态和繁殖特性等,是制定科学有效的保护管理措施的前提。然而,北海红树林中的红树蚬属贝类资源状况尚缺乏基础数据,为此我们在北海市城区红树林的主要分布区设置3个样地进行红树蚬属贝类资源调查。【拟解决的关键问题】通过样方调查,掌握北海城市红树林的红树蚬属贝类种类组成、分布密度及分布特征,为其物种资源的保护管理提供参考数据。
1 材料与方法 1.1 样地设置在北海市城区红树林主要分布区设置3个调查样地(图 1),样地A位于北岸的垌尾村,红树林林带宽约360 m,群落类型为白骨壤+秋茄群落,群落平均高度为2.5 m。样地B位于南岸的小冠沙,红树林林带宽约250 m,群落类型为白骨壤群落,群落平均高度为1.2 m。样地C位于东部的西村港,红树林林带宽约110 m,群落类型为白骨壤群落,群落平均高度为1.5 m。每个样地在高、中和低潮滩各设置1个调查站位,AH、AM和AL分别代表样地A的高、中和低潮滩站位,BH、BM和BL分别代表样地B的高、中和低潮滩站位,CH、CM和CL分别代表样地C的高、中和低潮滩站位。每个调查站位平行岸线设置3个10 m×10 m的调查样方,样方间距不小于50 m。

|
图 1 调查样地 Fig.1 The sampling site for survey |
2017年10月至11月,低潮时用齿耙挖掘采集红树蚬属贝类样品,挖掘深度为15 cm左右。每个样方内挖掘5 m2,四角和中部各1 m2。挖掘到的每个红树蚬属贝类样品按样方分别收集,8 h内常温干露运回实验室。分样方清洗干净贝壳表面泥沙和附着物后,按样方号和个体序号独立编号标记,室内常温干露保湿活体保存备用。
1.3 沉积物粒度和盐度测定沉积物粒度按国家标准GB/T 12763.8—2007采用筛分法测定[13],沉积物盐度按国家海洋行业标准HY/T 081—2005用盐度折射计测定[14]。
1.4 形态测量用精度0.1 mm的电子游标卡尺测量每个样品的壳长、壳高和壳宽。壳长为壳前端至后端的最长距离,壳高为与壳长垂直的壳顶至腹缘的距离,壳宽为左右两壳面间的最大距离。
1.5 物种鉴定依据形态学特征[3]进行初步鉴定,剔除非红树蚬属样品。每个样品解剖剪取闭壳肌,提取闭壳肌DNA。用广西红树林研究中心海洋生物与生物技术研究室研发的专用引物ErosaR/F和Expansa R/F(未发表),分别以样品闭壳肌DNA为模板进行PCR扩增,琼脂糖凝胶电泳检测PCR扩增结果。只有引物Erosa R/F能扩增出目标产物的为红树蚬,只有引物Expansa R/F能扩增出目标产物的为歪红树蚬,2种引物均能或均不能扩增出目标产物的样品,则用70%的乙醇保存并送专家鉴定。样品的DNA提取、PCR扩增及检测,在样品运达实验室后的72 h内完成。
1.6 数据处理统计每个样方内采集到的红树蚬和歪红树蚬个体数,计算分布密度。按样地、站位、物种和不同壳长组别对调查数据进行统计分析。利用SPSS19.0软件进行数据统计、方差分析(ANOVA)和LSD均值多重比较。
2 结果与分析 2.1 沉积物粉砂含量和盐度样地A、B和C各站位的沉积物粉砂含量均值分别为69.9%、25.5%和58.4%,样地间差异显著(P<0.05),表现为A>C>B;除样地A高潮滩站位(AH)外,同一样地各站位间无显著差异(P>0.05)。样地A、B和C的高潮滩站位间沉积物盐度无显著差异(P>0.05),中、低潮滩站位间差异显著(P<0.05),表现为B>C>A(图 2)。

|
图 2 北海城市红树林沉积物粉砂含量和盐度 Fig.2 Silt-clay composition and salinity of sediments in mangroves of Beihai City |
在3个样地9个站位的27个样方中,共采集到红树蚬属贝类559个,经鉴定分属红树蚬和歪红树蚬2种,红树蚬320个,歪红树蚬239个。各样方采集到的物种、个体数及分布密度见表 1。
| 表 1 北海城市红树林中红树蚬属贝类分布密度 Table 1 Density of Polymesoda spp.in mangroves of Beihai City |
北海城市红树林中红树蚬属贝类平均分布密度为4.14 ind/m2(图 3a),其中红树蚬2.37 ind/m2,歪红树蚬1.77 ind/m2,红树蚬分布密度显著高于歪红树蚬(P<0.05)(图 3c)。样地B中潮滩站位(BM)分布密度最高(6.67 ind/m2,其中红树蚬3.47 ind/m2,歪红树蚬3.20 ind/m2),样地A低潮滩站位(AL)无红树蚬属贝类分布(图 3b)。3个样地红树蚬的分布密度均大于歪红树蚬,但只有样地C达到显著差异水平(P<0.05)(图 3c)。除样地A低潮滩站位(AL)无红树蚬属贝类分布外,其他8个站位的红树蚬分布密度均大于歪红树蚬,但均未达到显著差异水平(P>0.05)(图 3d)。
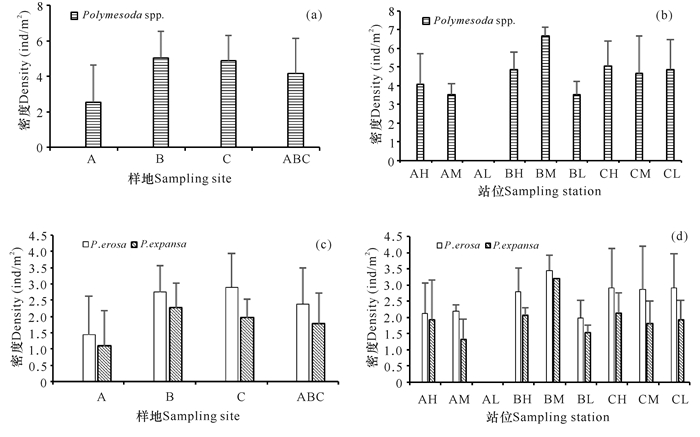
|
图 3 北海城市红树林红树蚬属贝类分布密度 Fig.3 Density of Polymesoda spp.in mangroves of Beihai City |
所采集到的红树蚬属贝类个体壳长为34.1~76.4 mm,平均为52.1 mm,样地A的平均壳长显著大于样地B和样地C(P<0.05)(图 4a)。不同壳长的个体数占总个体数的比例呈钟形分布,壳长46~50 mm的个体数最多,占25.6%(图 4b)。红树蚬平均壳长52.4 mm,歪红树蚬平均壳长51.6 mm,同一站位的红树蚬与歪红树蚬个体壳长无显著差异(P>0.05)(图 4c)。红树蚬壳长51~55 mm的个体数最多,占红树蚬总个体数的20.1%;歪红树蚬壳长46~50 mm的个体数最多,占歪红树蚬总个体数的28.0%(图 4d)。
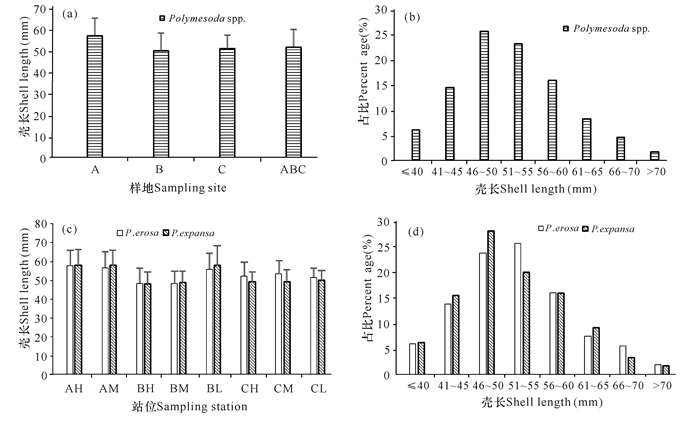
|
图 4 北海城市红树林红树蚬属贝类个体大小分布 Fig.4 Size distribution of Polymesoda spp.in mangroves of Beihai City |
壳长/壳高比值,红树蚬为1.02~1.33,平均为1.12;歪红树蚬为1.00~1.26,平均为1.13;两个物种间、不同站位间以及不同壳长组别间均无显著差异(P>0.05)(图 5a、b)。壳长/壳宽比值,红树蚬为1.61~4.15,平均为2.34;歪红树蚬为1.67~3.83,平均为2.38;样地C高潮滩站位(CH)的红树蚬和歪红树蚬壳长宽比均最高,样地A高潮滩站位(AH)的红树蚬和歪红树蚬壳长宽比均最低(图 5c);随着壳长的增大,壳长宽比持续降低;红树蚬壳长50 mm以下的各组,壳长宽比明显高于壳长50 mm以上的各组(P<0.05);歪红树蚬壳长55 mm以下的各组,壳长宽比明显高于壳长55 mm以上的各组(P<0.05)(图 5d)。
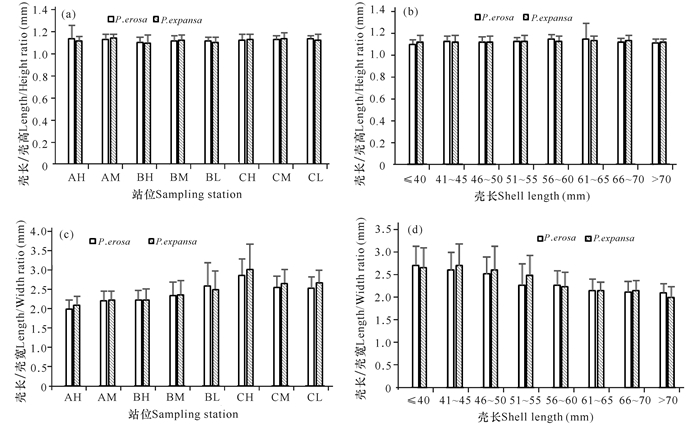
|
图 5 北海城市红树林红树蚬属贝类壳尺比例 Fig.5 Biometric ratio of Polymesoda spp.in mangroves of Beihai City |
本研究中红树蚬和歪红树蚬的平均分布密度分别是2.37 ind/m2(1.44~2.91 ind/m2)和1.77 ind/m2(1.09~2.27 ind/m2),远高于马来西亚马鲁都湾(Marudu Bay)红树林(红树蚬0.05~0.28 ind/m2,歪红树蚬0.01~0.04 ind/m2)[15]和印度尼西亚Liong River河口红树林(歪红树蚬0.44~1.66 ind/m2)[16],但低于印度卓若岛(Chorao Island)红树林(红树蚬7~12 ind/m2)[17],表明北海城市红树林中的红树蚬属贝类资源较丰富。
沉积物类型是影响海洋底栖动物分布的关键因素之一[18-19]。在印度卓若岛(Chorao Island)红树林区,粉砂含量高的样地红树蚬分布密度比粉砂含量低的样地高[17];在马来西亚马鲁都湾(Marudu Bay)红树林中,歪红树蚬只在粉砂含量大于80%的样地有分布[15]。本研究结果却几乎相反,样地B粉砂含量最低,但红树蚬属贝类的分布密度却最高;样地A低潮滩站位(AL)粉砂含量最高(77.8%),但无红树蚬属贝类分布;而红树蚬和歪红树蚬分布密度均最高的样地B中潮滩站位(BM),粉砂含量仅29.5%。红树蚬属贝类在繁殖生长过程中均经历了浮游幼体阶段,浮游幼体随潮流在海区扩散,当浮游幼体完成变态过程成为幼贝时,即下沉定居埋栖于滩涂。潮流带来了定居的红树蚬属贝类幼贝,同时也带来了泥砂沉积,不同的研究样地所表现出的不一样的红树蚬属贝类分布密度与沉积物粉砂含量的相关性,也许是潮流的作用结果。
红树蚬成贝主要分布在红树林高潮滩区域,分布密度沿退潮方向递减[10, 17, 20-21],而幼贝(定居阶段,壳长<3 mm)和稚贝(早期生长阶段,壳长3~30 mm)却正好相反,表现为沿退潮方向递增[17],说明定居后生长过程中的死亡率是决定其成贝分布的决定性因素,低潮滩死亡率高而高潮滩死亡率低。本研究中样地A成贝分布密度与文献报道的较为一致,样地B表现为中潮滩>高潮滩>低潮滩,而样地C高中低潮滩无显著差异。分析3个样地高中低潮滩站位间的环境条件差异,被潮水浸淹时间的长短差异比较明显:样地A红树林林带较宽,被潮水浸淹时间长度表现为低潮滩>中潮滩>高潮滩;样地B红树林林带较窄,中潮滩是凸起的沙丘,被潮水浸淹时间长度表现为低潮滩>高潮滩>中潮滩;样地C林带最窄,仅110 m左右,滩涂平坦,高中低潮滩被潮水浸淹时间长度几乎无差异。在同一样地中,被潮水浸淹时间越长的潮滩,成贝分布密度越低,可能是随潮水来去的天敌捕食幼稚贝所造成的。同一样地中,滩涂高程差异,被潮水浸淹的时间长度不同,幼稚贝被天敌捕食的几率不同,可能是导致高中低潮滩成贝分布密度差异的主要原因。
3.2 个体大小及壳尺性状本研究中不同壳长的个体数呈钟形分布,这与马来西亚马鲁都湾的红树蚬属贝类群体壳长分布特征一致。本研究中,壳长46~55 mm的个体数最多,最大壳长76.4 mm;在马鲁都湾,壳长55~70 mm的个体数最多,最大壳长89 mm[15];在菲律宾Iwahig River河口,红树蚬最大壳长102 mm,1龄贝即可生长至壳长70 mm[12]。北海的红树蚬繁殖期从6月延续到11月[11],本研究的采样时间是10~11月,壳长46~55 mm的个体年龄应该为1~1.5龄。相对于东南亚,北海的红树蚬属贝类个体相对较小,可能是温度相对较低导致的生长速度较慢。本研究中红树蚬和歪红树蚬占比最大的壳长组别分别是51~55 mm组和46~50 mm组,假定二者繁殖周期一致的话,可以推测红树蚬比歪红树蚬生长速度快,这与Argente等[22]对菲律宾Loay-Loboc River河口红树林中红树蚬属种群的研究结果一致。
本研究中,壳长/壳高比值在2个物种、不同样地站位及壳长组别间均无显著差异,但不同壳长组别间的壳长/壳宽比值却表现出一定的规律。随着壳长的增大,壳长/壳宽比值持续降低,红树蚬在壳长46~50 mm组处出现拐点,壳长50 mm及以下各组的壳长/壳宽比值显著高于壳长50 mm以上各组;歪红树蚬的拐点出现在51~55 mm组,壳长55 mm及以下各组的壳长/壳宽比值显著高于壳长55 mm以上各组。红树蚬壳长达到35~46 mm开始性成熟[2, 23-24],不同地域有一定的差异。依据红树蚬和歪红树蚬壳长与壳长/壳宽比值关系中拐点的存在,结合红树蚬开始达到性成熟的壳长,推测红树蚬和歪红树蚬性成熟后壳宽加速生长,歪红树蚬开始达到性成熟的壳长较红树蚬大。
4 结论北海城市红树林中红树蚬属贝类资源量相对丰富,个体相对较小。平均分布密度为4.14 ind/m2,壳长为34.1~76.4 mm,平均长52.1 mm;不同壳长的个体数占总个体数的比例呈“钟”形分布,壳长46~50 mm的个体数最多。有红树蚬和歪红树蚬2种,平均分布密度分别为2.37 ind/m2和1.77 ind/m2,平均壳长分别为52.4 mm和51.6 mm,壳长51~55 mm的红树蚬和壳长46~50 mm的歪红树蚬个体数分别占红树蚬和歪红树蚬个体总数的比例最高。随着壳长的增大,壳长/壳高比值无显著变化,壳长/壳宽比值持续降低。红树蚬和歪红树蚬壳长分别达到50 mm和55 mm后,壳长/壳宽比值显著降低。红树蚬的生长速度比歪红树蚬快,二者性成熟后壳宽均加速生长。3个样地间沉积物粉砂含量差异显著,粉砂含量高的样地红树蚬属贝类分布密度低。潮流和滩涂高程可能是红树蚬属贝类成贝分布密度的决定性因素。潮流带来了定居的红树蚬属贝类幼贝,同时也带来了泥砂沉积,成贝分布密度与沉积物粒度的相关性可能是潮流的影响结果:高程低的潮滩,被潮水浸淹时间长,成贝分布密度低。
| [1] |
CARPENTER K E, NIEM V H. The living marine resources of the western central Pacific[M]. Rome: Food and Agriculture Organization of the United Nations, 1998.
|
| [2] |
CLEMENTE S.Ecology and population dynamics of the mangrove clam Polymesoda erosa (Solander, 1876) in the mangrove ecosystem[D].Dona-Paula: National Institute of Oceanography, 2007.
|
| [3] |
MORTON B. A review of Polymesoda (Geloina) Gray 1842(Bivalvia:Corbiculacea) from Indo-Pacific mangroves[J]. Asian Marine Biology, 1984, 1: 77-86. |
| [4] |
周浩郎, 张俊杰, 邢永泽, 等. 红树蚬软体部营养成分分析与评价[J]. 南方农业学报, 2015, 46(2): 308-312. ZHOU H L, ZHANG J J, XING Y Z, et al. Analysis and evaluation of nutritive composition in the soft part of mangrove clam, Polymesoda erosa (Solander 1768)[J]. Journal of Southern Agriculture, 2015, 46(2): 308-312. DOI:10.3969/jissn.2095-1191.2015.2.308 |
| [5] |
CHATTERJI A, ANSARI Z A, INGOLE B S, et al. Indian marine bivalves:Potential source of antiviral drugs[J]. Current Science, 2002, 82(10): 1279-1282. |
| [6] |
YAP C K, EDWARD F B, TAN S G. Concentrations of heavy metals in different tissues of the bivalve Polymesoda erosa:Its potentials as a biomonitor and food safety concern[J]. Pertanika Journal of Tropical Agricultural Science, 2014, 37(1): 19-38. |
| [7] |
ONG M C, KAMARUZAMAN M I, CHUEN Y J, et al. Metals contamination using Polymesoda expansa(marsh clam) as bio-indicator in Kelantan river, Malaysia[J]. Malaysian Journal of Analytical Sciences, 2017, 21(3): 597-604. |
| [8] |
邢永泽, 农莹, 陆宇哲, 等. 红树蚬体内氧化逆境标志物对SCCPs暴露的响应[J]. 中国环境科学, 2017, 37(10): 3962-3971. XING Y Z, NONG Y, LU Y Z, et al. Response characteristics of oxidative stress biomarkers of Polymesoda erosa to exposure of SCCPs[J]. China Environmental Science, 2017, 37(10): 3962-3971. DOI:10.3969/j.issn.1000-6923.2017.10.041 |
| [9] |
农莹, 杨明柳, 邢永泽, 等. 红树蚬与歪红树蚬形态差异分析[J]. 广西科学院学报, 2015, 31(4): 268-272. NONG Y, YANG M L, XING Y Z, et al. Analysis on the morphological difference between Polymesoda erosa and Polymesoda expansa[J]. Journal of Guangxi Academy of Sciences, 2015, 31(4): 268-272. DOI:10.3969/j.issn.1002-7378.2015.04.008 |
| [10] |
周浩郎, 张俊杰, 邢永泽, 等. 广西红树蚬的分布特征及影响因素分析[J]. 广西科学, 2014, 21(2): 147-152. ZHOU H L, ZHANG J J, XING Y Z, et al. Characteristics of distribution and influential factors of mangrove clam, Polymesoda erosa (Solander 1768), in Guangxi[J]. Guangxi Sciences, 2014, 21(2): 147-152. |
| [11] |
周浩郎, 张俊杰, 杨明柳, 等. 廉州湾红树蚬的繁殖生物学研究[J]. 海洋科学, 2014, 38(12): 34-39. ZHOU H L, ZHANG J J, YANG M L, et al. The reproductive biology of the mangrove clam Polymesoda erosa (Solander 1768) in Lianzhou Bay[J]. Marine Sciences, 2014, 38(12): 34-39. DOI:10.11759/hykx20130514003 |
| [12] |
DOLOROSA R G, DANGAN-GALON F. Population dynamics of the mangrove clam Polymesoda erosa (Bivalvia:Corbiculidae) in Iwahig, Palawan, Philippines[J]. International Journal of Fauna and Biological Studies, 2014, 1(6): 11-15. |
| [13] |
李家彪, 柯长志, 康寿岭, 等.海洋调查规范第8部分海洋地质地球物理调查: GB/T 12763.8-2007[S].北京: 中国标准出版社, 2007. LI J B, KE C Z, KANG S L, et al.Specifications for oceanographic survey, Part 8: Marine geology and geophsics survey: GB/T 12763.8-2007[S].Beijing: Standards Press of China, 2007. |
| [14] |
国家海洋标准计量中心.红树林生态监测技术规: HY/T 081-2005[S].北京: 中国标准出版社, 2005. National Center of Ocean Standards and Metrology.Technical specification for eco-monitorinig of mangrove ecosystem: HY/T 081-2005[S].Beijing: Standards Press of China, 2005. |
| [15] |
RANSANGAN J, SOONT S. Occurrence and distribution of marsh clam, Polymesoda spp.in Marudu Bay, Sabah, Malaysia[J]. Open Journal of Marine Science, 2018, 8: 314-322. DOI:10.4236/ojms.2018.82017 |
| [16] |
YOSUA A P, EFRIVELDI, SIREGAR S H. Abundan-ce, distribution pattern and sex ratio of kerang lokan (Polymesoda expansa) in mangrove ecosystem of Liong River Estuary, Bantan District, Bengkalis Regency[J]. Jurnal Online Mahasiswa (JOM) Bidang Perikanan dan Ilmu Kelautan, 2016, 3(1). |
| [17] |
CLEMENTE S, INGOLE B. Recruitment of mud clam Polymesoda erosa (Solander, 1876) in a mangrove habitat of Choraoisland, Goa[J]. Brazilian Journal of Oceanography, 2011, 59(2): 153-162. DOI:10.1590/S1679-87592011000200004 |
| [18] |
HUXHAM M, RICHARDS M. Can postlarval bi-valves select sediment type during settlement? A field test with Macoma balthica(L.) and Cerastoderma edule(L.)[J]. Journal of Experimental Marine Biology and Ecology, 2003, 288(2): 279-293. DOI:10.1016/S0022-0981(03)00023-6 |
| [19] |
HOEY G V, DEGRAER S, VINCX M. Macrobenthic community structure of soft-bottom sediments at the belgian continental shelf[J]. Estuarine, Coastaland Shelf Science, 2004, 59(4): 599-613. DOI:10.1016/j.ecss.2003.11.005 |
| [20] |
INGOLE B S, NAIK S, FURTDO R, et al.Population characteristics of the mangrove clam Polymesoda (Geloina) erosa (Solander, 1786) in the Chorao mangroves, Goa[C].ICAR, Old Goa: National Conference on Coastal Agriculture, 2002(6/7): 211-212.
|
| [21] |
INGOLE B S, KUMARI L K, ANSARI Z A, et al. New record of mangrove clam Geloinaerosa (Solander, 1786) from the west coast of India[J]. Journal of the Bombay Natural History Society, 1994, 91: 338-339. |
| [22] |
ARGENTE F A T, ILANO A S.Population dynamics of mud clam Polymesoda expansa (Mousson 1849) (Bivalvia Corbiculidae) in Loay-Loboc River, Bohol, Philippines.A poster presented during the 45th annual FIFMS Convention.October 16-18, 2013, Legend Hotel, Palawan.2013.
|
| [23] |
MORTON B. The reproductive strategy of the mangrove bivalve Polymesoda (Geloina) erosa (Bivalvia:Corbiculoidea) in Hong Kong[J]. Malacological Review, 1985, 18(1/2): 83-90. |
| [24] |
JARERNPORNNIPAT A, THEPVORASUK V. Population structure and maturity of mud clam (Polymesoda erosa) in mangrove forest along Bandon Bay, Thailand.in 3rd International Fisheries Symposium.Eastern Convention Center, Ambassador City Jomtien, Pattaya, Thailand.2013.
|
 2018, Vol. 25
2018, Vol. 25 


