2. 广西石油资源加工与过程强化重点实验室, 广西南宁 530004
2. Guangxi Key Laboratory of Petrochemical Resources Processing and Process Intensification Technology, Nanning, Guangxi, 530004, China
【研究意义】人类正面临着发展与环境的双重压力。随着社会经济的发展,大量的化石资源被消耗,同时也对大气和水体造成严重的污染。生物质能源由于易获得、具有可再生性、燃烧碳中性、加工简便等优点[1-3],是化石资源的良好替代产品,因而受到广泛的关注。生物质通过热解可产生挥发性气体、生物半焦及生物油,生物半焦可用于生产富含H2气体合成气,从而实现生物半焦的清洁利用。但生物半焦反应性的高低对制备合成气的气化反应过程起着重要的影响,因此制备高反应性的生物半焦对生物质的高效清洁有重要意义。【前人研究进展】由于半焦的气化过程是一个速率控制步骤,因此半焦的反应性高低对气化反应的转化率有重要影响。在气化反应中,对半焦的反应性的影响有多种因素,如热解温度、热解气氛、热解过程中的催化剂等,Tay等[4]研究褐煤在水蒸气、CO2和低浓度O2中热解所产半焦的反应性研究中发现,水蒸气的引入可显著提高半焦的反应性。生物质热解过程中碱金属或碱土金属的存在起着明显的催化作用[5-6],并可提高半焦的反应性[7-8]。铁是生物质中存在的微量元素之一,热解过程中Fe也起着催化作用,热解后含Fe3+的半焦具有较强磁性,可用于吸附水中的重金属离子如Hg、Ni、Cr等[8-10],Zhang等[11]在研究中发现用生物半焦浸渍Fe2O3对污水中的重金属砷去除表现出优异的吸附能力,并且生物炭网络可以有效防止γ-Fe2O3颗粒的聚集。因此,研究Fe催化热解生物质制备半焦及其反应性具有良好的意义。【本研究切入点】以桉木为原料,使用Fe(NO)3进行浸渍,并使Fe3+附着在生物质上,通过快速热解制备出含铁的生物半焦,考察铁在热解过程中对生物半焦结构及其反应性的影响。【拟解决的关键问题】通过对硝酸铁催化桉木热解的研究,研究制备高反应性桉木半焦的有效方法。
1 材料与方法 1.1 材料试验所用桉木来自南宁市丰林木业集团股份有限公司, 在阳光下晾晒干燥,然后粉碎并筛分,得到桉木屑原样。盐酸、氢氟酸和Fe(NO)3·9H2O购买自南宁市蓝天实验设备有限公司(分析纯)。
1.2 桉木屑的脱灰及催化剂负载先将桉木屑原样在105℃下干燥24 h,然后粉碎过筛,选取粒径为50~120 μm的桉木粉,先用10 mol·L-1的HCl(5 g桉木粉使用100 mL的10 mol·L-1 HCl)在室温下洗涤24 h,过滤后用150 mL HF(22.6 mol·L-1)继续在室温下洗涤24 h,过滤,滤渣用去离子水反复洗涤,直到滤液中检测不到Cl-和F-的存在,最后将洗涤后的桉木粉在80℃下真空干燥24 h,冷却密闭保存,得到脱灰样。
取脱灰样分别用0.17 mol·L-1、0.35 mol·L-1和0.52 mol·L-1的Fe(NO)3溶液浸泡,室温下搅拌3 d,然后抽滤,滤渣放入105℃的101系列电热恒温鼓风干燥箱中干燥24 h,得到负载Fe3+的桉木样。
1.3 桉木半焦的制备取上述若干桉木样放入压片机中,以不超过5 MPa的压力进行压片,保持2 min后取出样品。待自制的石英管式热解炉(内径为25 mm)预热并稳定到设定的温度30 min后,将样品快速投入反应器中进行热解。本实验中热解温度分别设定为600℃、650℃、700℃、750℃、800℃,热解30 min后取出管式反应器,待温度降至室温后取出样品,装入样品袋中保存,并进行后续相关表征实验。
1.4 工业分析及元素分析桉木的工业分析参照美国材料与试验协会ASTM(E1755-01)标准进行,测定样品中的挥发分(V),灰分(A),水分(M)和固定碳(FC)的含量,采用元素分析仪(PE2400Ⅱ)测定样品中碳(C)、氢(H)、氮(N)和氧(O)的质量分数。参照GB/T 30725—2014,通过电感耦合等离子体-光发射光谱法(ICP-OES,Optima 7000,PerkinElmer)检测桉木粉原样中主要的金属含量。
1.5 热重分析使用热重分析仪(TG209 F3,德国耐驰仪器制造有限公司)测量桉木半焦的反应性,测定方法参考Shim和Hurt[12]。每个实验样品质量约为5 mg,高纯氮流量为100 mL·min-1,由室温以20℃·min-1升至100℃,恒温30 min,再以7℃·min-1升至450℃,恒温,使失重率稳定并低于3%以下,迅速将高纯氮切换为压缩空气,压缩空气的流量为100 mL·min-1,并开始连续记录燃烧反应过程中的温度和失重情况。
1.6 拉曼光谱分析使用激光拉曼光谱仪(inVia Reflex,英国雷尼绍公司)记录拉曼光谱,样品表面的激光功率约5 mW,激发波长为532 nm,该光谱记录范围为500~3 500 cm-1。
1.7 XRD分析使用配备Cu管的粉末衍射仪(DX-2700A,丹东浩元仪器设备有限公司)观察桉木半焦样品的XRD谱,扫描范围为5~90°,扫描速度0.2°·s-1。
1.8 生物半焦结构计算采用Bragg方程和Scherrer公式对半焦的晶格参数进行计算。由于半焦结构类似于煤,所以可以利用煤结构的计算分析方法与公式进行计算,公式如下:
| $\begin{array}{l} {\mathit{d}_{002}} = \frac{\lambda }{{2\sin {\mathit{\theta }_{002}}}}, \\ {L_\mathit{c}} = \frac{{{K_1}\mathit{\lambda }}}{{{\mathit{\beta }_{002}}\cos {\mathit{\theta }_{{\rm{002}}}}}}, \\ {L_a} = \frac{{{K_2}\mathit{\lambda }}}{{{\mathit{\beta }_{{\rm{100}}}}\cos {\mathit{\theta }_{100}}}}, \end{array} $ |
式中λ为入射波长,单位为Ǻ;对于CuKα射线,λ=1.541 78 Ǻ;θ为衍射角(2θ也为衍射角), 单位为(°); β为衍射峰的半高宽,单位为rad; K为系数, 采用CuKα射线时, K1=0.94, K2=1.84;下标002,100为衍射峰的峰位。d为半焦的芳香层间距(nm),La为芳香层片堆积高度(nm),Lc为芳香层片直径(nm)。
1.9 半焦的反应性分析样品固定碳气化转化率(x)根据以下等式计算:
| $x = \frac{{{m_0} - {m_\mathit{t}}}}{{{m_0} - {m_\infty }}}, $ |
式中x是固定碳转化的程度,m0表示样品的初始质量,mt是当时样品的瞬时t质量,m∞是样品的最终质量。
桉木焦的反应性可以用下面的公式进行计算:
| $R = - \frac{1}{W}\frac{{{\rm{d}}\mathit{W}}}{{{\rm{d}}\mathit{t}}}, $ |
其中W和t分别是以干基计算的某时刻的重量和时间。
1.10 傅里叶红外分析生物质样品中的官能团采用FTIR光谱仪(Nicolet iS 50,美国赛默飞世尔)表征,记录从400 cm-1到4 000 cm-1的分辨率为8的FTIR光谱,由64次累积扫描得到。
2 结果与分析 2.1 不同浓度的Fe(NO3)3催化生物半焦的反应性及结构表征 2.1.1 桉木粉工业分析及元素分析分析结果如表 1所示。
| 表 1 桉木粉工业分析及元素分析 Table 1 Industrial analysis and elemental analysis of eucalyptus industry |
由图 1可知,随着Fe3+浓度的升高,生物半焦的反应性呈现先增加后减少的趋势。Zou等[13]在研究碱金属K的存在对纤维素热裂解催化重整的影响时发现,少量的碱金属加速生物质热解过程中小分子气体的释放,但随着K添加量的增加,氢的收率降低。由此可推断,金属Fe3+的浓度较低时,热解过程加速小分子气体的释放,从而使生物半焦反应性增加;但是Fe3+的浓度较高时,释放出的氢会在热解的第二阶段促进小芳香环向大环聚并,导致半焦的反应性降低。
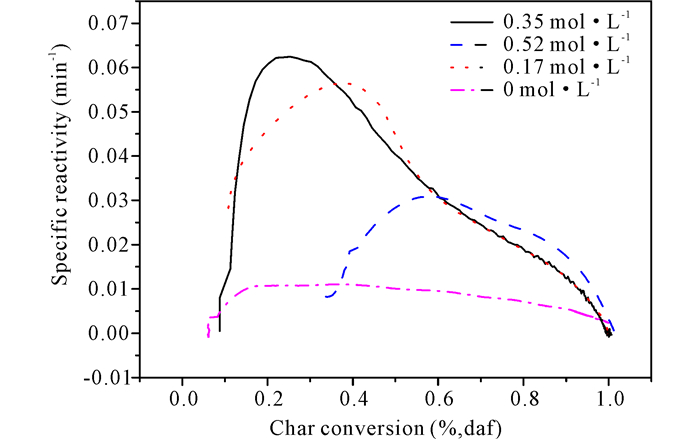
|
图 1 不同浓度的Fe(NO3)3催化热解桉木制备生物半焦的反应性曲线 Fig.1 Reactivity curve of biochar prepared by catalytic pyrolysis eucalyptus at different concentrations of Fe(NO3)3 |
图 2a是不同浓度的Fe(NO3)3催化热解产半焦的拉曼曲线。采用文献[14]的方法,对拉曼光谱采用oringin 8.0软件进行10个峰的分峰拟合处理(图 2b),各个峰所代表的半焦内部结构如文献[14]所述,D峰主要代表着半焦中大于6的大稠环芳香烃结构,而GR+VR+VL峰主要代表数量为3~5的小稠环芳香烃系统,也就是非定型碳结构;此外VL、VR主要贡献脂肪烃及羧基化合物结构,Gr主要与小环系统有关,因此,ID/IG和ID/I(GR+VR+VL)常用表示生物半焦中大环系统和小环系统的比例。由图 2b可知浓度为0.35 mol·L-1的Fe3+浸渍法催化后生物半焦的ID/IG数值小于0.17 mol·L-1和0.52 mol·L-1 Fe3+浸渍法催化的;ID/I(GR+VR+VL)的规律则正好相同。由此可推测,浓度为0.35 mol·L-1的Fe3+催化热解时,催化剂降低反应的活化能,热解过程的温度下降,相同温度下生物半焦中的可发挥发组分由于金属Fe3+的作用,可产生更多的可挥发组分,反应性变好,但是当Fe3+的浓度过高时,加快了挥发组分的逸出,热解反应进入晶化过程,半焦内部结构更加规整,反应性差,所以在一定范围内,Fe3+的浓度增加,生物半焦反应性会变好,但是超过一定范围,生物半焦反应性反而会变差。
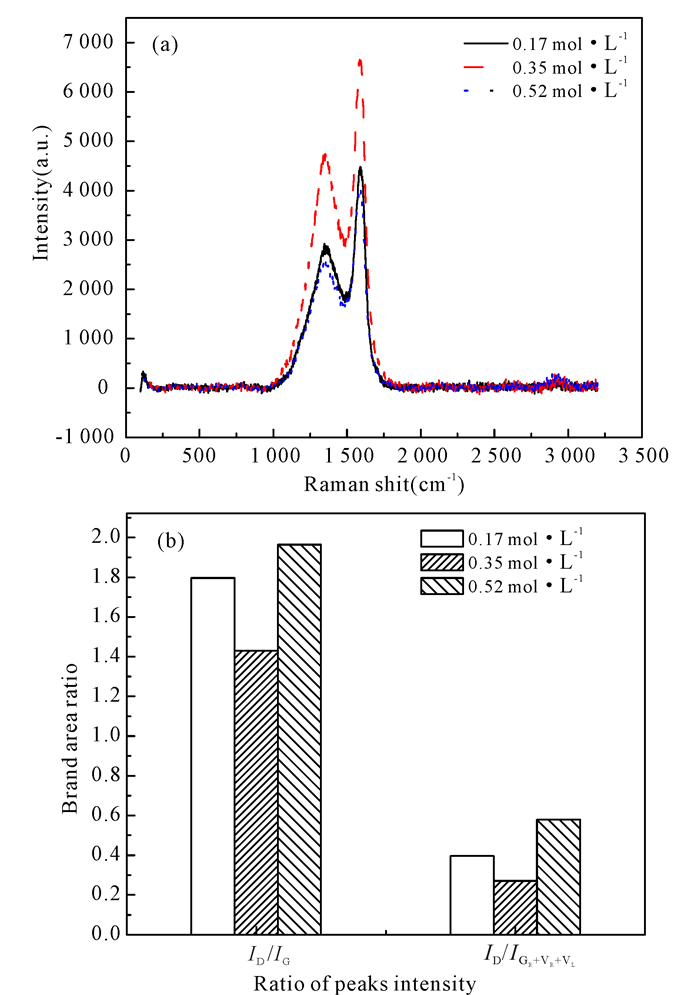
|
图 2 不同浓度的Fe(NO3)3催化桉木制备生物半焦的拉曼曲线(a)以及拉曼相关参数(b) Fig.2 (a) Raman curve and (b) Raman related parameters of biochar prepared by catalytic of eucalyptus at different concentrations of Fe(NO3)3 |
由图 3可以看出,0.35 mol·L-1 Fe3+催化后得到的生物半焦的(002)峰的峰宽大于0.17 mol·L-1和0.35 mol·L-1 Fe3+催化后得到的,峰宽变宽说明半焦的晶化程度低,半焦内部结构紊乱度大,与O2发生燃烧反应性好。
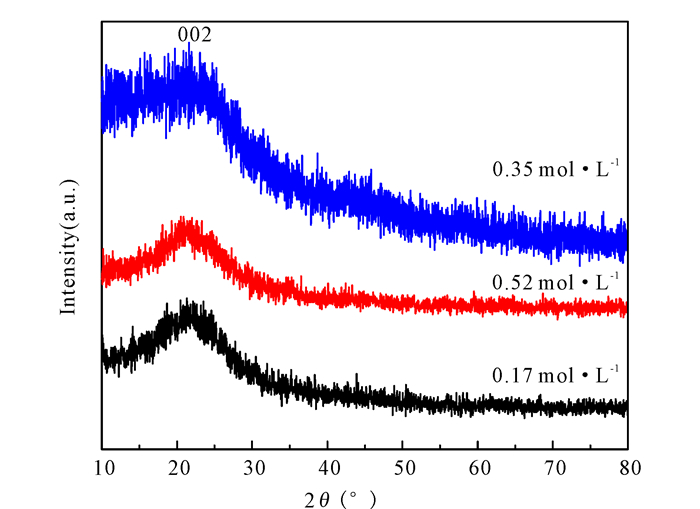
|
图 3 不同浓度Fe3+催化热解桉木制备半焦的XRD曲线 Fig.3 XRD curve of coke prepared by catalytic pyrolysis of eucalyptus at different concentrations of Fe3+ |
由Bragg方程和Scherrer公式对催化热解生物半焦芳香结构进行计算(表 3),从中可以看出,经过0.35 mol·L-1 Fe3+催化后的桉木热解制备得到的生物半焦的d002数值大于0.17 mol·L-1和0.52 mol·L-1 Fe3+催化后的,而Lc和La的数值恰好相反,说明在0.35 mol·L-1 Fe3+催化后的生物半焦的芳香化程度低于0.17 mol·L-1和0.52 mol·L-1Fe3+催化后的,层直径变小。在低浓度下,Fe3+扮演催化剂的角色,抑制生物半焦的芳香化趋势,从而增加生物半焦的反应性;随着Fe3+浓度的增加,生物半焦的反应性变好,但是超过一定范围后,生物半焦的反应性变差。这可能是由于Fe3+会发生团聚现象,分散性变差,从而无法发挥全部的催化作用,也就是说Fe3+的催化效果变差,从而导致生物半焦的反应性变差,所以随着Fe3+浓度的进一步增加,催化后的生物半焦的反应性呈现先增大后减小的趋势。
| 表 3 生物半焦结构计算结果 Table 3 Calculation results of biochar structure |
从图 4中可以看出,热解温度越高,经0.35 mol·L-1的Fe3+催化热解制备的半焦的反应性越低。到800℃时,在反应性测试条件下,半焦基本不与空气发生反应,这是由于热解温度越高,半焦晶化程度高,半焦中的碳结构基本为石墨化碳,在450℃条件下半焦很难与O2发生燃烧反应,反应性明显下降。
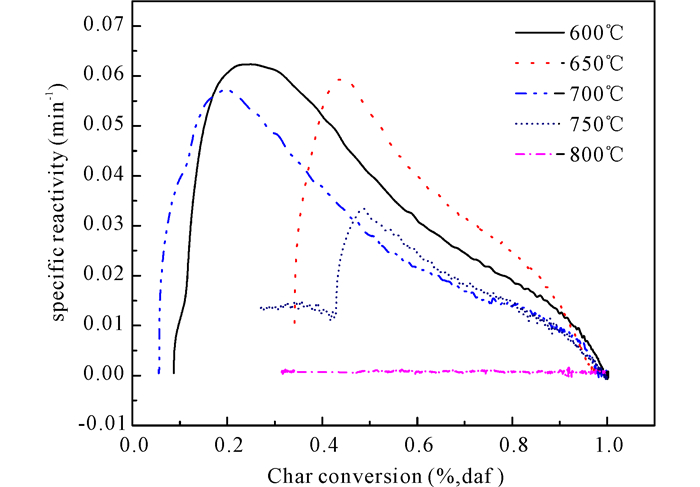
|
图 4 不同热解温度下桉木热解制备半焦的反应性曲线 Fig.4 Reactivity curve of coke prepared by pyrolysis of eucalyptus at different pyrolysis temperatures |
由图 5a可以清楚地看出,经过Fe3+催化后,桉木粉在不同热解温度下热解产半焦的拉曼光谱的峰强随着温度的升高,强度不断减弱。由图 5b可知,随着热解温度的升高,热解后得到的生物半焦的ID/IG和ID/I(GR+VR+VL)的数值不断升高,说明随着热解温度的升高,含有脂肪链及含氧官能团小的多芳烃结构明显减少,半焦结构转变为交联结构的芳香环;随着温度的升高ID/IG变大,表明多于6个苯环的芳香环含量增加,这是由于氢化芳香族化合物发生脱氢反应,造成芳环的增大,制备得到的生物半焦的石墨化程度高,反应性差。所以在较低的热解温度下制备得到的生物半焦反应性更好,而热解温度越高,生物半焦的结构越趋近于石墨化,结构更稳定,反应性差,这与反应性数据是相吻合的。

|
图 5 不同热解温度下热解桉木制备生物半焦的拉曼曲线(a)和拉曼相关参数(b) Fig.5 (a)Raman curve and (b)Raman related parameters of coke prepared by pyrolysis of eucalyptus at different pyrolysis temperatures |
由图 6可以看出,随着热解温度的升高,XRD的图谱曲线变陡;当达到800℃时,(002)峰晶化明显,说明随着热解温度的升高,生物半焦的结构越来越趋近石墨化,越来越稳定,反应性相应变差。
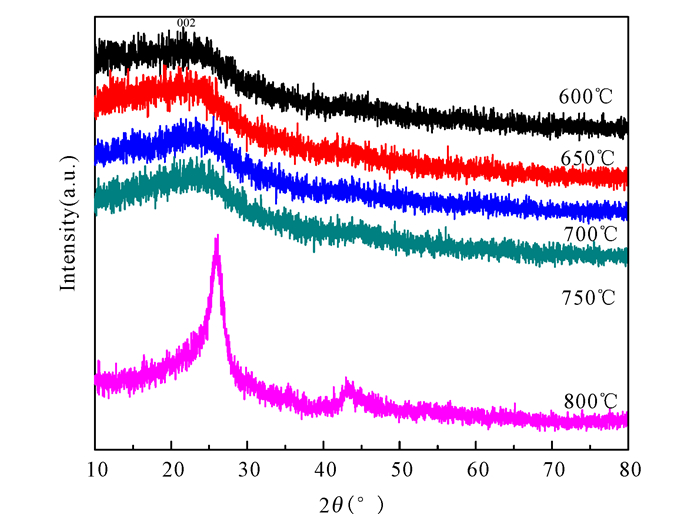
|
图 6 不同热解温度下热解桉木制备半焦的XRD曲线 Fig.6 XRD curve of coke prepared by pyrolysis of eucalyptus at different pyrolysis temperatures |
由Scherrer方程方程可以计算得到生物半焦芳香结构数据。由表 4看出,在600~800℃的温度范围内,600℃下的d002数值最大,随着温度升高,d002数值逐渐减小,而Lc和La的数值恰好相反。这是由于在低温热解温度下,生物半焦中存在大量的活性含氧基团,由于支链及功能基团的位阻效应,d002数值大;随着热解温度的升高,这些基团及脂肪烃侧链相继发生断裂,生成小分子的气体产物释放出来,位阻作用减弱,因而d002变小,半焦向规整的石墨化碳结构转变。
| 表 4 生物半焦结构计算结果 Table 4 Calculation results of biochar structure |
不同热解温度下桉木半焦的红外峰结果有所不同,由图 7中各峰位可知,3 500~3 300 cm-1处是由于半焦中的-OH伸缩振动而引起的,2 930 cm-1处是代表CH2对称伸缩振动,1 560 cm-1处代表的是-COOH及羰基的伸缩振动峰,1 000~1 100 cm-1处代表半焦中的C-OH酚羟基结构,873 cm-1处代表芳环结构上C-H键结构。此外由图中还可以发现,热解温度越高,桉木半焦在1 560 cm-1处的红外吸收峰强度逐渐变小甚至消失,这是由于热解过程中-COOH及羰基由于热裂解而被脱出,温度越高,脱出率越大,而含氧官能团的脱除降低了半焦的反应性。
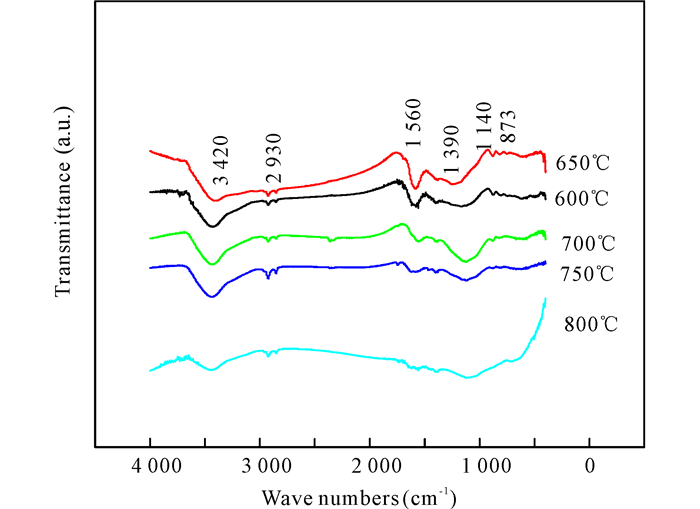
|
图 7 不同热解温度下热解桉木制备半焦的红外曲线 Fig.7 Infrared curve of coke prepared by pyrolysis of eucalyptus at different pyrolysis temperatures |
通过以上研究可以得到以下结论:
(1) Fe(NO3)3催化可明显提高桉木热解生物焦的反应性,随着Fe(NO3)3浓度由0.17 mol·L-1增加到0.35 mol·L-1,反应性由0.03 min-1升到0.06 min-1,但随着浓度的继续增加,反应性变化不明显。
(2) 600℃下Fe(NO3)3催化热解增加半焦结构中的d002间距,由催化前的0.341 nm增加至0.382 nm。
(3) 在0.35 mol·L-1 Fe3+催化下,随着温度的升高,热解焦反应性下降明显,在800℃时,生物焦反应性基本为0,产物几乎为石墨化炭结构。
| [1] |
刘荣厚. 生物质快速热裂解制取生物油技术的研究进展[J]. 沈阳农业大学学报, 2007, 38(1): 3-7. LIU R H. Present situation of biomass fast pyrolysis for bio-oil production[J]. Journal of Shenyang Agricultural University, 2007, 38(1): 3-7. |
| [2] |
欧阳平凯, 陈可泉, 贾红华, 等. 低劣生物质制备生物甲烷的研究进展与展望[J]. 广西科学, 2014, 21(1): 1-5. OUYANG P K, CHEN K Q, JIA H H, et al. Progress and prospect of biomethane production with low-valued biomass as material[J]. Guangxi Sciences, 2014, 21(1): 1-5. |
| [3] |
胡东南. 农林废弃物生物质压块燃料[J]. 广西科学院学报, 1994, 10(2): 68-69. HU D N. An organism pressing fuel derived from the trash of farming and forestry[J]. Journal of Guangxi Academy of Sciences, 1994, 10(2): 68-69. |
| [4] |
TAY H L, LI C Z. Changes in char reactivity and structure during the gasification of a victorian brown coal:Comparison between gasification in O2 and CO2[J]. Fuel Processing Technology, 2010, 91(8): 800-804. DOI:10.1016/j.fuproc.2009.10.016 |
| [5] |
廖艳芬, 王树荣, 骆仲泱, 等. 钙盐催化纤维素快速热裂解机理试验研究[J]. 太阳能学报, 2005, 26(5): 654-659. LIAO Y F, WANG S R, LUO Z Y, et al. Catalysis mechanism of calcium salt in cellulose rapid pyrolysis[J]. Acta Energiae Solaris Sinica, 2005, 26(5): 654-659. DOI:10.3321/j.issn:0254-0096.2005.05.011 |
| [6] |
王树荣, 廖艳芬, 文丽华, 等. 钾盐催化纤维素快速热裂解机理研究[J]. 燃料化学学报, 2004, 32(6): 693-698. WANG S R, LIAO Y F, WEN L H, et al. Catalysis mechanism of potassium salt during rapid pyrolysis of cellulose[J]. Journal of Fuel Chemistry and Technology, 2004, 32(6): 693-698. |
| [7] |
QUYN D M, WU H W, LI C Z. Volatilisation and catalytic effects of alkali and alkaline earth metallic species during the pyrolysis and gasification of Victorian brown coal.Part 1.Volatilisation of Na and Cl from a set of NaCl-loaded samples[J]. Fuel, 2002, 81(2): 143-149. DOI:10.1016/S0016-2361(01)00127-2 |
| [8] |
KEOWN D M, LI X J, HAYASHI J I, et al. Evolution of biomass char structure during oxidation in O2 as revealed with FT-Raman spectroscopy[J]. Fuel Processing Technology, 2008, 89(2): 1429-1435. |
| [9] |
YANG J P, MA S, ZHANG J Y, et al. Mercury removal by magnetic biochar derived from simultaneous activation and magnetization of sawdust[J]. Environment Science & Technology, 2016, 50(21): 12040-12047. |
| [10] |
RAWAL A, JOSEPH S D, HOOK J M, et al. Mineral-biochar composites:Molecular structure and porosity[J]. Environ Sci Technol, 2016, 50(14): 7706-7714. DOI:10.1021/acs.est.6b00685 |
| [11] |
ZHANG M, GAO B, VARNOOSFADERANI S, et al. Preparation and characterization of a novel magnetic biochar for arsenic removal[J]. Bioresource Technology, 2013, 130: 457-462. DOI:10.1016/j.biortech.2012.11.132 |
| [12] |
SHIM H S, HURT R H. Thermal annealing of chars from diverse organic precursors under combustion-like conditions[J]. Energy & Fuels, 2000, 14(2): 340-348. |
| [13] |
ZOU J, YANG H P, ZENG Z W, et al. Hydrogen production from pyrolysis catalytic reforming of cellulose in the presence of K alkali metal[J]. International Journal of Hydrogen Energy, 2016, 41(25): 10598-10607. DOI:10.1016/j.ijhydene.2016.04.207 |
| [14] |
LI T T, ZHANG L, DONG L, et al. Effects of gasification atmosphere and temperature on char structural evolution during the gasification of collie sub-bituminous coal[J]. Fuel, 2014, 117(Part B): 1190-1195. |
 2018, Vol. 25
2018, Vol. 25 


