2. 广西艾滋病防治研究重点实验室, 广西南宁 530021;
3. 广西医科大学公共卫生学院, 广西南宁 530021;
4. 广西科技经济开发中心, 广西南宁 530022
2. The Key Laboratory of AIDS Prevention and Research, Nanning, Guangxi, 530021, China;
3. Public Health of Guangxi Medical University, Nanning, Guangxi, 530021, China;
4. The Center of Guangxi Science and Technology Economic Development, Nanning, Guangxi, 530022, China
【研究意义】广西是我国速生桉种植面积最大的省份,速生桉的药用价值例如对于肝癌的辅助治疗作用以及对肿瘤细胞生长的影响等值得进行深入研究和探讨。【前人研究进展】速生桉属桃金娘科植物,其皮、树脂、叶、花、果、种子、木材皆有医疗用途,如桉叶油具有抗菌、抗氧化及杀虫等作用[1-2];速生桉中的小帽桉多酚和富含抗氧化剂成分能抑制胰腺癌细胞的增殖[3]。有研究发现,在肝癌研究方面,速生桉的树脂能抑制肝癌细胞株HepG2细胞增殖,其机制在于将HepG2细胞阻滞于G0/G1期,诱导HepG2细胞凋亡[4]。【本研究切入点】广西是全国肝癌高发区,肝癌发病率在肿瘤登记地区居于全国第二位,中标发病率为36.93/10万、中标死亡率为30.29/10万,高于全国水平[5],且发病率和死亡率呈现逐年上升的趋势[6],这些肿瘤患者约70%确诊时已处于晚期,不适合手术治疗[7],据此针对控制肿瘤的发生、发展、细胞失控性增殖和肿瘤细胞凋亡寻找新的肝癌治疗候选药物,可为发现疾病治疗新型先导化合物提供依据。【拟解决的关键问题】通过观察速生桉叶水提物(Eucalyptus robusta leaf water extract,ELWE)对HepG2细胞增殖和诱导细胞凋亡的影响,在分子水平上探讨可能的作用机制,为速生桉用于肝癌预防和治疗提供参考。
1 材料与方法 1.1 实验提取物和细胞速生桉叶采集于广西南宁市郊区的桉树林,采集时间为春季,选取位于速生桉树中部叶龄为3年生树叶,叶片大小控制为叶长8~17 cm,叶宽3~7 cm。速生桉叶片经蒸馏水冲洗,风干, 粉碎,以烧杯为容器,按照1:6的质量比加水煎煮至溶液体积浓缩为原先的1/3,经滤纸过滤残渣后收取速生桉水提液,2 000 g、30 min常温离心后取上清,最后用0.45 μm滤膜过滤残渣得到实验用的速生桉叶水提物初始溶液。
人肝癌细胞系HepG2细胞,由本实验室保存。
1.2 主要试剂和仪器试剂:二甲基亚矾(DMSO)购自Sigma公司;DMEM细胞培养基、胎牛血清(FBS)、青霉素、链霉素均购自Gibco公司;无菌PBS购自HycHyClone公司。即用型细胞核染料DAPI溶液购自北京索莱宝科技有限公司;荧光染料CFSE购自东仁化学科技上海有限公司。6孔、24孔、96孔细胞培养板均购自Greiner Bio-One公司。MTT细胞增殖及细胞毒性检测试剂盒购自江苏凯基生物技术股份有限公司。RIPA裂解液购自杭州联科生物技术公司;蛋白酶抑制剂(PMSF)购自武汉Boster生物工程公司;β-actin鼠单克隆抗体(货号:TA-09)购自Abcam公司,Caspase-3兔单克隆抗体(货号:9662S)购自美国CST公司;鼠二抗(Goat polyclonal Secondary Antibody to Mouse IgG H & L,HRP)(货号:ab97023)、兔二抗(Goat polyclonal Secondary Antibody to Rabbit IgG H & L,HRP)(货号:ab6741)购自英国Abcam公司。PVDF(0.22 μm)膜、PBST(20×)购自于北京索莱宝公司,脱脂奶粉购自于伊利实业集团股份公司。Trizol Reagent购自美国Thermo Fisher Scientific公司;氯仿购自国药集团化学试剂有限公司;异丙醇购自上海江莱生物科技有限公司;酒精购自成都科龙生物有限公司;无酶水(DNase/RNase-Free water)购自天根生化科技北京有限公司;逆转录试剂盒、荧光定量PCR试剂购自大连宝生物工程公司。β-catenin、Tcf-4、CD44v6的引物由生工生物工程上海股份有限公司合成。
仪器:二氧化碳培养箱(Thermo公司);全自动荧光倒置显微镜(型号:Evos FL Auto2,美国Thermo Scientific公司);多功能酶标仪(BioTek公司);ABI StepOnePlusTM荧光定量PCR仪(Applied Biosystems公司);ODYSSEY双红激光成像仪(LI-COR公司)。
1.3 方法 1.3.1 细胞培养与传代人肝癌细胞系HepG2细胞用含10%灭活的FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基于37℃、5%CO2饱和湿度培养箱中培养,用0.25%胰酶37℃消化细胞5~10 min后,加入5倍培养基将细胞充分吹打混匀,按1:3比例进行传代培养。
1.3.2 实验分组和药物处理浓度设定本研究设实验组、阴性对照组。实验组分别为0倍、5倍、10倍、30倍、50倍稀释的ELWE。阴性对照组为加入等体积的PBS处理HepG2细胞,每组设5个重复孔。
1.3.3 染色法观察ELWE处理后细胞核形态的变化取对数生长的细胞,用0.25%胰酶37℃消化细胞制备成单细胞悬液,以5×105个/孔的密度接种于24孔板,每孔900 μL,37℃的5%的CO2培养箱培养,当细胞生长至融合度约80%时,分别加入100 μL稀释5倍和10倍的ELWE,继续培养24 h、48 h、72 h。进行细胞核形态学观察,用预冷的PBS洗细胞2次后加入100 μL DAPI在室温避光染色5~10 min,吸除DAPI染色液,用预冷的PBS洗细胞2次。每孔加入稀释200倍的荧光染料CFSE,室温避光孵育30 min,弃去染色液用预冷的PBS洗2次,之后置于荧光倒置显微镜下观察。
1.3.4 MTT实验检测ELWE处理对细胞生长的影响和IC50的计算取对数生长的细胞,用0.25%胰酶37℃消化细胞制备成单细胞悬液,以1×105个/孔的密度接种于96孔板,每孔90 μL,37℃的CO2培养箱培养,当细胞生长至融合度约80%时,加入稀释0倍、5倍、10倍、30倍、50倍的100 μL ELWE,培养箱中继续培养48 h。每孔加入1×MTT液(1 mg/mL) 50 μL,放置4 h后,吸弃培养液,并加入150 μL DMSO,轻度振荡10 min,于550 nm波长处测定光吸收值(OD550)。按下列公式计算细胞生长抑制率,细胞生长抑制率(%)=1-[(AELWE 处理组-A空白组)/(A阴性对照组-A空白组)]×100%。用SPSS软件计算IC50。每次每组设5个重复孔。
1.3.5 Western Blot检测ELWE处理后caspase-3蛋白表达的变化提取稀释10倍ELWE处理48 h后的HepG2细胞总蛋白,经12%聚丙烯酰胺凝胶电泳分离,转到PVDF膜上,5%脱脂牛奶封闭后,一抗(1:1 000)4℃孵育过夜,PBST洗膜3次后,二抗(1:15 000)避光孵育1 h后、PBST洗膜3次,用ODYSSEY双红激光成像仪检测波长的光吸收。
1.3.6 荧光定量PCR检测ELWE对β-catenin、Tcf-4、CD44v6基因的影响提取稀释10倍ELWE处理48 h的HepG2细胞总RNA,将mRNA反转录成cDNA,以cDNA为模板,β-catenin用上游引物5′-GCCAAGTGGGTGGTATAGAGG-3′和下游引物5′-CGGGACAAAGGGCAAGAT-3′进行扩增;Tcf-4用上游引物5′-CAGAAGGCAGAGCGTGAG-3′和下游引物5′-TTTGAAAGCCTCGTTGATGT-3′进行扩增;CD44v6用上游引物5′-TTTGAAAGCCTCGTTGATGT-3′和下游引物5′-CCTCCTGAAGTGCTGCTCC-3′进行扩增;看家基因GAPDH用上游引物5′-GGTGGTCTCCTCTGACTTCAACA-3′和下游引物5′-GTTGCTGTAGCCAAATTCGTTGT-3′进行扩增。RT-RT-PCR反应体系总体积为25 μL,其中12.5 μL Hotstart Fluo-PCR mix,8 μL ddH2O,0.5 μL ROX,上下游引物各1 μL,2 μL反转录cDNA溶液。
1.4 统计学处理计量资料均数以(x±s)表示,不同处理组间以及处理组与阴性对照组的计量资料统计采用成组t检验,多组间统计采用单因素方差分析(One-way ANOVA)。统计学分析使用SPSS22.0软件进行分析。P < 0.05为差异有统计学意义。
2 结果与分析 2.1 ELWE对HepG2细胞增殖抑制作用的细胞形态学观察荧光显微镜观察用5倍和10倍ELWE原液稀释物处理HepG2细胞24 h、48 h、72 h后,细胞经DAPI核染色和CFSE细胞质染色,结果如图 1所示。阴性对照组的细胞形态规则,大小均一、生长状态好,细胞核染色均匀(图a~c);而5倍和10倍稀释处理HepG2细胞48 h、72 h时,形态变小,胞浆浓缩,细胞核发生改变,部分细胞核出现断裂、边缘化和凋亡小泡等明显的凋亡特征,见箭头指向(图e、f、h、i)。5倍和10倍ELWE原液稀释物处理HepG2细胞24 h,细胞生长未受到明显的抑制,5倍和10倍ELWE原液稀释物处理HepG2细胞72 h,细胞死亡数量大于48 h的,这可能是经过72 h细胞生存环境已经不利于细胞生存所致,故后续实验以48 h作为ELWE处理时间。
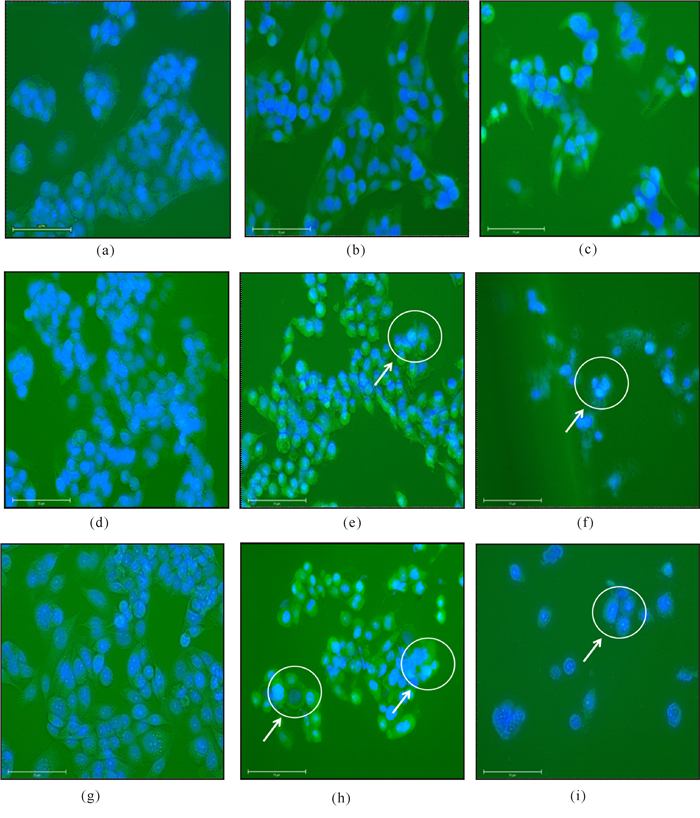
|
(a)24 h对照组细胞核形态;(b)48 h对照组细胞核形态;(c)72 h对照组细胞核形态;(d)稀释10倍ELWE处理24 h细胞核形态;(e)稀释10倍ELWE处理48 h细胞核形态;(f)稀释10倍ELWE处理72 h细胞核形态;(g)稀释5倍ELWE处理24 h细胞核形态;(h)稀释5倍ELWE处理48 h细胞核形态;(i)稀释5倍ELWE处理72 h细胞核形态 (a)Nudear morphology of control group for 24 h; (b)Nudear morphology of control group for 48 h; (c)Nudear morphology of control group for 72 h; (d)10 times dilutions of ELWE initial concentration treatment cells nuclear for 24 h; (e) 10 times dilutions of ELWE initial concentration treatment cells nuclear for 48 h; (f)10 times dilutions of ELWE initial concentration treatment cells nuclear for 72 h; (g) 5 times dilutions of ELWE initial concentration treatment cells nuclear for 24 h; (h) 5 times dilutions of ELWE initial concentration treatment cells nuclear for 48 h; (i) 5 times dilutions of ELWE initial concentration treatment cells nuclear for 72 h 图 1 免疫荧光观察不同处理组和不同处理时间产生的细胞核聚集现象(40×10) Fig.1 Immunofluorescence microscopic observation of nuclear condensation by DAPI and CFSE stains after ELWE treatments(40×10) |
分别用稀释0倍、5倍、10倍、30倍、50倍的ELWE处理HepG2细胞48 h,了解ELWE对HepG2细胞生长的影响。HepG2细胞抑制率分别为(81.59±3.61)%、(44.13±10.93)%、(25.93±8.37)%、(17.37±7.72)%、(8.05±8.03)%,比较差异具有统计学意义(F=25.79,P=0.002),各个浓度的ELWE对HepG2的细胞均具有抑制作用(图 2)。稀释5倍与稀释10倍ELWE处理HepG2细胞48 h细胞生长抑制率比较,差异具有统计学意义(P < 0.05)。经计算,48 h IC50位于4.30倍ELWE稀释计算浓度,据此,本研究后续实验采用稀释10倍的半致死剂量的ELWE处理HepG2细胞,48 h检测各项分子指标。
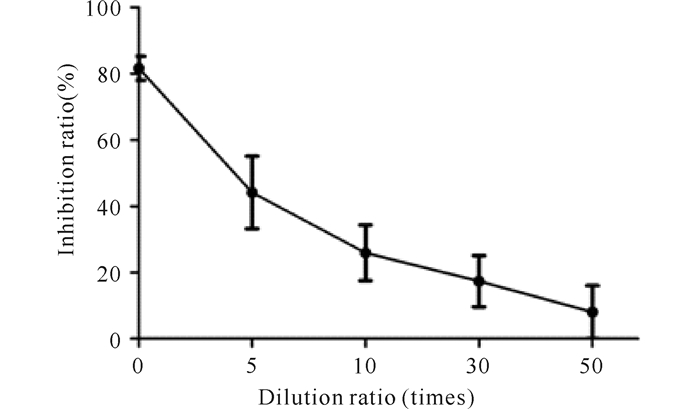
|
图 2 不同浓度ELWE处理HepG2细胞48 h细胞生长的抑制效果 Fig.2 Inhibitory effect of different ELWE dilution treatments after 48 h in HepG2 cells |
为了探讨ELWE是否会导致HepG2细胞凋亡,检测细胞凋亡的最典型蛋白caspase-3的表达情况。用稀释10倍ELWE处理HepG2细胞,48 h收集细胞并提取蛋白质,用Western Blot检测蛋白的表达水平,同时以对照组为对照,结果如图 3显示,与对照组相比,实验组的caspase-3蛋白表达水平显著上调,比较差异具有统计学意义(P < 0.01)。
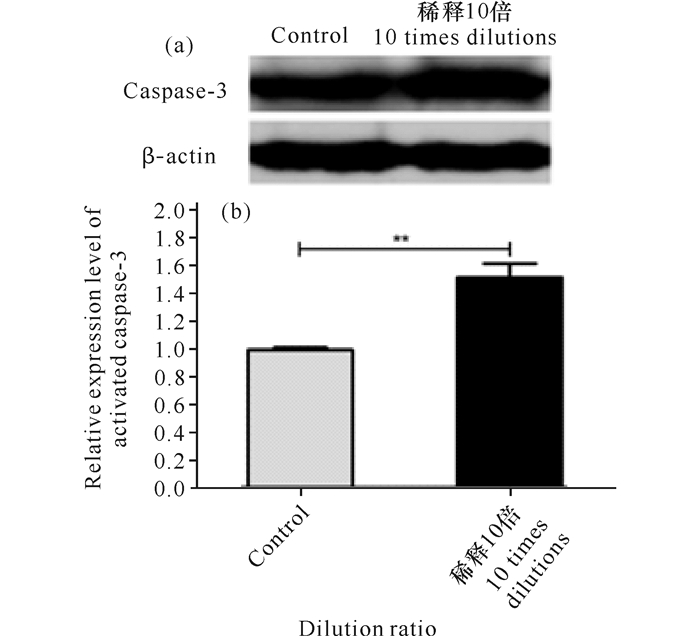
|
β-actin为内参;**与对照组相比,P < 0.01 (a)Western blot检测结果;(b)caspase-3蛋白量比值灰度分析 β-actin were used as internal reference; **compared with the control group, P < 0.01 (a)Western blot test results; (b)Gray scale analysis of caspase-3 protein ratio 图 3 10倍稀释ELWE对HepG2细胞caspase-3蛋白表达量的影响 Fig.3 Changes in caspase-3 proteins expressions observed after 48 h treatment with 10 times dilutions of ELWE |
用10倍稀释ELWE处理HepG2细胞,48 h收集细胞并提取RNA,用Real time-PCR检测HepG2细胞mRNA的表达水平,探讨ELWE对HepG2细胞凋亡的机制。与对照组相比,实验组的β-catenin、Tcf-4、CD44v6基因表达水平均下降,差异具有统计学意义(P < 0.01)(图 4)。在基因水平上分析ELWE可下调β-catenin、Tcf-4、CD44v6 mRNA表达水平。
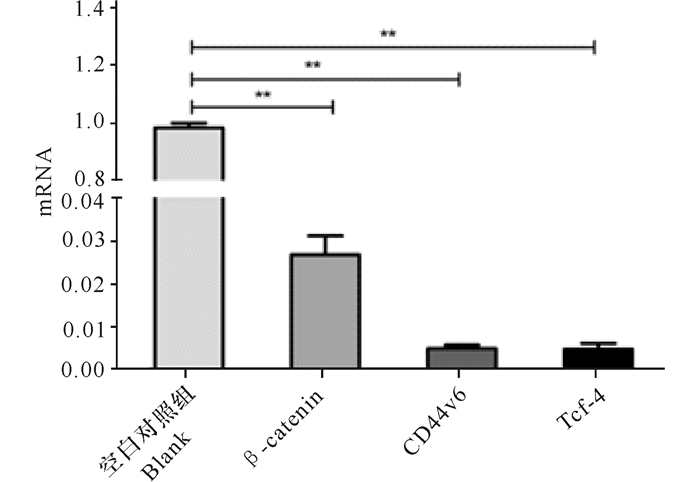
|
**与对照组相比,P < 0.01 **compared with the control group, P < 0.01 图 4 10倍稀释ELWE对HepG2细胞β-catenin、Tcf-4、CD44v6基因表达的影响 Fig.4 Changes in the expression of β-catenin, Tcf-4, CD44v6 observed in HepG2 cells after 48 h treatment with 10 times dilutions of ELWE |
我国有丰富的药用植物资源,许多天然植物水提取物,如雷公藤、大黄素、紫杉醇和姜黄素等具有抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡的作用[8-10],利用天然植物提取物进行肿瘤辅助治疗的研究近年呈增长趋势。本研究采用不同浓度的ELWE处理HepG2细胞, 发现MTT检测法检测到其稀释5~10倍对细胞增殖有抑制的作用,这种抑制作用可能通过下调β-catenin、Tcf-4、CD44v6 mRNA表达水平,诱导细胞凋亡。
为了进一步探讨ELWE对凋亡的影响机制,在蛋白质水平检测了作为细胞凋亡执行因子的caspase-3蛋白表达情况。Western Blot结果显示,ELWE可上调caspase-3蛋白表达量,由此分析ELWE对HepG2细胞生长的抑制作用可能是ELWE激活了细胞凋亡途径所致。当该细胞受到凋亡信号刺激后,caspase-3通过水解天冬氨酸残基位点的蛋白而激活,从而引发caspase级联反应,导致细胞凋亡。例如小檗胺在体外通过抑制Wnt/β-catenin信号通路活化诱导卵巢细胞凋亡,同时小檗胺增加了cleaved caspase-3的蛋白水平[11]。当细胞受到外界凋亡因子信号刺激时,Wnt/β-catenin信号通路中的β-catenin被激活后通过抑制caspase-8而抑制caspase-3的活性,诱导细胞增殖和抑制细胞凋亡,导致癌症的发生与发展[12]。考虑到ELWE诱导HepG2细胞凋亡有可能具有相似的通路,本研究通过荧光定量PCR的方法比较10倍稀释ELWE处理经48 h的凋亡细胞和未经处理的对照组细胞中β-catenin、Tcf-4、CD44v6基因的表达差异。数据显示ELWE能下调HepG2细胞中β-catenin、Tcf-4、CD44v6基因的表达量,这表明ELWE引起的凋亡极有可能是由Wnt/β-catenin途径介导的。
Wnt/β-catenin信号通路是一条具有高度保守的信号通路,在调控细胞生长增殖、细胞癌变中起重要的调节作用[13]。在正常的细胞中,Wnt/β-catenin信号通路不被激活。在肿瘤细胞中该通路被激活时,其关键因子β-catenin在细胞质内积聚,当其达到一定浓度时会向细胞核内转移,并与细胞核内的转录因子TCF/LEF结合,激活下游靶基因,如TCF-4、CD44v6、的表达,导致细胞异常增殖[14]。本研究发现,一定浓度的ELWE处理HepG2,可抑制β-catenin及其调控的靶基因,这表明ELWE对HepG2的凋亡作用可能与抑制Wnt/β-catenin信号通路有关。因此Wnt/β-catenin信号通路有望成为ELWE治疗肝癌的靶点。
4 结论速生桉叶水提物中存在抑制HepG2细胞增殖和诱导细胞凋亡的成分,其作用方式可能是通过调控Wnt/β-catenin信号通路和相关的凋亡途径实现,ELWE有可能成为肿瘤基因治疗的候选靶点药物。
细胞凋亡受多种信号通路和凋亡基因的调控,受时间和人力财力所限,目前无法考量还存在哪些重要的信号分子和基因共同参与诱导HepG2细胞凋亡。另外,本研究结果的实际应用价值尚需进行动物实验加以验证。
| [1] |
DHAKAD A K, PANDEY V V, BEG S, et al. Biological, medicinal and toxicological significance of Eucalyptus leaf essential oil:A review[J]. J Sci Food Agric, 2018, 98(3): 833-848. DOI:10.1002/jsfa.2018.98.issue-3 |
| [2] |
VIEIRA M, BESSA L J, MARTINS M R, et al. Chemical composition, antibacterial, antibiofilm and synergistic properties of essential oils from eucalyptus globulus labill and seven mediterranean aromatic plants[J]. Chem Biodivers, 2017, 14(6): 1-12. |
| [3] |
BHUYAN D J, VUONG Q V, BOND S R, et al.Eucalyptus microcorys leaf extract derived HPLC-fraction reduces the viability of MIA PaCa-2 cells by inducing apoptosis and arresting cell cycle[J].Biomed Pharmacother, 2018, 105:449-460.[Epub ahead of print].
|
| [4] |
SHEN K H, CHEN Z T, DUH P D. Cytotoxic effect of Eucalyptus citriodora resin on human hepatoma HepG2 cells[J]. Am J Chin Med, 2012, 40(2): 399-413. DOI:10.1142/S0192415X12500310 |
| [5] |
陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26(1): 1-7. CHEN W Q, ZHENG R S, ZHANG S W, et al. Report of cancer incidence and mortality in China, 2013[J]. China Cancer, 2017, 26(1): 1-7. |
| [6] |
CHEN W Q, ZHENG R S, ZHANG S W, et al. Cancer incidence and mortality in China in 2013:An analysis based on urbanization level[J]. Chinese Journal of Cancer Research, 2017, 29(1): 1-10. DOI:10.21147/j.issn.1000-9604.2017.01.01 |
| [7] |
PECK-RADOSAVLJEVIC M. Drug therapy for advan-ced-stage liver cancer[J]. Liver Cancer, 2014, 3: 125-131. DOI:10.1159/000343868 |
| [8] |
CHEN Y, LI J, CHEN S, et al. Nab-paclitaxel in combination with cisplatin versus docetaxel plus cisplatin as first-line therapy in non-small cell lung cancer[J]. Scientific Reports, 2017, 7(1): 10760. DOI:10.1038/s41598-017-11404-9 |
| [9] |
SHAHABIPOUR F, CARAGLIA M, MAJEE D, et al. Naturally occurring anticancer agents targeting EZH2[J]. Cancer Letters, 2017, 400: 325-335. DOI:10.1016/j.canlet.2017.03.020 |
| [10] |
ZHANG J, LIN M T, TUNG H Y, et al. Bruceine D induces apoptosis in human chronic myeloid leukemia K562 cells via mitochondrial pathway[J]. Am J Cancer Res, 2016, 6(4): 819-826. |
| [11] |
HENG Z, YUN P J, CHUN Y S, et al. Berbamine suppresses cell proliferation and promotes apoptosis in ovarian cancer partially via the inhibition of Wnt/β-Catenin signaling[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(6): 532-539. DOI:10.1093/abbs/gmy036 |
| [12] |
ZHAO X, SUN S, XU J, et al. MicroRNA-152 inhibits cell proliferation of osteosarcoma by directly targeting Wnt/β-catenin signaling pathway in a DKK1-dependent manner[J]. Oncol Rep, 2018, 40(2): 767-774. |
| [13] |
NISHIKAWA K, OSAWA Y, KIMURA K. Wnt/β-Catenin signaling as a potential target for the treatment of liver cirrhosis using antifibrotic drugs[J]. Int J Mol Sci, 2018, 19(10): 1-12. |
| [14] |
VALLEE A, LECARPENTIER Y. Crosstalk between peroxisome proliferator-activated receptor gamma and the canonical Wnt/β-Catenin pathway in chronic inflammation and oxidative stress during carcinogenesis[J]. Front Immunol, 2018, 9: 1-18. DOI:10.3389/fimmu.2018.00001 |
 2018, Vol. 25
2018, Vol. 25 


