2. 广西大学, 生命科学与技术学院, 亚热带农业生物资源保护与利用国家重点实验室, 广西南宁 530004
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, College of Life Science and Technology, Guangxi University, Nanning, Guangxi, 530004, China
【研究意义】非粮生物乙醇作为新一代的可再生能源,具有低碳清洁绿色环保等优势[1],是目前最为成功的液体替代燃料[2],如何研发和利用非粮生物乙醇是当前世界各国共同关注的焦点,已成为世界各国能源产业的发展趋势和必然选择[3-4]。实际上,非粮生物乙醇已成为我国的战略性新兴产业[5-6]。以非粮原料生产燃料乙醇,能一定程度上缓解我国的能源危机、保证我国的能源安全,意义重大。【前人研究进展】非粮生物乙醇原料来源丰富,主要是一些木质纤维,其中包括蔗渣、木薯、稻草、秸秆等,其主要成分为纤维素、半纤维素和木质素[7]。而半纤维素的主要组分是木聚糖,其作为第二大丰富的多聚糖类物质(仅次于纤维素),所占比例为20%~30%[8]。来源于自然界的木聚糖,具有结构复杂、分子量庞大、不易降解等特点。降解木聚糖的方法,包括酶解法以及传统的化学法等。化学法容易引发环境污染问题,而酶解法采用生物酶催化水解方法(木聚糖酶),具有高效、环保等特点,相较于化学法具有明显的优势[9]。木聚糖酶主要包括β-1, 4-内切酶(1, 4-β-D-xylan xylanohydrolase, EC 3.2.1.8)、β-木糖苷酶(β-D-xylosidase, EC 3.2.1.37)以及支链酶等[10],是可将木聚糖降解成为低聚木糖和木糖的一组酶的总称。其中最关键的酶是β-1, 4-内切酶(俗称木聚糖酶)和β-木糖苷酶[11],前者水解木聚糖分子中的β-1, 4-木糖苷键(以内切方式),主要产物是木寡糖和木二糖,后者降解产物主要是木糖。对于木聚糖酶的研究,国外起步较早,1955年就从牛瘤胃、土壤中发现了木聚糖酶[12]。随着后续的研究,截至目前,来源于自然界的能产木聚糖酶的微生物主要有黑曲霉Aspergillus niger[13-15]、微紫青霉菌Penicillium janthinellum[16]、节图霉属Arthrographis sp.[17]、高温放线菌Thermoactinomyces thalophilus subgroup C[18]、链霉菌Streptomyces sp.Ab106[19]、里氏木霉Trichoderma reesei[20-21]等,大部分的木聚糖酶属于碱性木聚糖酶,我国及其他一些国家早已对碱性木聚糖酶成功进行商业化生产及应用,如应用在造纸工业及生物工程领域[22-23]。据报道,我国最早对酸性木聚糖酶进行研究是在1990年,陈惠忠等[24]开展了产酸性木聚糖酶微生物的选育、酸性木聚糖酶的酶学特性分析及酶活性改造等[25]。【本研究切入点】纤维素乙醇产业化生产包括原料预处理、酶降解(纤维素酶、木聚糖酶等)、糖化发酵、蒸馏、脱水等工艺流程,发酵一般在酸性条件下(pH值3.8~4.0,即调酸发酵)进行,此酸性条件能抑制细菌等微生物的生长。近年来, 研发高效优良的酸性木聚糖酶(常温30~37℃、pH值约为4等酸性条件仍保持高酶活), 应用于纤维素乙醇等领域, 已成为研究的热点和难点[26-27]。采用酸性木聚糖酶降解半纤维素的主要组分木聚糖,生成能供给酵母(如树干毕赤酵母、酿酒酵母等)利用[28-29]的产物木糖,进而进行酒精发酵,这对于纤维素乙醇生产工艺来说,能节省调节pH值的时间及减少相应的设备,从而缩短酒精生产工艺流程,为实现纤维素乙醇高效、低成本、清洁生产打下基础。鉴于此,本研究将从自然界筛选产酸性木聚糖酶的微生物(采用pH值为4.0)。【拟解决的关键问题】选育优良的产酸性木聚糖酶的微生物,考察其所产酸性木聚糖酶的酶学性质(尤其是pH值为4.0),为实现纤维素乙醇低成本清洁生产打下基础。
1 材料与方法 1.1 材料 1.1.1 样品从广西大学农场采集土壤,去除地表覆盖的土层,在地表以下5~10 cm处取样。
1.1.2 试剂桦木木聚糖(Birchwood xylan)购自上海瀚鸿化工,羧甲基纤维素钠(CMC-Na)、榉木木聚糖(Beechwood xylan)购自Sigma公司,Bradford蛋白定量试剂盒、对硝基苯基-β-D-木糖苷(pNPX)分别购自上海捷瑞公司、上海梯希爱公司,其他试剂均为国产分析纯。
1.1.3 培养基筛选培养基(g/L):榉木木聚糖10,蛋白胨20,酵母粉10,KNO3 1,MgSO4·7H2O 0.5,KH2PO4 0.5,琼脂22。调节pH值至4.0。
产酶培养基(g/L):榉木木聚糖或桦木木聚糖10,(NH4)2SO4 5,蛋白胨10,MgSO4·7H2O 0.5,KH2PO4 1,CaCl2 0.2,FeSO4·7H2O 0.01。pH值调至4.0。
菌种保藏、活化的培养基均为PDA(g/L):马铃薯200,琼脂20,葡萄糖20。pH值为自然状态。
1.2 方法 1.2.1 产酸性木聚糖酶菌株的筛选选取一些呈弱酸性的土壤区域,取适量的土壤,加入50 mL无菌水进行稀释,取10 mL稀释液,加入至装有40 mL富集培养基的250 mL三角瓶,摇床培养(30℃,180 r/min) 2 d,从中吸取10 mL重复进行富集培养1次。然后经木聚糖平板进行初筛,选取水解圈较大的菌株进行纯化,经产酶液体培养和测酶活,选取酶活力较高的菌株进行保存及研究。
1.2.2 菌株ITS rDNA分子鉴定(1) 菌株DNA提取
采用CTAB(Cetyltrimethylammonium Bromide)法抽提。先收集菌体,添加液氮进行研磨,加入适量CTAB经65℃水浴1 h,氯仿/Tris平衡酚抽提,取上清加入适量经-20℃预冷的异丙醇离心(8 000 r/min,15 min,4℃)收集沉淀,沉淀经预冷75%(V/V)乙醇洗两次,沉淀风干后加入适量ddH2O溶解,吸至1.5 mL EP管做好标记后置于-20℃保存。
(2) 菌株ITS rDNA序列分子鉴定
以菌株DNA为模板扩增ITS rDNA序列,采用一对通用引物:ITS1(序列为:5′-TCCGTAGGTGAACCTGCGG-3′)及ITS4(序列为:5′-TCCTCCGCTTATTGATATGC-3′),PCR扩增条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃ 8 min。PCR产物送英骏生物公司测序,测序结果登陆NCBI网站进行序列比对。选取一些有代表性菌株的ITS序列,采用软件Mega 5.0版本,选用Kimura 2-parameter距离的模型,采取邻接法(neighbor-joining, NJ)进行系统发育树的构建,系统发育树的图片保存待用。
1.2.3 酶活力测定(1) 木聚糖酶
参考文献[21, 30]的方法,反应是在pH值为4.0条件下进行。1个酶活力单位(IU)的定义:特定反应条件,1 min转化1 μmol底物所需的酶量。
(2) 木糖苷酶
参考文献[21, 31]的方法,反应是在pH值为4.0条件下进行。1个酶活力单位(IU)的定义同上。
(3) 纤维素酶(CMCase酶活力)
参考文献[21]的方法,反应是在pH值为4.0条件下进行,底物为1%(W/V)羧甲基纤维素钠。1个酶活力单位(IU)的定义同上。
1.2.4 蛋白含量测定采用Bradford蛋白定量盒测定,按说明书进行(每一样品反应的体积均为20 μL)。
1.2.5 酶学性质(1) 酶最适温度及热稳定性
酶最适温度的测定参考文献[21]的方法,分别采用不同温度:20~90℃进行反应(pH值为4.0)。
酶热稳定性的研究参考文献[21]的方法,即在确定最适温度的前提下选取一些特定温度,分别保温5~30 min,经冰水冷却后测定酶活性(pH值为4.0)。
(2)酶最适pH值及稳定性
酶最适pH值的测定参考文献[21]的方法。缓冲液:pH值2.10~8.50的0.05 mol/L柠檬酸-磷酸氢二钠、pH值9.00~12.00的0.05 mol/L甘氨酸-NaOH。
酶pH值稳定性的研究参考文献[21]的方法,酶液分别于不同pH值(2.10~12.00)4℃保温处理24 h,测定酶活力。
2 结果与分析 2.1 菌株筛选及菌株鉴定从广西大学农场采集的土壤样品,经富集分离纯化,初步筛选出产木聚糖酶活力较高的菌株有5株,其中酸性木聚糖酶活力最高的是菌株XYW5。采用CTAB法提取菌株XYW5的基因组DNA,经PCR克隆出菌株XYW5的ITS rDNA序列片段,将该片段送英骏生物公司测序,获得菌株XYW5的ITS rDNA序列,然后登陆网站美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI),将该序列进行BLAST(Basic Local Alignment Search Tool)比对分析,发现其与日本曲霉Aspergillus japonicus strain A1.1 ITS rDNA序列同源性为99%,将其命名为Aspergillus japonicus XYW5。2012年7月5日,将菌株XYW5的ITS rDNA序列提交到GenBank,经接收后获得登录号JX277550,同时于2012年9月18日在GenBank上公布(为国内比较早登记的菌株)。通过ITS rDNA序列同源搜索,构建了菌株XYW5的系统进化树(图 1)。
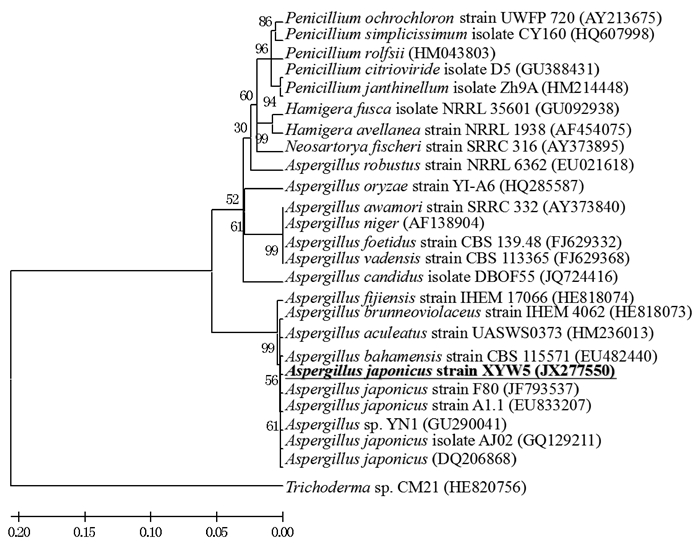
|
图 1 基于ITS rDNA序列构建的日本曲霉XYW5系统进化树 Fig.1 Phylogenetic dendrogram for Aspergillus japonicus XYW5 based on the ITS rDNA sequence |
木聚糖酶一般是诱导性的酶,为此,采用不同的木聚糖作为底物,所产酸性木聚糖糖酶的活力可能不同。菌株XYW5分别利用榉木木聚糖、桦木木聚糖作为底物进行产酶培养,产酶情况如图 2所示,两者所产的酸性木聚糖酶酶活力均在5 d时达到最高;采用榉木木聚糖诱导培养的酸性木糖苷酶酶活力3 d就能达到最高,而采用桦木木聚糖诱导培养的酸性木糖苷酶酶活力则需要5 d达到最高。此外,利用榉木木聚糖诱导所产的酸性木聚糖酶和酸性木糖苷酶的酶活力、蛋白含量均明显高于利用桦木木聚糖所诱导产生的(表 1),尤其是木聚糖酶,前者所产的酶活力是后者所产的4倍之多。菌株XYW5产酸性木聚糖酶和酸性木糖苷酶的酶活力最高分别达(26.26±0.97) U/mL和(0.63±0.02) U/mL,比活力分别为(85.50±0.63) U/mg和(1.80±0.01) U/mg。综上所述,以榉木木聚糖作为底物更有利于菌株XYW5产酸性木聚糖酶。
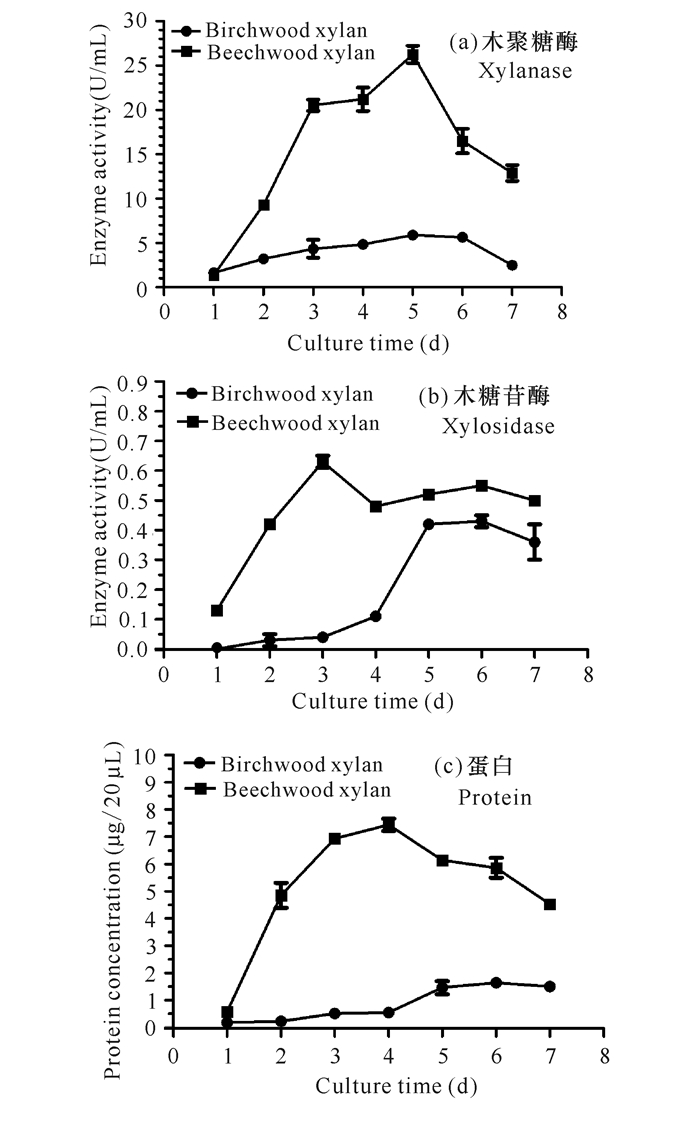
|
图 2 菌株XYW5的产酶曲线 Fig.2 Curve of xylanases of Aspergillus japonicus XYW5 |
| 表 1 不同木聚糖底物的产酶酶活力和蛋白含量 Table 1 Enzyme activity and concentration of protein of different xylan substrates |
菌株XYW5分别利用榉木木聚糖、桦木木聚糖两种底物,所产的酸性木聚糖酶均具有酸性CMCase酶活力,且榉木木聚糖所产的酸性CMCase酶活力明显高于桦木木聚糖所产的(表 2),由此可知,桦木木聚糖更有利于菌株XYW5产酸性木聚糖酶,兼有更高的酸性CMCase酶活力。此外,酸性条件下CMCase酶活均高于中性条件下的CMCose酶活力,从这一点上印证了菌株XYW5所产的酸性木聚糖酶具有酸性CMCase酶活力。
| 表 2 酸性CMCase活力比较 Table 2 Comparison of enzyme activity of acidic CMCase |
为考察菌株XYW5所产酸性木聚糖酶的最适温度及热稳定性,选取酸性木聚糖酶活力最强时的产酶上清液开展试验研究(图 3~4)。用榉木木聚糖作为碳源培养菌株XYW5产酶,收集5 d的粗酶液,经适当稀释,参照Bailey等[30]方法在20~90℃反应测定酸性木聚糖酶的酶活力,以最高酶活力作为100%,测定相对酶活力。酸性木聚糖酶的最适温度为65℃,在45~80℃温度范围内酶活力均超过最适温度的70%,而当温度低至30℃或高达90℃时酶活力仍分别有最适温度的40%或50%左右(图 3a)。当温度高于最适温度5℃(即70℃)条件下保温30 min后,酶活力仅下降不到30%(图 3b)。此外,当温度在30~40℃时,酶活力仍然是最适温度的35%~55%,这意味着菌株XYW5所产酸性木聚糖酶具有能被开发为常温木聚糖酶的潜力。
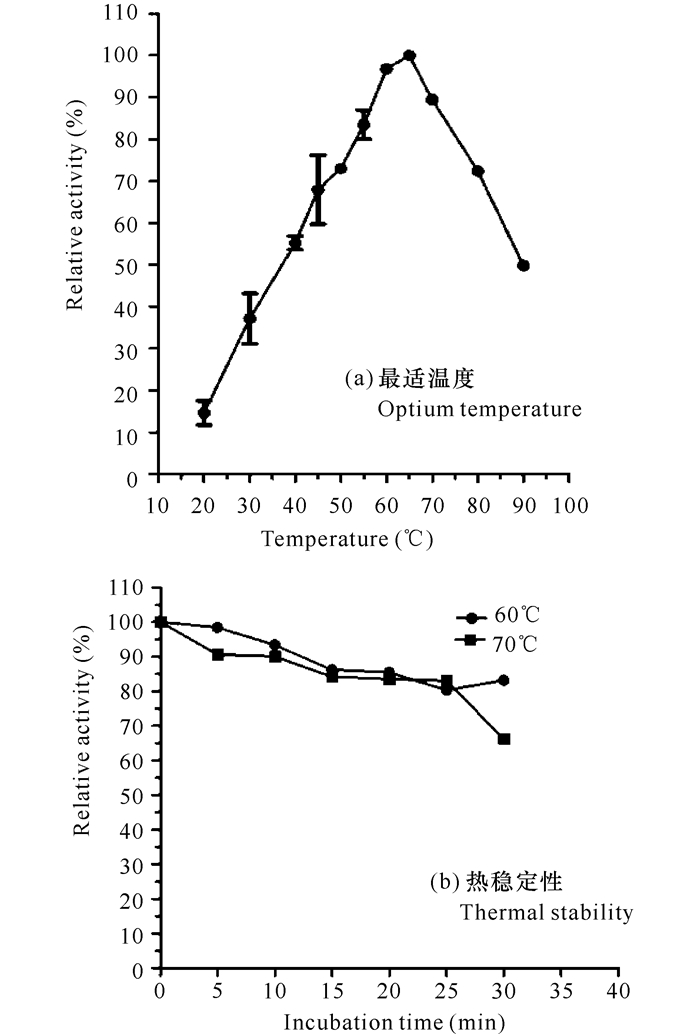
|
图 3 酸性木聚糖酶的最适温度及热稳定性 Fig.3 Optimum temperature and thermal stability of acidic xylanase |
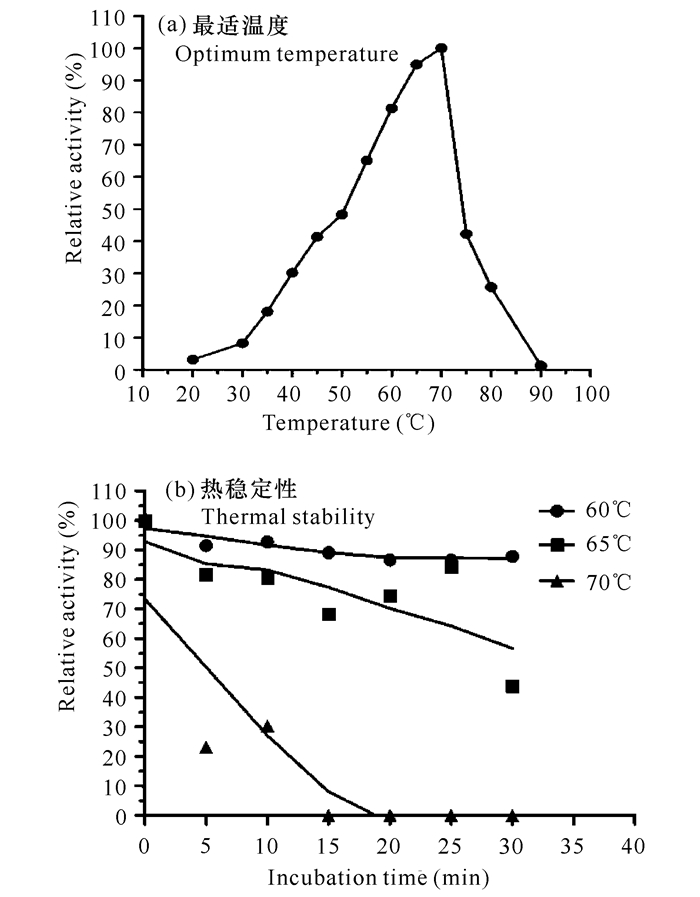
|
图 4 酸性木糖苷酶的最适温度及热稳定性 Fig.4 Optimum temperature and thermal stability of acidic xylosidase |
参照Poutanen等[31]方法,在20~90℃反应测定酸性木糖苷酶的酶活力,以最高酶活力作为100%,测定相对酶活力。菌株XYW5的酸性木糖苷酶的最适温度为70℃。当温度低于50℃或者高达75℃时,菌株XYW5酸性木糖苷酶的酶活力仅分别是最适温度的40%或50%左右。当温度在30~40℃时,酶活力仅分别是最适温度的10%~30%。而当温度高达90℃时,检测不到酸性木糖苷酶的酶活性(图 4a)。此外,当在最适温度70℃条件下保温15 min后,酸性木糖苷酶残余酶活力很低;在此温度保温20 min,残余酶活力为0(图 4b),由此可知,菌株XYW5的酸性木糖苷酶的热稳定性比较差。
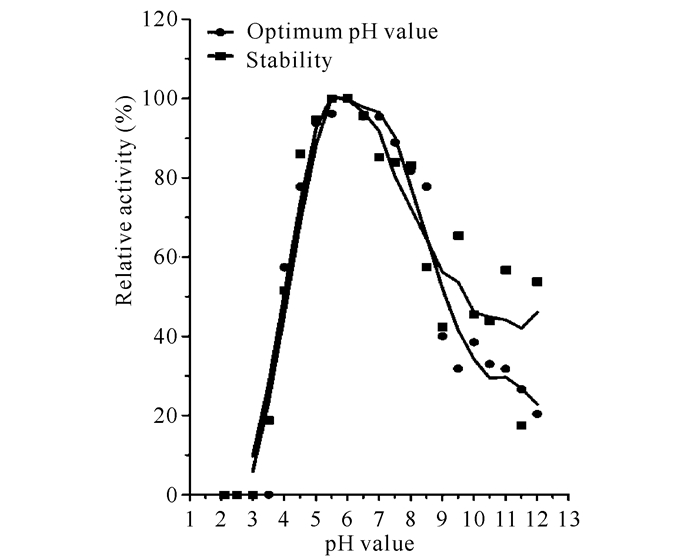
2.4.2 酶的最适pH值和pH值稳定性粗酶液在不同pH值(2.10~12.00)条件测定菌株XYW5酸性木聚糖酶的酶活,以最高酶活作为100%,测定相对酶活力,菌株XYW5所产的酸性木聚糖酶最适pH值为6.5,当pH值在4.5~8.0,酶活力均超过最适pH值条件下70%的活性。而当pH值为4.0时,酸性木聚糖酶的活力还能达到最适pH值时酶活性的一半(图 5)。
|
图 5 酸性木聚糖酶的最适pH值及pH稳定性 Fig.5 Optimum pH value and stability of acidic xylanase |
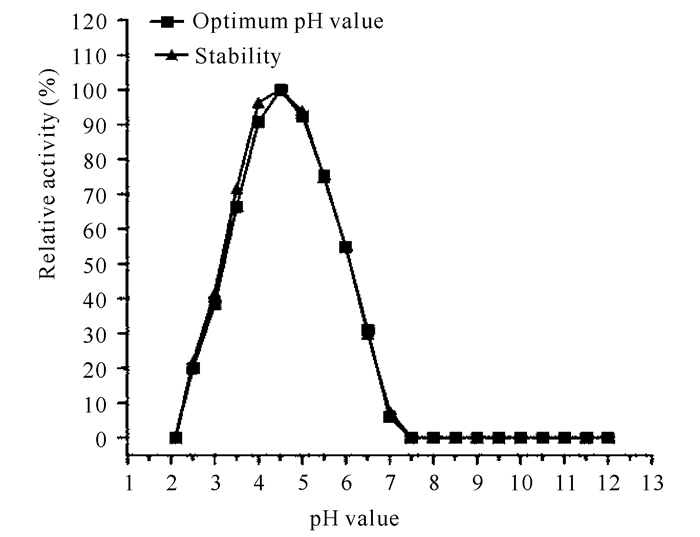
此外,测定得菌株XYW5的酸性木糖苷酶最适pH值为4.5(图 6)。当pH值在4.0~5.0,酶活力仍能保持超过最适pH值条件下90%的活性;当pH值在2.5~3.5,残余酶活力是20.00%~66.36%;当pH值为中性(7.0)时,酶活性是6.06%;当pH值超过7.5时,几乎检测不到酶活性。此外,菌株XYW5所产的酸性木糖苷酶在酸性条件下稳定性较好,在中性碱性条件下,酶活性很低甚至无酶活。由此可知,菌株XYW5所产的酸性木糖苷酶是典型的酸性木糖苷酶,能在酸性条件下发挥作用,而在中性或碱性条件下不能发挥作用。
|
图 6 酸性木糖苷酶的最适pH值及pH稳定性 Fig.6 Optimum pH value and stability of acidic xylosidase |
来源于自然界微生物的木聚糖酶很多,其中极小一部分来自细菌,如链霉菌[19]、高温放线菌[18]、莫海威芽孢杆菌[32]等,但大部分是来自真菌,如微紫青霉菌[16]、里氏木霉[23-24]、黑曲霉[13-14]等。从广西大学农场土壤分离出能产酸性木聚糖酶、酸性木糖苷酶的菌株XYW5经鉴定为日本曲霉Aspergillus japonicus。国外关于日本曲霉Aspergillus japonicus产木聚糖酶的报道较多[33-37],早在1981年就有日本曲霉Aspergillus japonicus OM-4能降解木质素的报道[38]。经后续研究,OM-4菌株所产的木聚糖酶活力为23.3 U/mL[33]。Facchini等[39]选育的日本曲霉C03菌株,其所产的木聚糖酶活力最高达(23.85±1.2) U/mL,且具备CMCase活性,最高达(0.98±0.02) U/mL。C03菌株以豆麸做底物,所产木聚糖酶活性最高达(224.62±1.38) U/g[40]。而Herculano等[41]以蓖麻皮等废弃物做干基(ds,dry substrate)进行产酶,结果日本曲霉URM5620菌种所产的木聚糖酶活力达到(29 085±1 808) U/(g·ds)。Wakiyama等[36]以燕麦木聚糖底物(0.5%,W/V)选育的Aspergillus japonicus MU-2菌株所产的木聚糖酶经纯化后,酶活力达566 U/mg,此外此MU-2菌株所产的木糖苷酶活性最高达1.88 U/mg[37]。国内目前仅有中南大学夏金兰课题组[42-44]开展了相关的研究,其选育的菌株为Aspergillus japonicus PJ01,该菌株的ITS rDNA序列于2015年10月27日在GenBank上公布(GenBank登陆号为KF550286)。该研究采用陈皮粉做原料,所产的木聚糖酶活力最高为(12.07±0.85) U/mL,兼有的纤维素酶CMCase酶活力最高为(2.69±0.20) U/mL。
XYW5菌株所产的酸性木聚糖酶、酸性木糖苷酶的酶活力不高,明显达不到工业化的要求。陈惠忠等[24]通过复合诱变手段(紫外及甲基磺酸乙酯)诱变野生型菌株C-2,选育到An-76突变株,An-76所产的木聚糖酶和木糖苷酶的活力比C-2的分别提高2倍和1倍(353.6 U/mL、4.5 U/mL)。王金华[45]克隆出黑曲霉N402的酸性木聚糖酶基因并成功实现了异源表达(Pichia pastoris),酶活比N402的提高了10.3倍,达到453.6 U/mL。鉴于此,可以考虑对XYW5菌株进行改造或实现异源高效表达酶活性,从而构建出产酶性能更优良的酸性木聚糖酶。
广西是我国最大的食糖生产基地,多年来每年的甘蔗产量均占全国的60%左右,位居全国第一。据统计,2007—2017年10年间甘蔗产量、混合糖产量年平均分别为5 800多万吨、700多万吨,相应的蔗渣产量近700万吨(以广西甘蔗品种,一般8.5 t甘蔗产出1 t糖和1 t的蔗渣),糖厂榨糖后所产的蔗渣比较集中,且蔗渣富含半纤维素,为此,下一步将开展菌株XYW5所产的酸性木聚糖酶处理蔗渣原料的应用研究,考察酶解效果及相关的产率等。
3.2 酶学性质的比较酸性木聚糖酶是一组酶的总称,起主要作用的是酸性β-1,4-内切酶(俗称酸性木聚糖酶)和酸性β-木糖苷酶(简称酸性木糖苷酶)。这两个关键酶均受到所处环境因素的影响,如温度、pH值等。Facchini等[40]选育的日本曲霉Aspergillus japonicus C03菌株,所产的木聚糖酶最适pH值、温度分别为4.0和60℃。Wakiyama等[36]选育的MU-2菌株,所产的木聚糖酶最适pH值、温度分别为5.0和60℃,45℃保温30 min,酶活性影响不大,但当温度上升至55℃,容易失去其活性。而MU-2菌株所产的酸性木糖苷酶最适pH值、温度分别为4.0和70℃[37]。Semenova等[35]选育的日本曲霉,所产的酸性木糖苷酶最适pH值、温度分别为3.5~4.0和70℃。而日本曲霉PJ01产酶初始pH值为5.0,木聚糖酶最适pH值也在5.0左右[42]。XYW5菌株所产的酸性木聚糖酶的最适温度和最适pH值分别为65℃和6.5,酸性木糖苷酶最适温度和最适pH值分别为70℃和4.5;酸性木聚糖酶兼有酸性CMCase酶活力,达到8.54 U/mL。
4 结论从广西大学农场采集土壤,富集后经产酸性木聚糖酶的培养,筛选出产酸性木聚糖酶活力较高的菌株XYW5。扩增菌株XYW5的ITS rDNA序列,经测序分析比对,将其初步鉴定为日本曲霉Aspergillus japonicus XYW5。菌株XYW5产酸性木聚糖酶和酸性木糖苷酶的酶活最高分别达(26.26±0.97)U/mL和(0.63±0.02) U/mL,两种酶所对应的比活力分别为(85.50±0.63)U/mg和(1.80±0.01)U/mg;其酸性木聚糖酶最适温度和最适pH值分别为65℃和6.5,当温度在30~40℃时,酸性木聚糖酶活力仍然是最适温度的35%~55%,酸性木糖苷酶最适温度和最适pH值分别为70℃和4.5;酸性木聚糖酶兼有酸性CMCase酶活力,达到8.54 U/mL。为此,这意味着菌株XYW5所产酸性木聚糖酶具有能被开发为优良酸性木聚糖酶的潜力。尽管如此,菌株XYW5所产的酸性木聚糖酶的各项指标仍未达不到工业用酶的标准,亟待进一步改造及研发。
| [1] |
FARGIONE J, HILL J, TILMAN D, et al. Land clearing and the biofuel carbon debt[J]. Science, 2008, 319(5867): 1235-1238. DOI:10.1126/science.1152747 |
| [2] |
ZABED H, SAHU J N, BOYCE A N, et al. Fuel ethanol production from lignocellulosic biomass:An overview on feedstocks and technological approaches[J]. Renewable and Sustainable Energy Reviews, 2016, 66: 751-774. DOI:10.1016/j.rser.2016.08.038 |
| [3] |
HIRANI A H, JAVED N, ASIF M, et al.A Review on first-and second-generation biofuel productions(eds)[M].Biofuels: Greenhouse Gas Mitigation and Global Warming.New Delhi: Springer, 2018: 141-154.
|
| [4] |
PENG K, LI J S, JIAO K L, et al.The bioeconomy of microalgal biofuels(eds), energy from microalgae[M].Green Energy and Technology.Cham: Springer, 2018: 157-169.
|
| [5] |
JIAO J L, LI J J, BAI Y. Ethanol as a vehicle fuel in China:A review from the perspectives of raw material resource, vehicle, and infrastructure[J]. Journal of Cleaner Production, 2018, 180: 832-845. DOI:10.1016/j.jclepro.2018.01.141 |
| [6] |
国家能源局.《关于扩大生物燃料乙醇生产和推广使用车用乙醇汽油的实施方案》印发.[2017-09-13].http://www.nea.gov.cn/2017-09/13/c_136606035.htm. National Energy Administration."On implementation plan for expanding biofuel ethanol production and promoting the use of ethanol gasoline for motor vehicles" printed and distributed.[2017-09-13].http://www.nea.gov.cn/2017-09/13/c_136606035.htm. |
| [7] |
BIELY P.Enzymological aspects of the production of microbial hemicellulases[M]//COUGLAND M P, HAZLEWOOD G P, eds.Hemi-celluloses and hemicellulases.London: Portland Press, 1993: 29-51.
|
| [8] |
PRADE R A. Xylanases:From biology to biotechnology[J]. Biotechnology and Genetic Engineering Reviews, 1995, 13(12): 100-131. |
| [9] |
BRISARIA V S, GHOSE T K. Biodegradation of cellulosic materials:Substrates, microorganisms, enzymes and products[J]. Enzyme and Microbial Technology, 1981, 3(2): 90-104. |
| [10] |
BIELY P. Microbial xylanolytic systems[J]. Trends in Biotechnol, 1985, 3(11): 286-290. DOI:10.1016/0167-7799(85)90004-6 |
| [11] |
SUBRAMANIYAN S, PREMA P. Biotechnology of microbial xylanases:Enzymology, molecular biology, and application[J]. Critical Reviews in Biotechnology, 2002, 22(1): 33-64. |
| [12] |
SØRENSEN H. Xylanase in the soil and the rumen[J]. Nature, 1955, 176: 74. |
| [13] |
JOHN M, SCHMIDT B, SCHMIDT J. Purification and some properties of five endo-1, 4-beta-D-xylanases and a beta-D-xylosidase produced by a strain of Aspergillus niger[J]. Can J Biochem, 1979, 57: 125-134. DOI:10.1139/o79-016 |
| [14] |
PEL H J, DE WINDE J H, ARCHER D B, et al. Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513.88[J]. Nature Biotechnology, 2007, 25(2): 221-231. |
| [15] |
张水龙, 陈东, 曹树威, 等. 黑曲霉木聚糖酶基因xynB的克隆及在酿酒酵母中的表达[J]. 广西科学, 2013, 20(2): 148-151, 157. ZHANG S L, CHEN D, CAO S W, et al. Cloning of xynB gene encoding xylanase B from Aspergillus niger and expression in Saccharomyces cerevisiae[J]. Guangxi Sciences, 2013, 20(2): 148-151, 157. DOI:10.3969/j.issn.1005-9164.2013.02.017 |
| [16] |
MILAGRES A M F, LACIS L S, PRADE R A. Characterization of xylanase production by a local isolate of Penicillium janthinellum[J]. Enzyme and Microbial Technology, 1993, 15(3): 248-253. |
| [17] |
OKEKE B C, OBI S K C. Preliminary studies on a xylanase from an Arthrographis species[J]. FEMS Microbiology Letters, 1992, 96(1): 43-47. DOI:10.1111/fml.1992.96.issue-1 |
| [18] |
KOHLI U, NIGAM P, SINGH D, et al. Thermostable, alkalophilic and cellulase free xylanase production by Thermoactinomyces thalophilus subgroup C[J]. Enzyme and Microbial Technology, 2001, 28(7/8): 606-610. |
| [19] |
TECHAPUN C, POOSARAN N, WATANABE M, et al. Optimization of aeration and agitation rates to improve cellulase-free xylanase production by thermotolerant Streptomyces sp.Ab106 and repeated fed-batch cultivation using agricultural waste[J]. Journal of Bioscience and Bioengineering, 2003, 95(3): 298-301. DOI:10.1016/S1389-1723(03)80033-6 |
| [20] |
TÖRRÖNEN A, MACH R L, MESSNER R, et al. The two major xylanases from Trichoderma Reesei:Characterization of both enzymes and genes[J]. Nature Biotechnology, 1992, 10: 1461-1465. DOI:10.1038/nbt1192-1461 |
| [21] |
吴仁智, 黄俊, 芦志龙, 等. 里氏木霉和黑曲霉产酸性木聚糖酶及酶学特性比较[J]. 广西科学, 2017, 24(1): 112-119. WU R Z, HUANG J, LU Z L, et al. Comparative analysis of the characterization of crude acidic xylanases from two strains between Trichoderma reesei and Aspergillus nige[J]. Guangxi Sciences, 2017, 24(1): 112-119. |
| [22] |
VIIKARI L, KANTELLINEN A, SUNDQUIST J, et al. Xylanases in bleaching:From an idea to the industry[J]. FEMS Microbiol Rev, 1994, 13: 335-350. |
| [23] |
PRADE R A. Xylanases:From biology to biotechnology[J]. Biotechnol Genet Eng Rev, 1996, 13: 101-131. DOI:10.1080/02648725.1996.10647925 |
| [24] |
陈慧忠, 高培基, 王祖农. 产木聚糖酶菌株的选育及其液体发酵条件[J]. 微生物学报, 1990, 30(5): 351-357. CHEN H Z, GAO P J, WANG Z N. Screening of high yield xylanase producing strain and studies on its submerged fermentation conditions[J]. Acta Microbiologica Sinica, 1990, 30(5): 351-357. |
| [25] |
曹钰, 陆健, 李胤. 酸性木聚糖酶的研究进展[J]. 工业微生物, 2005, 35(4): 41-45. CAO Y, LU J, LI Y. Research advances in acid-stable xylanase[J]. Industrial Microbiology, 2005, 35(4): 41-45. DOI:10.3969/j.issn.1001-6678.2005.04.010 |
| [26] |
PERALTA-YAHYA P P, ZHANG F Z, DEL CARDAYRE S B, et al. Microbial engineering for the production of advanced biofuels[J]. Nature, 2012, 488: 320-328. DOI:10.1038/nature11478 |
| [27] |
THOMAS L, PARAMESWARAN B, PANDEY A. Hydrolysis of pretreated rice straw by an enzyme cocktail comprising acidic xylanase from Aspergillus sp.for bioethanol production[J]. Renewable Energy, 2016, 98: 9-15. DOI:10.1016/j.renene.2016.05.011 |
| [28] |
吴仁智, 陈东, 芦志龙, 等. 发酵木糖高产乙醇树干毕赤酵母菌株的Co60诱变选育[J]. 广西科学, 2014, 21(1): 47-53. WU R Z, CHEN D, LU Z L, et al. Breeding of high yield Pichia stipitis strains by Co60 mutagenesis for ethanol fermentation from xylose[J]. Guangxi Sciences, 2014, 21(1): 47-53. |
| [29] |
刘宝利, 刘高冈, 林秋卉, 等. 多质粒共转化组合筛选方法构建木糖利用酿酒酵母的研究[J]. 中国生物工程杂志, 2016, 36(12): 86-97. LIU B L, LIU G G, LIN Q H, et al. Construction of recombinant xylose-utilizing Saccharomyces cerevisiae by three-plasmid co-transformation combinatorial screening method[J]. China Biotechnology, 2016, 36(12): 86-97. |
| [30] |
BAILEY M J, BIELY P, POUTANEN K. Interlaboratory testing of methods for assay of xylanase activity[J]. J Biotechnology, 1992, 23: 257-270. DOI:10.1016/0168-1656(92)90074-J |
| [31] |
POUTANEN K, PULS J. Characteristics of Trichoderma reesei β-xylosidase and its use in the hydrolysis of solubilized xylanase[J]. Appl Microbiol Biotechnol, 1988, 28: 425-432. DOI:10.1007/BF00268208 |
| [32] |
KALLELA F, DRISSA D, CHAARIA F, et al. Statistical optimization of low-cost production of an acidic xylanase by Bacillus mojavensis UEB-FK:Its potential applications[J]. Biocatalysis and Agricultural Biotechnology, 2016, 5: 1-10. DOI:10.1016/j.bcab.2015.11.005 |
| [33] |
SHARMA A, MILSTEIN O, VERED Y, et al. Effects of aromatic compounds on hemicellulose-degrading enzymes in Aspergillus japonicus[J]. Biotechnol Bioeng, 1985, 27(8): 1095-1101. DOI:10.1002/(ISSN)1097-0290 |
| [34] |
YANG C Y, SHEIH I C, FANG T J. Fermentation of rice hull by Aspergillus japonicus under ultrasonic pretreatment[J]. Ultrason Sonochem, 2012, 19(3): 687-691. |
| [35] |
SEMENOVA M V, DRACHEVSKAYA M I, SINIT-SYNA O A, et al. Isolation and properties of extracellular beta-xylosidases from fungi Aspergillus japonicas and Trichoderma reesei[J]. Biochemistry (Mosc), 2009, 74(9): 1002-1008. DOI:10.1134/S0006297909090089 |
| [36] |
WAKIYAMA M, YOSHIHARA K, HAYASHI S, et al. An extracellular endo-1, 4-β-xylanase from Aspergillus japonicus:Purification, properties, and characterization of the encoding gene[J]. Journal of Bioscience and Bioengineering, 2010, 109(3): 227-229. DOI:10.1016/j.jbiosc.2009.09.005 |
| [37] |
WAKIYAMA M, YOSHIHARA K, HAYASHI S, et al. Purification and properties of an extracellular β-Xylosidase from Aspergillus japonicus and sequence analysis of the encoding gene[J]. Journal of Bioscience and Bioengineering, 2008, 106(4): 398-404. DOI:10.1263/jbb.106.398 |
| [38] |
MILSTEIN O, VERED Y, GRESSEL J, et al. Biodegradation of wheat straw lignocarbohydrate complexes (LCC)[J]. European J Appl Microbiol Biotechnol, 1981, 13: 117. DOI:10.1007/BF00499699 |
| [39] |
FACCHINI F D A, VICI A C, BENASSI V M, et al. Optimization of fibrolytic enzyme production by Aspergillus japonicus C03 with potential application in ruminant feed and their effects on tropical forages hydrolysis[J]. Bioprocess and Biosystems Engineering, 2011, 34(8): 1027-1038. DOI:10.1007/s00449-011-0553-8 |
| [40] |
FACCHINI F D A, VICI A C, REIS V R A, et al. Production of fibrolytic enzymes by Aspergillus japonicus C03 using agro-industrial residues with potential application as additives in animal feed[J]. Bioprocess and Biosystems Engineering, 2011, 34(3): 347-355. DOI:10.1007/s00449-010-0477-8 |
| [41] |
HERCULANO P N, MOREIRA K A, BEZERRA R P, et al. Potential application of waste from castor bean (Ricinus communis L.) for production for xylanase of interest in the industry[J]. Biotech, 2016, 6(2): 144. |
| [42] |
LI P J, XIA J L, NIE Z Y, et al. Saccharification of orange peel wastes with crude enzymes from new isolated Aspergillus japonicus PJ01[J]. Bioprocess and Biosystems Engineering, 2016, 39(3): 485-492. DOI:10.1007/s00449-015-1531-3 |
| [43] |
LI P J, XIA J L, SHAN Y, et al. Comparative study of multi-enzyme production from typical agro-industrial residues and ultrasound-assisted extraction of crude enzyme in fermentation with Aspergillus japonicus PJ01[J]. Bioprocess and Biosystems Engineering, 2015, 38(10): 2013-2022. DOI:10.1007/s00449-015-1442-3 |
| [44] |
LI P J, XIA J L, SHAN Y, et al. Effects of surfactants and microwave-assisted pretreatment of orange peel on extracellular enzymes production by Aspergillus japonicus PJ01[J]. Applied Biochemistry and Biotechnology, 2015, 176(3): 758-771. DOI:10.1007/s12010-015-1609-z |
| [45] |
王金华.黑曲霉酸性木聚糖酶基因在毕赤酵母中的高效表达及其表达产物性质及应用特性研究[D].昆明: 云南师范大学, 2003. WANG J H.Cloning and overexpression of gene encoding acidic endo-β-1, 4-xylanase from Aspergillus niger (N402) in Pichia pastoris and analysis of properties of the recombinant xylanase[D].Kunming: Yunnan Normal University, 2003. |
 2018, Vol. 25
2018, Vol. 25 


