2. 广西职业技术学院食品与生物技术系,广西南宁 530226
2. The Food and Biotechnology, Guangxi Vocational and Technical College, Nanning, Guangxi, 530226, China
【研究意义】 7-氨基头孢烷酸(7-ACA)是头孢菌素C(CPC)的母核,是半合成头孢菌素类抗生素的重要原料,可利用它制备得到头孢匹罗、头孢唑南等几十种抗生素[1]。随着半合成头孢菌素类抗生素在临床用药的广泛运用,7-ACA的需求量也在日益扩大,国际竞争也益发激烈。【前人研究进展】 7-ACA的酶法制备工艺已经基本取代了对环境危害较大的化学法制备工艺。在酶法制备7-ACA中,双酶法(D-氨基酸氧化酶DAAO和戊二酰-7-氨基头孢烷酸酰化酶GA)工艺最为成熟[2-4],被大多数药企广泛运用,并产生了巨大的经济效益。一种新的三酶系统一步法工艺在2005年被提出[5],其工艺就是通过载体共固定化DAAO和过氧化氢酶(CAT)、与载体固定化GA同时加入CPC底物体系中一步法生产7-ACA(图 1)。CAT能够原位水解掉DAAO氧化反应所产生的H2O2,α-酮己二酰-7-氨基头孢烷酸(AKA-7-ACA)在无戊二酸的条件下可被GA水解产生7-ACA。同时避免了当前流行的双酶法工艺路线中H2O2对反应体系酶催化剂的失活及其对底物、中间产物的降解影响,这可以显著地提高酶催化剂的使用寿命[5-7],可有效地降低7-ACA的生产成本。但该工艺由于催化剂都处于相同的固定化形式,经多次重复利用催化剂后,因酶形式不可分离导致有活力的催化剂与失活的催化剂被一起丢弃而造成浪费。【本研究切入点】本研究利用酶形式可分离的三酶系统,通过一个设计的反应器体系外流加H2O2,一步法转化CPC制备7-ACA。【拟解决的关键问题】对重组大肠杆菌分别进行摇瓶和发酵罐高密度表达,获得最高酶活后使用两种酶形式差异的三酶系统一步法转化CPC制备7-ACA。

|
图 1 三酶系统一步法制备7-ACA示意 Fig.1 Schematic diagram of preparation of 7-ACA by tri-enzymatic system in one-pot |
重组pET-28b+GLA/BL21(DE3)是由金斯瑞生物科技公司合成。固定化DAAO购买于湖南宝利士生物技术有限公司。CPC购买于石家庄制药有限公司,戊二酰-7-氨基头孢烷酸(GL-7-ACA)由本实验室制备。十六烷基三甲基溴化铵(CTAB)、十二烷基硫酸钠(SDS)、乙二胺四乙酸(EDTA)等其他化学试剂均为分析纯,由南宁市优科实验试剂经营部提供。
1.2 方法 1.2.1 种子培养取重组菌在LB固体培养基(含50 mg/L卡那霉素)划线后37℃过夜培养,挑取单菌落在50 mL LB液体培养基(含50 mg/L卡那霉素)于37℃,200 r/min恒温摇床培养过夜备用。
1.2.2 摇瓶发酵将上述种子培养液,按8%的接种量接种到50 mL LB培养基(含50 mg/L卡那霉素)中,37℃下培养1~2 h到OD600达到0.8~1.0后,加入2.0%(W/V)乳糖,在25℃,200 r/min诱导表达48 h,每隔6 h取样测定酶活力。
1.2.3 发酵罐发酵在装有LB液体培养基的5 L发酵罐,按8%的接种量接入上述种子液(含50 mg/L卡那霉素),37℃下培养2~3 h至OD600达到1.0左右,加入2.0%(W/V)的乳糖,25℃下诱导表达84 h。分别在诱导6 h、12 h、24 h和36 h后分别补料添加100 mL甘油混合液(15%甘油+7.5%鱼蛋白胨,W/V)。无菌空气以2.5~3.0 L/min速度流入,并通过调节搅拌速度控制溶氧在30%以上,定时测定酶活力。
1.2.4 预处理取一定量重组菌体用0.1 mol/L pH值为8.0的磷酸钠盐缓冲液洗涤一次,离心收集菌体,再用0.1 mol/L pH值为8.0的磷酸钠盐缓冲液重悬,得到重悬液。(1)超声破碎:超声波破碎条件为工作5 s,间歇5 s,功率60 W,细胞悬液在冰浴中超声处理15 min,4 000 r/min下离心10 min,取上清液检测酶活力;(2)CTAB和SDS处理[8]:细胞悬液分别在4℃、200 r/min、0.3 mol/L NaCl条件下,在含0.5%(W/V)CTAB和0.5%(W/V)SDS溶液中分别处理24 h,离心后取上清液测定酶活力;(3)EDTA处理[9]:取适量细胞悬液,加入一定量的EDTA至终浓度0.1 mol/L,在200 r/min,4℃处理24 h,离心后取上清液测定酶活力;(4)乙酸乙酯处理:取适量细胞悬液,加入一定量的乙酸乙酯至终浓度5.0%(W/V),在200 r/min,4℃处理24 h,离心后取上清液测定酶活力;(5)丙酮处理:取适量细胞悬液,加入一定量的丙酮至终浓度30%(W/V),在200 r/min,4℃处理24 h,离心后取上清液测定酶活力;(6)冻融处理:取适量菌体于-20℃保存过夜后,室温条件下解冻,再用15 mL 0.1 mol/L磷酸钠盐缓冲液(pH值为8.0)悬浮,测定细胞酶活力。
1.2.5 酶活力测定GA酶活力的测定方法参考文献[10],其酶活力定义:在pH值8.0,37℃条件下每分钟催化GL-7-ACA产生1 μmol的7-ACA所需的酶量为一个单位(U)。CAT酶活测定方法参考文献[11],其酶活定义:在pH值7.0,25℃条件下每分钟分解1 μmol的H2O2所需的酶量为一个单位(U)。
1.2.6 三酶系统一步法制备7-ACA在一个设计的反应器中加入50 mL 1%的CPC溶液,同时加入固定化DAAO(约40 U)、游离酶形式(超声破碎细胞液)或冻融细胞形式的GA(约40 U)和CAT(约80 U),调节pH值至7.5,温度28℃,氧气流速0.2 L/min,反应体系外流加0.1 mol/L H2O2,催化CPC制备7-ACA,反应液经HPLC检测分析。
1.2.7 HPLC分析CPC,AKA-7-ACA,GL-7-ACA,7-ACA的定量与定性分析是在装有Zorbax Eclipse XDS-C18(250 mm×4.6 mm,5 μm)柱的Agilent1100 series HPLC系统中进行,检测波长λ=254 nm,流动相为含乙腈与磷酸二氢钾溶液(25 mmol/L,pH值为3.5),二者比例为8:92,流速为1.0 mL/min,进样量为1 μL,柱温为28℃。利用峰面积计算底物的转化率及产物的生成率。各成分出峰时间为CPC:3.3 min;AKA-7-ACA:4.6 min;GL-7-ACA:14.4 min;7-ACA:3.0 min。
2 结果与分析 2.1 GA和CAT在摇瓶中的表达研究发现最高的菌浓度(8.10 g/L)出现在36 h,而最高的GA活力(1 327.73 U/L)和CAT活力(1 852.09 U/L)分别出现在24 h和30 h(图 2)。最高GA活力的出现早于最大菌浓度,说明GA酶活力受诱导剂乳糖影响。当摇瓶发酵前期因含有充足的生长营养元素而利于产生大量GA,但到了发酵后期,由于碳源消耗而导致不足,乳糖被作为碳源消耗,菌体代谢保证了菌体的自身生长而不是产酶,因而影响GA的表达,所以导致酶活积累的下降。

|
●:生物量;▲:GA酶活力;■:CAT酶活力 ● :Biomass; ▲ :GA activity; ■ :CAT activity 图 2 摇瓶发酵表达对GA和CAT酶活力的影响 Fig.2 The effect of shaking flask fermentation on the activity of GA and CAT |
最大的菌浓度(35.21 g/L)出现在60 h,而最大的GA(7 099.85 U/L)和CAT(15 776.20 U/L)活力同时出现在72 h,当发酵时间超过72 h,菌体自溶,泡沫增多,导致菌体含量和酶活力同时下降(图 3)。通过发酵罐补料高密度发酵,由于营养物浓度和溶氧等有利因素的提高,导致菌体含量和酶活力都大幅提高。对比摇瓶发酵,菌体含量提高了4.3倍,GA酶活提高了5.3倍,CAT酶活提高了8.5倍。
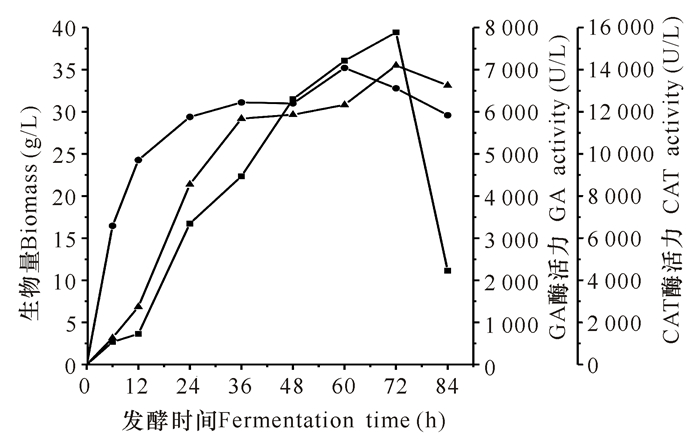
|
●:生物量;▲:GA酶活力;■:CAT酶活力 ● :Biomass; ▲ :GA activity; ■ :CAT activity 图 3 发酵罐发酵表达对GA和CAT活力的影响 Fig.3 The effect of tank fermentation on the activity of GA and CAT |
发酵罐高密度表达重组菌中CAT的酶活力较高,大约是GA酶活力的2倍,在酶促反应中不是一个限制因素。因此,本研究以GA酶活力作为指标考察不同预处理对酶活力的影响。不同的预处理对细胞壁/膜的损伤程度不同,导致胞内酶的失活程度及细胞壁/膜对底物和产物扩散阻力不同,因此造成表观酶活力的不同。本研究以冻融处理细胞的表观酶活为100%。冻融细胞GA酶活力最高,超声破碎细胞液的GA酶活力次之(图 4)。冻融处理,其操作简便,因避免了化学试剂对环境的影响,成本较低且有利于放大,可作为理想的酶催化剂使用。
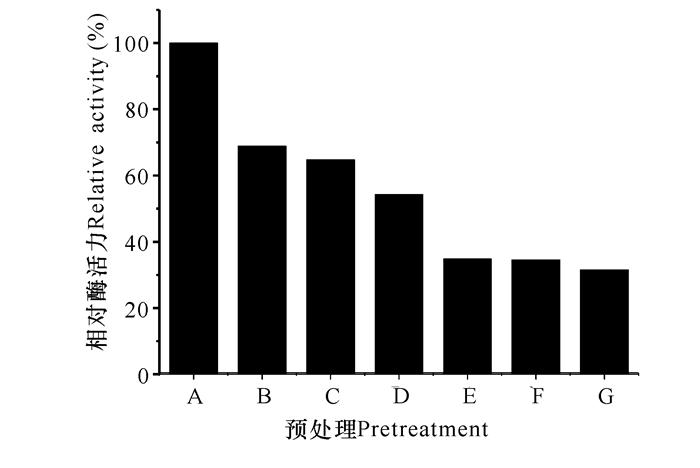
|
A:冻融;B:超声破碎;C:CTAB;D:丙酮;E:SDS;F:乙酸乙酯;G:EDTA A:freeze thaw; B:sonicate; C:CTAB; D:acetone; E:SDS; F:ethyl acetate; G:EDTA 图 4 不同预处理对GA酶活力的影响 Fig.4 The effect of various pretreatments on the activity of GA |
通过固定化DAAO和游离酶GA、CAT一步法催化CPC制备7-ACA,反应体系中充足的CAT分解反应过程中产生的H2O2,CPC完全转化变成AKA-7-ACA,反应过程中几乎检测不到GL-7-ACA。尽管反应结束时CPC已经被完全转化,但7-ACA的产率只达到46.98%。反应体系中36.65%AKA-7-ACA并没有转化成7-ACA,导致了7-ACA的产率很低(图 5)。这表明GA对中间产物AKA-7-ACA的偏好性差、水解能力较弱,远不及对GL-7-ACA水解能力强。
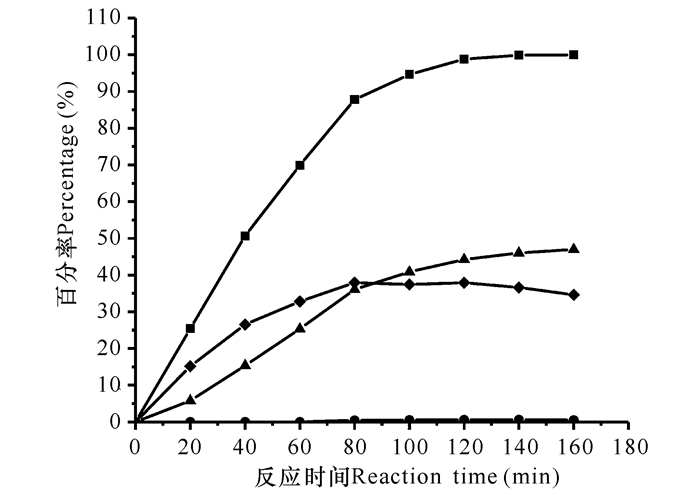
|
■:CPC转化率;◆:AKA-7-ACA生成率;●:GL-7-ACA生成率;▲:7-ACA生成率 ■ :CPC conversion rate; ◆ :AKA-7-ACA production rate; ● :GL-7-ACA production rate; ▲ :7-ACA production rate 图 5 游离酶组成的三酶系统一步法制备7-ACA Fig.5 Preparation of 7-ACA by tri-enzymatic system composed of free enzyme in one-pot |
上述反应过程中损失的GA和CAT可以通过流加新冻融细胞液或者游离酶液进行补偿。由于3种酶的形式可分离,反应的最后,失活的游离酶可被选择的丢弃,而固定化DAAO可以回收重复利用,避免浪费。考虑到H2O2对酶的影响,因此根据反应的需求设计了一个反应器,结构如图 6所示。反应器的底部装有一层过滤膜用于截留固定化酶及冻融酶液,而反应液可以自由通过。利用蠕动泵把反应液抽到外部串联的一个容器,通过流加适量的H2O2把多余的AKA-7-ACA全部转化成GL-7-ACA,再把反应液抽到系统中继续反应,这样能有效地避免了H2O2与酶催化剂的不良影响。
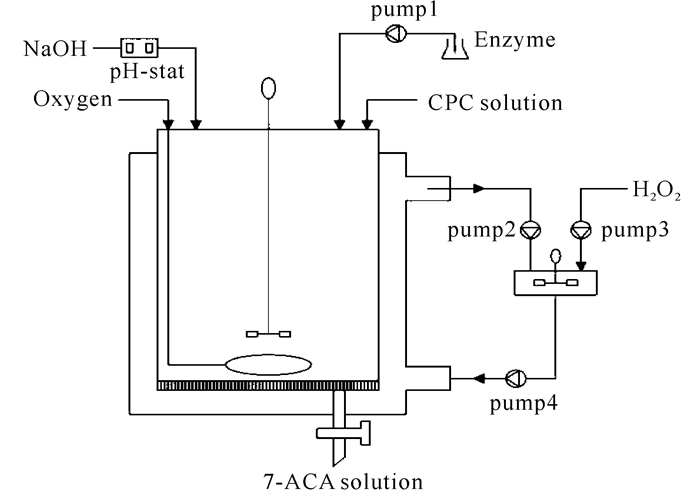
|
图 6 反应器示意 Fig.6 Schematic diagram of reactor system |
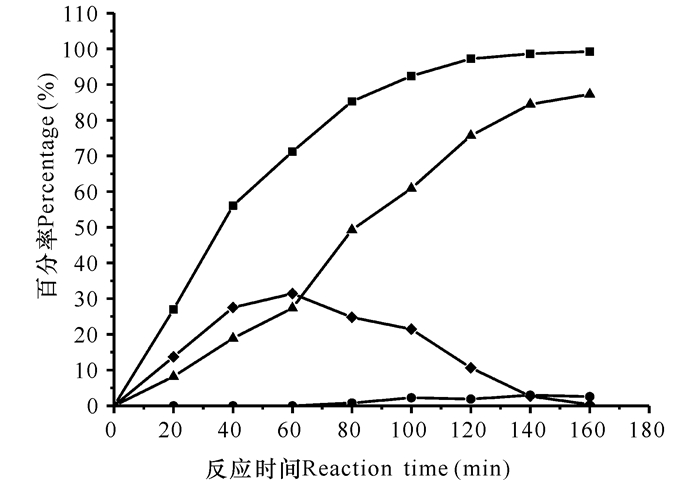
通过设计的反应器,体系外流加适量H2O2把系统中的AKA-7-ACA氧化生成GL-7-ACA,最终被GA催化生成7-ACA。如图 7所示,经过对H2O2的流加量优化,在系统中加入13 mL 0.1 mol/L H2O2,反应结束时,AKA-7-ACA完全被H2O2氧化生成GL-7-ACA,7-ACA的产率高达87.28%。相对于不流加H2O2工艺,7-ACA的产率提高了40.30%;同时CPC也能被完全转化。
|
■:CPC转化率;◆:AKA-7-ACA生成率;●:GL-7-ACA生成率;▲:7-ACA生成率 ■ :CPC conversion rate; ◆ :AKA-7-ACA production rate; ● :GL-7-ACA production rate; ▲ :7-ACA production rate 图 7 流加H2O2条件下游离酶组成的三酶系统一步法制备7-ACA Fig.7 Preparation of 7-ACA by tri-enzymatic system composed of free enzyme under adding H2O2 in one-pot |
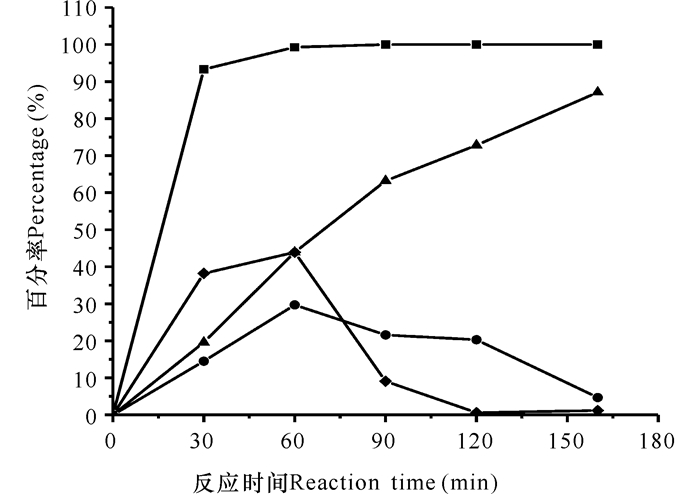
由上述酶反应器,在相同的反应条件下,利用冻融细胞形式GA和CAT代替游离酶形式,反应过程中酶活力损失通过流加细胞悬液补充,结果如图 8所示。在160 min的反应时间,CPC的转化率达到100%,7-ACA的生成率达到87.10%。反应过程未被转化的AKA-7-ACA被体系外加入的H2O2氧化生成GL-7-ACA,再被转化成7-ACA。该工艺所获得7-ACA产率与前述工艺大致相等,但由于冻融细胞处理更简便,易于扩大生产,酶活力更高且稳定性更好,所以选择冻融细胞制备7-ACA更能降低生产成本。固定化DAAO可以被选择的重复多次利用。
|
■:CPC转化率;◆:AKA-7-ACA生成率;●:GL-7-ACA生成率;▲:7-ACA生成率 ■ :CPC conversion rate; ◆ :AKA-7-ACA production rate; ● :GL-7-ACA production rate; ▲ :7-ACA production rate 图 8 流加H2O2条件下冻融细胞组成的三酶系统一步法制备7-ACA Fig.8 Preparation of 7-ACA by tri-enzymatic system composed of freeze-thaw cells under adding H2O2 in one-pot |
本研究对酶形式差异的三酶系统一步法制备7-ACA进行研究。通过设计的反应器体系外流加适量H2O2,利用固定化DAAO、游离酶GA和CAT转化CPC一步法制备7-ACA,CPC转化率达到100%,7-ACA的生成率达到87.28%;利用固定化DAAO、冻融细胞GA和CAT转化CPC一步法制备7-ACA,CPC转化率达到100%,7-ACA的生成率达到87.10%。因GA对中间产物AKA-7-ACA的底物选择性差,限制了三酶系统一步法工艺的工业运用。如能进一步深入对GA分子结构改造,通过突变技术提高GA对AKA-7-ACA的水解能力;或者通过微生物筛选技术寻找到一种对AKA-7-ACA催化活力更好的酶,就能完全避免由于H2O2带来的不良影响,该工艺将会产生巨大的经济效益。
| [1] |
徐兆瑜. 7-ADCA和7-ACA的应用与市场[J]. 化工技术经济, 2004(4): 18-23. XU Z Y. Application and market of pharmaceutical intermediates of 7-ADCA and 7-ACA[J]. Chemical Techno-Economics, 2004(4): 18-23. DOI:10.3969/j.issn.1673-9647.2004.04.005 |
| [2] |
CONLON H D, BAQAI J, BAKER K, et al. Two-step immobilized enzyme conversion of cephalosporin C to 7-amino cephalosporanic acid[J]. Biotechnology and Bioengineering, 1995, 46(6): 510-513. DOI:10.1002/(ISSN)1097-0290 |
| [3] |
BIANCHI D, BORTOLO R, GOLINI P, et al. Enzymatic transformation of cephalosporin C to 7-ACA by simultaneous action of immobilized d-ammo acid oxidase and glutaryl-7-ACA acylase[J]. Applied Biochemistry and Biotechnology, 1998, 73(2/3): 257-268. |
| [4] |
LUO H, LI Q, YU H, et al. Construction and application of fusion proteins of d-amino acid oxidase and glutaryl-7-aminocephalosporanic acid acylase for direct bioconversion of cephalosporin C to 7-aminocephalosporanic acid[J]. Biotechnol Lett, 2004, 26(11): 939-945. DOI:10.1023/B:bile.0000025907.33332.be |
| [5] |
LOPEZ-GALLEGO F, BATENCOR L, HIDALGO A, et al. One-pot conversion of cephalosporin C to 7-aminocephalosporanic acid in the absence of hydrogen peroxide[J]. Advanced Synthesis & Catalysis, 2005, 347(14): 1804-1810. |
| [6] |
TAN Q, ZHANG Y W, SONG Q S, et al. Single-pot conversion of cephalosporin C to 7-aminocephalosporanic acid in the absence of hydrogen peroxide[J]. World Journal Microbiology and Biotechnology, 2010, 26: 145-152. DOI:10.1007/s11274-009-0153-9 |
| [7] |
TAN Q, YUAN J, SONG Q S, et al.Conversion of cephalosporin C to 7-aminocephalosporanic acid using cell-bound and support-bound enzymes[C]. The 3rd Sino-Thai International Conference on Traditional Medicine and Natural Products, 2008: 155-159.
|
| [8] |
CHENG S W, WEI D Z, SONG Q X. Extraction penicillin G acylase from Alcaligenes faecalis in recombinant Escherichia coli with cetyl-trimethylammoniumbromide[J]. Biochemical Engineering Journal, 2006, 32(1): 56-60. |
| [9] |
KHEIROLOMOOM A, ARDJMAND M, FAZELINIA H, et al. Isolation of penicillin G acylase from Escherichia coli ATCC 11105 by physical and chemical treatments[J]. Biochemical Engineering Journal, 2001, 8(3): 223-227. |
| [10] |
PARK S W, KIM Y I, CHUNG K H, et al. Improvement of stability of immobilized GL-7-ACA acylase through modification with glutaraldehyde[J]. Process Biochemistry, 2001, 37(2): 153-163. |
| [11] |
BAI J, RODRIGUEZ A M, MELENDEZ J A, et al. Overexpression of catalase in cytosolic or mitochondrial compartment protects HepG2 cells against oxidative injury[J]. The Journal of Biological Chemistry, 1999, 274(37): 26217-26224. |
 2018, Vol. 25
2018, Vol. 25 


