【研究意义】氧化葡萄糖酸杆菌(Gluconobacter oxydans)是一种严格好氧的革兰氏阴性菌,属于醋酸菌科[1-2]。其最大的特点之一就是细胞膜上含有许多脱氢酶,可将羟基化合物不完全氧化生成相应的醛、酮或酸等。【前人研究进展】其中膜结合山梨醇脱氢酶(mSLDH)负责氧化甘油生产二羟基丙酮(DHA),负责编码该酶的基因sldAB的过量表达,可提高二羟基丙酮的产量和对高浓度底物产物的耐受性。当敲除了膜结合乙醇脱氢酶编码基因adh,上述现象更加明显[3]。膜结合乙醇脱氢酶(mADH)和膜结合乙醛脱氢酶(mALDH)共同参与了将一系列醇,如甲醇、乙醇、正丙醇、正丁醇、乙二醇、1, 4-丁二醇等氧化成相应醛最后得到相应的酸的反应,这两个酶基本不能氧化3个以上羟基的多元醇,如仲醇、多羟基醇等,随底物碳链长度的增加催化活性减小[4]。氧化葡萄糖酸杆菌是严格好氧微生物,周质空间发生的脱氢反应普遍需要消耗大量氧气,因此在很多产物的生产过程中都需保证较高的溶氧水平[5]。【本研究切入点】氧化葡萄糖酸杆菌有多种菌株,不同菌株之间的生理特性和催化性质不尽相同。氧化葡萄糖酸杆菌621H是一株模式菌株,并于2005年完成了基因组测序[6]。氧化葡萄糖酸杆菌DSM 2003常见于各种有机酸的生产[7-9]。目前国内外尚未有针对于这两株菌对不同醇的催化性能进行比较。【拟解决的关键问题】本研究将比较氧化葡萄糖酸杆菌DSM 2003和621H静息细胞对甘油、乙二醇及乙醇的催化能力,并比较溶氧对催化反应的影响,为改进氧化葡萄糖酸杆菌发酵生产二羟基丙酮、羟基乙酸等打下基础。
1 材料与方法 1.1 材料 1.1.1 菌种氧化葡萄糖酸杆菌DSM 2003和氧化葡萄糖酸杆菌621H(DSM 2343)购至购自德国DSM菌种保藏中心(DSMZ)。
1.1.2 培养基山梨醇培养基:山梨醇80 g/L,酵母粉20 g/L,KH2PO4 1.5 g/L,(NH4)2SO4 1.5 g/L和MgSO4·7H2O 0.5 g/L。
1.2 方法 1.2.1 细胞培养将氧化葡萄糖酸杆菌DSM 2003和621H在山梨醇培养基中活化,以1%的接种量分别转接到50 mL新鲜的山梨醇培养基中,30℃摇床培养,转速220 r/min,每份3瓶作为平行样品。
1.2.2 静息细胞制备氧化葡萄糖酸杆菌生长到指数生长末期(约20 h),在4℃下12 000 r/min离心10 min,倒掉上清液,收集菌体。用pH=6.0的磷酸缓冲液悬浮菌体,在4℃下12 000 r/min离心10 min,回收菌体,重复洗涤3遍。最后用pH=6.0的磷酸缓冲液重悬菌体。
1.2.3 静息细胞催化反应每个50 mL锥形瓶中的催化反应体系包括菌体1.0 g DCW/L(OD600=3.0),甘油或乙二醇10 g/L和pH=6.0的磷酸缓冲液共10 mL,每个反应作3个平行样品。催化反应条件:30℃,转速220 r/min。每隔一定时间取样1 mL于1 mL EP管中,样品在4℃下12 000 r/min离心10 min,取上清于1 mL EP管中。样品保存于4℃冰箱中,并于12 h内进行检测。
1.2.4 甘油浓度的测定甘油浓度的测定使用上海科欣生物技术研究所的甘油三酯试剂盒。
1.2.5 二羟基丙酮、羟基乙酸及乙酸浓度的测定二羟基丙酮、羟基乙酸及乙酸浓度的测定采用高压液相仪(HPLC)检测。具体色谱条件:反相色谱柱-ZorbaxRR SBAq (4.6 mm×250 mm, 5 μm);流动相:0.1%(V/V)稀磷酸;流速:1.0 mL/min;柱温:30℃;紫外检测波长:210 nm;进样体积:10 μL。
1.2.6 乙二醇浓度的测定乙二醇和内标1, 4-丁二醇的浓度使用气相色谱仪(Agilent 6890)检测。具体色谱条件为:DB-WAX毛细管柱,氮气为载气,流速为20 mL/min;进样口温度为250℃;氢火焰离子检测器;色谱柱升温程序为初始温度为100℃维持1 min,以20 ℃/min升温至180℃维持3 min;分流比20:1,进样体积:1 μL。
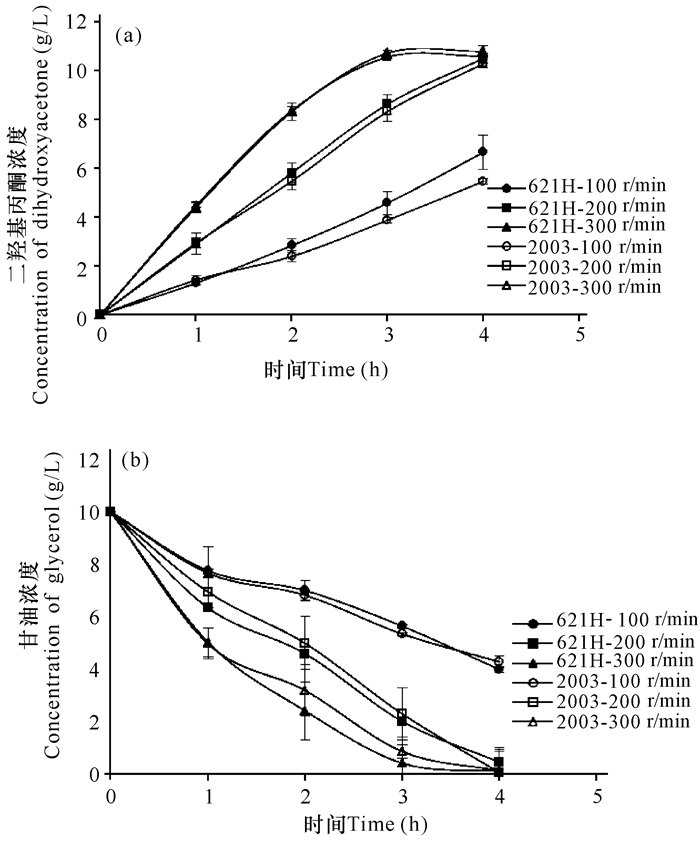
2 结果与分析 2.1 氧化葡萄糖酸杆菌转化甘油生成二羟基丙酮的研究氧化葡萄糖酸杆菌最大的特点之一是其细胞膜上具有丰富的脱氢酶,能够直接氧化一系列的醇生成酮、醛、酸等,底物不需要通过透膜运输而直接在胞外进行反应,极大地促进了催化效率。其中,氧化葡萄糖酸杆菌膜上山梨醇脱氢酶(mSLDH)能够将甘油转化为二羟基丙酮,该酶还具有其他底物活性,如甘露醇、山梨醇、阿拉伯醇、5-酮基-葡萄糖酸等。本研究考察了氧化葡萄糖酸杆菌DSM 2003和621H在不同转速下氧化甘油生成二羟基丙酮的情况。
图 1可见,两株氧化葡萄糖酸杆菌氧化甘油的能力受溶氧影响非常明显,随着转速提高二羟基丙酮的生成速率明显加快。经过3 h,转速为300 r/min下两株菌的甘油氧化反应基本结束,底物几乎完全转化为二羟基丙酮,转化率接近100%(图 1b)。200 r/min转速下的反应需经4 h才能结束,而此时转速为100 r/min下的静息细胞只氧化了大约50%底物。实验说明氧化葡萄糖酸杆菌氧化甘油的反应会消耗大量氧气,溶氧是影响反应速率的重要因素之一。尽管两种静息细胞在300 r/min的转速下生产二羟基丙酮的能力几乎相同,但是氧化葡萄糖酸杆菌621H在100 r/min和200 r/min下的反应速率略高于氧化葡萄糖酸杆菌DSM 2003(图 1a)。实验说明了氧化葡萄糖酸杆菌621H在低溶氧水平下比氧化葡萄糖酸杆菌DSM 2003拥有较强的催化甘油的能力,可能是由于氧化葡萄糖酸杆菌621H结合氧气的能力更强。
|
图 1 氧化葡萄糖酸杆菌DSM 2003和621H的静息细胞在不同转速下二羟基丙酮的生成曲线(a)与甘油的消耗曲线(b) Fig.1 Comparison of DHA production curve(a) and glycerol consumption curve(b) among G.oxydans DSM 2003 and 621H with different rotate speed |
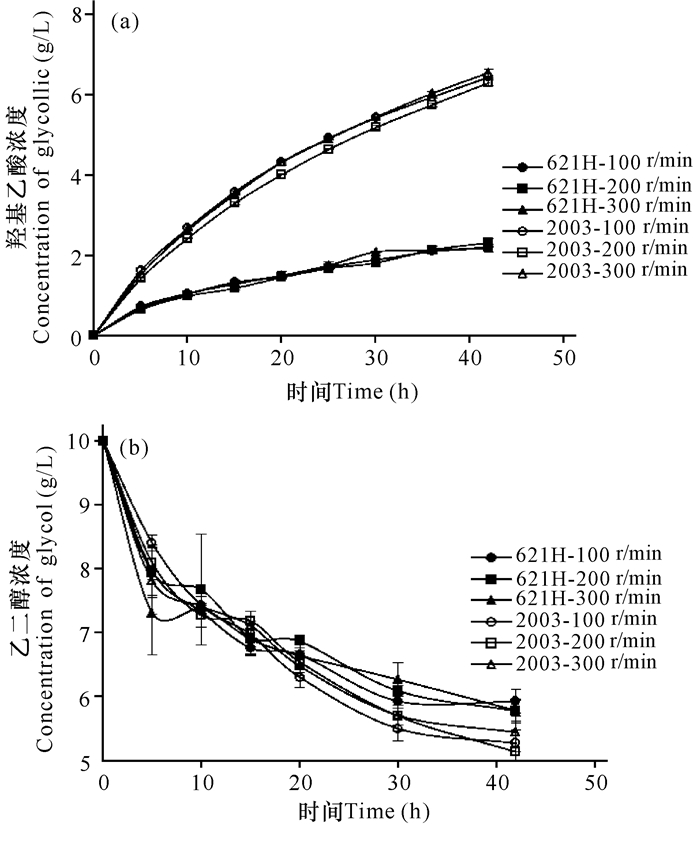
利用醋酸菌氧化乙醇酿造醋主要依靠膜结合PQQ依赖型乙醇脱氢酶(mADH)和膜结合PQQ依赖型乙醛脱氢酶(mALDH)参与的两步连续反应。mADH能够将乙醇氧化为乙醛,乙醛进一步被mALDH氧化为乙酸。这类酶与呼吸链相耦连,氧化底物过程中使膜上的泛醌(Q)还原(通过泛醌氧化酶再次氧化),能量主要来自与细胞色素bo3泛醌氧化酶相关的呼吸链,一小部分能量来自氰化物不敏感的氧化酶CioAB呼吸链,两者均能还原氧气生成水。mADH也参与氰化物不敏感的呼吸链[10]。本研究探讨了两种氧化葡萄糖酸杆菌对乙二醇催化的不同效果。
如图 2a所示,不同转速对静息细胞催化乙二醇生成羟基乙酸的影响并不是特别明显,说明溶氧并非这两株菌催化此反应的关键因素。氧化葡萄糖酸杆菌DSM 2003生产羟基乙酸的能力明显强于氧化葡萄糖酸杆菌621H。经过42 h,氧化葡萄糖酸杆菌DSM 2003生产羟基乙酸约6 g/L,是氧化葡萄糖酸杆菌621H的3倍。虽然氧化葡萄糖酸杆菌621H生产的羟基乙酸远少于氧化葡萄糖酸杆菌DSM 2003,但是氧化葡萄糖酸杆菌621H消耗的底物很多(约4.3 g/L),与氧化葡萄糖酸杆菌DSM 2003消耗约4.8 g/L乙二醇差别不大(图 2b),说明氧化葡萄糖酸杆菌621H消耗的乙二醇并没有完全转化为羟基乙酸而是产生了其他副产物,也可能是由于621H膜上的mADH及mALDH特异性不及DSM 2003的强。用氧化葡萄糖酸杆菌生成羟基乙酸的反应速率较生成二羟基丙酮的反应速率慢,其中一个原因可能是产物的积累使环境pH降低导致mADH及mALDH的活性降低。以前的研究发现敲除了膜结合乙醇脱氢酶的氧化葡萄糖酸杆菌不能氧化乙二醇,但敲除了膜结合乙醛脱氢酶的菌株仍然能够转化乙二醇为羟基乙酸,说明存在一些其他的同工酶能够行使与乙醛脱氢酶相同的作用,但是其催化能力不及乙醛脱氢酶,致使羟基乙酸产量不如野生型菌株高[9]。
|
图 2 氧化葡萄糖酸杆菌DSM 2003和621H的静息细胞在不同转速下羟基乙酸的生成曲线(a),乙二醇的消耗曲线(b) Fig.2 Comparison of glycollic acid production curve(a), glycol consumption curve(b) among G.oxydans DSM 2003 and 621H with different rotate speed |
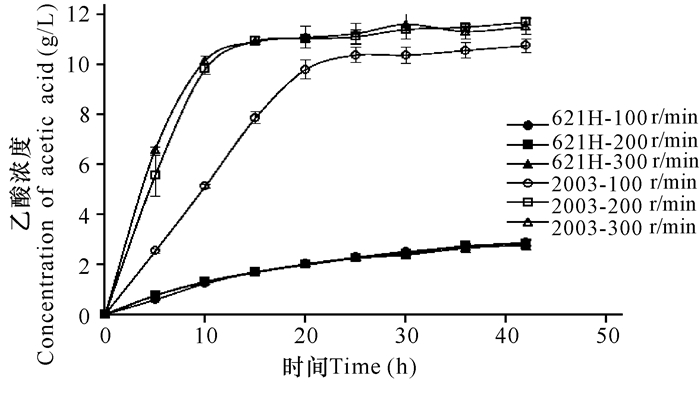
如图 3所示,与催化乙二醇相比,氧化葡萄糖酸杆菌DSM 2003对乙醇催化反应的进行速率要快得多,到15 h转速为200 r/min和300 r/min的底物氧化反应基本结束。而转速为100 r/min,DSM 2003催化乙醇生成乙酸的能力变弱,说明低溶氧不利于DSM 2003催化乙醇生成乙酸。同样地,621H催化乙醇生成乙酸的能力较DSM 2003弱很多,但溶氧对此菌株的催化能力影响不大。从乙二醇及乙醇的催化反应可以看出,氧化葡萄糖酸杆菌DSM 2003催化醇生成酸的能力要比621H强很多。
|
图 3 氧化葡萄糖酸杆菌DSM 2003和621H的静息细胞在不同转速下乙酸的生成曲线 Fig.3 The curve of acetic acid production among G.oxydans DSM 2003 and 621H with different rotate speed |
本文研究了氧化葡萄糖酸杆菌DSM 2003和621H静息细胞对甘油、乙二醇及乙醇的催化能力,以及比较了供氧对催化反应的影响。氧化葡萄糖酸杆菌菌株之间酶的性质有所不同。相较乙醇脱氢酶和乙醛脱氢酶氧化醇生成酸的反应而言,溶氧对山梨醇脱氢酶氧化甘油成二羟基丙酮反应影响比较明显。
两株氧化葡萄糖酸杆菌氧化甘油生成二羟基丙酮的能力相似,而催化醇生成酸的反应却大不相同。几乎消耗相同量的底物,氧化葡萄糖酸杆菌621H生产羟基乙酸和乙酸的能力都很低,氧化过程中产生了很多其他的副产物;氧化葡萄糖酸杆菌DSM 2003在催化醇生成酸的反应中特异性强,底物基本完全转化成了羟基乙酸和乙酸。
| [1] |
FLICKINGER M, PERLMAN D. Application of oxygen-enriched aeration in the conversion of glycerol to dihydroxyacetone by Gluconobacter melanogenus IFO 3293[J]. Applied and Environmental Microbiology, 1977, 33(3): 706-712. |
| [2] |
DE M C, PEREIRA C S, NAESSENS M, et al. The genus Gluconobacter oxydans:Comprehensive overview of biochemistry and biotechnological applications[J]. Critical Reviews in Biotechnology, 2007, 27(3): 147-171. DOI:10.1080/07388550701503584 |
| [3] |
LI M H, WU J, LIU X, et al. Enhanced production of dihydroxyacetone from glycerol by overexpression of glycerol dehydrogenase in an alcohol dehydrogenase-deficient mutant of Gluconobacter oxydans[J]. Bioresource Technology, 2010, 101(21): 8294-8299. DOI:10.1016/j.biortech.2010.05.065 |
| [4] |
韦柳静, 林金萍, 杨雪鹏, 等. 氧化葡萄糖酸杆菌DSM 2003膜结合乙醇脱氢酶的纯化鉴定和性质研究[J]. 食品科学, 2010, 31(13): 164-168. WEI L J, LIN J P, YANG X P, et al. Purification, identification and characterization of membrane-bound alcohol dehydrogenase from Gluconobacter oxydans DSM 2003[J]. Food Science, 2010, 31(13): 164-168. |
| [5] |
SILBERBACH M, MAIER B, ZIMMERMANN M, et al. Glucose oxidation by Gluconobacter oxydans:characterization in shaking-flasks, scale-up and optimization of the pH profile[J]. Applied Microbiology and Biotechnology, 2003, 62(1): 92-98. DOI:10.1007/s00253-003-1222-x |
| [6] |
PRUST C, HOFFMEISTER M, LIESEGANG H, et al. Complete genome sequence of the acetic acid bacterium Gluconobacter oxydans[J]. Nature Biotechnology, 2005, 23(2): 195-200. DOI:10.1038/nbt1062 |
| [7] |
WEI G D, YANG X P, GAN T, et al. High cell density fermentation of Gluconobacter oxydans DSM 2003 for glycolic acid production[J]. J Ind Microbiol Biotechnol, 2009, 36(8): 1029-1034. DOI:10.1007/s10295-009-0584-1 |
| [8] |
WEI G D, YANG X P, ZHOU W Y, et al. Adsorptive bioconversion of ethylene glycol to glycolic acidby Gluconobacter oxydans DSM 2003[J]. Biochemical Engineering Journal, 2009, 47(1): 127-131. |
| [9] |
WEI L J, ZHOU J L, ZHU D N, et al. Functions of membrane-bound alcohol dehydrogenase and aldehyde dehydrogenase in the bio-oxidation of alcohols in Gluconobacter oxydans DSM 2003[J]. Biotechnology and Bioprocess Engineering, 2012, 17(6): 1156-1164. DOI:10.1007/s12257-012-0339-0 |
| [10] |
YAKUSHI T, MATSUSHITA K. Alcohol dehydrogenase of acetic acid bacteria:structure, mode of action, and applications in biotechnology[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1257-1265. DOI:10.1007/s00253-010-2529-z |
 2018, Vol. 25
2018, Vol. 25 


