【研究意义】丙酮-丁醇-乙醇(ABE)发酵曾是仅次于酒精发酵的世界第二大发酵过程,但由于发酵法生产成本较高,发酵法生产丁醇难于与廉价的石油路线相竞争,因此在19世纪60年代后期发酵法生产丁醇处于基本停止状态[1-2]。生物丁醇与乙醇相似,是新一代的液体燃料,与乙醇相比,生物丁醇在燃料性能和经济性方面具有明显的优势[3]。另外,丁醇还是一种非常重要的化工原料和工业生产过程中的溶剂,广泛应用于化工、塑料、有机合成、油漆等工业,可用作油漆和表面涂料的溶剂和各种塑料、橡胶制品的生产,还可以生产醋酸丁酯、丙烯酸丁酯、丁醛、丁酸、丁胺和乳酸丁酯等化工产品。随着石油资源的日渐枯竭,发酵法生产生物丁醇越来越受到人们的重视[4]。【前人研究进展】本文作者所在的实验室研究了以木薯、甘蔗渣、糖蜜、新鲜马铃薯为原料发酵生产丙酮-丁醇-乙醇[5-9],陈丽杰等[10]以菊芋汁为原料发酵生产丙酮-丁醇-乙醇,马晓建等[11]研究了以玉米秸秆为原料发酵生产丙酮-丁醇-乙醇,王风芹等[12]研究了以玉米芯为原料发酵生产丙酮-丁醇-乙醇,龙飞等[13]研究了以鲜芭蕉芋为原料发酵生产丙酮-丁醇-乙醇,田毅红等[14]研究了以红薯为原料发酵生产丙酮-丁醇-乙醇。这些研究都取得了较好的研究成果,为拓宽丙酮-丁醇-乙醇发酵生产的原料来源奠定了基础。【本研究切入点】制约发酵法生产丙酮-丁醇-乙醇产业发展的主要因素是生产成本过高。而造成生产成本高的主要问题有两个:首先是目前生产中所用的菌种梭状芽孢杆菌的丁醇耐受性差,发酵成熟醪的丁醇含量为10~12 g/L、总溶剂为18~20 g/L,产品的分离成本过高。其次是目前我国发酵法生产丙酮-丁醇-乙醇主要是以全玉米为原料,原料成本过高也是造成生产成本过高的直接原因。玉米是一种粮食,以玉米为原料生产生物丁醇不符合我国生物质产业的发展要求。因此,除了致力于丙酮丁醇高产菌株的选育之外,寻找适合于丙酮-丁醇-乙醇发酵的非粮生物质原料也成为了目前的研究热点。甘薯是一种适应性强、易种植、耐旱、耐盐、单产高、淀粉含量高的农作物,在我国各地的丘陵、平坝、贫瘠的荒地或者边缘地带都可以种植。据统计,2015年我国甘薯种植面积在427万公顷左右,单产每公顷24.48 t,总产量约1.1亿吨[15]。我国甘薯总产量在国内农产品产量中位居第4位,仅次于水稻、小麦和玉米的产量。2007年国家发展和改革委员会公布的《可再生能源中长期发展规划》[16]中已将甘薯列为重点发展的燃料乙醇原料作物。因此,开展甘薯为原料发酵生产丙酮-丁醇-乙醇的研究具有重要的意义。【拟解决的关键问题】通过分离筛选获得适合于以甘薯为原料发酵生产丙酮-丁醇-乙醇的生产菌株,通过发酵培养基和发酵条件的优化,研究确定最佳的发酵工艺条件,为工业化生产奠定基础。
1 材料与方法 1.1 材料(1) 原材料及试剂:本研究所用的甘薯、豆粕和花生麸均为市售,其他试剂均为国产分析纯试剂。
(2) 主要仪器设备:气相色谱仪(SHIMADZU GC-2014C),Anoxomat Mark Ⅱ全自动厌氧培养系统(荷兰MART公司)。
(3) 样品采集:筛选菌种所用样品采自广西大学校园内的池塘淤泥、下水道淤泥及养猪场、果园、菜地等的土壤。
1.2 方法 1.2.1 培养基配制富集培养基:50 g/L葡萄糖,10 g/L蛋白胨,2 g/L酵母膏,0.5 g/L磷酸氢二钾,0.2 g/L硫酸镁,pH值为7.2,混匀后分装于大小规格为200 mm×20 mm试管中,每管装20 mL,115℃灭菌25 min,使用之前加入10 g/L正丁醇。
分离培养基:20 g/L葡萄糖,10 g/L蛋白胨,2 g/L酵母膏,0.5 g/L磷酸氢二钾,0.2 g/L硫酸镁,15 g/L琼脂,pH值为7.2,115℃灭菌25 min。待培养基冷却至50℃左右加入10 g/L正丁醇,混合均匀后倒平板。
液体试管培养基:在糖浓度为70 g/L甘薯液化液中添加8 g/L豆粕,pH值为6.0,混匀后分装于大小规格为200 mm×20 mm试管,每管装20 mL,121℃灭菌25 min。
1.2.2 菌种分离筛选富集培养:将5 g采集到的样品加入到装有20 mL富集培养基的试管中,置37℃培养箱中培养72 h。
菌种的分离:富集培养液经适当稀释后吸取100 μL涂布于含有分离培养基的平板上,涂布好的培养皿倒置放在厌氧罐里面,将厌氧罐与Anoxomat Mark Ⅱ全自动厌氧培养系统连接,通过气体的置换使厌氧罐保持厌氧状态,37℃培养48 h,挑取单菌落,划线纯化培养。
菌种的筛选:将分离纯化获得的单菌落分别接入液体试管培养基中,37℃培养72 h,用气相色谱法检测发酵产物,选出丁醇产量较高的菌株。
1.2.3 菌种鉴定采用菌落PCR方法,以筛选获得的丁醇产量较高的菌株的单个菌落作为模板,以细菌的16S rRNA基因通用引物27f-1492r直接扩增16S rRNA基因片断。PCR产物送上海生工生物工程股份有限公司测序,所得的序列在NCBI中进行BLAST比对,确定所筛选菌种的种属。
1.2.4 种子制备将菌种接入液体试管培养基中,37℃静止培养24 h,即获得种子液。
1.2.5 最佳发酵条件研究(1) 初糖浓度对菌株产溶剂的影响:配制初糖浓度为60 g/L、70 g/L、80 g/L、90 g/L、100 g/L和110 g/L的甘薯液化液培养基,分别添加8 g/L豆粕粉,用250 mL三角瓶盛装,装液量为200 mL,pH值调为6.0,按10%接种量接入种子液,37℃静置发酵72 h。发酵结束后,取样测定溶剂的产量及残糖含量。
(2) 不同氮源对菌株产溶剂的影响:在初糖浓度为100 g/L的甘薯液化液中分别添加2 g/L的NH4NO3、NH4Cl、NH4H2PO4、(NH4)2SO4、CH3COONH4、(NH4)2C2O4(草酸铵)和尿素以及10 g/L的豆粕、花生麸、麸皮、酵母膏和牛肉膏,以不添加氮源为对照,pH值为6.0,37℃发酵72 h。发酵结束后,取样测定溶剂的产量。
(3) 氮源浓度对菌株产溶剂的影响:在初糖浓度为100 g/L的甘薯液化液中分别添加0 g/L、2 g/L、4 g/L、6 g/L、8 g/L和10 g/L的豆粕或花生麸,pH值为6.0,37℃发酵72 h。发酵结束后,取样测定溶剂的产量。
(4) 无机盐对菌株产溶剂的影响:向初始糖浓度为100 g/L的甘薯液化液、8 g/L豆粕的培养基中分别加入0 g/L、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L和1 g/L的KH2PO4;或0 g/L、0.02 g/L、0.04 g/L、0.06 g/L、0.08 g/L和0.1 g/L的FeSO4·7H2O;或0 g/L、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L和1.0 g/L的MgSO4·7H2O。pH值为6.0,37℃培养72 h。发酵结束后,取样测定溶剂的产量。
(5) 初始pH对菌株产溶剂的影响:以初始糖浓度为100 g/L的甘薯液化液、8 g/L豆粕的培养基为基质,分别调节pH为4.5, 5.0, 5.5, 6.0, 6.5, 7.0和7.5,对照组的pH自然(5.8左右),37℃静置培养72 h。发酵结束后,取样测定溶剂的产量。
(6) 接种量对菌株产溶剂的影响:在初始糖浓度为100 g/L的甘薯液化液、8 g/L豆粕的培养基中,分别按照10%、14%、16%、20%、24%、28%和30%的接种量接入培养了24 h的种子液,37℃发酵72 h。发酵结束后,取样测定溶剂的产量。
(7) 种龄对菌株产溶剂的影响:在初始糖浓度为100 g/L的甘薯液化液、8 g/L豆粕的培养基中,按照10%的接种量分别接入于37℃培养了14 h、18 h、22 h、26 h和30 h的种子液,置37℃发酵72 h。发酵结束后,取样测定溶剂的产量。
1.2.6 10 L发酵罐的发酵动力学以初始糖浓度为100 g/L的甘薯液化液为发酵培养基,添加8.0 g/L的豆粕、0.8 g/L的KH2PO4和0.06 g/L的FeSO4·7H2O,初始pH自然,10 L发酵罐装料8 L,种龄22 h,接种量为10%,于37℃下进行发酵。发酵前16 h每2 h取一次样,16 h以后每隔4 h取样一次。样品取出来后立即用pH计测定样品pH,然后放入4℃冰箱保存。待发酵结束后,用气相色谱仪测定发酵产物含量,用斐林试剂法测定残糖含量。
1.2.7 发酵产物的测定发酵产物丁醇、丙酮、乙醇、乙酸和丁酸等采用气相色谱内标法测定(内标物为异丁醇)。分离柱为PEG-20M毛细管柱(30 m×0.32 mm×1.0 μm)。检测器为FID。载气为高纯度氮气(99.99%)。汽化室温度250℃。检测室温度250℃。进样量0.4 μL。升温程序:初温60℃,保持1 min;以10 ℃/min升温速率升至90℃;以20 ℃/min升温速率升至180℃,保持1 min。
糖浓度测定:采用菲林试剂滴定法。
2 结果与分析 2.1 生产菌株分离、筛选与鉴定所采集的样品经富集、初筛、复筛后获得了三株遗传稳定的丙酮-丁醇-乙醇生产菌株(表 1)。
| 表 1 丙酮-丁醇-乙醇生产菌株分离筛选的结果(g/L) Table 1 The results of isolation screening for ABE production strains (g/L) |
将分离筛选到的三个菌株的16S rDNA的PCR产物测序所获得的序列分别在GenBank数据库中的进行序列比对,比对的结果表明,这3株菌与Clostridium acetobutylicum ATCC 824的序列相似性均达到99%。初步确定这3株菌均属于丙酮丁醇梭菌(Clostridium acetobutylicum)。产物检测结果表明,菌株J-3-3的丁醇产量及总溶剂的产量最高,因此,选择菌株J-3-3作为后续研究的生产菌株。
2.2 最佳发酵条件 2.2.1 初糖浓度对菌株产溶剂的影响当初糖浓度为60~110 g/L时,初糖浓度越高,溶剂产量越高(表 2)。当初糖浓度为100 g/L时,丙酮、丁醇、乙醇及总溶剂的得率均达到最高值,分别为10.51%、20.48%、2.1%和33.7%(表 3)。综上考虑,初糖浓度100 g/L为甘薯液化液产溶剂的最适初始糖浓度。
| 表 2 初糖浓度对菌株J-3-3溶剂产量的影响(g/L) Table 2 Effect of concentration of initial sugar on solvent yield of C.acetobutylicum J-3-3(g/L) |
| 表 3 初糖浓度对产物得率的影响 Table 3 Effect of concentration of initial sugar on yield of product |
以甘薯为原料发酵生产丙酮丁醇时,添加无机氮源时丁醇产量为7~10 g/L,总溶剂为11~17g/L, 而添加有机氮源时丁醇产量为11~12 g/L,总溶剂为18~19 g/L,因此,向培养基中添加有机氮源更有利于溶剂的积累(表 4)。考虑到工业化的生产成本,可选择豆粕或花生麸作为甘薯为原料发酵生产丙酮丁醇的氮源。为此,我们进行了豆粕浓度和花生麸浓度对产溶剂的影响的研究,以便筛选出甘薯为原料发酵生产丙酮丁醇的最佳氮源。
| 表 4 氮源对菌株J-3-3溶剂产量的影响(g/L) Table 4 Effect of different nitrogen sources on solvent yield of C.acetobutylicam J-3-3(g/L) |
随着豆粕浓度的增加,丁醇浓度及总溶剂的浓度也随之升高(表 5)。当豆粕浓度为8 g/L时,丁醇、丙酮、乙醇和总溶剂产量分别为12.98 g/L、6.92 g/L、2.15 g/L和22.05 g/L。当豆粕浓度添加到10 g/L时,丁醇浓度及总溶剂的浓度增幅很小,说明添加8 g/L的豆粕已经能够满足J-3-3发酵甘薯液化液产生溶剂的要求,且性价比最高。
| 表 5 豆粕浓度对菌株J-3-3产溶剂的影响 Table 5 Effect of concentrations of soybean meal on solvent yield of C.acetobutylicam J-3-3 |
随着花生麸浓度的增加,丁醇浓度及总溶剂的浓度也随之升高,花生麸浓度达到6 g/L之后,丁醇浓度和总溶剂的浓度增幅很小(表 6)。研究结果显示,豆粕比花生麸能更好地促进菌株J-3-3发酵甘薯产溶剂。因此,以8 g/L的豆粕作为最佳氮源。
| 表 6 花生麸浓度对菌株J-3-3产溶剂的影响(g/L) Table 6 Effect of concentration of peanut bran on solvent yield of C.acetobutylicam J-3-3(g/L) |
实验表明,无机盐的添加对菌株J-3-3发酵产溶剂具有一定影响。当KH2PO4的浓度达到0.8 g/L时,总溶剂产量最高,与不添加KH2PO4相比,丁醇产量提高了15%,总溶剂产量提高19%(表 7)。当FeSO4·7H2O的含量为0.06 g/L时,溶剂产量达到最大,与对照组相比,正丁醇和总溶剂产量分别提高了29%和25%(表 8)。硫酸镁对J-3-3产溶剂的提高没有促进的作用(表 9)。因此,在以甘薯为原料发酵生产丙酮丁醇中,不考虑添加MgSO4·7H2O。
| 表 7 磷酸二氢钾浓度对菌株J-3-3发酵产溶剂的影响(g/L) Table 7 Effect of concentration of KH2PO4 on fermentation solvent yield of C.acetobutylicam J-3-3(g/L) |
| 表 8 FeSO4·7H2O对菌株J-3-3发酵产溶剂的影响(g/L) Table 8 Effect of concentration of FeSO4·7H2O on fermentation solvent yield of C.acetobutylicam J-3-3(g/L) |
| 表 9 MgSO4·7H2O对菌株J-3-3发酵产溶剂的影响(g/L) Table 9 Effect of concentration of MgSO4·7H2O on fermentation solvent yield of C.acetobutylicam J-3-3(g/L) |
当初始pH值在5.5及其以下时,丁醇和总溶剂产量较低(表 10)。在初始pH值为6.0~7.5时,溶剂产量虽有波动,但总体变化不大,正丁醇产量为9.0 g/L左右,总溶剂产量为14 g/L左右。对照组的初始pH自然,经测定其pH值在5.8左右,其正丁醇产量为9.05 g/L,总溶剂产量为14.30 g/L,与初始pH值为6.0~7.5的发酵结果相比,相差不大,因此,在以甘薯液化液发酵生产丙酮丁醇时,不需要调整pH值。
| 表 10 初始pH对菌株J-3-3产溶剂的影响(g/L) Table 10 Effect of initial pH on solvent yield of C.acetobutylicam J-3-3(g/L) |
接种量从10%至30%的范围内对发酵影响不大(表 11),说明10%的接种量已经能够满足发酵的要求。
| 表 11 接种量对菌株J-3-3产溶剂的影响 Table 11 Effect of inoculum size on solvent yield of C.acetobutylicam J-3-3 |
种龄为22 h时,各溶剂产量最高,丙酮、乙醇和丁醇的产量分别达到7.80 g/L、1.64 g/L和14.70 g/L,总溶剂产量达到24.14 g/L(表 12)。因此,37℃培养22 h为菌株J-3-3发酵甘薯产溶剂的最佳种龄。
| 表 12 种龄对菌株J-3-3产溶剂的影响 Table 12 Effect of seed age on solvent yield of C.acetobutylicam J-3-3 |
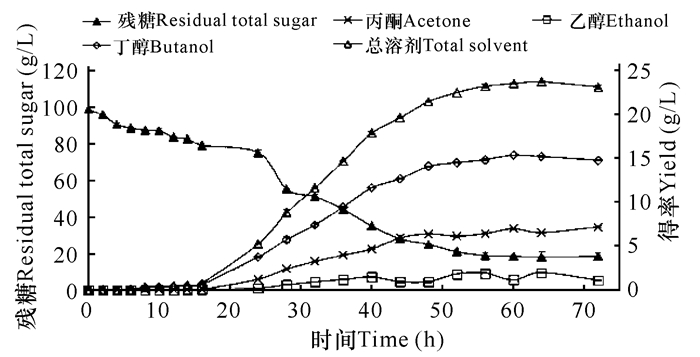
从图 1和图 2可以看出,J-3-3发酵甘薯生产丙酮和丁醇的发酵过程中存在明显的产酸期和产溶剂期,发酵16 h之前为产酸期,主要产物为乙酸和丁酸,发酵6 h开始产生乙酸,14 h乙酸含量达到最大值(7.47 g/L)。以6~14 h计算乙酸的生成速率为0.79 g/(L·h);发酵8 h开始产生丁酸,16 h丁酸达到最大值(4.27 g/L),以8~16 h计算丁酸的生成速率为0.40 g/(L·h)。随着乙酸和丁酸的生成,发酵液的pH值逐渐下降,发酵至16 h时pH值达到最低值(4.28)。发酵16 h之后发酵过程转入产溶剂期,开始大量合成丙酮、丁醇和乙醇。以发酵16~36 h计算,丙酮的生成速率为0.20 g/(L·h),丁醇的生成速率为0.44 g/(L·h),乙醇的生成速率为0.06 g/(L·h)。随着丙酮、丁醇和乙醇的生成,发酵液中的乙酸和丁酸的浓度逐渐下降,发酵液的pH值逐渐回升,发酵至28 h时pH值回升到4.57,之后pH值一直维持在4.5左右,直至发酵结束。说明在产酸期生成的乙酸和丁酸以及在产溶剂期产生的乙酸和丁酸均可被菌体吸收转化成溶剂。发酵至60 h时,丙酮丁醇的发酵已基本结束,此时溶剂产量达到最大。丙酮、乙醇和丁醇的产量分别为6.98 g/L、1.16 g/L和15.34 g/L,总溶剂产量达23.48 g/L。

|
图 1 J-3-3在甘薯发酵培养基中发酵产酸及发酵液中pH变化曲线 Fig.1 The curves of acid and pH during fermentation by J-3-3 in sweet potato medium |
|
图 2 发酵过程中溶剂产量和残糖变化曲线 Fig.2 The curves of solvent production and residual total sugar during fermentation |
目前,以甘薯为原料发酵生产丙酮丁醇的研究较少,田毅红等[14]以红薯为原料,乙酸铵作为氮源,添加乙酸钠作为前体物质发酵生产丙酮丁醇,发酵液中丁醇含量最高达到14.41 mg/mL。本研究以南宁市市售的甘薯为原料,以豆粕为氮源,以实验室自己分离鉴定的丙酮丁醇梭菌J-3-3为生产菌株进行了丙酮丁醇的发酵研究,发酵成熟醪的丁醇浓度达15.34 g/L,总溶剂产量达23.48 g/L。与田毅红等[14]的研究相比,本研究有几点优势:使用的氮源是廉价易获得的农副产品,无需添加前体物质,丁醇的产量略有提高。本研究中发酵结束后残糖较高,达18.5 g/L。我国的甘薯品种主要分为淀粉型品种和食用型品种,北方薯区以淀粉型品种为主,食用型品种为辅;南方薯区以食用型品种为主,淀粉型品种为辅;而长江中下游薯区则兼顾淀粉型品种和食用型品种[15]。发酵结束后残糖较高,是否与所用的甘薯品种有关,有待进一步研究。
4 结论本研究以市售的甘薯为原料,豆粕为氮源进行丙酮丁醇发酵,探索最佳发酵条件。实验结果表明,在甘薯液化液初糖浓度为100 g/L、豆粕8 g/L、KH2PO4 0.8 g/L、FeSO4·7H2O 0.06 g/L的配制下,37℃发酵60 h,可获得最佳发酵效果,丙酮、乙醇和丁醇的产量分别达到6.98 g/L、1.16 g/L和15.34 g/L,总溶剂为23.48 g/L。这一研究结果表明,以甘薯为原料发酵生产丙酮丁醇是可行的,具有较好的应用前景,可为发酵法生产丙酮丁醇的原料来源以及甘薯的深加工提供了新的思路。
| [1] |
CHIAO J S, SUN Z H. History of the acetone-butanol-ethanol fermentation industry in China:development of continuous production technology[J]. Journal of Molecular Microbiology & Biotechnology, 2007, 13(1-3): 12-14. |
| [2] |
EZEJI T C, QURESHI N, BLASCHEK H P. Butanol production from agricultural residues:Impact of degradation products on Clostridium beijerinckii growth and butanol fermentation[J]. Biotechnology and Bioengineering, 2007, 97(6): 1460-1469. DOI:10.1002/(ISSN)1097-0290 |
| [3] |
黄格省, 李振宇, 张兰波, 等. 生物丁醇的性能优势及技术进展[J]. 石化技术与应用, 2012, 30(3): 254-259. HUANG G S, LI Z Y, ZHANG L B, et al. Performance advantage and technology progress in biobutanol[J]. Petrochemical Technology & Application, 2012, 30(3): 254-258. |
| [4] |
苏会波, 李凡, 彭超, 等. 新型生物能源丁醇的研究进展和市场现状[J]. 生物质化学工程, 2014, 48(1): 37-43. SU H B, LI F, PENG C, et al. Research progress and market status of novel bioenergy-butanol[J]. Biomass Chemical Engineering, 2014, 48(1): 37-43. |
| [5] |
LI S B, GUO Y, LU F Z, et al. High-level butanol production from cassava starch by a newly isolated Clostridium acetobutylicum[J]. Applied Biochemistry & Biotechnology, 2015, 177(4): 831-841. |
| [6] |
LI S B, QIAN Y, LIANG Z W, et al. Enhanced butanol production from cassava with Clostridium acetobutylicum by genome shuffling[J]. World J Microbiol Biotechnol, 2016, 32(4): 53. DOI:10.1007/s11274-016-2022-7 |
| [7] |
PANG Z W, LU W, ZHANG H, et al. Butanol production employing fed-batch fermentation by Clostridium acetobutylicum GX01 using alkali-pretreated sugarcane bagasse hydrolysed by enzymes from Thermoascus aurantiacus QS 7-2-4[J]. Bioresour Technol, 2016, 212: 82-91. DOI:10.1016/j.biortech.2016.04.013 |
| [8] |
周英梅. 木薯与甘蔗糖蜜混合发酵产丙酮丁醇的研究[D]. 南宁: 广西大学, 2014. ZHOU Y M. Study of ABE production from cassava and molasses[D]. Nanning: Guangxi University, 2014. |
| [9] |
庞宗文, 俸雪, 吴三星, 等. 以新鲜马铃薯为原料发酵丙酮丁醇的研究[J]. 可再生能源, 2012, 30(11): 83-86. PANG Z W, FENG X, WU S X, et al. Study of acetone and butanol production from fresh potato[J]. Renewable Energy Resources, 2012, 30(11): 83-86. |
| [10] |
陈丽杰, 辛程勋, 邓攀, 等. 丙酮丁醇梭菌发酵菊芋汁生产丁醇[J]. 生物工程学报, 2010, 26(7): 991-996. CHEN L J, XIN C X, DENG P, et al. Butanol production from hydrolysate of Jerusalem artichokejuice by Clostridium acetobutylicum L7[J]. Chinese Journal of Biotechnology, 2010, 26(7): 991-996. |
| [11] |
马晓建, 张霞, 常春. 丙酮丁醇梭菌发酵玉米秸秆生产丁醇[J]. 华南理工大学学报:自然科学版, 2014, 24(2): 27-32. MA X J, ZHANG X, CHANG C. Butanol production from corn stover by fermentation with Clostridium acetobutylicum[J]. Journal of South China University of Technology:Natural Science Edition, 2014, 24(2): 27-32. |
| [12] |
王风芹, 仝银杏, 李传斌, 等. 蒸汽爆破玉米芯水解液脱毒及其发酵生产燃料丁醇[J]. 农业工程学报, 2016, 32(5): 257-262. WANG F Q, TONG Y X, LI C B, et al. Hydrolysate detoxified from steam exploded corn cob and its fermentationproducing butanol fuels[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(5): 257-262. DOI:10.11975/j.issn.1002-6819.2016.05.037 |
| [13] |
龙飞, 靳艳玲, 赵云, 等. 丙酮丁醇梭菌Clostridium acetobutylicum CICC 8012发酵鲜芭蕉芋生产丁醇[J]. 应用与环境生物学报, 2013, 19(1): 54-60. LONG F, JIN Y L, ZHAO Y, et al. Optimization of butanol production from Canna edulis Ker by Clostridium acetobutylicum using response surface methodology[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(1): 54-60. |
| [14] |
田毅红, 朱志豪, 高媛, 等. 红薯发酵产丁醇的工艺优化[J]. 化学与生物工程, 2016, 33(2): 64-66. TIAN Y H, ZHU Z H, GAO Y, et al. Optimization on fermentation conditions of butanol from sweet potato[J]. Chemistry & Bioengineering, 2016, 33(2): 64-66. |
| [15] |
蒋玉峰, 马代夫. 国家甘薯产业技术体系建设推动甘薯产业和学科发展[J]. 江苏师范大学学报:自然科学版, 2016, 34(3): 23-27. JIANG Y F, MA D F. The sweet potato of China agricultural research system promotes the industrilization and disciplinary development of sweet potato[J]. Journal of Jiangsu Normal University:Natural Science Edition, 2016, 34(3): 23-27. |
| [16] |
国家发展和改革委员会. 可再生能源中长期发展规划[J]. 可再生能源, 2007, 25(6): 1-5. National Development and Reform Commission. Long-term development plan for renewable energy[J]. Renewable Energy Resources, 2007, 25(6): 1-5. |
 2018, Vol. 25
2018, Vol. 25 


