【研究意义】结核病(Tuberculosis,TB)是全世界十大死因之一。据WHO报告[1]显示,2016年1 040万人患有结核病,170万人因该病死亡(包括40万艾滋病毒感染者)。结核病由经常感染肺部的结核分枝杆菌(Mycobacterium tuberculosis,MTB)引起。随着研究的深入,人们认识到非结核分枝杆菌(Nontuberculous mycobacteria,NTM)也可能对人类的生命和健康构成威胁,其中鸟分枝杆菌(Mycobacterium avium,MA)感染比例最大[2]。鸟分枝杆菌主要在巨噬细胞等宿主免疫系统的细胞内存活和繁殖,经常会引起吞噬体成熟和巨噬细胞的抗凋亡反应。巨噬细胞被鸟分枝杆菌感染后可以引发一系列细胞信号通路的激活以及免疫反应的起始[3]。先天免疫系统使宿主能够识别外来侵入的微生物,是抵御外来感染的主要防线,巨噬细胞细胞膜上Toll样受体(Toll-like receptor,TLRs)是这一过程的中心。Toll样受体可识别病原体的相关分子模式(Pathogen-associated molecular patterns,PAMPs)并启动信号通路,导致先天性免疫反应、细胞因子和适应性免疫应答的形成[4]。PAMPs是保守的微生物结构,如脂多糖(LPS),脂肽和DNA[5]。TLRs识别PAMPs发生在宿主防御反应的最早阶段,并且这些先天受体诱导细胞内炎症基因的表达,以消除入侵的病原体[3, 6]。所产生的炎症是旨在控制侵入微生物的免疫应答中的关键早期步骤[7]。分枝杆菌表面成分复杂,既存在可以被巨噬细胞识别而诱导巨噬细胞凋亡的相应配体,部分细菌表面成分又具有抑制凋亡的作用。因此,阐明TLRs在鸟分枝杆菌诱导巨噬细胞凋亡中的作用显得尤为重要。【前人研究进展】巨噬细胞主要依赖于分枝杆菌与Toll样受体的相互作用来识别吞噬分枝杆菌,故近年来分枝杆菌与Toll样受体之间的关系倍受关注。在Toll样受体家族中,关于TLRs研究最多的是TLR4,其次是TLR2[8-9]。TLR2并不像TLR4一样单独起作用,而是与TLR1或TLR6形成异源二聚体,以感应分枝杆菌的PAMPs,并通过衔接蛋白MyD88和TIRAP激活巨噬细胞和树突状细胞[10]。TLR2被认为是识别分枝杆菌表面组分的主要受体,并且在控制分枝杆菌感染中具有重要作用。TLR6与TLR2相关,识别二酰化脂蛋白,其是宿主炎症反应的有效诱导剂。【本研究切入点】研究表明,TLR2和TLR6多态性与某些人群的结核病风险增加有关[7]。然而,TLR2和TLR6在鸟分枝杆菌诱导巨噬细胞凋亡中的作用及其机制尚未完全清楚。【拟解决的关键问题】构建鸟分枝杆菌感染人体巨噬细胞U937模型,分析TLR2和TLR6在细胞中的表达情况。利用单克隆抗体分别或同时阻断TLR2和TLR6在巨噬细胞内的表达,分析与细胞凋亡相关的细胞因子TNF-α的分泌量和细胞凋亡的关键蛋白BCL-2、BAX的表达量变化情况,以阐明两个细胞表面受体TLR2和TLR6在鸟分枝杆菌诱导人体巨噬细胞凋亡时所起的作用。
1 材料与方法 1.1 材料 1.1.1 实验细胞人单核巨噬细胞系U937,购自和元生物技术(上海)有限公司。
1.1.2 菌株鸟分枝杆菌(Mycobacterium avium,MA)临床分离株由本实验室保存。
1.1.3 主要试剂及仪器Middle brook 7H9/OADC培养基(美国BD公司);RPMI 1460培养基(诺唯赞);Toll-like receptor 2 antibody,Toll-like receptor 6 antibody,TNF-α凋亡试剂盒(北京博士德生物有限公司)。SDS-PAGE电泳装置(美国Bio-Rad公司);流式细胞仪(Merck Millipore)。
1.2 方法 1.2.1 鸟分枝杆菌培养将鸟分枝杆菌接种于Middle brook 7H9/OADC液体培养基中,于37℃培养15 d至对数生长期,使用麦氏比浊仪,测定菌液浊度(McFarland turbidity standard,McF)。实验前,将鸟分枝杆菌培养物离心,去上清,用PBS洗涤两次,用含有10%胎牛血清的RPMI 1640培养液重悬并稀释,调整菌液浓度为1×108 CFU /mL。
1.2.2 巨噬细胞U937培养U937细胞使用含有10%胎牛血清,100 μg/mL青霉素,30 μg/mL链霉素的RPMI 1640培养液,在37℃、5% CO2的条件下培养。每48 h换液传代1次。用无抗生素的培养液调整培养瓶里的细胞浓度达到1×106个/mL,2 mL/孔铺于6孔板中。
1.2.3 鸟分枝杆菌感染巨噬细胞模型的建立U937细胞和鸟分枝杆菌按照上述方法培养后,按照细胞比细菌为100:1的比例将细菌加入U937细胞的6孔板中,在37℃、5% CO2的条件下培养。另外,未感染鸟分枝杆菌的U937细胞悬液作为对照组。
1.2.4 TLR2、TLR6和TNF-α表达的检测分别取鸟分枝杆菌感染后4 h,8 h,16 h,24 h和48 h各感染组的U937细胞,用预冷的PBS洗3次,每1×106个细胞加入100 μL的细胞裂解液,冰上裂解10 min,4℃、12 000 g离心15 min,收集上清,BCA法测定蛋白浓度。以β-actin为内参,Western blot分别检测细胞内TLR2和TLR6表达量,取其细胞培养上清液用ELISA检测TNF-α含量的变化。
1.2.5 U937细胞分组干预本实验分为空白组、实验组、对照组。实验组分别用TLR2单克隆抗体(10 mg/L)、TLR6单克隆抗体(10 mg/L)、TLR2单克隆抗体+TLR6单克隆抗体(10 mg/L)孵育U937细胞1 h后,加入鸟分枝杆菌(1×108 CFU/mL)刺激细胞24 h; 对照组鸟分枝杆菌(1×108 CFU/mL)感染U937细胞24 h;空白组加入等体积的PBS。
将各组分成3份检测。一份离心取沉淀用Western blot检测细胞内关键蛋白BAX和BCL-2的含量;一份离心取细胞培养上清液用ELISA检测TNF-α的含量;一份用流式细胞仪检测U937细胞的凋亡率。
1.2.6 统计学方法应用SPSS 17.0软件处理,统计资料以均数±标准差(x±s)表示,组间均数比较采用单因素方差分析,两组实验数据检验比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果与分析 2.1 鸟分枝杆菌感染U937细胞对TLR2、TLR6和TNF-α表达的影响用鸟分枝杆菌感染U937细胞并分别于感染0 h、8 h、16 h、24 h和48 h后检测TLR2、TLR6和TNF-α的表达水平。Western blot检测结果显示,在相应的分子量位置上均有可见条带(图 1a、1b),说明TLR2和TLR6在U937细胞正常状态下也有表达。使用Alpha View软件对Western blot结果进行分析,将TLR2和TLR6条带的灰度值与β-actin条带的灰度值进行相比,所得比值客观反映鸟分枝杆菌感染U937细胞不同的感染时间内两种受体TLR2和TLR6的表达量以及其变化。结果显示(图 1c、1d),随着鸟分枝杆菌感染U937细胞的时间的增加,TLR2和TLR6蛋白表达都显著上调,且在感染24 h后随着时间的延长,表达量逐渐下降并趋于稳定。因此,以下试验均选定感染时间为24 h。

|
Western blot检测TLR2和TLR6的表达情况。与对照组相比*P<0.05,**P<0.01 The protein expression of TLR2 and TLR6 was detected by Western blot.*P<0.05, **P<0.01 control 图 1 Mycobacterium avium感染U937细胞对TLR2和TLR6蛋白表达的影响 Fig.1 Expression of TLR2(a, c) and TLR6(b, d) in U937 cells infected with Mycobacterium avium |
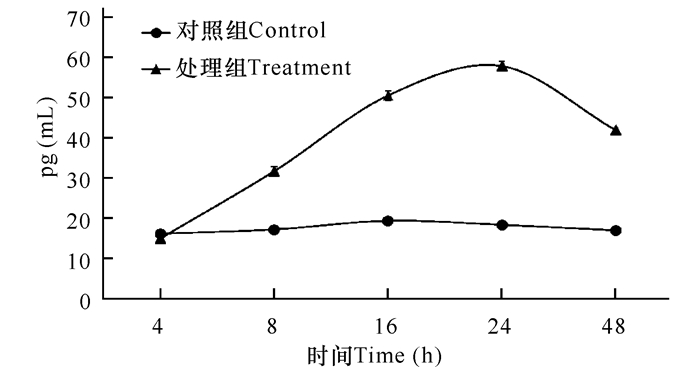
通过用ELISA方法检测不同感染时间下U937细胞培养物上清液中TNF-α的含量,由图 2可见感染4 h内,实验组与对照组相比,TNF-α的含量变化不大。4 h后,实验组的TNF-α的含量开始增加,感染24 h后随着时间的延长,其含量逐渐下降并趋于稳定。其结果与TLR2和TLR6蛋白表达量变化一致,说明TLR2和TLR6与鸟分枝杆菌诱导巨噬细胞凋亡相关。
|
用ELISA技术检测U937细胞培养上清液中TNF-α含量 The cytokines of TNF-α was measured by ELISA from U937 cells supernatant 图 2 TNF-α含量随感染时间的变化 Fig.2 The changes in content of TNF-α with time of infection |
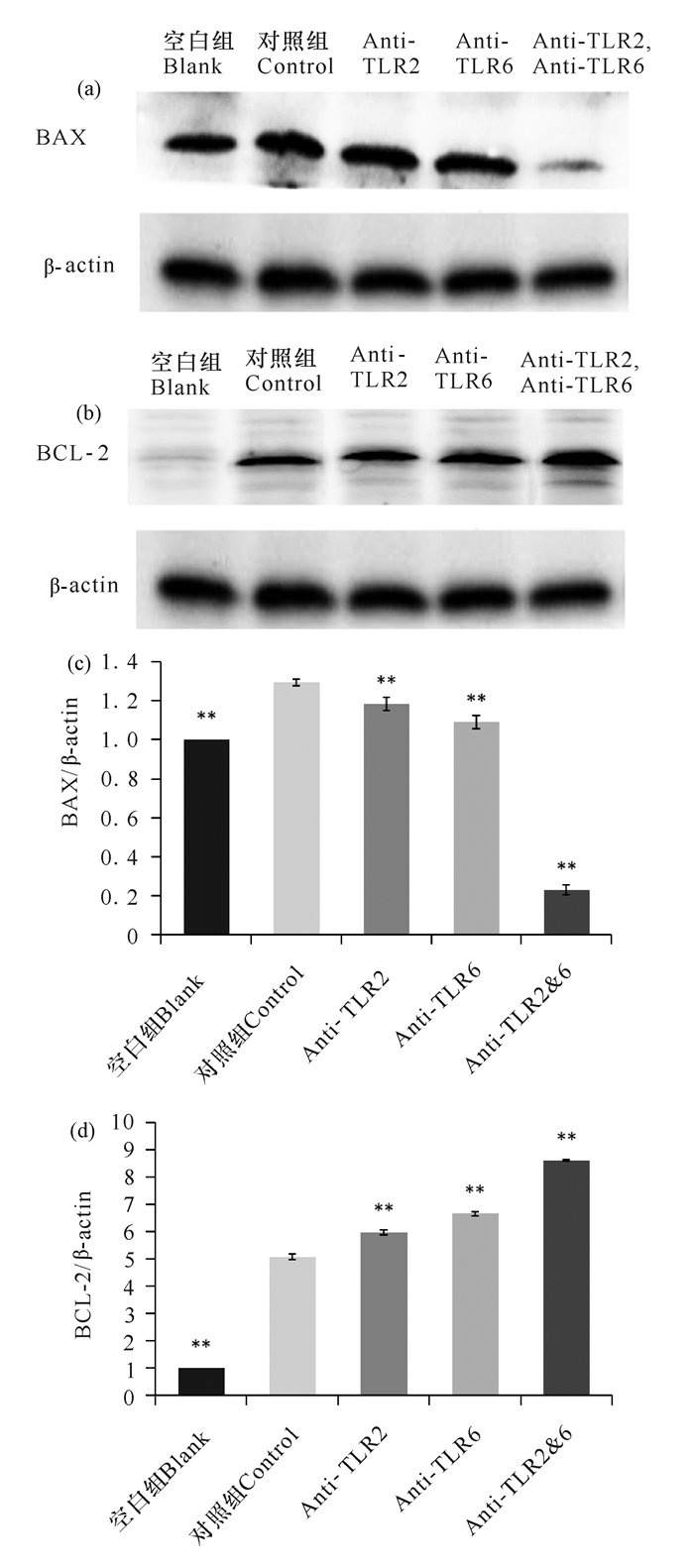
分别用TLR2单克隆抗体(10 mg/L)、TLR6单克隆抗体(10 mg/L)、TLR2单克隆抗体+TLR6单克隆抗体(10 mg/L)孵育U937细胞1 h后,加入鸟分枝杆菌(1×108 CFU/mL)刺激细胞24 h,提取细胞总蛋白,检测U937细胞内关键蛋白的含量变化。Western blot检测结果经AlphaView软件分析,结果显示促凋亡蛋白BAX蛋白(图 3a、3c)的表达与对照组相比明显下调(P < 0.01),而抑制凋亡蛋白BCL-2蛋白(图 3b、3d)的表达与对照组相比显著上升(P < 0.01)。
|
Western blot检测BAX和BCL-2的表达情况。与对照组相比**P < 0.01 The expression of BAX and BCL-2 was detected by Western blot.**P < 0.01 vs control 图 3 BAX和BCL-2蛋白含量在不同处理因素中的表达情况 Fig.3 The protein content of BAX(a, c) and BCL-2(b, d) under different treatment factors |
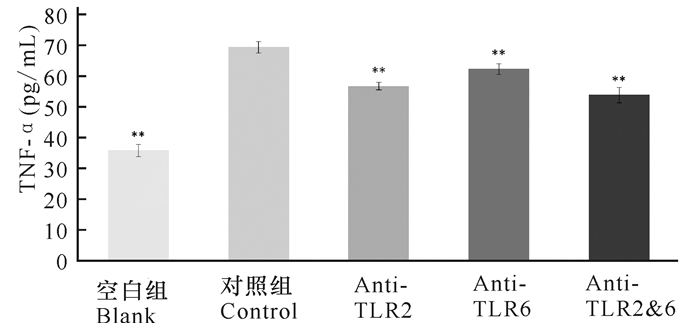
分别用TLR2单克隆抗体(10 mg/L)、TLR6单克隆抗体(10 mg/L)、TLR2单克隆抗体+TLR6单克隆抗体(10 mg/L)孵育U937细胞1 h后,加入鸟分枝杆菌(1×108 CFU/mL)刺激细胞24 h后通过ELISA方法检测其培养上清液中TNF-α的含量,如图 4所示,空白组与对照组相比较,对照组中TNF-α的含量显著增加(P <0.01)。U937细胞与TLR2单克隆抗体或TLR6单克隆抗体的预孵育显著阻断了鸟分枝杆菌诱导的TNF-α的产生。然而,与用单独用TLR2单克隆抗体或TLR6单克隆抗体预培养的细胞相比,同时用TLR2、TLR6单克隆抗体处理的U937细胞对TNF-α释放具有更大的影响。结果表明TLR2和TLR6参与了U937细胞对鸟分枝杆菌识别,并抑制TNF-α的产生。
|
用ELISA技术检测U937细胞培养上清液中TNF-α含量。与对照组相比**P < 0.01 The cytokines of TNF-α was measured by ELISA from U937 cells supernatant.**P < 0.01 vs control 图 4 TNF-α含量在不同感染组中的情况 Fig.4 The content of TNF-α in different infection groups |
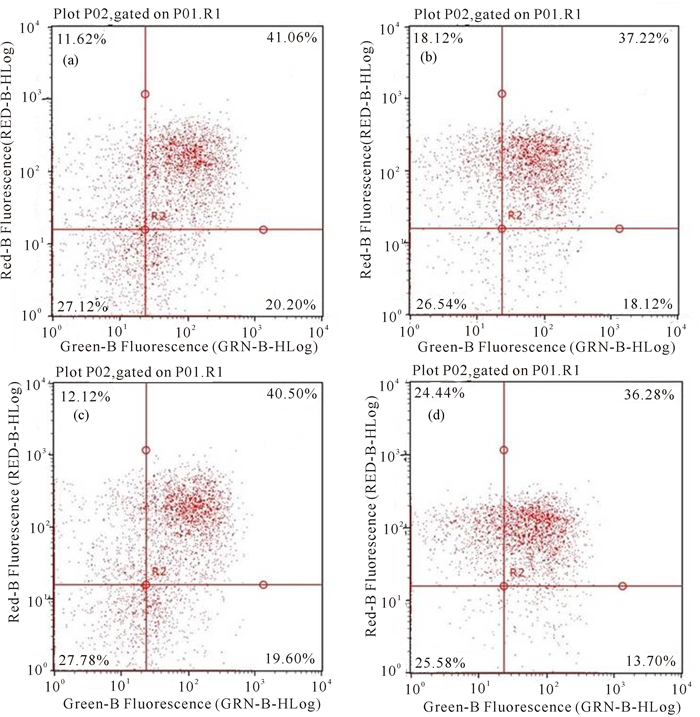
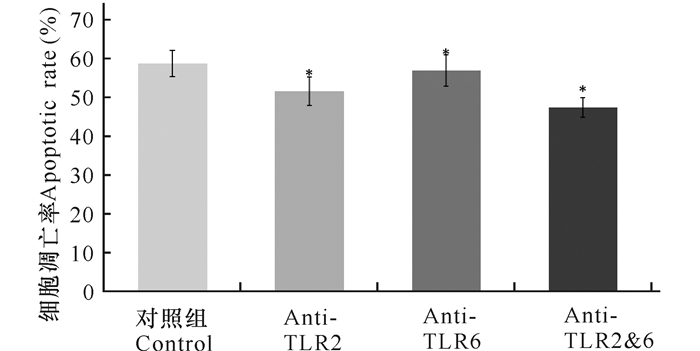
为了进一步验证TLR2和TLR6与巨噬细胞的凋亡关系,将TLR2和TLR6单克隆抗体分别与鸟分枝杆菌共感染巨噬细胞,用流式细胞仪检测巨噬细胞的凋亡率。结果如图 5, 6所示,阻断TLR2、TLR6后,U937的凋亡率较之未阻断TLR2、TLR6时明显下降(P <0.05),且同时阻断TLR2、TLR6后U937的凋亡率为最低。其结果与TLR2和TLR6单克隆抗体分别与鸟分枝杆菌共感染巨噬细胞后巨噬细胞内促凋亡蛋白BAX、抑凋亡蛋白BCL-2以及肿瘤凋亡因子TNF-α的表达量变化一致。
|
用流式细胞仪检测U937细胞的凋亡变化。(a)对照组;(b)TLR2抗体;(c)TLR6抗体;(d)TLR2和TLR 6抗体 U937 cell apoptosis changes was detected with flow cytometry.(a)Control; (b)Anti-TLR2;(c)Anti-TLR6;(d)Anti-TLR2, 6 图 5 各个感染组感染巨噬细胞24 h后流式细胞仪检测的凋亡率 Fig.5 The apoptotic rate measured by cyto flowmetry after infected for 24 h in different infection-groups |
|
用流式细胞仪检测U937细胞的凋亡变化。与对照组相比*P < 0.05 U937 cell apoptosis changes was detected with flow cytometry *P < 0.05 vs control. 图 6 阻断TLR2、TLR6后,鸟分枝杆菌感染U937细胞的凋亡率的变化情况 Fig.6 Apoptotic rate changes of U937 cells after Mycobacterium avium without TLR2-blocking or TLR6-bloking |
鸟分枝杆菌是一种寄生于细胞内的分枝杆菌,容易在患有免疫缺陷症病人的体内被查到。感染宿主后巨噬细胞在防御方面起重要作用,巨噬细胞通过TLRs等表面受体来识别多种分枝杆菌的PAMP,进而将其吞噬进巨噬细胞内部。鸟分枝杆菌在人体内被巨噬细胞吞噬之后,为了可以在巨噬细胞体内生长繁殖,演化出一系列逃脱巨噬细胞消除机制的行为,从而使自己存活下来,进而感染宿主。
TNF-α为肿瘤凋亡因子,是一种与细胞凋亡息息相关的细胞因子,它是凋亡的主要外源调节物[11]。细胞的凋亡会引起TNF-α的释放,而TNF-α进而会与TNFR结合,引起相关的细胞凋亡。TLRs参与识别和建立保护性免疫应答[12]。巨噬细胞通过TLR2和TLR6识别鸟分枝杆菌,而鸟分枝杆菌又能反过来调节TLR2和TLR6的表达。本实验中,我们使用鸟分枝杆菌感染U937细胞,研究鸟分枝杆菌感染巨噬细胞后诱导巨噬细胞凋亡的情况。实验过程中,鸟分枝杆菌感染巨噬细胞后,TNF-α含量逐渐升高,在感染时间达到24 h时达到最高,之后缓慢下降趋于平缓,而两种关键受体TLR2和TLR6的表达量也随着鸟分枝杆菌的感染时间的增加而显著上调,于24 h后又有所下降。TNF-α与两种关键Tolls受体的表达量变化一致(P < 0.05),说明TLR2和TLR6与鸟分枝杆菌诱导巨噬细胞的凋亡相关。
我们还通过阻断U937细胞的TLR2和TLR6后感染鸟分枝杆菌,观察U937细胞促凋亡蛋白BAX和抑凋亡蛋白BCL-2表达量以及其凋亡水平的变化,以进一步明确TLR2和TLR6在鸟分枝杆菌感染巨噬细胞中的作用。结果显示在分别阻断TLR2和TLR6后,鸟分枝杆菌感染的U937细胞促凋亡蛋白BAX表达量下降(P <0.01),抑凋亡蛋白BCL-2表达量上升(P < 0.01),凋亡率下降(P < 0.05),与未阻断TLR2和TLR6的U937细胞比较均有显著差异(P < 0.05)。而同时阻断TLR2和TLR6后,鸟分枝杆菌感染的U937细胞这两种关键蛋白和凋亡率均表现出同样的趋势,且较分别阻断TLR2和TLR6更显著。同时其上清液中的TNF-α的含量也表现出了明显的下降趋势(P < 0.01)。
4 结论鸟分枝杆菌感染巨噬细胞U937的过程中,TLR2和TLR6参与了U937细胞对鸟分枝杆菌识别,在鸟分枝杆菌诱导巨噬细胞的凋亡过程中有重要作用,而鸟分枝杆菌又可以通过促进TLR2和TLR6的表达来影响巨噬细胞相关的凋亡通路,从而诱导巨噬细胞的凋亡。
| [1] |
World Health Organization. Global tuberculois report[EB/OL]. http://www.who.int/zh.2017.
|
| [2] |
GRIFFITH D E, AKSAMIT T, BROWN-ELLIOTT B A, et al. An official ATS/IDSA statement:diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases[J]. Am J Respir Crit Care Med, 2007, 175(4): 367-416. DOI:10.1164/rccm.200604-571ST |
| [3] |
ZHU J, MOHAN C. Toll-like receptor signaling pathways-therapeutic opportunities[J]. Mediators of nflammation, 2010, (2010-08-04), 2010, 2010(8): 781235.
|
| [4] |
BAFICA A, SCANGA C A, FENG C G, et al. TLR9 regulates Th1 responses and cooperates with TLR2 in mediating optimal resistance to Mycobacterium tuberculosis[J]. Journal of Experimental Medicine, 2005, 202(12): 1715-1724. DOI:10.1084/jem.20051782 |
| [5] |
SCHURZ H, DAYA M, MOLLER M, et al. TLR1, 2, 4, 6 and 9 variants associated with tuberculosis susceptibility:A systematic review and meta-analysis[J]. PLOS ONE, 2015, 10(10): e0139711. DOI:10.1371/journal.pone.0139711 |
| [6] |
BEUTLER B. Microbe sensing, positive feedback loops, and the pathogenesis of inflammatory diseases[J]. Immunological Reviews, 2009, 227(1): 248-263. DOI:10.1111/imr.2008.227.issue-1 |
| [7] |
SHEY M S, RANDHAWA A K, BOWMAKER M, et al. Single nucleotide polymorphisms in toll-like receptor 6 are associated with altered lipopeptide- and mycobacteria-induced interleukin-6 secretion[J]. Genes & Immunity, 2010, 11(7): 561-572. |
| [8] |
MIKOCKA-WALUS A A, TURNBULL D A, MOULDING N T, et al. Controversies surrounding the comorbidity of depression and anxiety in inflammatory bowel disease patients:a literature review[J]. Inflammatory Bowel Diseases, 2007, 13(2): 225-34. DOI:10.1002/ibd.20062 |
| [9] |
VICTOR F C, GOTTLIEB A B. TNF-alpha and apoptosis:Implications for the pathogenesis and treatment of psoriasis[J]. J Drugs Dermatol, 2002, 1(3): 264-275. |
| [10] |
O'NEILL L, ABOWIE A G. The family of five:TIR-domain-containing adaptors in Toll-like receptor signalling[J]. Nat Rev Immunol, 2007, 7(5): 353-64. DOI:10.1038/nri2079 |
| [11] |
SEDLAK T W, OLTVAI Z N, YANG E, et al. Multiple Bcl-2 family members demonstrate selective dimerizations with Bax[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(17): 7834-7838. DOI:10.1073/pnas.92.17.7834 |
| [12] |
SWEET L, SCHOREY J S. Glycopeptidolipids from Mycobacterium avium promote macrophage activation in a TLR2- and MyD88-dependent manner[J]. J Leukoc Biol, 2006, 80(2): 415-423. DOI:10.1189/jlb.1205702 |
 2018, Vol. 25
2018, Vol. 25 


