【研究意义】自噬是一种蛋白质大量降解过程,该过程中待降解的蛋白质包裹于自噬体中,传递至溶酶体或者液泡中进行降解[1]。自噬对于生命体的生存、分化及维持自身稳态起着至关重要的作用。大量的研究表明,肿瘤与细胞自噬有密切的关系[2]。微管相关蛋白1轻链3(Microtubule-associated protein 1 light chain 3,MAP1-LC3,LC3)是自噬相关基因Atg8(Autophagy-related 8 genes,Atg8s)的同源物之一[3]。【前人研究进展】 LC3具有LC3-Ⅰ、LC3-Ⅱ两种剪切形式,在自噬过程中,LC3-Ⅰ在泛素样酶的作用下会逐渐转变成LC3-Ⅱ[4]。LC3-Ⅱ定位于自噬体膜,研究发现LC3-Ⅱ在自噬泡的形成中起着十分重要的作用[5],是哺乳动物的自噬体标志物,已经被用于研究神经肌肉疾病、肿瘤发生、细菌病毒感染等[6-7]。【本研究切入点】通过构建pEGFP-N1-LC3真核表达载体,转染人胚肾细胞293T表达带有绿色荧光的GFP-LC3融合蛋白,荧光显微镜下观察其定位。然后通过Earle's盐平衡液饥饿诱导实验观察自噬的发生过程。【拟解决的关键问题】获得能够在真核细胞中表达GFP-LC3融合蛋白的真核表达载体,为以后进一步研究自噬在癌细胞病理进程中的机制提供一种新的实验工具。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株和细胞pEGFP-N1真核表达载体、人胚肾细胞293T、人肺腺癌细胞A549均由本实验室保存。
1.1.2 主要试剂总RNA提取试剂盒、质粒小提试剂盒、DNA纯化回收试剂盒均购自天根公司;PrimeScrip Ⅱ 1st Strand cDNA Synthesis Kit、PrimeSTAR GST DNA Polymerase高保真酶、T4 DNA Ligase、限制性内切核酸酶EcoRⅠ和XhoⅠ均购自Takara公司;胎牛血清(FBS)、DMEM细胞培养液、细胞内保护液DMSO购自Gibco公司;无血清培养基Opti-MEM、转染试剂Lipofectamine LTX购自Invitrogen公司;Protein Marker、PVDF膜购自BIO-RAD公司,抗LC3抗体购自武汉三鹰公司,内参抗体和辣根过氧化物酶二抗购自EPITOMICS公司。
1.2 方法 1.2.1 人肺腺癌A549细胞cDNA的合成复苏培养实验室保存的人肺腺癌A549细胞,待细胞长满后,使用总RNA提取试剂盒提取A549细胞总RNA。之后将获得的总RNA使用PrimeScrip Ⅱ 1st Strand cDNA Synthesis Kit进行RT-PCR合成A549细胞的cDNA。
1.2.2 重组质粒的构建及鉴定以人肺腺癌细胞A549的总RNA中反转录获得的cDNA为模板,根据人LC3蛋白基因编码序列设计引物,上、下游引物分别带有NheⅠ和EcoRⅠ酶切位点序列。上下游引物序列:
LC3(GFP)-F 5′-ACGTGCTAGCATGCCCTCAGACCGGCCTT-3′,
LC3(GFP)-R 5′-ACGTGAATTCGGAAGCCGAAGGTTTCCTG-3′。
使用PrimeSTAR GST DNA Polymerase高保真酶进行PCR扩增(94℃ 5 min,94℃ 30 s,58℃ 30 s,72℃ 2 min,循环30次;72℃ 10 min),扩增得到目的片段的大小约为470 bp。将扩增片段和pEGFP-N1空载体用NheⅠ、EcoRⅠ双酶切3 h,电泳回收酶切片段。用T4 DNA Ligase连接载体与目的片段,转化DH5α感受态细胞。从转化重组质粒的平板中挑取单菌落在含卡那霉素的液体LB培养基中进行培养,提取质粒进行双酶切鉴定。将初步鉴定正确的重组质粒进行序列测定,BLAST进行序列比对,结果表明测序结果与NCBI中公布的LC3基因信息完全一致,将构建成功的质粒命名为pEGFP-N1-LC3。
1.2.3 重组质粒的转染及融合蛋白表达检测 1.2.3.1 荧光显微镜下观察融合蛋白定位按照每孔5×105个细胞的接种量,将293T细胞接种于6孔板中,细胞融合至80%时,按照Lipofectamine LTX说明书转染重组质粒pEGFP-N1-LC3以及空载体pEGFP-N1,分别设为实验组和空载体对照组。转染24 h后吸取DMEM完全培养基,加入新的培养基并在Leica DMi8倒置荧光显微镜下观察融合蛋白的分布情况。
1.2.3.2 融合蛋白表达检测收集空载体对照组以及实验组细胞,裂解提取总蛋白,定量后进行SDS-PAGE电泳,采用电转法[8]将蛋白转至PVDF膜,5%脱脂牛奶封闭2 h,分别孵育LC3多克隆抗体(1:1 000)、GAPDH多克隆抗体(1:1 000),4℃孵育过夜,PBST洗涤3次,羊抗兔二抗(1:2 000)室温孵育2 h,PBST洗涤3次,ECL发光液显色,暗盒X光胶片显影。
1.2.4 Earle's盐平衡液饥饿诱导实验检测自噬 1.2.4.1 Western blot检测细胞自噬将转染了重组质粒pEGFP-N1-LC3的293T细胞分为4组:①对照组:正常培养24 h;②实验组1:正常培养20 h后Earle's盐平衡液饥饿诱导自噬4 h;③实验组2:正常培养16 h后Earle's盐平衡液饥饿诱导自噬8 h;④实验组3:Earle's盐平衡液饥饿诱导自噬24 h。分别收集实验组、对照组总蛋白,定量后进行SDS-PAGE电泳,湿法转膜电转至PVDF膜上,使用5%脱脂牛奶室温封闭2 h,依次敷LC3多克隆抗体(1:1 000)、GAPDH抗体,4℃过夜,PBST漂洗3次,用羊抗兔IgG(1:3 000)室温敷2 h,PBST漂洗3次,ECL发光液显色显影,将得到的胶片扫描并用软件进行处理。
1.2.4.2 激光共聚焦显微镜下观察自噬现象分别将转染了重组质粒以及空载体的293T细胞以每孔2×105个细胞接种到有爬片的24孔板中,24 h后分为2组;①实验组:Earle's盐平衡液饥饿诱导2 h;②对照组:继续正常培养2 h。两组细胞先去除培养基,PBS漂洗3次,再用4%多聚甲醛固定10 min,PBS清洗3次,接着用0.2% Triton进行透化,PBS清洗3次,最后用10%山羊血清封闭1 h,PBS清洗3次。取出爬片,加入含有DAPI的封片剂,封片,然后置于Leica TCS SP8共聚焦显微镜下,观察非自噬诱导状态下融合蛋白的分布情况,以及诱导自噬后细胞内自噬体的形成情况。
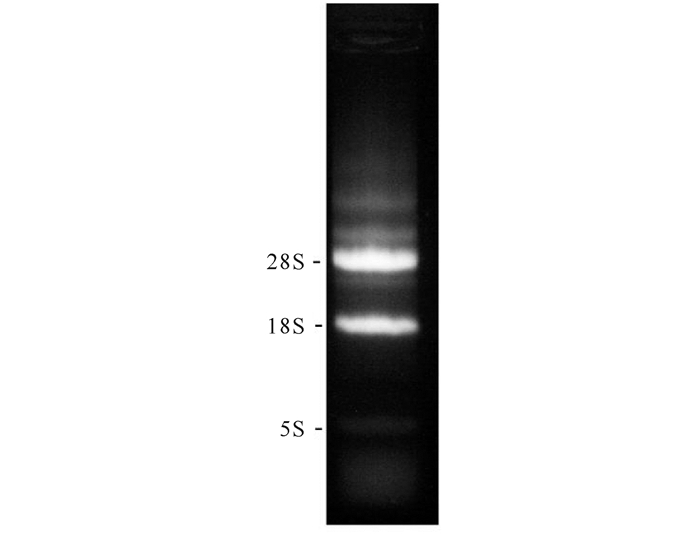
2 结果与分析 2.1 人肺腺癌A549细胞cDNA的合成使用总RNA提取试剂盒提取A549细胞的总RNA,琼脂糖凝胶电泳结果显示成功获得了高纯度的总RNA(图 1)。之后将获得的总RNA使用PrimeScrip Ⅱ 1st Strand cDNA Synthesis Kit进行RT-PCR,制备A549细胞的cDNA。
|
图 1 人肺腺癌A549细胞总RNA的提取 Fig.1 Total RNA extraction from human lung adenocarcinoma A549 cells |
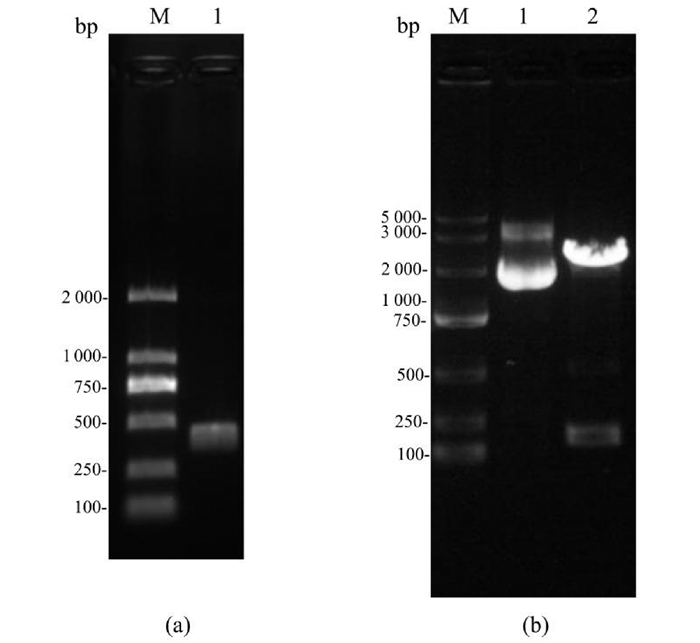
以A549细胞总RNA反转录的cDNA为模板,设计分别带有NheⅠ和EcoRⅠ酶切位点序列的上下游引物进行PCR扩增,得到片段大小约为470 bp的LC3全长基因(图 2a)。扩增产物和pEGFP-N1空载体同时进行双酶切、回收、连接、转化,得到重组pEGFP-N1-LC3质粒。将重组质粒用限制性内切酶EcoRⅠ和XhoⅠ进行双酶切,电泳结果显示大小约470 bp的特异条带(图 2b)。将重组质粒送Invitrogen公司测序,测序结果显示与LC3序列完全一致,证明本实验成功构建了pEGFP-N1-LC3真核表达载体。
|
(a)RT-PCR扩增LC3基因;M:DL2000 marker;1:LC3基因;(b)重组质粒的双酶切验证; M:DL5000 marker;1:pEGFP-N1-LC3重组质粒;2:pEGFP-N1-LC3重组质粒的NheⅠ和EcoRⅠ双酶切 (a)RT-PCR amplification of LC3 gene; M:DL2000 marker; 1:LC3 gene; (b) Double digestion of recombinant plasmid; M:DL5000 marker; 1:recombinant plasmid pEGFP-N1-LC3;2:Recombinant plasmid pEGFP-N1-LC3 digested with NheⅠand EcoRⅠ 图 2 pEGFP-N1-LC3重组质粒的鉴定 Fig.2 Identification of pEGFP-N1-LC3 recombinant plasmid |
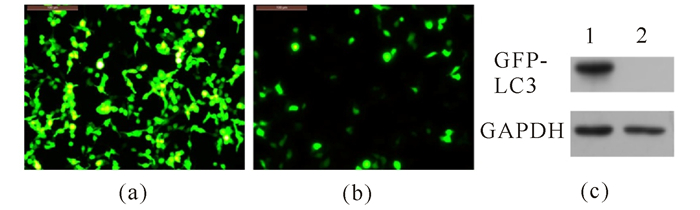
将pEGFP-N1-LC3重组质粒转染入293T细胞,对照组转染pEGFP-N1空载体,24 h后在荧光倒置显微镜下观察,转染重组质粒以及空载体细胞都表达绿色荧光蛋白,且荧光均匀分布于细胞质中。但是,转染重组载体的细胞荧光较弱,可能是因为重组质粒分子量较大,转染效率相对比空载体低而导致的(图 3a~b)。收集实验组和对照组转染细胞,裂解提取总蛋白进行Western blot实验,结果显示融合蛋白在293T细胞中成功表达(图 3c)。
|
(a)空载体转染293T细胞;(b) pEGFP-N1-LC3重组质粒转染293T细胞;(c)Western blot检测GFP-LC3融合蛋白表达;GAPDH:甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase),作为内参;1:转染pEGFP-N1-LC3重组质粒;2:转染pEGFP-N1空载体 (a) Empty vector transfected 293T cells; (b) pEGFP-N1-LC3 recombinant plasmid transfected 293T cells; (c) Western blot detection of GFP-LC3 fusion protein expression.GAPDH(Glyceraldehyde-3-phosphate dehydrogenase) were used as internal reference; 1:Cells transfected with pEGFP-N1-LC3 recombinant plasmid; 2:Cells transfected with pEGFP-N1 vector 图 3 GFP-LC3融合蛋白在293T细胞中的表达的检测 Fig.3 Detection of GFP-LC3 fusion protein expression in 293T cells |
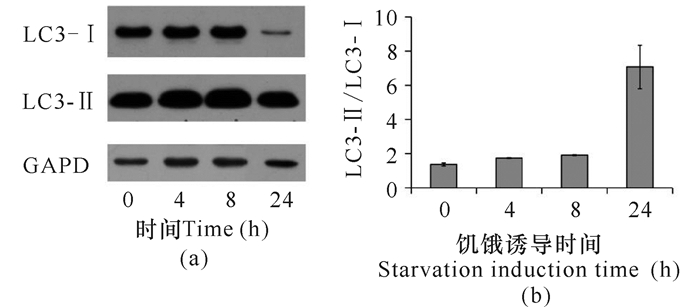
收集实验组1、实验组2、实验组3及对照组细胞,裂解提取总蛋白进行Western blot实验,实验结果及其灰度分析显示,随着饥饿诱导的进行,LC3-Ⅰ向LC3-Ⅱ的转化率逐渐增加,自噬现象逐渐增强(图 4)。实验结果表明Earle's盐平衡液能够成功诱导自噬现象。该方法可以用于进一步研究细胞自噬的亚结构变化。
|
(a)Western blot检测结果;GAPDH为内参;(b) LC3-Ⅱ/LC3-Ⅰ蛋白量比值灰度分析 (a) Western blot results.GAPDH were used as internal reference; (b) Gray scale analysis of LC3-Ⅱ/LC3-Ⅰ protein ratio 图 4 Western blot检测饥饿诱导后LC3-Ⅰ向LC3-Ⅱ的转化 Fig.4 Western blot detected the conversion from LC3-Ⅰto LC3-Ⅱ after starvation induction |
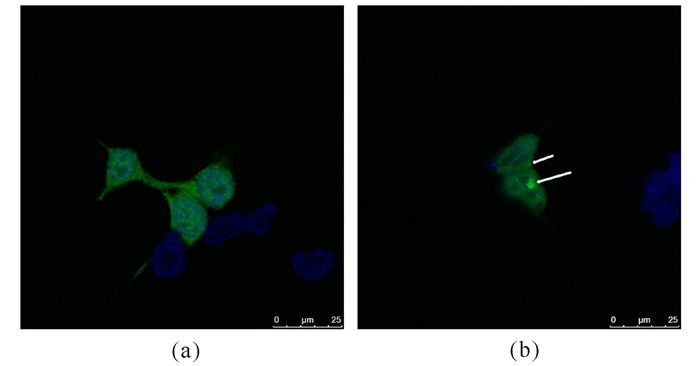
将转染重组质粒的细胞分为实验组和对照组:实验组诱导自噬2 h,对照组正常培养2 h。制作爬片并于激光共聚焦显微镜下观察:对照组中绿色荧光蛋白均匀分布于细胞质中,并没有形成点状自噬泡,说明此时并未发生细胞自噬(图 5a);而在实验组中,293T细胞的细胞质中出现了点状自噬泡,表明此时出现了细胞自噬(图 5b)。
|
(a)正常培养的293T细胞;(b)Earle's盐平衡液饥饿诱导自噬2 h的293T细胞。蓝色荧光为DAPI染色的细胞核,而绿色荧光为GFP-LC3融合蛋白 (a) Normally cultured 293T cells; (b) 293T cells induced by Earle's Balanced salt solution for 2 h.Nucleus stained with DAPI showed blue and GFP-LC3 fusion protein was green 图 5 激光共聚焦下观察饥饿诱导后的自噬泡形成(箭头指示自噬泡) Fig.5 Observation of autophagic vacuolization induced by starvation under confocal laser scanning microscope (Arrows indicate the autophagic bubble) |
自噬是细胞内一种分解代谢途径。该过程是通过形成自噬体、双膜囊泡,将受损或者过量的蛋白质及细胞器递送到溶酶体中,实现这些成分的再循环,从而维持体内平衡,增强了生存能力[9]。而在肿瘤细胞中,自噬起着一个动态的角色:一方面,在肿瘤发生早期,自噬可以通过消除多余的蛋白、受损的细胞器等从而抑制癌细胞的生长;另一方面,一旦肿瘤形成以后,自噬的促活功能有助于癌细胞在饥饿环境中生存,抵抗电离辐射以及化学疗法,促进了癌细胞的生存。可以说,自噬既能够抑制肿瘤生长也能够促进肿瘤的生长,这种矛盾的作用引发了人们对于自噬与癌症关系的激烈争论[10-11]。
自噬相关基因是细胞生存必不可少的重要基因,目前在哺乳动物中发现了4个自噬相关基因Atg8同源物:LC3、GABARAP、GATE-16、Atg8L[12]。而在其中,LC3是研究得最为透彻的一个。LC3蛋白有LC3-Ⅰ和LC3-Ⅱ两种剪切形式。在自噬体膜形成过程中,LC3前体在Atg4B作用下形成LC3-Ⅰ,游离LC3-Ⅰ进一步在Atg7和Atg3活性位点的介导下与磷脂结合形成膜结合形式的LC3-Ⅱ,定位于自噬膜。随着自噬进行,LC3-Ⅱ和LC3-Ⅰ的比值会逐渐增加[13]。该过程对于自噬体的形成具有关键的调控作用,所以LC3-Ⅱ与LC3-Ⅰ相对比值是检测自噬启动的关键性指标。
绿色荧光蛋白(Green fluorescent protein,GFP)是一种在紫外或蓝光激发下能够发出绿色荧光的蛋白[14]。绿色荧光蛋白具有性质稳定、灵敏度高、持续时间长、对目的基因结构功能没有影响等优点,具有十分广泛的应用前景,现在已应用于分子标记、药物筛选、抗体制备等[15]。所以可以用绿色荧光标记的LC3蛋白对自噬泡形成情况进行定量定位检测。
Earle's平衡盐溶液是一种磷酸盐缓冲液,该缓冲液内不包含氨基酸以及血清,能够满足细胞内一定代谢的需要,除了能够诱导自噬以外并无其他细胞毒性,是一种常用的饥饿诱导自噬试剂[16-17]。
本研究将目的基因LC3插入pEGFP-N1真核表达载体,使其能够在真核细胞内表达GFP-LC3绿色荧光融合蛋白,将重组质粒转染进人胚肾细胞293T,通过Earle's盐平衡液饥饿诱导实验诱导细胞自噬,并在荧光显微镜下观察融合蛋白的表达情况。显微观察可以发现,pEGFP-N1-LC3真核表达载体在293T细胞能够大量表达GFP-LC3融合蛋白,未饥饿诱导时,荧光融合蛋白均匀分布于细胞质,并没有自噬泡的形成;而进行Earle's盐平衡液饥饿诱导后,可以观察到细胞内产生了颗粒状的自噬泡,表明产生细胞自噬。Western blot测定结果表明,转染重组表达质粒的293T细胞能够大量表达GFP-LC3融合蛋白,且随着饥饿诱导时间的推进,LC3-Ⅰ向LC3-Ⅱ的转化更加明显,细胞自噬逐渐增强,Earle's盐平衡液饥饿诱导作用明显。
4 结论本研究成功构建了pEGFP-N1-LC3真核表达载体,其能够在转染的293T细胞中大量表达GFP-LC3融合蛋白,且通过Earle's盐平衡液饥饿诱导能够明显观察到自噬现象,为以后进一步研究自噬在癌细胞病理进程中的机制提供实验材料。
| [1] |
KLIONSKY D J, EMR S D. Autophagy as a regulated pathway of cellular degradation[J]. Science, 2000, 290: 1717-1721. DOI:10.1126/science.290.5497.1717 |
| [2] |
MATHEW R, KARANTZA-WADSWORTH V, WHITE E. Role of autophagy in cancer[J]. Nature Reviews Cancer, 2007, 7(12): 961-967. DOI:10.1038/nrc2254 |
| [3] |
KABEYA Y, MIZUSHIMA N, UENO T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. The EMBO Journal, 2000, 19(21): 5720-5728. DOI:10.1093/emboj/19.21.5720 |
| [4] |
倪志华, 张玉明, 邓传怀, 等. LC3基因在细胞自噬过程中的表达研究[J]. 湖北农业科学, 2015, 54(20): 4932-4936. NI Z H, ZHANG Y M, DENG C H, et al. Expression of LC3 gene in cell autophagy[J]. Hubei Agricultural Sciences, 2015, 54(20): 1932-4936. |
| [5] |
SOU Y S, WAGURI S, IWATA J, et al. The Atg8 conjugation system is indispensable for proper development of autophagic isolation membranes in mice[J]. Molecular Biology of the Cell, 2008, 19: 4762-4775. DOI:10.1091/mbc.e08-03-0309 |
| [6] |
TANIDA I, UENO T, KOMINAMI E. LC3 conjugation system in mammalian autophagy[J]. The International Journal of Biochemistry & Cell Biology, 2004, 36(12): 2503-2518. |
| [7] |
KIMURA S, FUJITA N, NODA T, et al. Chapter 1 monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods in Enzymology, 2009, 452: 1-12. DOI:10.1016/S0076-6879(08)03601-X |
| [8] |
朴君, 武翼, 朴敬爱, 等. 血管内皮细胞黏附分子胞外区基因真核表达载体构建及表达[J]. 免疫学杂志, 2013, 29(2): 156-160. PIAO J, WU Y, PIAO J A, et al. Construction and expression of the eukaryotic expression vector of VCAM-1extracellular domains[J]. Immunological Journal, 2013, 29(2): 156-160. |
| [9] |
CECCONI F, LEVINE B. The role of autophagy in mammalian development: cell makeover rather than cell death[J]. Developmental Cell, 2008, 15(3): 344-357. DOI:10.1016/j.devcel.2008.08.012 |
| [10] |
LEVINE B. Cell biology: Autophagy and cancer[J]. Nature, 2007, 446(7137): 745-747. DOI:10.1038/446745a |
| [11] |
KIMMELMAN A C. The dynamic nature of autophagy in cancer[J]. Genes Dev, 2011, 25(19): 1999-2010. DOI:10.1101/gad.17558811 |
| [12] |
TANIDA I, SOU Y S, MINEMATSU-IKEGUCHI N, et al. Atg8L/Apg8L is the fourth mammalian modifier of mammalian Atg8 conjugation mediated by human Atg4B, Atg7 and Atg3[J]. Febs Journal, 2006, 273(11): 2553-2562. DOI:10.1111/j.1742-4658.2006.05260.x |
| [13] |
TANIDA I. Autophagy basics[J]. Microbiology and Immunology, 2011, 55: 1-11. DOI:10.1111/mim.2011.55.issue-1 |
| [14] |
宗兆文, 程天民. 绿色荧光蛋白标记在干细胞移植中的应用[J]. 中国临床康复, 2006, 10(29): 141-143. ZONG Z W, CHENG T M. Application of green fluorescent protein labeling in the study of stem cells transplantation[J]. Chinese Journal of Clinical Rehabilitation, 2006, 10(29): 141-143. DOI:10.3321/j.issn:1673-8225.2006.29.059 |
| [15] |
孙艺佩. 绿色荧光蛋白——结构及应用[J]. 当代化工研究, 2017(8): 124-125. SUN Y P. Green fluorescent protein——structure and application[J]. Chemical Intermediate, 2017(8): 124-125. |
| [16] |
张文亮, 张明明, 刘斌, 等. Earle's盐平衡液饥饿诱导DLD-1, HCT-116, A2780, CHO, Hep G2和SMMC7721肿瘤细胞系自噬发生的时间优化[J]. 中山大学学报:自然科学版, 2016, 55(4): 108-117. ZHANG W L, ZHANG M M, LIU B, et al. Optimal timing of autophagy occurrence induced by earle's balanced salts solution in DLD-1, HCT-116, A2780, CHO, Hep G2 andSMMC7721 cancer cell lines[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(4): 108-117. |
| [17] |
MIN Y, XU W, LIU D, et al. Earle's balanced salts solution and rapamycin differentially regulate the Bacillus Calmette-Guerin-induced maturation of human dendritic cells[J]. Acta Biochimica et Biophysica Sinica, 2013, 45(3): 162-169. DOI:10.1093/abbs/gms117 |
 2018, Vol. 25
2018, Vol. 25 


